Method Article
Изучение актинового цитоскелета в клетках эндотелия Живая выражая GFP-актин
В этой статье
Резюме
Микроскопические изображения живых эндотелиальных клеток, экспрессирующих GFP-актин позволяет характеристике динамических изменений цитоскелета структур. В отличие от методов, которые используют фиксированных экземпляров, этот метод обеспечивает детальную оценку временных изменений в актина цитоскелета в тех же камерах до, во время и после различных физических, фармакологических, или воспалительные стимулы.
Аннотация
Микрососудистых эндотелий играет важную роль в качестве выборочно проницаемой барьер для жидкостей и растворенных веществ. Клей соединения между эндотелиальных клеток регулируют проницаемость эндотелия, и многие исследования показали, важный вклад актина цитоскелета определения целостности соединительных 1-5. Корковых пояса актина считается важным для поддержания стабильного переходы 1, 2, 4, 5. В противоположность этому, волокна актина стресс, как полагают, генерировать центростремительные напряженности в эндотелиальных клетках, которое ослабляет контакты 2-5. Большая часть этой теории была основана на исследованиях, в которых эндотелиальные клетки обрабатывают медиаторов воспаления известно, увеличивает проницаемость эндотелия, а затем фиксация клеток и маркировка F-актин для микроскопического наблюдения. Однако, эти исследования дают весьма ограниченное представление о роли актина цитоскелета, поскольку изображения основных клетки обеспечивают только снимки ввремя нет информации о динамике структуры актина 5.
Live-ячейки изображения позволяет включение динамической природы актина цитоскелета в изучении механизмов, определяющих целостность эндотелиального барьера. Основным преимуществом этого метода является то, что влияние различных воспалительных стимулов на актин структур в эндотелиальных клетках может быть оценен в тот же набор живых клеток до и после лечения, удаления потенциальных смещения, которые могут возникнуть при наблюдении фиксированных экземпляров. Пупочной вены человека эндотелиальных клеток (HUVEC) являются трансфицированных GFP-β-актина плазмиды и выросли до слияния на стекло покровные. Покадровый образы GFP-актина в сливной HUVEC фиксируются до и после того медиаторов воспаления, которые вызывают зависящие от времени изменения в эндотелиальных целостности барьера. Эти исследования позволяют визуального наблюдения жидкости последовательность изменения актина цитоскелета, которые способствуют эндотелийл нарушению барьера и реставрации.
Наши результаты показывают, последовательно местных, актин богатых lamellipodia формирования и оборота в эндотелиальных клетках. Образование и движение волокон актиновых стресс может также наблюдаться. Анализ частоты формирования и оборота местного lamellipodia, до и после лечения воспалительных стимулов может быть документально подтверждено кимограф анализов. Эти исследования дают важную информацию о динамичном характере актинового цитоскелета в клетках эндотелия, который может использоваться для обнаружения ранее неизвестных молекулярных механизмов, важных для поддержания целостности эндотелиального барьера.
протокол
1. Трансфекция HUVEC с GFP-актин
- Различные методы могут быть использованы для трансфекции HUVEC. Наша лаборатория использует Nucleofector системы (Lonza, Базель, Швейцария), изложенные ниже. В общем, действовать быстро, чтобы улучшить жизнеспособность клеток и эффективности трансфекции. Каждый трансфекции требует 5 х 10 5 HUVEC, которые будут посеяны на два стекла покровные (Corning, № 1, 22 х 50 мм). Nucleofector сочетает электропорации и химических реагентов для трансфекции ДНК плазмиды, и обычно достигает> 50% выражение эффективности. Химические реагенты трансфекции альтернативного метода. Одна группа успешно трансфицированных бычьих эндотелиальных клеток с GFP-актин использованием реагента GenePORTER 6. Nucleofector протокола мы используем, описанных ниже.
- Presterilized cultureware или обычный покровные могут быть использованы, в зависимости от типа камеры. Для стекла покровные, стерилизуют в биологической безопасности капот, поместив их в 10 см пластины культурысодержащих около 5 мл 70% этанола в течение 2 мин. Возьмите их с стерильных щипцов и сухой воздух, наклоняясь против них сторону отдельную табличку культуры.
- После высыхания, место каждого покровное в своем собственном 10 см пластины культуры. Внесите 300 мкл шарик теплого раствора желатина (1,5% в 0,9% NaCl) в центре покровного и дайте ему отстояться в течение 5 мин., А затем аспирации. Имея это матрица покрытия в центре, не касаясь краев, будет гарантировать, что клетки будут посеяны густо и добьется слияния быстро.
- Подготовьте 1,5 мл микроцентрифужную трубки в трансфекции с 500 мкл EGM2MV СМИ (Lonza) и отложите в 37 ° С, 5% СО 2 инкубатора.
- Отсоедините HUVEC с 0,25% трипсина-EDTA и собирают в 15 мл коническую трубку. Граф клеток. 5 х 10 5 клеток необходимы для каждого трансфекции. Регулировка громкости клеточной суспензии для получения гранул, который будет содержать 5 х 10 5 клеток умножается на число transfections должны быть выполнены.
- Центрифуга суспензии клеток в клинической центрифуге при 5000 оборотах в минуту в течение 3 минут при комнатной температуре. Аспирируйте супернатант наклона трубки удалить как можно больше средств массовой информации, насколько возможно.
- Ресуспендируют гранул с базовой Nucleofector решение либо из HUVEC или первичной эндотелиальных клеток Nucleofector Kit (Lonza). Используйте 100 мкл на 5 х 10 5 клеток. Из-за токсичности этого решения, очень важно работать быстро в то время как клетки взвешены в этом решении.
- Добавить GFP-β-актина вектора плазмиды (0.2-2 мкг в 100 мкл Nucleofector подвеска) для трансфекции образца. 0,2-2 мкг GFP-актин плазмидной ДНК в 5 х 10 5 клеток на трансфекции.
- Передача 100 мкл клеточной суспензии для Nucleofector кювет. Обложка и нажмите кювет несколько раз, чтобы гарантировать клеточной суспензии весь путь до самого дна.
- Место кювету в Nucleofector слот устройства кювета II и запустить гesired программы электропорации. Мы используем программу-034 для HUVEC.
- Вернуться в кювете биологическое капот безопасности. Принесите один из микроцентрифужную трубы от 37 ° С инкубатор, который содержит 500 мкл EGM2MV на капот. С помощью одного из передачи пипетки представлена в Nucleofector комплект, аккуратно добавить теплое 500 мкл СМИ суспензии клеток в кювете. Перенесите все содержимое из кювета обратно микроцентрифужную трубки и место в инкубаторе в течение 15 мин. чтобы позволить клеткам восстанавливаться.
- Повторите шаги 9-11 по мере необходимости, если больше клеток для трансфекции.
- Один микроцентрифужную пробирку, содержащую 600 мкл трансфицированных HUVEC подвеска может быть заполнена на две покровные. Под капотом и с 1000 мкл микропипетки, осторожно пипеткой вверх и вниз один раз перемешать подвеска, а затем поместить 300 мкл суспензии непосредственно на желатин покрытием покровным. Не позволяйте подвески касался края покровного стекла. Место в 37 ° C / 5% CO 2 инкубаторе в течение 1-4 ч, чтобы для сотовых вложения.
- После 1-4 ч, осмотрите трансфицированных клеток для подтверждения они прикрепили к покровным. Затем добавьте 10 мл EGM2MV средства массовой информации, и вернуться к пластине 37 ° C / 5% СО 2 инкубатора. GFP-актин выражение как правило, может наблюдаться в течение 4-8 часов. Эксперименты, как правило, осуществляется в течение 24-48 ч.
2. Настройка жить-клеточного изображения камеры и стадии нагреватель
- Для большинства наших исследованиях мы использовали Warner инструменты открытых алмаз ванны (RC22), размещенные в PH-1 этап нагреватель, питаемый системы самотеком. Тем не менее, существует несколько вариантов для живой клетки визуализации этапов, в том числе камер, вмещающих стеклянным дном культуры посуды, открытые против закрытых камерах, а также различные microincubator / цель комбинации нагревателя и больших систем инкубатора. В конечном счете, выбор камеры будет зависеть от факторов, в том числе необходимо получить доступ к ванной, чтобы добавить агент тестирования или наркотиков, Wheесть среда будет статическим или по потоку, и длина эксперимента. Кроме того, иногда такие факторы, как нестабильность температуры может вызвать дрейф внимания, и могут быть минимизированы путем системы управления, которая может поддерживать стабильные ванны и объективной температурах.
- Алиготе достаточно среда для эксперимента. Мы аликвоту 50 мл физиологического раствора альбумина соли (АПСС; табл. 1) за каждый час эксперимент будет продолжаться.
- Либо насос или самотечного система может быть использована для доставки средней камере. Для нашей системы, мы добавляем АПСС к простому самотечного система, построенная из капельницу поток, связанный с встроенным нагревателем (Warner инструменты модель SH-27A). Мы применяем потока примерно в 40 мл / ч.
- Если открытой камерой ванны, как наша, будет использован, применяют вакуумную смазку на внешний край на нижней стороне ванны алмазов и ватным наконечником аппликатором. Далее, мы получаем одну ячейку покрытые покровным из инкубатора, и осторожно поднимите покровное использованием щипцов. Gentlу сенсорным зад, чтобы kimwipe, чтобы впитать избыточное среды, сохраняя при этом клетка покрытая сторону мокрое. С клетки лицом вверх, место алмаз ванну в течение покровное для формирования палаты.
- Быстро месте камеры в стадии нагревателя и вручную затяните зажимы на камеру. Одной из основных проблем на данном этапе является возможность того, что клетки высыхают. Поэтому важно работать быстро и когда сделали, сразу же пипеткой ~ 1 мл среды в камере, чтобы предотвратить клетки от высыхания.
- Наша камера позволяет устойчивый поток среды над клетками. Как раз перед поворотом на поток, важно приложить вакуумный шланг к ее владельцу на камеру, чтобы позволить выйти избыточного культуральной среде (АПСС). Встроенный обогреватель и ванной нагреватель должен быть включен этот момент (до 37 ° С). Наша система также имеет термистора зонд для контроля температуры, который должен быть сделан на краю ванны.
- Тщательно протрите нижнюю сотрудничестваverslip с kimwipe пропитанной 70% этанолом, чтобы удалить остатки EGM2MV СМИ и соль наращивание. Протрите второй раз с сухим kimwipe или линзы бумаги.
- После камера была создана, поток идет, и температура устойчиво при 37 ° С, позволяет клетки по крайней мере 30 минут, чтобы регулировать и стабилизировать перед началом эксперимента.
- Во время ожидания, включить все компоненты жить-клеточной визуализации микроскопа (лампы, фильтры контроллер колеса, камеры, компьютера).
3. Сбор данных с живой-клеточной визуализации микроскопа
- Различные живые системы микроскопии ячейки имеются. Наша система Nikon Eclipse TE-2000U со следующими компонентами:
- Саттер инструменты Lambda LS 300 Вт ксеноновой лампы
- Саттер инструменты Lambda 10-3 фильтра возбуждения колесо с SmartShutter и S492 фильтр (D350 и S572 фильтры возбудителя, также доступны для УФ и RFP приложений)
- Дихроичным 2002bs эмиттера (Nikon 61002m)
- CI Plan Fluor 10X Цель DLL, Н. А. 0,30 (Nikon MRH10100)
- Plan Fluor ELWD 40X DM Цель, Н. А. 0,60 (Nikon MRH08420)
- Plan Apo VC 100X Нефть Цель, Н. А. 1,40 (Nikon MRD01901)
- Фотометрические CoolSNAP HQ2 камера, 1392 х 1040 изображений массива, 6,45 х 6,45 мкм пиксели
(Roper Scientific) - У нас также есть два программных пакетов, которые могут быть использованы для получения изображений. Nikon Элементы-AR 3.0 и Метаморф 6.1.
- После просмотра клетки и поиск соответствующей области для исследования, блокировка ручки грубой фокусировки и проверить приобретение программного обеспечения настройки так, чтобы:
- Фильтр колесо устанавливается на S492 фильтр (с надписью "FITC" в нашей конфигурации)
- В приобретении программного обеспечения, цель установлена в соответствии с желаемой увеличением (наш микроскоп без двигателя, но это создает мкм / пиксель отношение). Также убедитесь, что optivar линзы на микроскопе установлен в 1,0 увеличение. Настройка optivар на 1,5 может увеличить увеличение, однако за счет потери интенсивности сигнала.
Увеличение для использования зависит целей исследования. За лучшую деталь, 100X объектива с высокой числовой апертурой обеспечит лучшее пространственное разрешение и передачу сигнала. Наши микроскопом также оснащен большим рабочим расстоянием 40X цель предназначена для различного применения, которое требует дополнительного расстояния. Тем не менее, эта цель может быть полезно, когда мы хотим наблюдать несколько камер одновременно, и прекрасно работает для просмотра органелл-размерных структур, однако на счет потери пространственного разрешения и интенсивности сигнала. Для любого исследования, в котором интенсивность сигнала конечной точки или для более продвинутых методов визуализации, таких как флуоресценции спекл-микроскопия, 100X целью рекомендуется. - Время экспозиции камеры находится между 0.5-2 сек Это зависит от GFP-актин интенсивности в клетках. Мы вообще использовать минимальное время экспозиции, чтобы избежать блeaching из GFP-актин и потенциальной токсичности для клеток.
- Для достижения наилучшего разрешения, Биннинг должен быть установлен на 1 х 1 и усиления на 1. В некоторых случаях мы установили биннинга до 2 х 2 по снижению воздействия времени, однако это снижает точность измерений, мы можем сделать на движущихся объектов в замедленной исследования.
- Настройка покадровой настройки:
- Выберите папку для сохранения отснятых изображений и тип файла.
- Установить количество изображений и время интервала продолжительность эксперимента. Обычно мы используем 15 с до 1 мин интервал между изображениями и до 2 ч в течение всего срока.
- Убедитесь, что активным затвором установлен быть закрыт с приобретениями.
- Перед началом покадровой получения изображения, выключите комнате свет и захватить одно изображение, чтобы проверить настройки.
- Кроме захвата светлого образа. Убедитесь, что конденсатор установлен на надлежащее фазы или DIC фильтр. Включатьгалогенная лампа и собирать изображения. Выключите галогенные лампы.
- Вернуть обратно в "FITC" настройки для покадровой обработки изображений и захват тестового изображения.
- Захват покадровой серии.
В ходе эксперимента, важно следить изображения как они приобретаются. В некоторых случаях небольшие изменения температуры внутри камеры может вызвать фокус дрейф. Этого можно избежать за счет оптимизации притока и вакуумной линии так, что поток устойчив по ячейкам. Кроме того, минимизации трафика в микроскоп комнате, и перенаправление проектов из отверстия потолка воздуха от микроскоп может быть полезным. Альтернативу, которая хорошо зарекомендовала себя в своем опыте использования 37 ° C / 5% СО 2 инкубатор камер, в которых заключены все стадии и объективным. Они предлагают преимущества мониторинга клетки на ночь или дольше, но доступ к клеткам ограничено.
При необходимости, пауза покадровой приобретение и переориентировать изображение. Выполните переориентировать как можно быстрее, чтобы избегать изменения временного интервала между изображениями. - Типичный протокол будет состоять из 20-30 минут базовых образов, прежде чем добавлять агент тестирования следуют от 0,5 до 4 часов дополнительного захвата изображений. Длина эксперимент может быть ограничено фотообесцвечивания GFP с течением времени, поэтому важно выбирать кратчайшие сроки экспозиции. Он также может быть желательно, чтобы изменить интервал между изображениями промежуток времени до 30-60 с, если больше исследовании желательно.
4. Анализ данных
- Несколько пакетов программного обеспечения может быть использована для анализа изображения множества, такие как элементы NIS, Метаморф, Slidebook и т.д. Как правило, мы выполняем свою анализ изображений с использованием NIH ImageJ позволяет анализ на любом компьютере в нашей лаборатории или дома. Версии мы используем:
ФМС ImageJ ( http://www.macbiophotonics.ca/imagej/ )
Фиджи (я "целевых =" _blank "> http://pacific.mpi-cbg.de/wiki/index.php/Fiji). - ImageJ может быть использована для анализа многих динамических процессов, в том числе:
- Частота выступы lamellipodia
- Расстояние, время и скорость выступы
- Актина волокна движения с течением времени
- В ImageJ, когда открывается изображение, установленное число ломтик / всего ломтики будут отображаться в левом верхнем углу окна, вместе с именем файла, количество пикселей, тип файла, и размер. Z прокрутки на нижней соответствует времени. Кроме того, парящий над изображением курсор будет отображаться х, у и z. пиксель в нижней части панели инструментов ImageJ.
- Lamellipodia выступ может быть изучена путем определения числа новых выступы с течением времени. Это может быть сделано для всему периметру ячейки или выбранного региона. Этот тип анализа также может быть выполнена в nonconfluent, untransfected клеток с фазового контраста или DIC микроскопии. Однако, использование клеток, экспрессирующих GFP-актин позволяет анализировать сливной монослоев, особенно, когда клетки, содержащие и не хватает GFP-актин примыкают друг к другу.
- Lamellipodia выступ расстояние, настойчивость (время), и скорость можно оценить с помощью кимограф (линия сканирования) анализа. Нарисуйте линии, перпендикулярной к краю клетки (это самый легкий способ, если нет соседней клетке, или смежную ячейку не выражает GFP-актин). В ImageJ, нажатие "/" будет генерировать кимограф, с осью х представляющий гistance и оси ординат представления времени (15 с до 1 мин на пиксель в соответствии с руководящими принципами временной интервал выше). Линии могут быть сделаны более выступающие lamellipodia и размер ящика измеряется (нажатием клавиши M в ImageJ). Расстояние, время и скорость может быть вычислена.
- Движение стресс волокна могут также быть измерена кимограф анализа аналогичным образом.
5. Представитель Результаты:
С нашей трансфекции протокол, мы обычно видим выражение GFP-актин, по крайней мере 50% HUVEC трансфекции, и часто можно найти участки на покровное где> 90% HUVEC в регионе выразить GFP-актин. Примером живого эксперимента клетки с изображениями subconfluent HUVEC выражения GFP-актин показан в фильме 1. Для данного эксперимента, снимок был получен раз в минуту. Как можно видеть в фильме, GFP-актина в HUVEC можно наблюдать по всей цитоплазме, а также в нитевидные структурыUres и в местных lamellipodia выступающие вдоль края ячейки. Также очевидно в фильме является то, что GFP-актин выражение не является равномерным между клетками. Клетки выбрали для исследования обычно имеют достаточно GFP-актин настоящее время для визуализации различных структур, содержащих нитевидные актина. Клетки, экспрессирующие очень высокие уровни GFP-актин может быть проблематичным для исследования, так как в этих клетках он, как правило, трудно отличить F-актин структур из большого количества G-актин присутствует.
Фильм 2 показывает пример поведения сливной HUVEC выражения GFP-актин. Как subconflent HUVEC, активная lamellipodia формирования и обороте по периметру клетки была очевидной. Однако эти lamellipodia часто породило мембраны оборками, указывая на менее эффективные выступ 7. Это, вероятно, из-за присутствия соседних ячеек блокирование поблизости субстрат. Актина корковых волокон и стресс волокна также видны в кино 1 и 2. Хотя клеток мы оbserved оставались неподвижными, стресс волокна похожи на поперечные волокна дуги в мигрирующих клетках, образуя возле края ячейки и перемещение с боков к клеточный центр, где они разбирать 8, 9. Дополнительные динамические особенность наблюдается в этих клетках было формирование структуры актина кольцо, что расширение концентрически, которая ранее называлась актина облака 10.
Пример того, как расстояние, настойчивости и скорости клеточных выступов количественно из этих покадровой изображения множеств с помощью кимограф анализа показано на рисунке 1. На рисунке 1А, одна строка пикселей обращается примерно перпендикулярной границе ячейки для генерации кимограф (рис. 1б). В этом кимограф, области, определяемой линия расположена вертикально и изображения со всей покадровой укладываются горизонтально. Взгляд из слева направо в кимограф, выступы представлены в виде восходящего движения в край клетки. На рисунке 1С, линия вирerimposed на краю одного из этих выступов, и пиксельные данные, связанные с этой линии были собраны и показаны в окне результатов в нижней части панели. Этот анализ позволяет количественное выступ динамика, а также может быть использована для оценки выступ частота (количество выступов / время) в этой области клетки.
Пример анализа напряженно движение волокна показано на рисунке 2. Большинство волокон стресс мы наблюдали формируются вблизи периферии клетки и двинулся к клеточный центр, где они в конечном итоге разобрали. Это также может быть количественно кимограф анализа. Линия перпендикулярно границе ячейки и стресс волокон (рис. 2A) и кимограф образуется (рис. 2В). Стресс волокна выглядят как сплошные линии в цитоплазматической области, в кимограф, часто двигаться вниз и вправо (в направлении клеточный центр). Иногда волокна трудно увидеть в оригинальной кимограф, и в этих случаях мыиспользование маски нерезкости фильтр резкости изображения (рис. 2С). Линии нанесены на стресс волокон и пиксельные данные собираются использовании функция меры (рис. 2D). Альтернативный способ собрать эти данные, чтобы нарисовать линию от начала и до конца выявленных стресс волокна, чтобы получить средний уклон на время, что слой наблюдалось (рис. 2Е). Этот анализ позволяет количественное стресса волокна бокового движения, а также может быть использована для количественного числа стресс волокна в этом регионе наблюдается клетки.
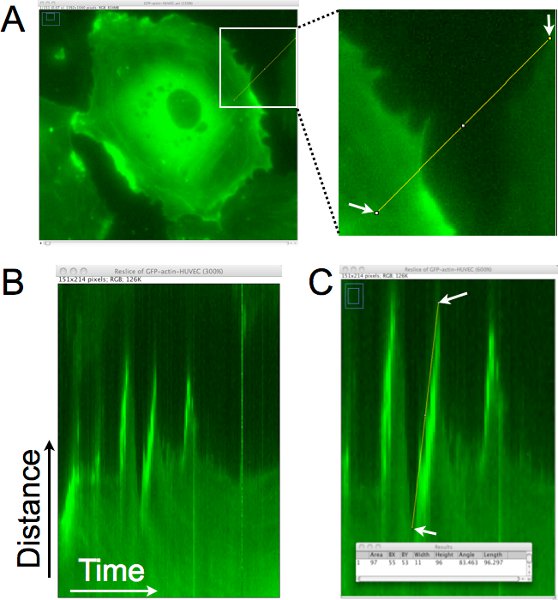
Рисунок 1. Кимограф анализ края ячейки, чтобы определить расстояние выступа, настойчивости и скорости местного lamellipodia.. Одной линии пикселей обращается примерно перпендикулярно к краю клетки. В этом регионе добывается из каждого образа покадровой набор для создания монтаж регионе с течением времени. B. В гоэлектронная результате кимограф, оси Х время, двигаясь слева направо, а ось у показывает расстояние. Движение края ячейки с течением времени может быть оценена в этой кимограф и lamellipodia определены регионы, где края ячейки, двигаясь вправо, идет вверх. C. Линия на границе ячейки, где выступ на lamellipodium выявлено не было. Размеры прямоугольника, ограничивающего линию, проведенную затем приобретенных (показано на наложенный окне). Ширина используется для расчета времени выступ или настойчивости. Высота используется для расчета выступ расстояния. Выступ скорость рассчитывается путем деления высоту на ширину. В этом примере вверх расстояние было 96 точек х 0,16125 мкм / пиксель = 15,5 мкм, а время было 11 пикселов х 1 мин. / пиксель = 11 мин. Скорость была рассчитана как 15,5 μm/11 мин. = 1,4 мкм / мин.

FРисунок 2. кимограф Анализ движения волокон актиновых стресс.. Одну строку пиксель перпендикулярно к краю ячейки для создания кимографе. B. Как показано на рис. 1, в результате кимограф, оси Х времени и оси ординат расстояние. Стресс волокна наблюдаются в виде непрерывных линий в клетке, часто собираемся вниз и вправо (стрелки) C. Чтобы лучше визуализировать напряжение волокон, фильтр Unsharp Mask может быть использован. В этом примере, радиус 3 пикселя и маску весом 0,60 был использован. D. Обычные линии пикселей, затем обращается за выявленные стресс волокна, и собранных данных. В этой панели три линии были нарисованы, а затем «удалить» была нажата, чтобы сделать постоянным аннотацию (белая линия) своих местах после каждого измерения. E. Или же, если среднее расстояние, время и скорость стресс волокно желании линию можно сделать из начала и окончания точек (желтая линия), а также данные длят, которые могут быть приобретены (выделено в окне результатов). Для этого примера, измерения проводились на это напряжение волокна в течение 37 кадров х 1 кадр / мин. = 37 мин. Расстояние, пройденное за этот период времени составила 75 кадров х 0,16125 мкм / пиксель = 12,1 мкм. В результате бокового скорость стресс волокна составил 12,1 μm/37min = 0,33 мкм / мин. Положительное значение для скорости предназначен для волокна движется к клеточный центр, и негативные для волокон движется к периферии.
Фильм 1. Покадровый изображения живых HUVEC выражения GFP-актин. Интервал между снимками составляет 1 мин. Местные lamellipodia торчали по всему периметру клетки. Кроме того, поперечные волокна напряжение дуги переехал с боков к центру клетки. Когда тромбина (1 ед / мл) добавляют к ванне, клетки контракту немного и внешние выступы lamellipodia паузу в течение приблизительно 10 мин. После клетки сжимается, lamellipodia формирования и оборота возобновить d. Нажмите сюда, чтобы посмотреть фильм.
Фильм 2. Сливной HUVEC выражения GFP-актин, до и после лечения с помощью тромбина. Прошедшее время отображается в правом нижнем углу, как минуты: секунды. Интервал между снимками составляет 30 s. Тромбина (1 ЕД / мл) после 45 мин. базового периода. Аннотированный события включают локальной формации lamellipodia и оборот (наконечники стрел вблизи сотовых края, 0:59 - 37:29), актин облака (стрелки, 1:59 - 21:29), и разрыв в tricellular узел, который расширяется после тромбина добавлен (стрелка, 62:30 - 70:00). Поперечные волокна напряжение дуги заметны также в несколько клеток. Клетки отображается активного формирования и оборота местного lamellipodia вдоль их границ, со многими что приводит к мембранным оборками. Тромбин вызвало паузу в lamellipodia формирования и оборота, и краткое появление некоторых малых промежутков между клетками.https://www.jove.com/files/ftp_upload/3187/Movie2-confluentHUVEC.avi "> Нажмите сюда, чтобы посмотреть фильм.
Обсуждение
Визуализации GFP-актин в живых клетках эндотелия позволяет детальный анализ динамики актина цитоскелета в ответ на воспалительные стимулы. Этот метод может быть также полезно опираться на предыдущие результаты исследования, реконструкции цитоскелета в ответ на физические силы, как напряжение сдвига 11. Кроме того, этот метод позволяет детальной оценки вклада актина цитоскелета динамику различных эндотелиальных деятельность клеток, включая миграцию, митоз, формирование межклеточных соединений и соединительных созревания, и поддержание барьерной функции.
В данных показал, поведение эндотелия цитоскелета актина можно наблюдать до и после лечения с помощью тромбина. Местные lamellipodia все по краям эндотелиальных клеток наблюдалось формирование и регресс в течение долгого времени в обоих nonconfluent и сливной монослоя клеток. Лечение тромбина ненадолго прерваться lamellipodia формуation и оборота. Тромбин также вызывает клетки сокращаться немного, в согласии с предыдущими докладами, что тромбин причины стресса актина формирование волокна и увеличение центростремительного развития напряженности в эндотелиальных клетках 12-14. Тем не менее, от живой клетки изображений исследования, такие, как эта, происхождение стресс волокна может быть определена. В HUVEC, большинство из стресса волокнах возникают на периферии клетки и напоминают волокна поперечной дуги в мигрирующих клетках 8, 9. Другой сильной стороной этого метода по сравнению с использованием фиксированных клеток, что количество стресса волокна могут быть определены количественно в отдельных клетках до и после лечения тромбина, устраняя ошибки отбора экспериментальных групп.
С помощью этого протокола мы оцениваем динамическое движение краю клетки и волокна актина стресса. Для того чтобы понять динамику актиновых мономеров в эндотелиальных клетках, более продвинутые методы, такие как флуоресценция восстановления после фотообесцвечивания (FRAP) или флуоресценции спекл-микроскопиикопия (ФШМ) может быть применена 15, 16. Кроме того, из клеток эндотелия капилляров может представлять лучшие модели микрососудистых барьерной функции, оптимизация трансфекции протоколов эффективно выразить GFP-актина в клетках эндотелия капилляров представляет логическое направление будущего.
Таким образом, изображение живых эндотелиальных клеток, экспрессирующих GFP-актин представляет собой мощный инструмент, чтобы определить, как эндотелиальные цитоскелета актина клетка реагирует на различные виды раздражителей. Исследования с использованием плотно сливной эндотелиальных монослоев поможет определить роль динамических структур, таких как актин-богатых lamellipodia и поперечные дуги напряжение волокон в функции эндотелия барьер. Кроме того, живые изображения ячейке эндотелиальных клеток, экспрессирующих GFP-актин или других белков слияния, которые позволяют визуализировать других субклеточных структур будет представить подробную пространственно-временной информации, необходимой для понимания сигнализации и структурные механизмы, которые гetermine барьер целостности.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
GFP-β-актина плазмида была любезно предоставлена д-р Уэйн Орр, LSUHSC-S отдел патологии, и усиливалось в лаборатории доктора Бекки Worthylake, LSUHSC-NO кафедрой фармакологии. Эта работа была поддержана грантами от Национального института здоровья (P20 RR-018766) и Американской ассоциации сердца (05835386N).
Материалы
| Name | Company | Catalog Number | Comments |
| 1. Рингер 5x со | |||
| Химический | Компания | Номер в каталоге | Количество |
| Хлористый натрий | EMD | SX0420-3 | 35 г |
| Хлористый калий | JT Baker | 3040 | 1,75 г |
| Хлорид кальция | Сигма | C-3881 | 1,47 г |
| Сульфат магния | Сигма | М-9397 | 1,44 г |
| Стерильные фильтрованной воды | N / A | N / A | Довести до 1 л |
| Стерильные фильтр в автоклаве бутылки и сохраняет при температуре 4 ° C | |||
| 2. MOPS буфера | |||
| Химический | Компания | Номер в каталоге | Количество |
| MOPS | Сигма | M3183 | 125,6 г |
| Стерильные фильтрованной воды | N / A | N / A | Довести до 1 л |
| Стерильные фильтр в автоклаве бутылки и сохраняет при температуре 4 ° C | |||
| 3. Альбумин физиологическим раствором соли (АПСС) | |||
| Химический | Компания | Номер в каталоге | Количество |
| Рингер акций (5x) | N / A | N / A | 200 мл |
| Швабры буфера | N / A | N / A | 5 мл |
| Фосфат натрия | Сигма | S-9638 | 0,168 г |
| Натрий Пируват | Сигма | P5280 | 0,22 г |
| Натриевая соль ЭДТА | Сигма | ED2SS | 0,0074 г |
| Глюкоза | Сигма | G7528 | 0,901 г |
| Альбумин, говядину | USB | 10856 | 10 г |
| Стерильные фильтрованной воды | N / A | N / A | Довести до 1 л |
| Отрегулируйте рН до 7,4 при 37 ° С, то стерильный фильтр в автоклаве бутылки и хранить при 4 ° C. | |||
| 4. 0,9% Соленая | |||
| Химический | Компания | Номер в каталоге | Количество |
| Хлористый натрий | EMD | SX0420-3 | 9 г |
| Стерильные фильтрованной воды | N / A | N / A | Довести до 1 л |
| Стерильные фильтр в автоклаве бутылки и сохраняет при температуре 4 ° C | |||
| 5. 1,5% раствор желатина | |||
| Желатин из кожи свиньи | Сигма | G2500 | 15 г |
| 0,9% Соленая | N / A | N / A | Довести до 1 л |
| Теплый раствор до 37 ° С для растворения желатина в достаточной степени. Еще теплый, стерильный фильтр в автоклаве бутылки и хранить при 4 ° C | |||
Ссылки
- Spindler, V., Schlegel, N., Waschke, J. Role of GTPases in control of microvascular permeability. Cardiovasc. Res. 87, 243-253 (2010).
- Wojciak-Stothard, B., Ridley, A. J. Rho GTPases and the regulation of endothelial permeability. Vascul. Pharmacol. 39, 187-199 (2002).
- Yuan, S. Y. Signal transduction pathways in enhanced microvascular permeability. Microcirculation. 7, 395-403 (2000).
- Birukov, K. G. Small GTPases in mechanosensitive regulation of endothelial barrier. Microvasc. Res. 77, 46-52 (2009).
- Duran, W. N., Sanchez, F. A., Breslin, J. W. Microcirculatory Exchange Function. Handbook of Physiology: Microcirculation. Tuma, R. F., Duran, W. N., Ley, K. , 2nd Edition, Elsevier. San Diego. 81-124 (2008).
- Hu, Y. L., Chien, S. Dynamic motion of paxillin on actin filaments in living endothelial cells. Biochem. Biophys. Res. Commun. 357, 871-876 (2007).
- Borm, B., Requardt, R. P., Herzog, V., Kirfel, G. Membrane ruffles in cell migration: indicators of inefficient lamellipodia adhesion and compartments of actin filament reorganization. Exp. Cell. Res. 302, 83-95 (2005).
- Hotulainen, P., Lappalainen, P. Stress fibers are generated by two distinct actin assembly mechanisms in motile cells. J. Cell. Biol. 173, 383-394 (2006).
- Pellegrin, S., Mellor, H. Actin stress fibres. J. Cell. Sci. 120, 3491-3499 (2007).
- Ballestrem, C., Wehrle-Haller, B., Imhof, B. A. Actin dynamics in living mammalian cells. J. Cell. Sci. 111, 1649-1658 (1998).
- Helmke, B. P., Rosen, A. B., Davies, P. F. Mapping mechanical strain of an endogenous cytoskeletal network in living endothelial cells. Biophys. J. 84, 2691-2699 (2003).
- Birukova, A. A., Smurova, K., Birukov, K. G., Kaibuchi, K., Garcia, J. G., Verin, A. D. Role of Rho GTPases in thrombin-induced lung vascular endothelial cells barrier dysfunction. Microvasc. Res. 67, 64-77 (2004).
- van Nieuw Amerongen, G. P., van Delft, S., Vermeer, M. A., Collard, J. G., van Hinsbergh, V. W. Activation of RhoA by thrombin in endothelial hyperpermeability: role of Rho kinase and protein tyrosine kinases. Circ. Res. 87, 335-340 (2000).
- Moy, A. B., Blackwell, K., Kamath, A. Differential effects of histamine and thrombin on endothelial barrier function through actin-myosin tension. Am J Physiol Heart Circ Physiol. 282, H21-H29 (2002).
- Wittman, T., Littlefield, R., Waterman-Storer, C. Fluorescent speckle microscopy of cytoskeletal dynamics in living cells. Live Cell Imaging: A Laboratory Manual. Goldman, R. D., Spector, D. L. , Cold Spring Harbor Laboratory Press. 184-204 (2005).
- Rabut, G., Ellenberg, J. Photobleaching techniques to study mobility and molecular dynamics of proteins in live cells: FRAP, iFRAP, and FLIP. Live Cell Imaging: A Laboratory Manual. Goldman, R. D., Spector, D. L. , Cold Spring Harbor Laboratory Press. 101-126 (2005).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены