Method Article
Studio del citoscheletro di actina in vivo le cellule endoteliali Esprimendo GFP-Actina
In questo articolo
Riepilogo
Immagini microscopiche dal vivo di cellule endoteliali che esprimono GFP-actina permette la caratterizzazione dei cambiamenti dinamici nelle strutture del citoscheletro. A differenza delle tecniche che utilizzano campioni fissati, questo metodo fornisce una valutazione dettagliata delle variazioni temporali del citoscheletro di actina nelle cellule stesse prima, durante e dopo vari stimoli fisici, farmacologici o infiammatoria.
Abstract
L'endotelio microvascolare svolge un ruolo importante come una barriera selettiva permeabile ai fluidi e soluti. Le giunzioni adesive tra cellule endoteliali regolano la permeabilità dell'endotelio, e molti studi hanno indicato l'importante contributo del citoscheletro a determinare l'integrità giunzionale 1-5. Una cintura di actina corticale è pensato per essere importante per il mantenimento di stabili svincoli 1, 2, 4, 5. Al contrario, lo stress delle fibre di actina sono pensati per generare tensione centripeta all'interno delle cellule endoteliali che indebolisce giunzioni 2-5. Gran parte di questa teoria si è basata su studi in cui sono trattate le cellule endoteliali con i mediatori infiammatori noti per aumentare la permeabilità endoteliale, e poi fissare le cellule e l'etichettatura di F-actina per l'osservazione microscopica. Tuttavia, questi studi forniscono una comprensione molto limitata del ruolo del citoscheletro delle cellule perché le immagini fisse fornire istantanee solo neltempo con nessuna informazione sulla dinamica delle strutture actina 5.
Live-cell imaging consente l'incorporazione della natura dinamica del citoscheletro di actina in studio dei meccanismi per determinare l'integrità endoteliale barriera. Uno dei principali vantaggi di questo metodo è che l'impatto di vari stimoli infiammatori sulle strutture di actina in cellule endoteliali può essere valutata alla stessa serie di cellule viventi, prima e dopo il trattamento, eliminando potenziali bias che possono verificarsi quando si osservano campioni fissati. Cellule endoteliali della vena ombelicale (HUVEC) sono transfettate con un GFP-β-actina plasmide e cresciuto fino a confluenza su lamelle di vetro. Time-lapse immagini di GFP-actina in HUVEC confluenti vengono catturati prima e dopo l'aggiunta di mediatori infiammatori che provocano tempo-dipendente cambiamenti nella integrità barriera endoteliale. Questi studi consentono l'osservazione visuale della sequenza fluida di cambiamenti nel citoscheletro di actina che contribuiscono a endotelil interruzione barriera e restauro.
I nostri risultati dimostrano costantemente locali, ricche di actina formazione lamellipodia e fatturato in cellule endoteliali. La formazione e la circolazione delle fibre di actina lo stress può anche essere osservato. L'analisi della frequenza di formazione e di fatturato del locale lamellipodia, prima e dopo il trattamento con stimoli infiammatori possono essere documentate da analisi chimografo. Questi studi forniscono informazioni importanti sulla natura dinamica del citoscheletro di actina in cellule endoteliali che può essere usato per scoprire i meccanismi molecolari precedentemente identificati importante per il mantenimento dell'integrità della barriera endoteliale.
Protocollo
1. Transfezione di HUVEC con GFP-actina
- Vari metodi possono essere usati per trasfettare HUVEC. Il nostro laboratorio utilizza il sistema Nucleofector (Lonza, Basilea Svizzera) riportate qui di seguito. In generale, lavorare velocemente per migliorare la vitalità cellulare e l'efficienza di trasfezione. Ogni trasfezione richiede 5 x 10 5 HUVEC che saranno seminate su due coprioggetto di vetro (Corning No. 1, 22 x 50 mm). L'elettroporazione Nucleofector combina reagenti chimici e di trasfezione di DNA plasmidico, e raggiunge una efficienza tipicamente espressione> 50%. Reagenti di transfezione chimici sono un metodo alternativo. Un gruppo è riuscito a bovino cellule endoteliali transfettate con GFP-actina usando il reagente GenePORTER 6. Il protocollo Nucleofector che usiamo è descritto di seguito.
- Presterilizzati coprioggetto cultureware o ordinaria può essere utilizzato, a seconda del tipo di camera. Per coprioggetto di vetro, sterilizzare in una cappa di sicurezza biologica mettendo il loro in una tavola 10 centimetri culturacontenente circa 5 ml di etanolo al 70% per 2 min. Raccoglierli con una pinza sterile e aria secca appoggiandosi contro il fianco di una piastra di coltura separate.
- Una volta asciutto, ogni coprioggetto nel proprio piatto 10 centimetri cultura. Pipettare 300 ul uno goccia di soluzione di gelatina calda (1,5% a 0,9% NaCl) al centro del vetrino e lasciare riposare per 5 minuti., E quindi aspirarla. Mantenere questo rivestimento matrice al centro, senza toccare i bordi, farà in modo che le cellule saranno seminate densamente e raggiungerà confluenza in fretta.
- Preparare una provetta da microcentrifuga 1,5 ml per la transfezione con 500 ml di EGM2MV media (Lonza) e mettere da parte a 37 ° C, 5% CO 2 incubatore.
- Staccare HUVEC con il 0,25% tripsina-EDTA e raccogliere in un tubo da 15 ml. Contare le celle. 5 x 10 5 cellule sono necessarie per ogni trasfezione. Regolare il volume di sospensione cellulare per ottenere un pellet che conterrà 5 x 10 5 cellule moltiplicate per il numero di transfeZIONI da eseguire.
- Centrifugare la sospensione cellulare in una centrifuga clinica a 5000 giri per 3 minuti a temperatura ambiente. Aspirare il surnatante inclinando il tubo per rimuovere mezzi di comunicazione il più possibile.
- Risospendere il pellet con Basic Solution Nucleofector sia dal HUVEC o primaria delle cellule endoteliali Nucleofector Kit (Lonza). Utilizzare 100 l per 5 x 10 5 cellule. A causa della tossicità di questa soluzione, è importante lavorare velocemente, mentre le cellule sono sospese in questa soluzione.
- Aggiungere la GFP-β-actina vettore plasmidico (0,2-2 mg per 100 ml di sospensione Nucleofector) al campione di trasfezione. 0,2-2 mg di GFP-actina DNA plasmidico per 5 x 10 5 cellule per trasfezione.
- Trasferire 100 ml di sospensione cellulare in un Cuvette Nucleofector. Coprire e toccare la cuvetta alcuni dei tempi per garantire la sospensione cellulare è tutto il senso fino in fondo.
- Posizionare la cuvetta nella fessura Nucleofector cuvetta II dispositivo ed eseguire il delettroporazione programma esired. Noi usiamo il programma A-034 per HUVEC.
- Ritorna la cuvetta alla cappa di sicurezza biologica. Portare uno dei tubi microcentrifuga dal 37 ° C incubatore che contiene 500 ml di EGM2MV alla cappa. Utilizzando uno dei trasferimento pipette fornite nel kit Nucleofector, delicatamente aggiungere il caldo 500 microlitri di supporti alla sospensione cellulare nella cuvetta. Trasferire tutto il contenuto della schiena cuvetta nella provetta per microcentrifuga e metterlo in incubatrice per 15 min. per consentire alle cellule di riprendersi.
- Ripetere i passaggi 9-11 come necessario se più celle devono essere transfettate.
- Una provetta da microcentrifuga contenente 600 ml di sospensione HUVEC trasfettate possono essere seminati su due lamelle. Sotto il cofano e con una micropipetta 1000 ml, pipettare delicatamente su e giù una volta per miscelare la sospensione, e poi posto 300 ul della sospensione direttamente su una gelatina rivestita coprioggetto. Non lasciate che la sospensione toccare il bordo del vetrino. Posto nel 37 ° C / 5% CO 2 incubatore per 1-4 ore per consentire l'attaccamento delle cellule.
- Dopo 1-4 h, esaminare le cellule transfettate per confermare che hanno attaccato al coprioggetto. Aggiungere quindi 10 ml di EGM2MV media, e ritorno alla piastra ai 37 ° C / 5% di CO2 incubatore. GFP-actina espressione in genere può essere osservato entro 4-8 ore. Gli esperimenti sono tipicamente eseguiti entro 24-48 h.
2. Impostazione del live-cellule in camera di imaging e di riscaldamento stadio
- Per la maggior parte dei nostri studi, abbiamo usato un Warner Instruments aperto diamante bagno (RC22) immessi in una PH-1 riscaldatore stadio, alimentato da un sistema a flusso gravità. Tuttavia, diverse opzioni sono disponibili per stadi di imaging cellulare, comprese le camere che accolgono i piatti di vetro cultura fondo, camere aperto vs chiuso, e vari microincubator / obiettivo combinazioni di riscaldamento e grandi sistemi incubatrice. In definitiva, la selezione della camera dipenderà da fattori tra cui la necessità di accedere al bagno di aggiungere un agente di test o di droga, wheci sarà il supporto statico o in condizioni di flusso e la durata dell'esperimento. Inoltre, a volte fattori come la temperatura può causare instabilità deriva fuoco, e può essere minimizzato da sistemi di controllo che può mantenere la vasca stabile e temperature obiettivo.
- Aliquota media sufficiente per l'esperimento. Noi aliquota 50 ml di albumina soluzione salina fisiologica (APSS; Tabella 1) per ogni ora l'esperimento durerà.
- Un sistema di pompa o la gravità di flusso possono essere usati per fornire supporto alla camera. Per il nostro sistema, aggiungiamo APSS ad un semplice sistema a flusso gravità costruito da una linea di flusso per via endovenosa, collegato ad un radiatore in linea (Warner Instruments modello SH-27A). Noi applichiamo il flusso a circa 40 ml / h.
- Se una camera da bagno aperta come la nostra, saranno utilizzati, applicare grasso per vuoto verso il bordo esterno sul lato inferiore del bagno di diamanti e con un cotone con punta dell'applicatore. Successivamente, si ottiene una cellula coperta coprioggetto dal termostato, e sollevare delicatamente il coprioggetto utilizzando pinze. Gently toccare il sedere ad un kimwipe per assorbire l'eccesso medio, mantenendo la cellula coperta di lato bagnato. Con le cellule a faccia in su, posto il bagno diamante negli coprioggetto per formare una camera.
- Introdurre rapidamente la camera nella stufa palco e stringere a mano i morsetti sopra la camera. Una delle principali preoccupazioni in questa fase è la possibilità che le cellule si asciughino. Perciò è importante lavorare in modo rapido e una volta fatto, subito pipetta ~ 1 ml di terreno nella camera per evitare che le cellule si secchi.
- La nostra camera permette di flusso costante del mezzo sulle celle. Poco prima di accendere il flusso, è importante per collegare un tubo di aspirazione al suo titolare sulla camera per consentire l'uscita del terreno di coltura in eccesso (APSS). Il riscaldatore in linea bagno e riscaldamento dovrebbe anche essere attivata su un questo punto (a 37 ° C). Il nostro sistema ha anche una sonda a termistore per controllare la temperatura, che dovrebbe essere posto sul bordo della vasca.
- Asciugare con cura la parte inferiore del coverslip con un kimwipe imbevuto con il 70% EtOH per rimuovere i media rimanenti EGM2MV e l'accumulo di sale. Pulire una seconda volta con un kimwipe asciutto o carta per lenti.
- Dopo che la camera è stata costituita, il flusso è attivo, e la temperatura è costante a 37 ° C, permettono alle cellule di almeno 30 minuti per regolare e stabilizzare prima di iniziare l'esperimento.
- In attesa, attivare tutte le componenti del live-microscopio delle cellule di imaging (lampade, controller ruota portafiltri, macchina fotografica, computer).
3. Acquisizione di dati con live-microscopio delle cellule di imaging
- Vari sistemi di microscopia delle cellule vive sono disponibili. Il nostro sistema è una Nikon Eclipse TE-2000U con i seguenti componenti:
- Sutter Instruments Lambda LS 300 W lampada allo xeno
- Sutter Instruments Lambda 10-3 ruota eccitazione filtro con SmartShutter e S492 filtro (D350 e S572 filtri eccitatori sono disponibili anche per applicazioni UV e RFP)
- Dicroici emettitore 2002bs (Nikon 61002m)
- CI Plan Fluor Obiettivo DLL 10X, NA 0,30 (Nikon MRH10100)
- Plan Fluor ELWD Obiettivo 40X DM, NA 0,60 (Nikon MRH08420)
- Piano di Apo VC 100X Obiettivo olio, NA 1,40 (Nikon MRD01901)
- Photometrics CoolSNAP HQ2 telecamera, 1392 x 1040 serie di immagini, 6,45 x 6,45 micron pixel
(Roper Scientific) - Ci sono anche due pacchetti software che possono essere utilizzati per l'acquisizione delle immagini. Elementi-AR Nikon 3.0 e Metamorph 6.1.
- Dopo aver visto le cellule e la ricerca di una superficie adeguata per lo studio, bloccare la manopola grossolana messa a fuoco e controllare le impostazioni di acquisizione del software in modo che:
- La ruota portafiltri è fissata per il filtro S492 (con l'etichetta "CIC", nella nostra configurazione)
- Nel software di acquisizione, l'obiettivo è impostato per corrispondere l'ingrandimento desiderato (il nostro microscopio non è motorizzato, ma questa imposta il micron / pixel ratio). Assicurarsi inoltre che l'obiettivo Optivar sul microscopio è impostato ingrandimento 1.0X. Impostazione della optivar a 1.5X può aumentare l'ingrandimento, ma a scapito di perdere intensità del segnale.
L'ingrandimento da utilizzare dipende dalla finalità dello studio. Per il miglior dettaglio, un obiettivo 100X con un'apertura elevata numerica fornirà la migliore risoluzione spaziale e la trasmissione del segnale. Il nostro microscopio è inoltre dotato di un obiettivo di lunga distanza di lavoro 40X destinato a una diversa applicazione che richiede la distanza in più. Tuttavia, questo obiettivo può essere utile quando si vuole osservare più celle contemporaneamente, e funziona bene per la visualizzazione degli organelli di dimensioni delle strutture, anche se a costo di perdere la risoluzione spaziale e l'intensità del segnale. Per qualsiasi studio in cui l'intensità del segnale è un endpoint, o per ulteriori tecniche di imaging avanzate, come la microscopia a fluorescenza speckle, un obiettivo 100X è raccomandato. - Il tempo di esposizione della fotocamera si trova tra il 0,5-2 s. Questo dipende dalla GFP-actina intensità nelle cellule. Generalmente usiamo il tempo di esposizione più basso possibile per evitare blDIDATTICA della GFP-actina e potenziale tossicità per le cellule.
- Per ottenere la migliore risoluzione, la categorizzazione dovrebbe essere fissato a 1 x 1 e Gain a 1. In alcuni casi abbiamo impostato binning a 2 x 2 per ridurre il tempo di esposizione, ma questo riduce la precisione delle misure che possiamo fare su oggetti in movimento in time-lapse di studio.
- Configurare il time-lapse impostazioni:
- Scegliere la cartella in cui salvare le immagini catturate e digitare un nome di file.
- Impostare il numero di immagini e tempi di durata dell'intervallo per l'esperimento. Usiamo tipicamente a 15 s per intervalli di 1 minuto tra le immagini e fino a 2 ore per tutta la durata.
- Assicurarsi che l'otturatore attivo è impostato per essere chiuso tra le acquisizioni.
- Prima di iniziare il time-lapse di acquisizione dell'immagine, spegnere le luci della stanza e catturare una singola immagine per controllare le impostazioni.
- Anche catturare un'immagine campo chiaro. Assicurarsi che il condensatore è impostata la fase di corretta o filtro DIC. Accenderela lampada alogena e raccogliere l'immagine. Spegnere la lampada alogena.
- Tornare a "CIC" impostazioni per il time-lapse imaging e catturare un'immagine di prova.
- Cattura il time-lapse serie.
Durante l'esperimento, è importante monitorare le immagini così come sono acquisite. In alcuni casi piccole variazioni di temperatura all'interno della camera può causare deriva fuoco. Ciò può essere evitato, ottimizzando l'afflusso e le linee di vuoto in modo che il flusso è costante sulle celle. Inoltre, riducendo al minimo il traffico in camera microscopio, e riorientare tratte da prese d'aria lontano dal soffitto al microscopio può essere utile. Un'alternativa che ha funzionato bene nella nostra esperienza è l'uso di 37 ° C / 5% di CO 2 camere di incubatore che racchiudono l'intera fase e obiettivo. Questi offrono il vantaggio di cellule di monitoraggio durante la notte o più, ma l'accesso alle cellule è limitata.
Se necessario, mettere in pausa il time-lapse di acquisizione e rimettere a fuoco l'immagine. Eseguire la riorientare il più rapidamente possibile non alterare l'intervallo di tempo tra le immagini. - Un protocollo tipico sarà composto da 20-30 minuti di immagini di base prima di aggiungere un agente di test seguiti da 0,5 a 4 ore di acquisizione di immagini aggiuntive. La lunghezza di questo esperimento può essere limitata da photobleaching del GFP nel corso del tempo, che è perché è importante scegliere il più breve tempo possibile esposizione. Può anche essere opportuno modificare l'intervallo tra le immagini lasso di tempo a 30-60 s se uno studio a più si desidera.
4. Analisi dei dati
- Diversi pacchetti software può essere utilizzato per analizzare il set di immagini, come ad esempio elementi NIS, Metamorph, Slidebook, ecc tipicamente effettuare la nostra analisi dell'immagine utilizzando NIH ImageJ consente analisi su qualsiasi computer sul nostro laboratorio oa casa. Le versioni da noi utilizzati sono:
MBF ImageJ ( http://www.macbiophotonics.ca/imagej/ )
FIJI (i "target =" _blank "> http://pacific.mpi-cbg.de/wiki/index.php/Fiji). - ImageJ può essere utilizzato per analizzare molti processi dinamici, tra cui:
- Frequenza delle sporgenze lamellipodia
- Distanza, tempo e velocità di sporgenze
- Fibra di actina movimento nel tempo
- In ImageJ, quando l'immagine si apre impostare il numero di slice / fette totale sarà visualizzata nell'angolo in alto a sinistra della finestra, insieme con il nome del file, il numero di pixel, tipo di file, e le dimensioni. La Z barra di scorrimento sul fondo corrisponde al tempo. Inoltre, passando il puntatore sopra l'immagine verrà visualizzata la x, y, z pixel posizione sulla parte inferiore della barra degli strumenti ImageJ.
- Protrusione Lamellipodia può essere studiata attraverso la determinazione del numero di sporgenze nuovo corso del tempo. Questo può essere fatto per il perimetro intera cella o di una regione selezionata. Questo tipo di analisi può essere eseguita anche in nonconfluent, le cellule untransfected con contrasto di fase o microscopia DIC. Tuttavia, utilizzando cellule che esprimono GFP-actina permette l'analisi di monostrati confluenti, in particolare quando le cellule contenenti e privi di GFP-actina sono adiacenti l'uno all'altro.
- Distanza protrusione Lamellipodia, persistenza (tempo), e la velocità può essere valutata chimografo (linea di scansione) analisi. Disegnare una linea perpendicolare al bordo di una cella (è molto più semplice se non ci sono celle adiacenti, o la cella adiacente non esprime GFP-actina). In ImageJ, premendo il tasto "/" genererà un chimografo, con l'asse x rappresenta distance e l'asse y rappresenta il tempo (15 s per 1 min per pixel in base alle linee guida intervallo di tempo precedente). Le linee possono essere redatto su un lamellipodia sporgente e le dimensioni misurate box (premendo M in ImageJ). La distanza, tempo, velocità e può quindi essere calcolato.
- Il movimento delle fibre di stress può anche essere misurata attraverso l'analisi chimografo in modo simile.
5. Rappresentante dei risultati:
Con il nostro protocollo di trasfezione, di solito vedere l'espressione di GFP-actina in almeno il 50% delle HUVEC trasfettate, e spesso possono trovare aree sul vetrino in cui> 90% delle HUVEC nella regione di esprimere la GFP-actina. Un esempio di un esperimento dal vivo imaging cellulare con HUVEC subconfluent che esprimono GFP-actina è mostrato in Movie 1. Per questo particolare esperimento, un'immagine è stata acquisita una volta al minuto. Come si può vedere nel film, GFP-actina in HUVEC può essere osservato in tutto il citoplasma, così come nella struttura filamentosatransnazionali e locali in lamellipodia sporgenti lungo il bordo della cella. Evidente anche nel film è che la GFP-actina espressione non è uniforme tra le cellule. Scelto per lo studio delle cellule in genere hanno abbastanza GFP-actina presente per visualizzare varie strutture contenenti actina filamentosa. Cellule che esprimono livelli molto alti di GFP-actina può essere problematico per lo studio, perché in queste cellule è in genere difficile distinguere F-actina strutture dalla elevata quantità di G-actina presente.
Movie 2 mostra un esempio del comportamento di HUVEC confluenti che esprimono GFP-actina. Come il HUVEC subconflent, attivo formazione lamellipodia e fatturato lungo i perimetri delle cellule era evidente. Tuttavia, questi lamellipodia spesso hanno dato luogo a membrana volant, indicando protrusione meno efficiente 7. Questo è probabilmente dovuto alla presenza di celle adiacenti bloccando il substrato nelle vicinanze. Fibre di actina corticale e fibre di stress sono visibili anche in Film 1 e 2. Anche se le cellule si observed rimasta stazionaria, le fibre di stress sono simili alle fibre arco trasversale migrazione delle cellule, formando vicino al bordo delle cellule e spostando lateralmente verso il centro della cella in cui si smontare 8, 9. Un'ulteriore caratteristica dinamica osservata in queste cellule è stata la formazione di strutture ad anello di actina che si è espansa in modo concentrico, precedentemente denominata actina nuvole 10.
Un esempio di come la distanza, la persistenza e la velocità di protrusioni cellulari vengono quantificati da questi time-lapse immagine fissa con l'analisi chimografo è mostrato in Figura 1. Nella Figura 1A, una linea di singolo pixel viene disegnato approssimativamente perpendicolare al bordo delle cellule per la generazione di un chimografo (Figura 1B). In questo chimografo, la regione definita dalla linea è posta in verticale e le immagini provenienti da tutto il time-lapse sono impilati in senso orizzontale. Guardando da sinistra a destra nella chimografo, protrusioni sono rappresentati come movimenti verso l'alto nel bordo della cella. Nella Figura 1C, una linea è stata superimposed sul bordo di una di queste sporgenze, nonché i dati dei pixel associati a tale linea sono stati raccolti e vengono visualizzati nella finestra Risultati nella parte inferiore del pannello. Questa analisi consente la quantificazione delle dinamiche protrusione, e può anche essere usato per stimare la frequenza sporgenza (numero di sporgenze / tempo) in questa regione della cellula.
Un esempio di analisi del movimento sforzo delle fibre è mostrato in Figura 2. Fibre più lo stress che abbiamo osservato formata vicino alla periferia delle cellule e spostato verso il centro della cellula, dove alla fine smontato. Questo può anche essere quantificato con l'analisi chimografo. Si traccia una linea perpendicolare al bordo delle cellule e le fibre stress (Figura 2A) e un chimografo viene generato (Figura 2B). Le fibre di stress appaiono come linee continue nella zona citoplasmatica in chimografo, spesso in movimento verso il basso e verso destra (verso il centro della cella). A volte le fibre sono difficili da vedere nella chimografo originale, e in questi casi siutilizzare il filtro maschera di contrasto per rendere più nitida l'immagine (Figura 2C). Le linee sono disegnate sulle fibre di stress ed i dati dei pixel vengono raccolti utilizzando la funzione di misura (Figura 2D). Un modo alternativo per raccogliere questi dati è quello di tracciare una linea dall'inizio alla fine della fibra di stress individuato per ottenere la pendenza media per la durata che la fibra è stata osservata (2E Figura). Questa analisi consente la quantificazione del movimento laterale in fibra di stress e può anche essere utilizzato per quantificare il numero di fibre di stress osservato in questa regione della cellula.
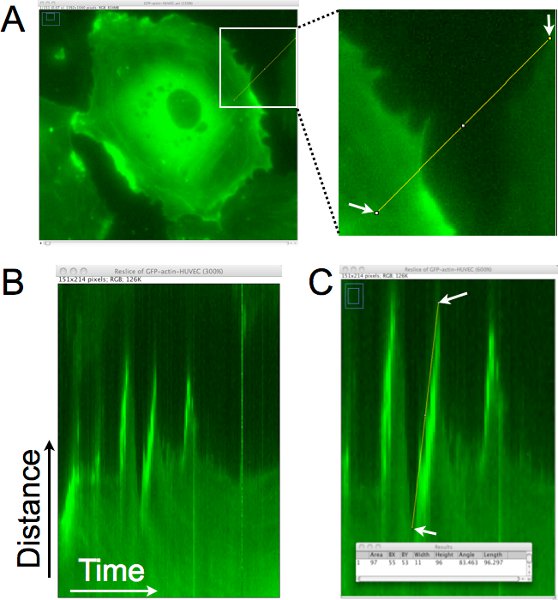
Figura 1. Chimografo analisi del bordo cella per determinare la distanza di protrusione, la persistenza e la velocità di locali lamellipodia. A. Una linea singolo pixel viene disegnato approssimativamente perpendicolare al bordo della cella. Questa regione viene estratto da ogni immagine del time-lapse impostato per generare un montaggio della regione nel corso del tempo. B. In the conseguente chimografo, l'asse x rappresenta il tempo, muovendosi da sinistra a destra, e l'asse y mostra la distanza. Movimento del bordo di cellule nel tempo possono essere valutati in questa chimografo e lamellipodia sono identificati regioni in cui il limite di cella, in movimento verso destra, va verso l'alto. C. Una linea è disegnata sul bordo cella dove una sporgenza da un lamellipodium è stato identificato. Le dimensioni del rettangolo di delimitazione per la linea tracciata vengono poi acquisite (mostrato nella finestra sovrapposta). La larghezza viene utilizzato per calcolare il tempo di protrusione o di persistenza. L'altezza è utilizzato per calcolare la distanza sporgenza. La velocità sporgenza è calcolato dividendo l'altezza per la larghezza. In questo esempio, la distanza verso l'alto è stato 96 pixel x 0,16125 micron / pixel = 15,5 micron, e il tempo è stato di 11 pixel x 1 min. / pixel = 11 min. La velocità è stato calcolato come 15,5 μm/11 min. = 1,4 micron / min.

FIGURA 2. chimografo analisi del movimento delle fibre di stress di actina. A. Una linea singolo pixel è perpendicolare al bordo della cella per generare un chimografo. B. Come mostrato in fig. 1, nel chimografo risultante, l'asse delle ascisse rappresenta il tempo e l'asse y distanza. Fibre di stress sono osservate come linee continue nella cella, spesso andando verso il basso e verso destra (frecce) C. Per meglio visualizzare le fibre di stress, il filtro maschera di contrasto può essere utilizzato. In questo esempio, un raggio di 3 pixel e peso maschera di 0,60 è stato utilizzato. D. Linee singolo pixel vengono poi disegnati sopra la fibra di stress identificati, e dei dati raccolti. In questo pannello di tre linee sono state disegnate e poi "elimina" è stato premuto per fare una annotazione permanente (linea bianca) delle loro posizioni dopo ogni misurazione. E. In alternativa, se la distanza media, il tempo e la velocità della fibra stress è desiderato, una linea si possono trarre da punti di inizio e fine (linea gialla), ed i dati perr che possono essere acquisite (evidenziato nella finestra Risultati). Per questo esempio, le misurazioni sono state fatte su questa fibra stress per 37 fotogrammi x 1 min telaio /. = 37 min. La distanza percorsa in questo periodo di tempo era di 75 frame x 0,16125 micron / pixel = 12,1 micron. La velocità risultante laterale della fibra di stress è stato del 12,1 μm/37min = 0,33 micron / min. Un valore positivo per la velocità viene assegnato per le fibre di muoversi verso il centro delle cellule, e negativi per le fibre in movimento verso la periferia.
Movie 1. Time-lapse immagini di vivere HUVEC esprimono GFP-actina. L'intervallo tra le immagini è di 1 min. Locali lamellipodia sporgeva lungo tutto il perimetro delle cellule. Inoltre, fibre di stress trasversale arco spostato lateralmente verso il centro delle cellule. Quando trombina (1 U / ml) è stato aggiunto al bagno, le cellule leggermente contratta e le sporgenze verso l'esterno di lamellipodia in pausa per circa 10 min. Dopo la contrazione delle cellule, la formazione lamellipodia e fatturato riprendere d. Clicca qui per guardare il film.
Movie 2. HUVEC confluenti che esprimono GFP-actina, prima e dopo il trattamento con trombina. Tempo trascorso viene visualizzato nell'angolo in basso a destra come minuti: secondi. L'intervallo tra le immagini è di 30 s. Trombina (1 U / ml) è stata aggiunta dopo la min 45. periodo di riferimento. Eventi annotati includono formazione lamellipodia e fatturato (punte di freccia vicino ai bordi delle cellule, 0:59 - 37:29), actina nuvole (frecce, 1:59-21:29), e un gap ad un bivio tricellular che si allarga dopo trombina viene aggiunto (freccia, 62:30 - 70:00). Trasversale delle fibre di stress arco sono anche evidente in molte delle cellule. Le cellule visualizzata formazione attiva e un fatturato di locali lamellipodia lungo il loro perimetro, con molti dando vita a membrana volant. La trombina ha causato una pausa nella formazione lamellipodia e fatturato, e la breve apparizione di alcuni piccoli spazi tra le cellule.https://www.jove.com/files/ftp_upload/3187/Movie2-confluentHUVEC.avi "> Clicca qui per guardare il film.
Discussione
L'imaging di GFP-actina in cellule endoteliali consente di vivere una dettagliata analisi delle dinamiche del citoscheletro di actina in risposta a stimoli infiammatori. Questo metodo può essere utile anche a sviluppare i risultati precedenti che mostrano rimodellamento del citoscheletro in risposta a forze fisiche come lo stress di taglio 11. Inoltre, questo metodo permette una valutazione dettagliata del contributo delle dinamiche di actina del citoscheletro a diverse attività delle cellule endoteliali, compresa la migrazione, la mitosi, la formazione di giunzioni intercellulari e maturazione giunzionale, e il mantenimento della funzione di barriera.
Nei dati riportati, il comportamento del citoscheletro di actina endoteliali possono essere osservati prima e dopo il trattamento con trombina. Lamellipodia locali tutti lungo i bordi delle cellule endoteliali è stata osservata formazione e regredire nel tempo in monostrati cellulari sia nonconfluent e confluenti. Il trattamento con trombina interrotto brevemente forma lamellipodiazione e fatturato. La trombina anche causato alle cellule di contratto leggermente, in accordo con i rapporti precedenti che lo stress provoca la formazione di trombina in fibra di actina e il rafforzamento dello sviluppo centripeto tensione nelle cellule endoteliali 12-14. Tuttavia, da studi di imaging dal vivo delle cellule di questo tipo, l'origine delle fibre di stress può essere determinato. In HUVEC, la maggior parte delle fibre di stress origine alla periferia delle cellule e fibre assomigliano arco trasversale nella migrazione delle cellule 8, 9. Altro punto di forza di questo metodo rispetto all'uso di cellule fissa è che il numero di fibre di stress può essere quantificato in celle individuali prima e dopo il trattamento trombina, eliminando bias di selezione tra i gruppi sperimentali.
Con questo protocollo si valuta il movimento dinamico del bordo delle cellule e le fibre di stress di actina. Per capire le dinamiche monomero di actina in cellule endoteliali, le tecniche più avanzate, come il recupero di fluorescenza dopo photobleaching (FRAP) o fluorescenza speckle microcopia (FSM) può essere applicato 15, 16. Inoltre, poiché cellule endoteliali possono rappresentare un modello migliore della funzione di barriera microvascolare, l'ottimizzazione dei protocolli di trasfezione per esprimere efficacemente GFP-actina in cellule endoteliali rappresenta una direzione logica futuro.
In sintesi, l'imaging dal vivo di cellule endoteliali che esprimono GFP-actina rappresenta un potente strumento per determinare come il citoscheletro delle cellule endoteliali risponde a vari tipi di stimoli. Gli studi che utilizzano monostrati endoteliali strettamente confluenti aiuterà a determinare i ruoli delle strutture dinamiche come actina-lamellipodia ricco e trasversale delle fibre arco stress in funzione di barriera endoteliale. Inoltre, l'imaging cellulare dal vivo delle cellule endoteliali che esprimono GFP-actina o altre proteine di fusione che consentono la visualizzazione di altre strutture subcellulari fornirà dettagliate informazioni spazio-temporali necessarie per comprendere i meccanismi di segnalazione e strutturali che determine barriera integrità.
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
La GFP-β-actina plasmide è stato generosamente offerto dal Dr. Wayne Orr, LSUHSC-S Dipartimento di Patologia, ed è stato amplificato nel laboratorio del Dr. Becky Worthylake, LSUHSC-NO Dipartimento di Farmacologia. Questo lavoro è stato sostenuto dalle concessioni dal National Institutes of Health (P20 RR-018766) e l'American Heart Association (05835386N).
Materiali
| Name | Company | Catalog Number | Comments |
| 1. Suoneria Archivi 5x | |||
| Chimico | Azienda | Numero di catalogo | Quantità |
| Cloruro di sodio | EMD | SX0420-3 | 35 g |
| Cloruro di potassio | JT Baker | 3040 | 1,75 g |
| Cloruro di calcio | Sigma | C-3881 | 1,47 g |
| Solfato di Magnesio | Sigma | M-9397 | 1,44 g |
| Acqua sterile filtrata | N / A | N / A | Portare a 1 L |
| Filtro sterile in bottiglie in autoclave e negozi a 4 ° C | |||
| 2. MOPS buffer di | |||
| Chimico | Azienda | Numero di catalogo | Quantità |
| MOPS | Sigma | M3183 | 125,6 g |
| Acqua sterile filtrata | N / A | N / A | Portare a 1 L |
| Filtro sterile in bottiglie in autoclave e negozi a 4 ° C | |||
| 3. Albumina soluzione fisiologica (APSS) | |||
| Chimico | Azienda | Numero di catalogo | Quantità |
| Ringer magazzino (5x) | N / A | N / A | 200 mL |
| Mops Buffer | N / A | N / A | 5 mL |
| Fosfato di sodio | Sigma | S-9638 | 0,168 g |
| Piruvato di sodio | Sigma | P5280 | 0,22 g |
| EDTA sale di sodio | Sigma | ED2SS | 0,0074 g |
| Glucosio | Sigma | G7528 | 0,901 g |
| Albumina, bovina | USB | 10856 | 10 g |
| Acqua sterile filtrata | N / A | N / A | Portare a 1 L |
| Regolare il pH a 7,4 a 37 ° C, poi filtro sterile in bottiglia in autoclave e conservare a 4 ° C. | |||
| 4. 0,9% Saline | |||
| Chimico | Azienda | Numero di catalogo | Quantità |
| Cloruro di sodio | EMD | SX0420-3 | 9 g |
| Acqua sterile filtrata | N / A | N / A | Portare a 1 L |
| Filtro sterile in bottiglie in autoclave e negozi a 4 ° C | |||
| 5. 1,5% Soluzione di gelatina | |||
| Gelatina da pelle del maiale | Sigma | G2500 | 15 g |
| 0,9% Saline | N / A | N / A | Portare a 1 L |
| Caldo la soluzione a 37 ° C per sciogliere la gelatina a sufficienza. Mentre sono ancora calde, filtro sterile in bottiglie in autoclave e conservare a 4 ° C | |||
Riferimenti
- Spindler, V., Schlegel, N., Waschke, J. Role of GTPases in control of microvascular permeability. Cardiovasc. Res. 87, 243-253 (2010).
- Wojciak-Stothard, B., Ridley, A. J. Rho GTPases and the regulation of endothelial permeability. Vascul. Pharmacol. 39, 187-199 (2002).
- Yuan, S. Y. Signal transduction pathways in enhanced microvascular permeability. Microcirculation. 7, 395-403 (2000).
- Birukov, K. G. Small GTPases in mechanosensitive regulation of endothelial barrier. Microvasc. Res. 77, 46-52 (2009).
- Duran, W. N., Sanchez, F. A., Breslin, J. W. Microcirculatory Exchange Function. Handbook of Physiology: Microcirculation. Tuma, R. F., Duran, W. N., Ley, K. , 2nd Edition, Elsevier. San Diego. 81-124 (2008).
- Hu, Y. L., Chien, S. Dynamic motion of paxillin on actin filaments in living endothelial cells. Biochem. Biophys. Res. Commun. 357, 871-876 (2007).
- Borm, B., Requardt, R. P., Herzog, V., Kirfel, G. Membrane ruffles in cell migration: indicators of inefficient lamellipodia adhesion and compartments of actin filament reorganization. Exp. Cell. Res. 302, 83-95 (2005).
- Hotulainen, P., Lappalainen, P. Stress fibers are generated by two distinct actin assembly mechanisms in motile cells. J. Cell. Biol. 173, 383-394 (2006).
- Pellegrin, S., Mellor, H. Actin stress fibres. J. Cell. Sci. 120, 3491-3499 (2007).
- Ballestrem, C., Wehrle-Haller, B., Imhof, B. A. Actin dynamics in living mammalian cells. J. Cell. Sci. 111, 1649-1658 (1998).
- Helmke, B. P., Rosen, A. B., Davies, P. F. Mapping mechanical strain of an endogenous cytoskeletal network in living endothelial cells. Biophys. J. 84, 2691-2699 (2003).
- Birukova, A. A., Smurova, K., Birukov, K. G., Kaibuchi, K., Garcia, J. G., Verin, A. D. Role of Rho GTPases in thrombin-induced lung vascular endothelial cells barrier dysfunction. Microvasc. Res. 67, 64-77 (2004).
- van Nieuw Amerongen, G. P., van Delft, S., Vermeer, M. A., Collard, J. G., van Hinsbergh, V. W. Activation of RhoA by thrombin in endothelial hyperpermeability: role of Rho kinase and protein tyrosine kinases. Circ. Res. 87, 335-340 (2000).
- Moy, A. B., Blackwell, K., Kamath, A. Differential effects of histamine and thrombin on endothelial barrier function through actin-myosin tension. Am J Physiol Heart Circ Physiol. 282, H21-H29 (2002).
- Wittman, T., Littlefield, R., Waterman-Storer, C. Fluorescent speckle microscopy of cytoskeletal dynamics in living cells. Live Cell Imaging: A Laboratory Manual. Goldman, R. D., Spector, D. L. , Cold Spring Harbor Laboratory Press. 184-204 (2005).
- Rabut, G., Ellenberg, J. Photobleaching techniques to study mobility and molecular dynamics of proteins in live cells: FRAP, iFRAP, and FLIP. Live Cell Imaging: A Laboratory Manual. Goldman, R. D., Spector, D. L. , Cold Spring Harbor Laboratory Press. 101-126 (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon