Method Article
Studie des Aktin-Zytoskeletts in Live Endothelial Cells, die GFP-Aktin
In diesem Artikel
Zusammenfassung
Mikroskopische Aufnahmen von Live-Endothelzellen exprimieren GFP-Aktin ermöglicht die Charakterisierung der dynamischen Veränderungen in Zytoskelettstrukturen. Im Gegensatz zu Techniken, die fixierten Proben verwenden, bietet diese Methode eine detaillierte Bewertung der zeitlichen Veränderungen in der Aktin-Zytoskelett in den gleichen Zellen vor, während und nach verschiedenen physikalischen, pharmakologischen oder entzündliche Reize.
Zusammenfassung
Die mikrovaskuläre Endothel spielt eine wichtige Rolle als eine selektiv durchlässige Barriere gegen Flüssigkeiten und gelöste Stoffe. Der Klebstoff Übergänge zwischen Endothelzellen regulieren Permeabilität des Endothels, und viele Studien haben den wichtigen Beitrag des Aktin-Zytoskeletts auf die Bestimmung junctional Integrität 1-5 angegeben. Ein kortikalen Aktin-Gürtel wird angenommen, dass für die Aufrechterhaltung stabiler Verbindungen 1, 2, 4, 5 wichtig. Im Gegensatz dazu sind Aktin-Stress-Fasern gedacht, zentripetalen Spannungen innerhalb Endothelzellen, die Kreuzungen 2-5 schwächt generieren. Ein großer Teil dieser Theorie hat sich auf Studien, in denen Endothelzellen mit Entzündungsmediatoren bekannt endotheliale Permeabilität zu erhöhen behandelt werden, und dann Fixierung der Zellen und Kennzeichnung F-Aktin für die mikroskopische Beobachtung basiert. Allerdings liefern diese Studien ein sehr begrenztes Verständnis von der Rolle des Aktin-Zytoskeletts, weil Bilder von fixierten Zellen nur Momentaufnahmen liefern inZeit ohne Informationen über die Dynamik des Aktin-Strukturen 5.
Live-Cell-Imaging ermöglicht Einbindung der dynamischen Natur des Aktin-Zytoskeletts in den Studien über die Mechanismen der Bestimmung endothelialen Barriere Integrität. Ein großer Vorteil dieser Methode ist, dass die Auswirkungen der verschiedenen entzündlichen Stimuli auf Aktin-Strukturen in Endothelzellen in die gleiche Gruppe von lebenden Zellen vor und nach der Behandlung beurteilt werden kann, Beseitigung möglicher Bias, die auftreten, wenn die Beobachtung fixierten Proben können. HUVEC-Zellen (HUVEC) mit einem GFP-β-Aktin transfiziert gewachsen und bis zur Konfluenz auf Deckgläschen. Zeitraffer-Bilder von GFP-Aktin in konfluenten HUVEC werden vor und nach der Zugabe von Entzündungsmediatoren, die zeitabhängige Veränderungen in endothelialen Barriere Integrität entlocken eingefangen. Diese Studien ermöglichen die visuelle Beobachtung der Flüssigkeit Folge von Veränderungen in der Aktin-Zytoskeletts, die Endothelien beitragenl Schrankenstörung und Restaurierung.
Unsere Ergebnisse zeigen übereinstimmend, lokale, Aktin-reichen Lamellipodien Bildung und Umsatz in Endothelzellen. Die Bildung und Bewegung von Aktin-Stress-Fasern können auch beobachtet werden. Eine Analyse der Häufigkeit der Bildung und des Umsatzes des lokalen Lamellipodien, vor und nach der Behandlung mit entzündlichen Reizen kann durch Kymographion Analysen dokumentiert werden. Diese Studien liefern wichtige Informationen über die dynamische Natur des Aktin-Zytoskeletts in Endothelzellen, die verwendet werden, um bisher nicht identifizierten molekularen Mechanismen wichtig für die Aufrechterhaltung der endothelialen Barriere Integrität entdecken können.
Protokoll
1. Transfektion von HUVEC mit GFP-Aktin
- Verschiedene Methoden können zur HUVEC Transfektion werden. Unser Labor verwendet die Nucleofector System (Lonza, Basel Schweiz) unten beschrieben. In der Regel schnell zu arbeiten, um die Lebensfähigkeit der Zellen und die Transfektionseffizienz zu verbessern. Jede Transfektion benötigt 5 x 10 5 HUVEC, dass auf zwei Deckgläser (Corning Nr. 1, 22 x 50 mm) ausgesät werden. Die Nucleofector verbindet Elektroporation und chemische Reagenzien, um Plasmid-DNA transfiziert, und in der Regel erreicht eine> 50% Wirkungsgrad Ausdruck. Chemische Transfektionsreagenzien sind eine alternative Methode. Eine Gruppe hat erfolgreich Rinder-Endothelzellen mit GFP-Aktin mit dem GenePORTER Reagens 6 transfiziert. Die Nucleofector Protokoll verwenden wir im Folgenden beschrieben.
- Vorsterilisiert cultureware oder gewöhnlichen Deckgläser verwendet werden, abhängig von der Kammer aus. Für Deckgläser in einer biologischen Schutzhaube zu sterilisieren, indem die sie in eine 10 cm Kulturschalemit etwa 5 ml 70% Ethanol für 2 min. Nehmen sie mit einer sterilen Pinzette und an der Luft trocknen, indem er sich ihnen an der Seite eines separaten Kultur Teller.
- Nach dem Trocknen Ort jedes Deckglas in seinem eigenen 10 cm Kulturschale. Pipette ein 300 ul Raupe warme Gelatine-Lösung (1,5% in 0,9% NaCl) auf die Mitte des Deckglases und lassen Sie es 5 min. Stehen, und dann absaugen. Vor diesem Matrix-Beschichtung in der Mitte, ohne den Rand zu berühren, wird sichergestellt, dass die Zellen dicht wird ausgesät werden und wird Zusammenfluss schnell zu erreichen.
- Bereiten Sie eine 1,5 ml Mikrozentrifugenröhrchen pro Transfektion mit 500 ul EGM2MV Medien (Lonza) und beiseite stellen in einem 37 ° C, 5% CO 2-Inkubator.
- Lösen Sie HUVEC mit 0,25% Trypsin-EDTA und sammeln in einen 15 mL konischen Rohr. Zählen Sie die Zellen. 5 x 10 5 Zellen werden für jede Transfektion erforderlich. Passen Sie die Zellsuspension Lautstärke auf ein Pellet, dass 5 x 10 5 Zellen durch die Anzahl der transfe multipliziert enthalten, werden erhaltenASSNAHMEN durchgeführt werden.
- Centrifuge der Zellsuspension in einer klinischen Zentrifuge bei 5000 rpm für 3 Minuten bei Raumtemperatur. Saugen Sie den Überstand durch Kippen der Röhre, um so viel Medien wie möglich zu entfernen.
- Das Pellet mit Basic Nucleofector Lösung entweder aus der HUVEC oder Primary Endothelial Cell Nucleofector Kit (Lonza). Verwenden Sie 100 ul pro 5 x 10 5 Zellen. Aufgrund der Toxizität dieser Lösung ist es wichtig, schnell zu arbeiten, während die Zellen in dieser Lösung suspendiert sind.
- Fügen Sie die GFP-β-Aktin Vektorplasmid (0.2-2 g pro 100 ul Nucleofector Suspension), um die Transfektionseffizienz Probe. 0,2-2 pg GFP-Aktin Plasmid-DNA pro 5 x 10 5 Zellen pro Transfektion.
- Transfer 100 ul Zellsuspension auf eine Nucleofector Cuvette. Cover und tippen Sie auf die Küvette ein paar Mal zu der Zellsuspension zu gewährleisten ist den ganzen Weg nach unten.
- Setzen Sie die Küvette in die Nucleofector II Gerät Küvettenschacht und führen Sie die desired Elektroporation Programm. Wir verwenden das Programm A-034 für HUVEC.
- Bringen Sie die Küvette um die biologische Sicherheit Kapuze. Bringen Sie eine der Mikrozentrifugenröhrchen aus dem 37 ° C Inkubator, 500 ul der EGM2MV enthält auf der Motorhaube. Mit einem der Transferpipetten in der Nucleofector Kit bereitgestellt, sanft fügen Sie die warme 500 ul von Medien, um die Zellsuspension in der Küvette. Übertragen Sie alle von den Inhalten der Küvette zurück zum Mikrozentrifugenröhrchen und in den Inkubator für 15 min. , damit die Zellen sich zu erholen.
- Wiederholen Sie die Schritte 9-11 wie nötig, wenn mehr Zellen transfiziert werden.
- Ein Mikrozentrifugenröhrchen mit 600 ul von transfizierten HUVEC Suspension kann auf zwei Deckgläsern ausgesät werden. Unter der Haube und mit einem 1000 ul Mikropipette, sanft Pipette auf und ab, sobald die Aussetzung zu mischen, und dann statt 300 ul der Suspension direkt auf eine mit Gelatine beschichtete Deckglas. Lassen Sie sich nicht die Aussetzung berühren den Rand des Deckglases. Platz in der 37 ° C / 5% CO 2 Inkubator für 1-4 h für Zell-Anbindung zu ermöglichen.
- Nach 1-4 h, inspizieren die transfizierten Zellen zu bestätigen, müssen sie das Deckglas befestigt. Dann gibt man 10 ml EGM2MV Medien, und zurück auf die Platte um die 37 ° C / 5% CO 2-Inkubator. GFP-Aktin-Expression kann in der Regel innerhalb von 4-8 Stunden beobachtet werden. Experimente sind in der Regel innerhalb von 24-48 h durchgeführt
2. Einrichten der live-cell imaging Kammer und Bühne Heizung
- Für die meisten unserer Studien haben wir ein Warner Instruments offene Raute Bad (RC22) in einer PH-1 Bühne Heizung gelegt, durch eine Schwerkraft-System eingespeist werden. Allerdings gibt mehrere Optionen für Live Cell Imaging Stadien, darunter Kammern, Glasboden Kulturschalen, Offene und geschlossene Kammern und verschiedene microincubator / Ziel Heizer-Kombinationen und großen Inkubator-Systeme unterbringen Verfügung. Letztendlich wird die Kammer Auswahl von Faktoren einschließlich der Notwendigkeit, das Bad Zugang zu einem Test Mittel oder Arzneimittel hinzuzufügen, WHE hängenes mittelfristig werden statisch oder unter fließen, und die Länge des Experiments. Darüber hinaus, manchmal Faktoren wie Temperatur Instabilität kann zu konzentrieren Drift, und kann von Steuerungen, die stabil Bad und objektive Temperaturen halten kann, minimiert werden.
- Aliquot genug Medium für das Experiment. Wir Aliquot von 50 ml Albumin physiologischer Kochsalzlösung (APSS; Tabelle 1) für jede Stunde das Experiment dauern wird.
- Entweder eine Pumpe oder Schwerkraft-Flow-System kann verwendet werden, um mittel-bis der Kammer zu liefern. Für unser System, fügen wir APSS eine einfache Schwerkraft-Flow-System aus einer intravenösen Vorlauf, verbunden mit einem Durchlauferhitzer (Warner Instruments Modell SH-27A) gebaut. Wir wenden Flow auf etwa 40 ml / h.
- Wenn ein offenes Bad Kammer wie der unsrigen verwendet werden, gelten Vakuumfett an den äußeren Rand auf der Unterseite des Diamanten Bad und mit einem Wattestäbchen. Als nächstes bekommen wir eine Zelle bedeckt Deckglas aus dem Inkubator, und heben Sie vorsichtig das Deckglas mit einer Pinzette. GenTLy berühren die Rückseite einer Kimwipe zu tanken überschüssige Medium, während die Zell-abgedeckte Seite nass. Mit den Zellen bis Gesicht, statt der Diamant Bad über dem Deckglas in eine Kammer zu bilden.
- Schnell Ort der Kammer in der Bühne Heizung und handfest anziehen Schellen über der Kammer. Ein wichtiges Anliegen in diesem Stadium ist die Möglichkeit, dass die Zellen austrocknen. Deshalb ist es wichtig, schnell zu arbeiten und wenn Sie fertig sind, sofort Pipette ~ 1 ml Medium in die Kammer, um die Zellen vor dem Austrocknen zu verhindern.
- Unsere Kammer ermöglicht stetigen Fluss des Mediums in den Zellen. Kurz vor dem Einschalten fließen, ist es wichtig, einen Saugschlauch an der Halterung an der Kammer legen, um zu beenden überschüssige Kulturmedium (APSS) zu ermöglichen. Die Inline-Heizung und Bad Heizung sollte auch auf einem dieser Stelle (bis 37 ° C) gedreht werden. Unser System verfügt über eine Thermistorsonde die Temperatur überwachen, die auf dem Rand der Badewanne platziert werden soll.
- Wischen Sie die Unterseite der Zusammenarbeitverslip mit einem Kimwipe mit 70% EtOH getaucht, um die verbleibenden EGM2MV Medien und Salz Ablagerungen zu entfernen. Wischen Sie ein zweites Mal mit einem trockenen Kimwipe oder Brillenputztuch.
- Nachdem die Kammer eingerichtet worden ist, wird der Durchfluss auf, und die Temperatur konstant bei 37 ° C, damit die Zellen mindestens 30 Minuten einstellen und vor Beginn des Experiments zu stabilisieren.
- Während des Wartens auf alle Komponenten des Live-Cell-Imaging-Mikroskop (Lampen, Filterrad-Controller, Kamera, Computer) einzuschalten.
3. Übernahme von Daten mit live-cell imaging Mikroskop
- Verschiedene Live-Cell-Mikroskopie-Systeme stehen zur Verfügung. Unser System ist eine Nikon Eclipse TE-2000U mit den folgenden Komponenten:
- Sutter Instruments Lambda LS 300 W Xenon-Lampe
- Sutter Instruments Lambda 10-3 Anregung Filterrad mit SmartShutter und S492-Filter (D350 und S572 Erreger-Filter sind auch für UV-und RFP-Anwendungen verfügbar)
- Dichroitische 2002bs Emitter (Nikon 61002M)
- CI Plan Fluor 10x DLL Ziel, NA 0,30 (Nikon MRH10100)
- Plan Fluor ELWD 40X DM Ziel, NA 0,60 (Nikon MRH08420)
- Plan Apo VC 100X Oil Ziel, NA 1,40 (Nikon MRD01901)
- Photometrics CoolSNAP HQ2 Kamera, 1392 x 1040 Imaging-Array, 6,45 x 6,45 um Pixel
(Roper Scientific) - Wir haben auch zwei Software-Pakete, für die Bildaufnahme verwendet werden können. Nikon Elements-AR 3,0 und Metamorph 6.1.
- Nach der Besichtigung der Zellen und die Suche nach einer geeigneten Fläche für Studium, sperren Sie die groben Fokusknopf und überprüfen Sie die Software-Beschaffung Einstellungen, so dass:
- Das Filterrad ist für den S492-Filter (mit der Aufschrift "FITC" in unserer Konfiguration) eingestellt
- In der Übernahme-Software, ist es das Ziel gesetzt, um die gewünschte Vergrößerung (unser Mikroskop ist nicht motorisiert, aber dies setzt das um / Pixel-Verhältnis) übereinstimmen. Stellen Sie außerdem sicher, dass die Optivar Objektiv des Mikroskops zu 1.0X Vergrößerung eingestellt ist. Einstellen der Optivar um den Faktor 1,5 erhöhen Vergrößerung, jedoch auf Kosten des Verlustes Signalintensität.
Die Vergrößerung verwendet werden, hängt Ziele der Studie. Für das beste Detail wird ein 100X Objektiv mit hoher numerischer Apertur bieten die beste räumliche Auflösung und Übertragung des Signals. Unser Mikroskop ist auch mit einem großen Arbeitsabstand 40X-Objektiv für eine andere Anwendung, die die zusätzliche Entfernung erfordert bestimmt ausgestattet. Allerdings kann dieses Ziel sinnvoll sein, wenn wir mehrere Zellen gleichzeitig zu beobachten wollen, und funktioniert gut für die Anzeige von Organellen-Größe Strukturen, jedoch auf Kosten des Verlustes räumliche Auflösung und Signalintensität. Für jede Studie, in der Signalintensität ist ein Endpunkt, oder für fortgeschrittene bildgebende Verfahren wie die Fluoreszenz-Speckle-Mikroskopie wird ein 100X Objektiv empfohlen. - Die Kamera Belichtungszeit liegt zwischen 0,5-2 s eingestellt Dies hängt von der GFP-Aktin-Intensität in den Zellen. Wir verwenden in der Regel die niedrigste mögliche Belichtungszeit, um bl zu vermeidenURCHGEFUHRTE der GFP-Aktin und potentielle Toxizität für die Zellen.
- Um die beste Auflösung, sollte das Binning auf 1 x 1 gesetzt werden und Verstärkung bei 1. In einigen Fällen haben wir gesetzt Binning bis 2 x 2, um die Exposition zu verringern, aber dies verringert die Genauigkeit der Messungen, die wir auf sich bewegende Objekte in der Zeitraffer-Studie machen kann.
- Konfigurieren Sie die Zeitraffer-Einstellungen:
- Wählen Sie den Ordner, um die aufgenommenen Bilder speichern und geben Sie einen Dateinamen.
- Legen Sie die Anzahl der Bilder und Intervalldauer Zeiten für das Experiment. Wir verwenden in der Regel 15 s bis 1 min Intervall zwischen den Bildern und bis zu 2 h für die Dauer.
- Stellen Sie sicher, dass die aktive Shutter eingestellt ist, dass zwischen den Aufnahmen geschlossen werden.
- Vor Beginn der Zeitraffer-Bildaufnahme, schalten Sie die Raumbeleuchtung und fangen ein einzelnes Bild, um die Einstellungen zu überprüfen.
- Auch ein Capture eines Hellfeld Bild. Achten Sie darauf, in den Kondensator auf der richtigen Phase oder DIC-Filter gesetzt. Einschaltender Halogenlampe und sammeln das Bild. Schalten Sie die Halogenlampe.
- Revert zurück zu "FITC" Einstellungen für den Zeitraffer-Imaging und erfassen ein Testbild.
- Capture the Zeitserien.
Während des Versuchs ist es wichtig, die Bilder zu überwachen, wie sie erworben werden. In einigen Fällen kleine Veränderungen in der Temperatur in der Kammer kann Fokus Drift. Dies kann durch die Optimierung der Zu-und Vakuum-Leitungen so, dass der Volumenstrom konstant über die Zellen vermieden werden. Außerdem können die Minimierung Verkehr in Mikroskop Zimmer und das Umlenken Entwürfe von der Decke Lüftungsschlitze vom Mikroskop hilfreich sein. Eine Alternative, die auch in unserer Erfahrung funktioniert ist die Verwendung von 37 ° C / 5% CO 2-Inkubator Kammern, die die gesamte Bühne und objektiv zu umschließen. Diese bieten den Vorteil der Überwachung Zellen über Nacht oder länger, aber der Zugang zu den Zellen ist begrenzt.
Falls erforderlich, halten Sie den Zeitraffer-Übernahme und Neuausrichtung des Bildes. Führen Sie die so schnell wie möglich auszurichten, um Vermeiden Sie die Manipulation der Zeitabstand zwischen den Bildern. - Ein typisches Protokoll wird von 20-30 Minuten von Baseline-Bilder, bevor Sie einen Test-Agent von 0,5 bis 4 Stunden zusätzliche Bildaufnahme gefolgt bestehen. Die Länge des Experiments kann durch Ausbleichen des GFP im Laufe der Zeit, weshalb es wichtig ist, wählen Sie die kürzeste Belichtungszeit möglich ist begrenzt. Es kann auch wünschenswert sein, den Abstand zwischen den Zeitreihen-Aufnahmen auf 30-60 s ändern, wenn eine längere Studie ist erwünscht.
4. Datenanalyse
- Mehrere Software-Pakete können verwendet werden, um das Bild setzt, wie NIS Elements, Metamorph, Slidebook, etc. analysieren wir in der Regel führen unsere Bildanalyse mit NIH ImageJ ermöglicht Analysen auf jedem Computer im unserem Labor oder zu Hause sein. Die Versionen, die wir verwenden, sind:
MBF ImageJ ( http://www.macbiophotonics.ca/imagej/ )
Fidschi (i "target =" _blank "> http://pacific.mpi-cbg.de/wiki/index.php/Fiji). - ImageJ kann verwendet werden, um viele dynamische Prozesse, einschließlich zu analysieren:
- Die Häufigkeit der Lamellipodien Vorsprünge
- Entfernung, Zeit und Geschwindigkeit von Vorsprüngen
- Aktin-Faser Bewegung im Laufe der Zeit
- In ImageJ wird, wenn das Bild legen Sie die Slice-Nummer / Gesamtzahl Scheiben öffnet sich in der oberen linken Ecke des Fensters angezeigt werden, zusammen mit dem Dateinamen, die Anzahl der Pixel, Dateityp und-größe. Die Z Scrollbalken auf der Unterseite der Zeit entspricht. Darüber hinaus wird Schweben Sie den Mauszeiger über das Bild zeigt die x, y, und z-Pixel-Position auf der Unterseite des ImageJ Toolbar.
- Lamellipodien Vorsprung kann durch Bestimmung der Anzahl von neuen Erhebungen im Laufe der Zeit untersucht werden. Dies kann für die gesamte Zelle Umfang oder einen ausgewählten Bereich durchgeführt werden. Diese Art der Analyse kann auch in nonconfluent, nicht transfizierten Zellen mit Phasenkontrast oder DIC-Mikroskopie durchgeführt werden. Allerdings unter Verwendung von Zellen, die GFP-Aktin ermöglicht die Analyse der konfluente Monolayer, insbesondere dann, wenn Zellen mit und ohne GFP-Aktin nebeneinander sind.
- Lamellipodien Vorsprungs Abstand, Persistenz (Zeit), und die Geschwindigkeit kann durch Kymographion (Line-Scan-Analyse) zu beurteilen. Ziehen Sie eine Linie senkrecht zum Rand einer Zelle (das ist am einfachsten, wenn es keine benachbarten Zelle oder die benachbarte Zelle nicht exprimiert GFP-Aktin). In ImageJ, mit "/" generiert eine Kymographion, mit der x-Achse repräsentiert distance und der y-Achse die Zeit darstellt (15 s bis 1 min pro Pixel nach dem Zeitintervall Richtlinien oben). Linien können über einen hervorstehenden Lamellipodien und die Box-Maße gemessen werden (durch Drücken von M in ImageJ) gezogen werden. Die Entfernung, Zeit und Geschwindigkeit kann dann berechnet werden.
- Die Bewegung von Stress-Fasern kann auch durch Kymographion Analyse in ähnlicher Weise gemessen werden.
5. Repräsentative Ergebnisse:
Mit unserem Transfektionsprotokolls wir in der Regel sehen die Expression von GFP-Aktin in mindestens 50% der HUVEC transfiziert, und oft können Bereiche auf dem Deckglas zu finden, wo> 90% der HUVEC in der Region zum Ausdruck GFP-Aktin. Ein Beispiel für eine Live Cell Imaging Experiment mit subkonfluenten HUVEC, die GFP-Aktin ist in Movie 1 dargestellt. Für dieses spezielle Experiment wurde ein Bild einmal pro Minute erworben. Wie in dem Film, GFP-Aktin in der HUVEC gesehen werden kann das ganze Zytoplasma beobachtet werden, sowie in filamentösen structnahmen und in lokalen Lamellipodien vorstehende entlang der Zelle Rand. Ebenfalls zeichnet in dem Film ist, dass GFP-Aktin-Expression nicht einheitlich zwischen den Zellen. Cells für die Studie ausgewählten haben in der Regel genug GFP-Aktin präsentieren verschiedene Strukturen mit filamentösen Aktin zu visualisieren. Zellen, die ein sehr hohes Niveau der GFP-Aktin kann problematisch sein, für das Studium, weil in diesen Zellen ist es in der Regel schwierig ist, F-Aktin-Strukturen aus dem hohen Anteil an G-Aktin Gegenwart zu unterscheiden.
Movie 2 zeigt ein Beispiel für das Verhalten von konfluenten HUVEC, die GFP-Aktin. Wie die subconflent HUVEC, aktiv war Lamellipodien Bildung und Umsatz entlang der Umfänge der Zellen deutlich. Allerdings sind diese Lamellipodien oft entstand Membran Rüschen, was darauf hinweist weniger effizient Vorsprung 7. Dies ist wahrscheinlich auf die Anwesenheit von benachbarten Zellen blockiert die Nähe Substrat. Aktin kortikalen Fasern und Stress-Fasern sind auch in Filme 1 und 2 zu sehen. Obwohl die Zellen, die wir observed stationär geblieben sind die Stress-Fasern ähnlich wie Quer-Bogen Fasern bei der Migration von Zellen und bilden in der Nähe der Zelle Rand und seitlich bewegt in Richtung Zentrum der Zelle, wo sie zu zerlegen 8, 9. Eine zusätzliche dynamische Funktion in diesen Zellen zu beobachten war die Bildung von Aktin-Ring-Strukturen, die konzentrisch erweitert, zuvor genannten Aktin Wolken 10.
Ein Beispiel, wie die Entfernung, Ausdauer und Geschwindigkeit der Zelle Vorsprünge sind von diesen Zeitraffer-Bild quantifiziert Sets mit Kymographion Analyse ist in Abbildung 1 dargestellt. In Abbildung 1A wird ein einzelnes Pixel-Linie etwa senkrecht zu der Zelle Rand zur Erzeugung eines Kymographion (Abbildung 1B) gezogen. In diesem Kymographion ist die Region durch die Linie definiert senkrecht gestellt und die Bilder aus der ganzen Zeitraffer werden horizontal gestapelt. Blickt man von links nach rechts in die Kymographion, sind Vorsprünge als Aufwärtsbewegungen in den Rand der Zelle dargestellt. In Abbildung 1C, wurde eine Linie superimposed am Rande einer dieser Vorsprünge und das Pixel-Daten mit dieser Linie verbunden wurden gesammelt und angezeigt werden im Fenster Ergebnisse am unteren Rand des Panels. Diese Analyse ermöglicht die Quantifizierung des Vorsprungs Dynamik, und kann auch verwendet werden, um den Vorsprung Frequenz (Anzahl der Vorsprünge / Zeit) in diesem Bereich der Zelle zu schätzen.
Ein Beispiel für die Analyse von Stress-Faser Bewegung ist in Abbildung 2 dargestellt. Die meisten Stress Fasern beobachteten wir bildeten in der Nähe der Zellperipherie und bewegte sich auf der Zelle entfernt, wo sie zerlegt schließlich. Dies kann auch durch Kymographion Analyse quantifiziert werden. Eine Linie wird senkrecht auf die Zelle Rand und den Stress-Fasern (Abbildung 2A) und einem Kymographion erzeugt wird (Abbildung 2B) gezogen. Der Stress-Fasern werden als durchgezogene Linien in den zytoplasmatischen Bereich, in dem Kymographion, oft nach unten und nach rechts (in Richtung Zentrum der Zelle). Manchmal sind die Fasern nur schwer in die ursprüngliche Kymographion zu sehen, und in diesen Fällen sind wirVerwendung der Filter Unscharf maskieren, um das Bild (Abbildung 2C) zu schärfen. Die Linien sind auf den Stress Fasern gezogen und die Pixel-Daten erhoben werden über die Messfunktion (Abb. 2D). Ein alternativer Weg, um diese Daten zu sammeln ist eine Linie von Anfang an zu ziehen, um der identifizierten Stress Faserausrüstung die durchschnittliche Steigung für die Dauer, dass die Faser zu beobachten war (Abb. 2E) zu bekommen. Diese Analyse ermöglicht die Quantifizierung von Stress Faser seitliche Bewegung und kann auch verwendet werden, um die Zahl der Stress-Fasern in dieser Region der Zelle beobachtet zu quantifizieren.
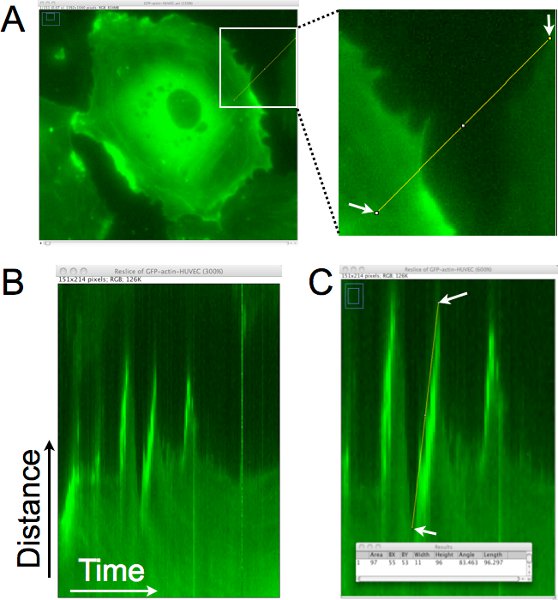
Abbildung 1. Kymographion Analyse der Zelle Rand zu bestimmen, den Vorsprung Abstand, Ausdauer und Geschwindigkeit der lokalen Lamellipodien. A. Ein einzelnes Pixel-Linie ist in etwa senkrecht zur Kante der Zelle gezogen. Diese Region ist von jedem Bild der Zeitraffer-Set, um eine Montage aus der Region im Laufe der Zeit zu erzeugen extrahiert. B. In the resultierende Kymographion stellt die x-Achse die Zeit, sich von links nach rechts und die y-Achse zeigt die Entfernung. Die Bewegung der Zelle Rand im Laufe der Zeit kann in diesem Kymographion ausgewertet werden, und Lamellipodien sind Regionen, in denen die Zelle Rand bewegen nach rechts, geht nach oben identifiziert. C. Eine Linie wird auf die Zelle Rand, wo ein Vorsprung von einem Lamellipodium identifiziert wurde gezogen. Die Abmessungen des umschließenden Rechtecks für die Linie gezeichnet werden dann übernommen (siehe überlagert Fenster). Die Breite wird verwendet, um den Vorsprung der Zeit oder Dauer zu berechnen. Die Höhe wird verwendet, um den Vorsprung Abstand zu berechnen. Der Vorsprung Geschwindigkeit wird berechnet, indem die Höhe der Breite berechnet. In diesem Beispiel wurde die Aufwärtsbewegung Abstand 96 Pixel x 0,16125 um / Pixel = 15,5 um, und die Zeit war 11 Pixel x 1 min. / pixel = 11 min. Die Geschwindigkeit wurde als 15,5 μm/11 min berechnet. = 1,4 mu m / min.

FBBILDUNG 2. Kymographion Analyse der Bewegung von Aktin-Stress-Fasern. A. Ein einzelnes Pixel-Linie senkrecht zum Rand der Zelle gezogen, um eine Kymographion zu generieren. B. Wie in Abb.. 1, in dem sich ergebenden Kymographion stellt die x-Achse die Zeit und die y-Achse zu erreichen. Stress-Fasern sind als durchgezogene Linien in der Zelle, oft geht nach unten und nach rechts (Pfeile) C beobachtet. Zur besseren Visualisierung der Stress-Fasern kann das Filter Unscharf Maskieren verwendet werden. In diesem Beispiel wurde ein Radius von 3 Pixel und Maske Gewicht von 0,60 verwendet. D. Einzel-Pixel-Linien werden dann über die identifizierten Stress Faser gezogen und Daten gesammelt. In diesem Panel drei Linien gezogen wurden und dann auf "Löschen" gedrückt wurde, um eine dauerhafte Annotation (weiße Linie) von ihren Standorten nach jeder Messung zu machen. E. Alternativ, wenn die durchschnittliche Entfernung, Zeit und Geschwindigkeit des Stress-Faser gewünscht wird, kann eine Linie vom Start-und Endpunkt (gelbe Linie) gezogen werden, und die Daten fürr, dass erworbene (hervorgehoben im Fenster Ergebnisse) werden kann. Für dieses Beispiel wurden die Messungen an diesen Stress-Faser für 37 Frames x 1 Bild / min hergestellt. = 37 min. Die zurückgelegte Wegstrecke in diesem Zeitraum lag bei 75 Frames x 0,16125 um / Pixel = 12,1 um. Die daraus resultierende Quergeschwindigkeit des Stress-Faser betrug 12,1 μm/37min = 0,33 mu m / min. Ein positiver Wert für die Geschwindigkeit ist für Fasern sich in Richtung der Zelle entfernt, und negativ für Fasern sich in Richtung der Peripherie zugeordnet.
Movie 1. Zeitraffer-Bilder von Live-HUVEC, die GFP-Aktin. Das Intervall zwischen den Bildern ist 1 min. Lokale Lamellipodien ragten entlang des gesamten Umfangs der Zellen. Darüber hinaus zog quer arc Stress Fasern seitlich in Richtung der Mitte der Zellen. Wenn Thrombin (1 U / ml), das Bad wurde hinzugefügt, beauftragte die Zellen leicht an und die äußeren Vorsprünge von Lamellipodien pausiert für ca. 10 min. Nachdem die Zellen kontrahiert, wieder Lamellipodien Bildung und Umsatz d. Klicken Sie hier, um den Film zu sehen.
Movie 2. Confluent HUVEC, die GFP-Aktin, vor und nach der Behandlung mit Thrombin. Sekunden: Abgelaufene Zeit ist in der unteren rechten Ecke in Minuten angezeigt. Das Intervall zwischen den Bildern beträgt 30 s. Thrombin (1 U / ml) wurde nach dem 45 min aufgenommen. Basisperiode. Kommentierte Veranstaltungen gehören lokale Lamellipodien Bildung und Umsatz (Pfeilspitzen in der Nähe Zelle Kanten, 0:59 - 37:29), Aktin-Wolken (Pfeile, von 1.59 bis 21.29 Uhr), und eine Lücke in einem tricellular Kreuzung, die nach Thrombin zugegeben erweitert (Pfeil, 62:30 - 70:00). Quer Bogen Stress Fasern sind auch in einigen der Zellen deutlich. Die Zellen angezeigt aktive Gestaltung und einem Umsatz von lokalen Lamellipodien entlang ihrem Umfang, mit vielen, die zu Membran Rüschen. Thrombin verursacht eine Pause in Lamellipodien Bildung und Umsatz, und die kurzen Auftritt von einigen kleinen Lücken zwischen den Zellen.https://www.jove.com/files/ftp_upload/3187/Movie2-confluentHUVEC.avi "> Klicken Sie hier, um den Film zu sehen.
Diskussion
Die Bildgebung von GFP-Aktin in lebenden Endothelzellen ermöglicht eine detaillierte Analyse der Dynamik des Aktin-Zytoskeletts in Reaktion auf entzündliche Reize. Diese Methode kann auch nützlich sein, um auf frühere Ergebnisse zeigen Umbau des Zytoskeletts in Reaktion auf physikalische Kräfte wie Schubspannung 11 Build. Darüber hinaus ermöglicht diese Methode eine detaillierte Bewertung des Beitrags von Aktin-Zytoskelett Dynamik zu verschiedenen Endothelzellen, einschließlich der Migration, der Mitose, die Bildung von interzellulären Verbindungen und junctional Reifung und Pflege der Barrierefunktion.
In den Daten zeigt, kann das Verhalten des endothelialen Aktin-Zytoskeletts vor und nach der Behandlung mit Thrombin beobachtet werden. Lokale Lamellipodien alle an den Rändern von Endothelzellen beobachtet Umform-und Rückschritte im Laufe der Zeit in beiden nonconfluent und konfluierende Zellrasen. Die Behandlung mit Thrombin kurz unterbrochen Lamellipodien FormATION und Umsatz. Thrombin verursachte auch die Zellen mit einem leicht rückläufigen, in Übereinstimmung mit früheren Berichten, dass Thrombin Aktin Stress Faserbildung und erhöhte zentripetalen Zug der Entwicklung in Endothelzellen 12-14 Ursachen. Jedoch von Live Cell Imaging Studien wie diese, kann der Ursprung des Stress-Fasern nun ermittelt werden. In HUVEC, die meisten Stress-Fasern an der Zellperipherie stammen und ähneln quer arc Fasern in wandernden Zellen 8, 9. Eine weitere Stärke dieser Methode gegenüber der Verwendung fixierten Zellen ist, dass die Zahl der Stress-Fasern in einzelnen Zellen können vor und nach der Thrombin-Behandlung quantifiziert werden, sodass selection bias zwischen experimentellen Gruppen.
Mit diesem Protokoll bewerten wir dynamische Bewegung der Zelle Rand und Aktin Stress-Fasern. Um Aktin Monomer Dynamik in Endothelzellen, fortgeschrittene Techniken wie die Fluoreszenz-Recovery verstehen nach Ausbleichen (FRAP) oder Fluoreszenz-Speckle-microscopy (FSM) können 15 aufgebracht werden, 16. Darüber hinaus, weil mikrovaskulären Endothelzellen darstellen können ein besseres Modell der mikrovaskulären Barrierefunktion, die Optimierung der Transfektion Protokolle effektiv auszudrücken GFP-Aktin in mikrovaskulären Endothelzellen stellt einen logischen zukünftige Richtung.
Zusammenfassend stellt Imaging an lebenden Endothelzellen exprimieren GFP-Aktin ein mächtiges Werkzeug, um festzustellen, wie die Endothelzellen Aktin-Zytoskeletts, um verschiedene Arten von Stimuli reagiert. Studien mit eng konfluente Endothelzellen Monoschichten wird helfen, die Rolle des dynamischen Strukturen wie Aktin-reichen Lamellipodien und quer arc Stress Fasern in endothelialen Barrierefunktion. Darüber hinaus werden Live Cell Imaging von endothelialen Zellen, die GFP-Aktin oder anderen Fusionsproteine, die Visualisierung von anderen subzellulären Strukturen ermöglichen eine detaillierte raumzeitliche Informationen, die zur Signalisierung und strukturellen Mechanismen zu verstehen, dass determine Barriere Integrität.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Die GFP-β-Aktin Plasmid wurde freundlicherweise von Dr. Wayne Orr, LSUHSC-S Department of Pathology Verfügung gestellt und wurde im Labor von Dr. Becky Worthylake, LSUHSC-NO Department of Pharmacology verstärkt. Diese Arbeit wurde durch Mittel der National Institutes of Health (P20 RR-018766) und der American Heart Association (05835386N) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 1. Ringer 5x Lager | |||
| Chemikalie | Firma | Katalog-Nummer | Höhe |
| Kochsalz | EMD | SX0420-3 | 35 g |
| Kaliumchlorid | JT Baker | 3040 | 1,75 g |
| Calcium Chloride | Sigma | C-3881 | 1,47 g |
| Magnesium Sulfate | Sigma | M-9397 | 1,44 g |
| Steriles gefiltertes Wasser | N / A | N / A | Bring to 1 L |
| Sterile Filter in autoklaviert Flaschen und speichert bei 4 ° C | |||
| 2. MOPS-Puffer | |||
| Chemikalie | Firma | Katalog-Nummer | Höhe |
| MOPS | Sigma | M3183 | 125,6 g |
| Steriles gefiltertes Wasser | N / A | N / A | Bring to 1 L |
| Sterile Filter in autoklaviert Flaschen und speichert bei 4 ° C | |||
| 3. Albumin physiologischer Kochsalzlösung (APSS) | |||
| Chemikalie | Firma | Katalog-Nummer | Höhe |
| Ringer Lager (5x) | N / A | N / A | 200 ml |
| MOPS-Puffer | N / A | N / A | 5 mL |
| Sodium Phosphate | Sigma | S-9638 | 0,168 g |
| Natriumpyruvat | Sigma | P5280 | 0,22 g |
| EDTA-Natriumsalz | Sigma | ED2SS | 0,0074 g |
| Glucose | Sigma | G7528 | 0,901 g |
| Albumin, Bovine | USB | 10856 | 10 g |
| Steriles gefiltertes Wasser | N / A | N / A | Bring to 1 L |
| Der pH-Wert auf 7,4 bei 37 ° C, dann Sterilfilter in autoklaviert Flaschen und lagern bei 4 ° C. | |||
| 4. 0,9% Saline | |||
| Chemikalie | Firma | Katalog-Nummer | Höhe |
| Kochsalz | EMD | SX0420-3 | 9 g |
| Steriles gefiltertes Wasser | N / A | N / A | Bring to 1 L |
| Sterile Filter in autoklaviert Flaschen und speichert bei 4 ° C | |||
| 5. 1,5% Gelatine-Lösung | |||
| Gelatine aus Schweinehaut | Sigma | G2500 | 15 g |
| 0,9% Saline | N / A | N / A | Bring to 1 L |
| Wärmen Sie die Lösung auf 37 ° C zu lösen Gelatine ausreichend. Während noch warm, Sterilfilter in autoklaviert Flaschen und lagern bei 4 ° C | |||
Referenzen
- Spindler, V., Schlegel, N., Waschke, J. Role of GTPases in control of microvascular permeability. Cardiovasc. Res. 87, 243-253 (2010).
- Wojciak-Stothard, B., Ridley, A. J. Rho GTPases and the regulation of endothelial permeability. Vascul. Pharmacol. 39, 187-199 (2002).
- Yuan, S. Y. Signal transduction pathways in enhanced microvascular permeability. Microcirculation. 7, 395-403 (2000).
- Birukov, K. G. Small GTPases in mechanosensitive regulation of endothelial barrier. Microvasc. Res. 77, 46-52 (2009).
- Duran, W. N., Sanchez, F. A., Breslin, J. W. Microcirculatory Exchange Function. Handbook of Physiology: Microcirculation. Tuma, R. F., Duran, W. N., Ley, K. , 2nd Edition, Elsevier. San Diego. 81-124 (2008).
- Hu, Y. L., Chien, S. Dynamic motion of paxillin on actin filaments in living endothelial cells. Biochem. Biophys. Res. Commun. 357, 871-876 (2007).
- Borm, B., Requardt, R. P., Herzog, V., Kirfel, G. Membrane ruffles in cell migration: indicators of inefficient lamellipodia adhesion and compartments of actin filament reorganization. Exp. Cell. Res. 302, 83-95 (2005).
- Hotulainen, P., Lappalainen, P. Stress fibers are generated by two distinct actin assembly mechanisms in motile cells. J. Cell. Biol. 173, 383-394 (2006).
- Pellegrin, S., Mellor, H. Actin stress fibres. J. Cell. Sci. 120, 3491-3499 (2007).
- Ballestrem, C., Wehrle-Haller, B., Imhof, B. A. Actin dynamics in living mammalian cells. J. Cell. Sci. 111, 1649-1658 (1998).
- Helmke, B. P., Rosen, A. B., Davies, P. F. Mapping mechanical strain of an endogenous cytoskeletal network in living endothelial cells. Biophys. J. 84, 2691-2699 (2003).
- Birukova, A. A., Smurova, K., Birukov, K. G., Kaibuchi, K., Garcia, J. G., Verin, A. D. Role of Rho GTPases in thrombin-induced lung vascular endothelial cells barrier dysfunction. Microvasc. Res. 67, 64-77 (2004).
- van Nieuw Amerongen, G. P., van Delft, S., Vermeer, M. A., Collard, J. G., van Hinsbergh, V. W. Activation of RhoA by thrombin in endothelial hyperpermeability: role of Rho kinase and protein tyrosine kinases. Circ. Res. 87, 335-340 (2000).
- Moy, A. B., Blackwell, K., Kamath, A. Differential effects of histamine and thrombin on endothelial barrier function through actin-myosin tension. Am J Physiol Heart Circ Physiol. 282, H21-H29 (2002).
- Wittman, T., Littlefield, R., Waterman-Storer, C. Fluorescent speckle microscopy of cytoskeletal dynamics in living cells. Live Cell Imaging: A Laboratory Manual. Goldman, R. D., Spector, D. L. , Cold Spring Harbor Laboratory Press. 184-204 (2005).
- Rabut, G., Ellenberg, J. Photobleaching techniques to study mobility and molecular dynamics of proteins in live cells: FRAP, iFRAP, and FLIP. Live Cell Imaging: A Laboratory Manual. Goldman, R. D., Spector, D. L. , Cold Spring Harbor Laboratory Press. 101-126 (2005).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten