このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
マウス胚の脊髄の全載標本での分岐軸索勉強するDRGニューロンのDII -標識
要約
齧歯類の脊髄への感覚求心性のステレオタイプの予測は、単一の軸索のトレースを通して軸索分岐を研究するために簡単にアクセス可能な実験系を提供する。
要約
ここでは、親油性トレーサー1,1' -ジオクタデシル- 3、3,3'、過塩素酸塩(DII)1 3' - tetramethylindocarbocyanineを使用して拡散染色により胚脊髄にDRGニューロンの小グループの軌跡をラベル付けする手法を提案。遺伝子が変異されたマウス系統のものと野生型の軸索経路の比較では、神経系の配線に不可欠な機構である軸索分岐の制御の候補タンパク質の機能的役割をテストできます。軸索分岐は、それによって情報の並列処理のための物理的な基礎を提供する、複数のターゲットに接続する個々のニューロンが可能になります。軸索成長の中間ターゲット領域での影響は、終末分枝と区別されることがあります。また、軸索枝形成の異なるモードが成長円錐の活動(分割または遅延ブラジャーからかどうかの分岐の結果に応じて分類することができるnching)またはプロセスにおける軸索のシャフトから担保の出芽からは、間質分岐2( 図1)と呼ばれる。
DRGからのニューロンの中央の突起軸索分岐の両方のタイプを研究するために有用な実験系を提供する:それらの求心性軸索は10〜13胚日の間に脊髄の後根のエントリーゾーン(DREZ)に到達(E10 - E13)、それらT -またはY字型の分岐部の紋切り型のパターンが表示されます。得られた2つの娘の軸索は、脊髄の背側縁に、それぞれ、吻側または尾側方向に進むと待機期間の担保は、特定の中継ニューロンに灰白質(間質分岐)とプロジェクトを貫通して、これらの幹の軸索から発芽した後にのみ彼らはさらに樹枝状になる脊髄のラミナ(端子分岐)3。 DIIの追跡機能は、PRにあるように見えた脊髄の後根のエントリーゾーンで成長円錐を明らかにしたその分岐を示唆分割のocessが成長円錐自体4( 図2)の分割によって引き起こされる、しかし、他のオプションはよく5として議論されている。
このビデオでは、接続されているDRGを残しE12.5マウスの脊髄を分析する方法を第一を示しています。 DIIの試料微量の以下の固定は、キャピラリーチューブから引っ張ってガラスの針を使用して、DRGに適用されます。インキュベーションステップの後、標識された脊髄は、蛍光顕微鏡を使用して、個々の軸索を分析するために反転のオープンブックの準備としてマウントされます。
プロトコル
1。解剖の手順
注 :マウスの実験的使用は、実験動物の管理と使用のための公式に承認されたガイドラインに従ってください。
- 準備する前に、あなたの解剖顕微鏡を設定し、大型と小型のはさみ、大歯鉗子、湾曲鉗子と鉗子(内側研磨のヒントを持っているうちの2つを)解剖デュモン5号の4組を含む解剖に必要な手術器具をレイアウト(詳細については、)特定の試薬や機器の表を参照してください。 100 mmのSylgardコーティングしたシャーレにろ紙のシートを置きます。 、12ウェルプレートの各ウェルに100 mmのペトリ皿および12 mlチューブを冷PBSを注ぎ、氷の上に残す。氷上で2番目の12ウェルプレートと場所の各ウェルに固定バッファのピペット2ミリリットル(PBS、pH7.4中4%パラホルムアルデヒド)。
- 麻酔後、E12.5(膣栓の検出はE0.5として指定された)タイミング妊娠ダムを犠牲に、マウスを置く紙タオル3枚で、最大の腹側で、70%エタノールで腹部を浸す。
- 腹骨盤腔を開き、二国間の子宮角を分離し、氷冷PBSで100 mmディッシュの一つにそれらを転送する。
- 微細な制御下で、小さな、ストレートハサミで子宮壁の縦切開を行い、胎盤から各羊膜嚢を切り取る。
- 離れてピール各胚から羊膜嚢とへその緒を切る。
- タイピングが要求されるべき場合、小さなはさみを使用して、胚を刎ねるとゲノムDNAの単離のためにヘッドまたはそれらの一部を脇に置く。その後、冷PBSで12ウェルプレートの各ウェルにtorsoの複数形を転送する。
- PBSを数滴Sylgard皿にろ紙を湿らせ、紙にその背側と胚の胴を置きます。優れた安定性のために、身体から離れて、その尾と四肢をまっすぐ。
- 操作約16倍の倍率で解剖顕微鏡下で、慎重に微細な先端鉗子の2組脊髄上記の胚の皮膚をつまんで、ゆっくりとそれを引き裂く。途中で始まる、尾に向けた最初の進んでして、前方側に向かって途中から再開。
- 乾燥を防ぐためにPBSの二、三滴で時間から時間まで胚を濡らす。
- それは内部の研磨チップによる微細な鉗子の刃で水平方向のスライド運動によって周囲の軟骨性脊柱からDRGと脊髄を切断胚から削除されたときにそのDRGを防ぐためには、脊髄からオフtearedされています。胚の右側の真ん中に開始、前端にして尾部に向かって、あなたのように働くと。その後、反対側の手順を繰り返します。関連したDRGを裂くように注意してください。
- 胚から完全に緩んで脊髄を切断するために、そのcervicを拾うらは、微細な鉗子を持つ部分とその尾方端に向かって一体に引き出します。
- 12ウェルプレートのウェルに接続されたDRGと水没孤立脊髄は、固定バッファで満たされ、残りの胚から脊髄の準備を進める。
- 氷上での脊髄少なくとも2時間を修正。
2。 DRGニューロンのDII標識
- ラベル付けされる各脊髄の場合は、マイクロピペットプラーで2つのガラス針を準備。 。。。、2 HEAT = 600、VEL = 25、TIME = 175、3 HEAT = 630、VEL = 1 HEAT = 625、VEL = 35、TIME = 175:我々は、サッターモデルP - 97電極プラー(プログラムの設定を使用30、TIME = 150)。
- 微細な制御下でエタノールのDIIの5%(w / v)溶液中の各ガラス針の先端3〜5倍のディップ。エタノールを蒸発させると、針のDII結晶の薄層を作成します。
- 約40倍の倍率で解剖顕微鏡下で働いて、そのvを付けて脊髄を配置スライド上のentralサイドアップ。春のはさみを使用して、後で逆のオープンブックモード(セクションCを参照)で準備のマウントを可能にするfloorplateを切断することによって、全体の長さで腹側にコードを開きます。
- スライド上で、最大背側に脊髄を置きます。その後、手動で顕微鏡可視化の下でガラス針のDIIに覆われた先端と脊髄の片側に慎重に穴を開けるには毎秒DRGと脊髄にアプローチ。 DIIのほとんど痕跡は、神経細胞のごく少数のラベルを確保するためにピアスDRGに表示されないはず。コードのもう一方の側に第二針を取る。のみ毎秒DRGを目指しては、個々の軸索の分化を複雑にするかもしれない隣接DRGからラベル付き軸索投射の重複を避けることができます。
- ° Cでディに染料のために時間を与えるために4℃、周囲温度または一晩で少なくとも6時間暗所での固定バッファとインキュベートして脊髄を返す原形質膜内の軸索に沿ってffuse。脊髄への担保の成長の分析が望まれる場合には、より長い潜伏期間(4時までの二日間° C)を可能にする。
3。取り付けと顕微鏡分析
- その背側を持つ単一の脊髄では、PBSのドロップにカバースリップを下に染料拡散、位置に続く。添付のDRGが横方向に正しく向いていると混在しないように注意してください。余分な水分を吸引し、鉗子を用いて反転、オープンブックモードでコードを平らにならす。
- PBSを用いて顕微鏡スライド上に準備をマウントします。
- 標識した軸索突起の蛍光顕微鏡分析を染色不要なバックグラウンドの上昇を防ぐために、取り付けの日を行ってください。それまでは4℃、暗所でスライドを保持℃を
4。代表的な結果:
マウスの脊髄では、求心性のPRを受け取る子宮頸部の8組からojections、胸部の13ペア、60脊髄神経節に合計仙骨DRGの腰椎と4組の5組。いくつかのトレーニングの後、まだ接続されているほとんどのDRGと脊髄は、5分以内で胚から単離することができる。この手順は、E11.5からE13.5マウス胚に添付されたDRGと脊髄の分離に適しています。しかし、最良の結果がE12.5から得られます。ここで説明する標識手順の典型的な結果を図3に示されています。脊髄の全長にわたってDRGの標識は、その後、別の脊椎レベル( 図4)に軸索の分岐動作を定量化するために使用されることがあります。

図1:Schemeの軸索分岐の二つの主要なモードを描いた。ここに示されるように - - (A)分岐につながる可能性のある成長円錐の活動により分岐するだけでなく、複雑な端末アーバー(B)軸索のシャフト(間質性分岐)における担保の形成。後者のモードでは、6,7皮質と視床皮質軸索を投射するの支配分岐タイプです。

図2胚の脊髄へのDRGニューロンの求心性投射が軸索分岐の両方のタイプが表示されます:。分岐によってDREZ(1)および間質分岐(2)によって待機期間後に得られる娘の支店の副血行路の形態からの軸索最初のブランチを。
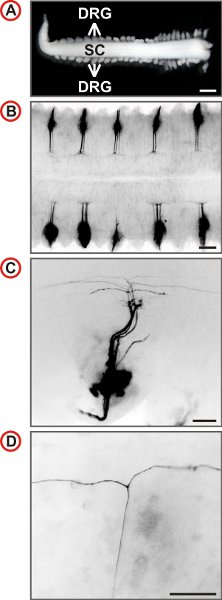
図3。胚のマウスのDRGニューロンの単一の軸索軌道の可視化。 (A)付属のDRGと脊髄は、E12.5マウス胚から調製。増加倍率での野生型マウスのDII標識DRGの(スケールバーは1mm。)(BD)背側のビューが表示されます。 Bで毎秒DRGはlabeleですDIIによるD。蛍光画像が反転されて、尾は左にあり、横方向のCとD、で一番下にあります。 Cでの軸索の数が少ないが標識され、より高い倍率でT -のような枝の存在は、脊髄のDREZで識別することができます。 (スケールバーは、250μm以下(B)、100μmの(C)および50μm(D)。)
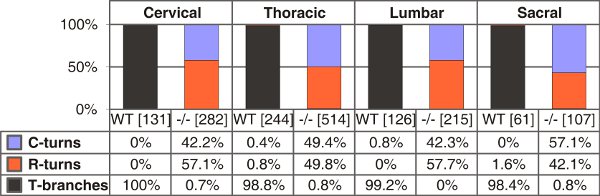
野生型およびC型ナトリウム利尿ペプチド(CNP)欠損E13.5のマウスのT字型の枝の図は、4。定量、単一の吻側または尾ターン。カウント単一の軸索の番号は、各遺伝子型ごとに異なるトランクレベルのカッコ内に表示されます。 C -またはR -ターン - 尾または吻側方向にのみ成長、それぞれ。
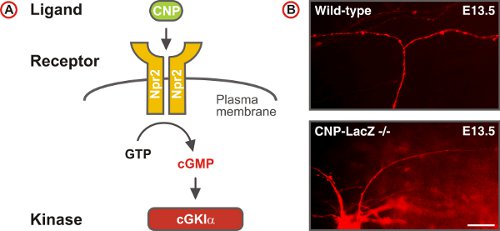
図5。cGMPのシグナル伝達経路は、脊髄のDREZで感覚軸索分岐をトリガします。の(A)スキームリガンドCNP、受容体グアニル酸シクラーゼNpr2とセリン/胚DRGニューロンにおけるスレオニンキナーゼcGKIαで構成されるcGMPのシグナル伝達経路。 Npr2は、CNPによる刺激によりGTPからcGMPを生成します。 (B)DIIは、野生型およびCNP欠損マウスでは神経細胞をDRGの単一の軸索のトレース。 (スケールバーは25μm。)
ディスカッション
DIIラベリングのための固定組織の使用と組み合わせての準備の容易さと一緒に軸索枝の形成の両方のタイプで構成されるステレオタイプ化された投影パターンは分岐軸索の勉強に有利なモデルをDRGの添付を持つ胚脊髄になります。コーティングされたガラスの針を使用してDIIの微量のアプリケーションが可能に - DRGニューロンの小集団の可視化と、それによって個々の軸索とその分岐パ...
開示事項
著者らは、開示することは何もない。
謝辞
著者は、有益なコメントを博士アリステアGarratt(マックスデルブリュックセンター、ベルリンの)感謝します。この作品は、ドイツの研究評議会(DFG)の共同研究センター(SFB665)によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント(省略可能) |
| 実体顕微鏡STEMI DRC | ツァイス | ||
| リン酸緩衝溶液(PBS) | Biochrom AG | L182 - 50 | |
| パラホルムアルデヒド | メルク | 8.18715.1000 | |
| 標準的な外科はさみ | ファイン科学ツール | 14001〜13 | |
| 歯標準鉗子 | ファイン科学ツール | 11021〜14 | |
| 極細アイリスのはさみ | ファイン科学ツール | 14088〜10 | |
| 湾曲鉗子 | ファイン科学ツール | 11003〜13 | |
| デュモン5号ファインチップの鉗子 | ファイン科学ツール | 11254〜20 | |
| デュモン5号鏡面仕上げ鉗子 | ファイン科学ツール | 11252〜23 | |
| Vannas -テュービンゲンバネはさみ | ファイン科学ツール | 15008〜08 | |
| ろ紙 | フィッシャーサイエンティフィック | FB59041 | |
| Sylgard 184 | 世界のPrecissionインスツルメンツ | SYLG184 | |
| 100 mmのペトリ皿 | Greinerの | 663102 | |
| 12 mlのポリプロピレンチューブ | カールロート社 | ECO3.1 | |
| 12ウェル培養プレート | ベクトンディッキンソン | 35から3043 | |
| エタノール | メルク | 1.00983.2500 | |
| ブラウン/燃えるようなマイクロピペットプラーP - 97 | サターインストゥルメント(株) | ||
| ホウケイ酸ガラス毛細管 | ハーバード装置 | 30から0066 | |
| DII(1,1' -ジオクタデシル- 3、3,3'、3' -テトラメチル-過塩素酸塩をindocarbocyanine) | シグマアルドリッチ | 468495 | |
| 顕微鏡はSuperFrost Plusをスライド | カールロート社 | H867.1 | |
| ガラスカバースリップ | カールロート社 | 1870.2 |
参考文献
- Honig, M. G., Hume, R. I. Dil and diO: versatile fluorescent dyes for neuronal labelling and pathway tracing. Trends. Neurosci. 12 (9), 333-333 (1989).
- Acebes, A., Ferrus, A. Cellular and molecular features of axon collaterals and dendrites. Trends. Neurosci. 23 (11), 557-557 (2000).
- Ozaki, S., Snider, W. D. Initial trajectories of sensory axons toward laminar targets in the developing mouse spinal cord. J. Comp. Neurol. 380 (2), 215-215 (1997).
- Schmidt, H. The receptor guanylyl cyclase Npr2 is essential for sensory axon bifurcation within the spinal cord. J. Cell Biol. 179 (2), 331-331 (2007).
- Gibson, D. A., Ma, L. Developmental regulation of axon branching in the vertebrate nervous system. Development. 138 (2), 183-183 (2011).
- O'Leary, D. D., Terashima, T. Cortical axons branch to multiple subcortical targets by interstitial axon budding: implications for target recognition and "waiting periods". Neuron. 1 (10), 901-901 (1988).
- Portera-Cailliau, C. Diverse modes of axon elaboration in the developing neocortex. PLoS. Biol. 3 (8), e272-e272 (2005).
- Gan, W. B. Vital imaging and ultrastructural analysis of individual axon terminals labeled by iontophoretic application of lipophilic dye. J. Neurosci. Methods. 93 (1), 13-13 (1999).
- Schmidt, H. C-type natriuretic peptide (CNP) is a bifurcation factor for sensory neurons. Proc. Natl. Acad. Sci. U. S. A. 106 (39), 16847-16847 (2009).
- Zhao, Z. Regulate axon branching by the cyclic GMP pathway via inhibition of glycogen synthase kinase 3 in dorsal root ganglion sensory neurons. Journal of Neuroscience. 29 (5), 1350-1350 (2009).
- Zhao, Z., Ma, L. Regulation of axonal development by natriuretic peptide hormones. Proc. Natl. Acad. Sci. U. S. A. 106 (42), 18016-18016 (2009).
- Schmidt, H., Rathjen, F. G. Signalling mechanisms regulating axonal branching in vivo. Bioessays. , (2010).
- Feng, G. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28 (1), 41-41 (2000).
- Livet, J. Transgenic strategies for combinatorial expression of fluorescent proteins in the nervous system. Nature. 450 (7166), 56-56 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved