Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
DII-étiquetage des neurones DRG pour l'étude de branchement axonal dans une préparation Mont entiers de souris embryonnaires de la moelle épinière
Dans cet article
Résumé
Les projections stéréotypée des afférences sensorielles dans la moelle épinière des rongeurs offrent un système facilement accessible à l'étude expérimentale de branchement axonal par le traçage d'axones unique.
Résumé
Nous présentons ici une technique d'étiqueter les trajectoires des petits groupes de neurones DRG dans la moelle épinière embryonnaire par coloration diffusif en utilisant les traceurs lipophiles 1,1 '-dioctadécyl-3, 3,3', 3'-tetramethylindocarbocyanine perchlorate (DII) 1 . La comparaison des voies axonales de type sauvage avec ceux des lignées de souris dont les gènes sont mutés permet de tester un rôle fonctionnel des protéines candidates dans le contrôle des axones de branchement qui est un mécanisme essentiel dans le câblage du système nerveux. Axonale branchement permet un neurone individuel de se connecter avec des cibles multiples, fournissant ainsi la base physique pour le traitement parallèle des informations. Ramifications au niveau des régions objectif intermédiaire de croissance axonale peut être distinguée de l'arborisation terminale. Par ailleurs, différents modes de formation de la branche axonale peuvent être classés selon que les résultats de branchement des activités du cône de croissance (splitting ou soutien-gorge retardéenching) ou à partir du bourgeonnement de collatérales de l'arbre axone dans un processus appelé interstitielle branchement 2 (fig. 1).
Les projections centrales des neurones du DRG offrir un système expérimental utile pour étudier les deux types de branchement axonal: quand leurs axones afférents atteignent la zone de la racine dorsale d'entrée (DREZ) de la moelle épinière entre jours embryonnaires 10 à 13 (E10 - E13), ils afficher un motif stéréotypé de T ou en forme de Y bifurcation. Les deux filles résultant axones ensuite dans des directions rostrale ou caudale, respectivement, à la marge du cordon dorsolatéral et seulement après une période d'attente collatéraux poussent à partir de ces axones souches pour pénétrer la matière grise (interstitiels de branchement) et projet de neurones relais spécifiques lames de la moelle épinière, où ils ont en outre s'arborisent (borne de branchement) 3. Tracés DiI ont révélé des cônes de croissance dans la zone d'entrée des racines dorsales de la moelle épinière qui semblait être dans le processus de fractionnement ce qui suggère que la bifurcation est causée par fractionnement du cône de croissance lui-même 4 (Fig. 2), toutefois, d'autres options ont été discutées ainsi 5.
Cette vidéo montre d'abord comment disséquer la moelle épinière des souris E12.5 laissant le DRG-joint. Suite à la fixation des montants du spécimen minuscule DiI sont appliqués à l'aide d'aiguilles de verre DRG tirée de tubes capillaires. Après une étape d'incubation, le cordon médullaire étiquetés est monté comme un livre ouvert inversé la préparation d'analyser les axones individuels en utilisant la microscopie à fluorescence.
Protocole
1. Procédure de dissection
Remarque: l'utilisation expérimentale de la souris doit suivre des directives officiellement approuvées pour le soin et l'utilisation des animaux de laboratoire.
- Avant la préparation, mettre en place votre loupe binoculaire et à exposer les instruments chirurgicaux nécessaires à la dissection, y compris les ciseaux, grandes et petites, grandes pinces à griffes, pinces courbes et quatre séries de Dumont No.5 dissection pince (dont deux ont à l'intérieur poli astuces) ( pour plus de détails voir le tableau des réactifs spécifiques et les équipements). Placez une feuille de papier filtre dans un 100 mm Sylgard enduits boîte de Pétri. Verser PBS froid dans le puits d'une plaque de 12 puits, un plat de Pétri de 100 mm et un tube de 12 ml et laisser sur la glace. Pipeter 2 ml de tampon de fixation (paraformaldéhyde à 4% dans du PBS, pH 7,4) dans chaque puits d'une seconde plaque de 12 puits et la placer sur la glace.
- Après l'anesthésie, le sacrifice du barrage chronométré enceinte à E12.5 (détection de bouchon vaginal a été désigné comme E 0,5), placez la sourisavec sa place face ventrale sur trois feuilles de papier absorbant et les faire tremper la région abdominale avec de l'éthanol à 70%.
- Ouvrez la cavité abdomino-pelvienne, d'isoler les cornes utérines bilatérales et les transférer dans l'un des plats de 100 mm avec PBS glacé.
- Sous contrôle microscopique, faire une incision longitudinale de la paroi utérine avec de petits ciseaux droits et couper chaque sac amniotique du placenta.
- Peler le sac amniotique de chaque embryon et couper le cordon ombilical.
- L'utilisation de petits ciseaux, décapitent les embryons et de mettre les têtes ou une partie d'entre eux de côté pour l'isolement de l'ADN génomique, si génotypage devrait être requise. Par la suite, le transfert de l'Torsi aux puits respectifs de la plaque de 12 puits avec du PBS froid.
- Mouiller le papier filtre dans le plat Sylgard avec quelques gouttes de PBS et la position un torse embryonnaires avec sa face dorsale sur le papier. Pour une meilleure stabilité, redresser sa queue et les extrémités du corps.
- De travailsous un microscope à dissection avec un grossissement d'environ 16x, soigneusement pincer la peau de l'embryon au-dessus de la moelle épinière avec deux paires de pinces fines pointes et doucement la déchirer. À partir du milieu, procéder d'abord vers la queue et ensuite reprendre à partir du milieu vers le côté antérieur.
- Mouiller l'embryon de temps en temps avec deux ou trois gouttes de PBS pour l'empêcher de sécher.
- Pour éviter que les DRG sont déchiré hors de la moelle épinière où il est retiré de l'embryon détacher le DRG et la moelle épinière de la colonne vertébrale cartilagineuse entourant par des mouvements horizontaux coulissants avec la lame d'un pince fine avec à l'intérieur poli conseils. A partir du milieu du côté droit de l'embryon, de travailler votre chemin vers la queue et ensuite à l'extrémité antérieure. Ensuite, répétez la procédure de l'autre côté. Attention à ne pas déchirer la DRG associés.
- Pour détacher complètement desserré le cordon médullaire de l'embryon, ramasser ses cervicpartie avec une pince fine al et le sortir en un seul morceau vers son extrémité caudale.
- Immerger le cordon épinière isolée avec des DRG attachés dans un puits de la plaque de 12 puits rempli de tampon de fixation et de procéder à la préparation de la moelle épinière à partir des embryons restants.
- Fixer la moelle épinière au moins deux heures sur la glace.
2. DII-étiquetage des neurones DRG
- Pour chaque moelle épinière pour être étiqueté, préparer deux aiguilles de verre avec un extracteur micropipette. Nous utilisons un modèle Sutter extracteur P-97 de l'électrode (réglage du programme: 1 CHALEUR = 625, Vel = 35, HEURE = 175; chaleur 2 = 600, Vel = 25, HEURE = 175; 3 CHALEUR = 630, Vel =... 30, HEURE = 150).
- Sous contrôle microscopique trempe le bout de chaque aiguille de verre trois à cinq fois dans un 5% (p / v) solution de DiI dans l'éthanol. L'évaporation de l'éthanol crée une fine couche de cristaux DiI sur l'aiguille.
- Travaillant sous une loupe binoculaire avec un grossissement d'environ 40x, placez une moelle épinière avec ses ventral côté sur une diapositive. Avec des ciseaux à ressort, ouvrez le cordon sur la face ventrale à sa longueur en coupant à travers la plaque de sol pour permettre le montage ultérieur de la préparation dans un livre ouvert inversé mode (voir section C).
- Position de la moelle épinière à la face dorsale sur une diapositive. Ensuite manuellement l'approche du cordon avec la pointe de la DII-couverte de l'aiguille de verre sous visualisation microscopique et soigneusement tous les DRG Pierce secondes sur un côté de la moelle épinière. Presque pas de traces de DiI devrait être visible dans le DRG percé pour assurer l'étiquetage de seulement un petit nombre de neurones. Prenez une seconde aiguille pour l'autre côté de la corde. Visant seulement chaque DRG seconde évite un chevauchement des projections axonales des étiquetés DRG voisins qui pourraient compliquer la différenciation des axones individuels.
- Retour de la moelle épinière à la mémoire tampon de fixation et incuber dans l'obscurité pendant au moins six heures à température ambiante ou une nuit à 4 ° C pour donner du temps pour que le colorant diffuse long de l'axone au sein de la membrane plasmique. Prévoir une période d'incubation plus longue (jusqu'à deux jours à 4 ° C) si l'analyse de la croissance des garanties dans la moelle épinière est souhaitée.
3. Analyse de montage et microscopique
- Après la diffusion, la position de teinture un seul cordon médullaire avec sa face dorsale vers le bas sur une lamelle dans une goutte de PBS. Prenez soin que le DRG attachés sont correctement orientés latéralement et ne se mêlent. Aspirer l'excès de liquide et aplatir le cordon à l'envers à livre ouvert mode en utilisant une pince.
- Monter la préparation sur une lame de microscope à l'aide de PBS.
- Pour éviter l'augmentation de la coloration de fond indésirable analyse par fluorescence microscopique des projections axonales étiqueté doit être effectué le jour du montage. Jusque-là garder les lames dans l'obscurité à 4 ° C.
4. Les résultats représentatifs:
La moelle épinière de la souris reçoit afférentes projections de 8 paires de cervicales, 13 paires de thoraciques, 5 paires de paires lombaires et 4 de la DRG sacrée totalisant à 60 ganglions spinaux. Après une formation une moelle épinière avec la plupart des DRG encore attaché peut être isolé à partir d'un embryon dans moins de cinq minutes. Cette procédure est adaptée pour l'isolement de la moelle épinière avec des DRG jointe de E11.5 E13.5 d'embryons de souris. Cependant, les meilleurs résultats sont obtenus à partir E12.5. Des exemples de résultats de la procédure de labellisation décrites ici sont présentés dans la figure 3. L'étiquetage des DRG sur toute la longueur de la moelle épinière peuvent alors être utilisés pour quantifier le comportement de branchement axonal à différents niveaux vertébraux (Fig. 4).

Figure 1. Schéma illustrant les deux principaux modes de branchement axonal. (A) Branchement par les activités du cône de croissance qui pourrait conduire à une bifurcation - comme indiqué ci - ainsi que tonnelles terminaux complexes ouFormation de vaisseaux collatéraux (B) à l'arbre axone (interstitiels de branchement). Le dernier mode est le type dominant de branchement des axones projetant corticales et thalamo 6,7.

Figure 2 projections afférentes des neurones DRG dans la moelle épinière embryonnaire d'affichage des deux types de branchement axonal:. Axones première succursale à l'DREZ par bifurcation (1) et de la fille des branches forme résultant collatéraux après une période d'attente par interstitielles de branchement (2).
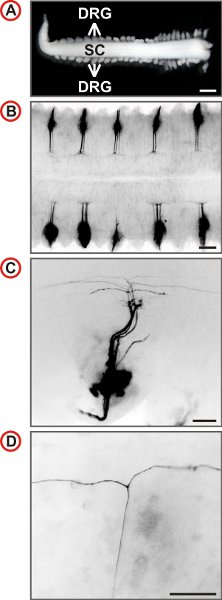
Figure 3. Visualisation des trajectoires simples axonales des neurones DRG embryonnaire de la souris. (A) de la moelle épinière avec des DRG attachés préparés à partir d'un embryon de souris E12.5. (Barre d'échelle, de 1 mm.) (BD) vues dorsale de DII-étiquetés DRG de souris de type sauvage à un grossissement de plus en plus sont affichés. Dans tous les B DRG deuxième labelej en DII. Images de fluorescence sont inversées, caudale est à gauche et en C et D, latéral est à la base. En C, un petit nombre d'axones est étiqueté et un plus fort grossissement de la présence de T-comme les branches peuvent être identifiées dans le DREZ de la moelle épinière. (Barres d'échelle, 250 um (B), 100 um (C) et 50 microns (D).)
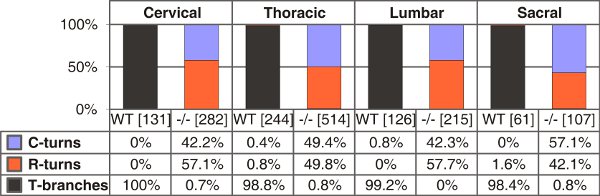
Figure 4. Quantification des branches en forme de T, unique tourne rostrale ou caudale de type sauvage et le C-peptide natriurétique de type (CNP) des souris déficientes à E13.5. Le nombre d'axones seule compté sont indiquées entre parenthèses pour des niveaux différents du tronc de chaque génotype. C-ou R-tours - la croissance seulement en direction caudale ou rostrale, respectivement.
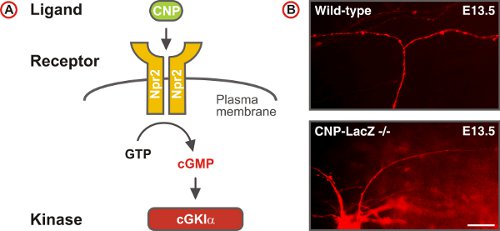
Figure 5. Un GMPc déclenche la signalisation de bifurcation axonale sensorielle à la DREZ de la moelle épinière. (A) Schéma dela voie de signalisation GMPc composé du ligand, le récepteur CNP guanylyl cyclase Npr2 et la sérine / thréonine kinase cGKIα dans les neurones DRG embryonnaire. Npr2 génère cGMP du GTP lors de la stimulation par la CNP. (B) DiI traçage des axones des neurones DRG unique chez les souris de type sauvage et CNP-déficients. (Barre d'échelle, 25 pm).
Discussion
Schémas stéréotypés de projection comprenant deux types de formation branche axonale en collaboration avec la facilité de préparation en combinaison avec l'utilisation de tissus fixés pour l'étiquetage DiI rend le cordon embryonnaire épinière avec un modèle fixé DRG favorables pour étudier axonale branchement. L'application de quantités infimes de DiI utilisant des aiguilles de verre enduit permet - contrairement à la majeure partie de l'étiquetage DRG - la visualisation des petits groupe...
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Les auteurs tiennent à remercier le Dr Alistair Garratt (Centre Max Delbrück, Berlin) pour leurs précieux commentaires. Ce travail a été soutenu par le Centre de recherche en collaboration (SFB665) du Conseil allemand de la recherche (DFG).
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | Commentaires (optionnel) |
| Stéréomicroscope Stemi RDC | Zeiss | ||
| Solution tampon phosphate (PBS) | Biochrom AG | L 182-50 | |
| Paraformaldéhyde | Merck | 8.18715.1000 | |
| Standard ciseaux chirurgicaux | Outils Fine Science | 14001-13 | |
| Crantée pince standards | Outils Fine Science | 11021-14 | |
| Extra fine ciseaux à iris | Outils Fine Science | 14088-10 | |
| Pince courbée | Outils Fine Science | 11003-13 | |
| Dumont No.5 fines pinces à pointes | Outils Fine Science | 11254-20 | |
| Dumont No.5 finition miroir pince | Outils Fine Science | 11252-23 | |
| Vannas-Tübingen ciseaux à ressort | Outils Fine Science | 15008-08 | |
| Le papier filtre | Fisher Scientific | FB59041 | |
| Sylgard 184 | Instruments indéterminations mondiale | SYLG184 | |
| 100 mm boîtes de Pétri | Greiner | 663102 | |
| Tube en polypropylène de 12 ml | Carl Roth GmbH | ECO3.1 | |
| Plaque de culture à 12 puits | Becton Dickinson | 35-3043 | |
| Éthanol | Merck | 1.00983.2500 | |
| Flaming / Brown micropipette extracteur P-97 | Sutter Instrument Co. | ||
| Verre borosilicate capillaires | Harvard Apparatus | 30-0066 | |
| DII (1,1 '-dioctadécyl-3, 3,3', 3'-tétraméthyl - indocarbocyanine perchlorate) | Sigma-Aldrich | 468495 | |
| Lames SuperFrost plus | Carl Roth GmbH | H867.1 | |
| Lamelles de verre | Carl Roth GmbH | 1870.2 |
Références
- Honig, M. G., Hume, R. I. Dil and diO: versatile fluorescent dyes for neuronal labelling and pathway tracing. Trends. Neurosci. 12 (9), 333-333 (1989).
- Acebes, A., Ferrus, A. Cellular and molecular features of axon collaterals and dendrites. Trends. Neurosci. 23 (11), 557-557 (2000).
- Ozaki, S., Snider, W. D. Initial trajectories of sensory axons toward laminar targets in the developing mouse spinal cord. J. Comp. Neurol. 380 (2), 215-215 (1997).
- Schmidt, H. The receptor guanylyl cyclase Npr2 is essential for sensory axon bifurcation within the spinal cord. J. Cell Biol. 179 (2), 331-331 (2007).
- Gibson, D. A., Ma, L. Developmental regulation of axon branching in the vertebrate nervous system. Development. 138 (2), 183-183 (2011).
- O'Leary, D. D., Terashima, T. Cortical axons branch to multiple subcortical targets by interstitial axon budding: implications for target recognition and "waiting periods". Neuron. 1 (10), 901-901 (1988).
- Portera-Cailliau, C. Diverse modes of axon elaboration in the developing neocortex. PLoS. Biol. 3 (8), e272-e272 (2005).
- Gan, W. B. Vital imaging and ultrastructural analysis of individual axon terminals labeled by iontophoretic application of lipophilic dye. J. Neurosci. Methods. 93 (1), 13-13 (1999).
- Schmidt, H. C-type natriuretic peptide (CNP) is a bifurcation factor for sensory neurons. Proc. Natl. Acad. Sci. U. S. A. 106 (39), 16847-16847 (2009).
- Zhao, Z. Regulate axon branching by the cyclic GMP pathway via inhibition of glycogen synthase kinase 3 in dorsal root ganglion sensory neurons. Journal of Neuroscience. 29 (5), 1350-1350 (2009).
- Zhao, Z., Ma, L. Regulation of axonal development by natriuretic peptide hormones. Proc. Natl. Acad. Sci. U. S. A. 106 (42), 18016-18016 (2009).
- Schmidt, H., Rathjen, F. G. Signalling mechanisms regulating axonal branching in vivo. Bioessays. , (2010).
- Feng, G. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28 (1), 41-41 (2000).
- Livet, J. Transgenic strategies for combinatorial expression of fluorescent proteins in the nervous system. Nature. 450 (7166), 56-56 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon