Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
DiI-Markierung von DRG-Neuronen zu Study Axonal Branching in einer Whole Mount Vorbereitung von embryonalen Maus-Spinal Cord
In diesem Artikel
Zusammenfassung
Die stereotypen Projektionen von sensorischen Afferenzen in das Nagetier Rückenmark bieten eine leicht zugängliche experimentelle System zur axonalen Verzweigung durch die Verfolgung einzelner Axone zu studieren.
Zusammenfassung
Hier präsentieren wir eine Technik, um die Flugbahnen der kleinen Gruppen von DRG-Neuronen in den embryonalen Rückenmark Label diffusive Färbung unter Verwendung des lipophilen Tracer 1,1 '-Dioctadecyl-3, 3,3', 3'-tetramethylindocarbocyanine Perchlorat (DiI) 1 . Der Vergleich der axonalen Bahnen von Wildtyp-mit denen der Maus Zeilen, in denen Gene mutiert sind erlaubt die Prüfung für eine funktionale Rolle der Kandidaten-Proteine in der Kontrolle des axonalen Verzweigungen, die ein wesentlicher Mechanismus in der Verdrahtung des Nervensystems ist. Axonal Verzweigung ermöglicht ein einzelnes Neuron mit mehreren Zielen verbinden, wodurch die physikalische Grundlage für die parallele Verarbeitung von Informationen. Ramifications bei mittleren Zielregionen des axonalen Wachstums kann von Endverzweigung unterschieden werden. Darüber hinaus kann in verschiedenen Modi axonale Verzweigung Bildung abhängig davon, ob Verzweigung ergibt sich aus der Tätigkeit des Wachstums Kegel (Splitting oder verzögert BH klassifiziert werdennching) oder aus den Knospen von Sicherheiten aus dem Axon Welle in einem Prozess namens interstitielle Verzweigung 2 (Abb. 1).
Die zentralen Projektionen von Neuronen aus dem DRG bieten ein nützliches experimentelles System, um beide Arten von axonalen Verzweigung Studie: wenn ihre afferenten Axone erreichen die Spinalganglien entry zone (Drez) des Rückenmarks zwischen embryonalen Tage 10 bis 13 (E10 - E13) sie Anzeige einer stereotypen Muster von T-oder Y-förmigen Verzweigung. Die beiden entstehenden Tochterzellen Axone dann in rostralen oder kaudalen Richtungen gehen jeweils an der dorsolateralen Rand der Schnur und erst nach einer Wartezeit Sicherheiten sprießen aus diesen Stammzellen Axone in die graue Substanz (interstitielle Verzweigung) und Projekt-Relais Nervenzellen in bestimmten eindringen Laminae des Rückenmarks, wo sie weiter verzweigen (Klemme Verzweigung) 3. DiI Kurven haben das Wachstum Kegel an der Spinalganglien Eingangszone des Rückenmarks, die in der pr sein schien enthülltocess der Aufspaltung darauf hindeutet, dass Bifurkation durch die Spaltung des Wachstums Konus selbst 4 (Abb. 2) verursacht wird, jedoch auch andere Optionen, wie gut 5 diskutiert worden.
Dieses Video zeigt zunächst, wie man das Rückenmark von E12.5 Mäusen Verlassen des DRG befestigt sezieren. Nach der Fixierung des Prüflings winzige Mengen DiI angewendet werden, um DRG mit Glas Nadeln aus Kapillaren gezogen. Nach einer Inkubationszeit Schritt wird der markierte Rückenmark als ein umgekehrtes Open-Book Vorbereitung auf einzelne Axone mittels Fluoreszenzmikroskopie analysiert montiert.
Protokoll
1. Dissection Verfahren
Hinweis: Experimentelle Verwendung von Mäusen sollten amtlich zugelassen folgen Richtlinien für die Pflege und Nutzung von Labortieren.
- Vor der Präparation, richten Sie Ihren Präpariermikroskop und legen die chirurgischen Instrumente für die Präparation, darunter grosse und kleine Schere, große Zahn-Zange, einer gebogenen Pinzette und vier Gruppen von Dumont No.5 Pinzette (von denen zwei inside-polierte Spitzen haben) notwendig ( für Details siehe die Tabelle der spezifischen Reagenzien und Geräte). Legen Sie ein Blatt Filterpapier in ein 100-mm Sylgard-beschichtete Petrischale. Gießen Sie kaltes PBS in die Vertiefungen einer 12-Well-Platte, ein 100-mm-Petrischale und einem 12-ml-Tube und lassen auf Eis. Pipette 2ml Fixierung Puffer (4% Paraformaldehyd in PBS, pH 7,4) in jede Vertiefung einer zweiten 12-Well-Platte und auf Eis stellen.
- Nach Betäubung, opfern die zeitgesteuerte schwangere Mutter bei E12.5 (Nachweis von Vaginalpfropf wurde als E0.5 bezeichnet), platzieren Sie den Mauszeigermit seiner Bauchseite bis auf drei Blatt Papier Handtücher und genießen den Bauchbereich mit 70% Ethanol.
- Öffnen Sie die Bauch-Hohlraum, isolieren die bilateralen Uterushörner und überführen sie in eine der 100-mm-Schalen mit eiskaltem PBS.
- Unter mikroskopischer Kontrolle, machen Sie einen Längsschnitt der Gebärmutterwand mit kleinen, geraden Schere und schnitt jedes Fruchtblase aus der Plazenta.
- Peel entfernt die Fruchtblase von jedem Embryo und die Nabelschnur.
- Mit einer kleinen Schere, enthaupten die Embryonen und legte die Köpfe oder ein Teil von ihnen beiseite für die Isolierung genomischer DNA, wenn Genotypisierung erforderlich sein sollte. Anschließend übertragen Sie die Torsi, die entsprechenden Wells der 12-Well-Platte mit kaltem PBS.
- Wet das Filterpapier in die Sylgard Teller mit ein paar Tropfen PBS und die Position eines embryonalen Torso mit seiner dorsalen Seite nach oben auf dem Papier. Für eine bessere Stabilität, gerade mit dem Schwanz und Extremitäten vom Körper weg.
- Arbeitenunter einem Binokular mit einer Vergrößerung von ca. 16x, sorgfältig Sie die Haut des Embryos über das Rückenmark mit zwei Paaren von feinen Spitzen einer Pinzette und sanft zerreißen. Beginnend in der Mitte, zunächst weiter in Richtung Heck und dann die Wiederaufnahme von der Mitte in Richtung der vorderen Seite.
- Wet der Embryo von Zeit zu Zeit mit zwei oder drei Tropfen PBS auf sie vor dem Austrocknen zu verhindern.
- Um zu verhindern, dass DRG werden aus dem Rückenmark gerissen, wenn es aus dem Embryo entnommen wird lösen die DRG und das Rückenmark von den umgebenden knorpeligen Wirbelsäule durch Horizontal-Schiebe-Bewegungen mit der Klinge eines feinen Pinzette mit inside-polierte Spitzen. Ab in die Mitte des Embryos der rechten Seite, arbeiten Sie Ihren Weg in Richtung Schwanz und dann auf das vordere Ende. Danach wiederholen Sie den Vorgang auf der anderen Seite. Achten Sie darauf, rip off der zugehörigen DRG.
- So trennen Sie völlig die gelösten Rückenmark aus dem Embryo, abholen seine cervical Teil mit feinen Pinzetten und ziehen Sie sie in einem Stück zu seinem kaudalen Ende.
- Tauchen Sie die isolierten Rückenmark mit angeschlossenem DRG in eine Vertiefung der 12-Well-Platte mit Fixierung Puffer gefüllt und mit der Vorbereitung des Rückenmarks von den übrigen Embryonen.
- Fix Rückenmark mindestens zwei Stunden auf dem Eis.
2. DiI-Markierung von DRG-Neuronen
- Für jedes Rückenmark gekennzeichnet werden, bereiten zwei Glas-Nadeln mit einer Mikropipette Abzieher. Wir verwenden eine Sutter Modell P-97-Elektrode Abzieher (Programm-Einstellung: 1 HEAT = 625, VEL = 35, TIME = 175, 2 HEAT = 600, VEL = 25, TIME = 175, 3 HEAT = 630, VEL =... 30, TIME = 150).
- Unter mikroskopischer Kontrolle dip der Spitze jeder Glasnadel drei vor fünf Mal in einer 5% (w / v) Lösung von DiI in Ethanol. Die Verdampfung des Ethanol erzeugt eine dünne Schicht von DiI-Kristalle auf der Nadel.
- Das Arbeiten unter einem Binokular mit einer Vergrößerung von ca. 40x, legen Sie ein Rückenmark mit seinen ventral Seite nach oben auf einer Folie. Mit Feder Schere, öffnen Sie das Netzkabel auf der Bauchseite auf seiner ganzen Länge durch einen Schnitt durch die Bodenplatte, damit die spätere Montage der Zubereitung in einer invertierten Open-Book-Modus (siehe Abschnitt C).
- Position des Rückenmarks mit der dorsalen Seite nach oben auf einer Folie. Dann manuell Ansatz die Schnur mit der DiI verschneiten Spitze der Glas-Nadel unter mikroskopischer Visualisierung und sorgfältig durchdringen jede zweite DRG auf einer Seite des Rückenmarks. Fast keine Spuren von DiI sollte in die durchbohrte DRG sichtbar für die Kennzeichnung von nur einer kleinen Zahl von Neuronen sorgen. Nehmen Sie eine zweite Nadel für die andere Seite des Kabels. Aiming nur jede zweite DRG vermeidet eine Überschneidung der markierten axonalen Projektionen aus dem benachbarten DRG, die die Differenzierung einzelner Axone erschweren könnte.
- Zurück im Rückenmark, die Fixierung Puffer und Inkubation im Dunkeln für mindestens sechs Stunden bei Raumtemperatur oder über Nacht bei 4 ° C, um Zeit für den Farbstoff geben, diffuse entlang des Axons innerhalb der Plasmamembran. Lassen Sie für eine längere Inkubationszeit (bis zu zwei Tage bei 4 ° C), wenn die Analyse von Sicherheiten Wachstum in das Rückenmark ist erwünscht.
3. Montage-und mikroskopische Analyse
- Nach Farbstoffdiffusion, Position einer Rückenmark mit seiner dorsalen Seite nach unten auf einem Deckglas in einem Tropfen PBS. Achten Sie darauf, dass die angehängte DRG richtig ausgerichtet sind seitlich und nicht vermischen. Saugen Sie überschüssige Flüssigkeit und abflachen das Kabel in einem umgekehrten Open-Book-Modus mit einer Pinzette.
- Montieren Sie die Vorbereitung auf einen Objektträger mit PBS.
- Um zu verhindern, die Zunahme von unerwünschten Hintergrundfärbung fluoreszenzmikroskopische Analyse von markierten axonalen Projektionen sollte der Tag der Montage durchgeführt. Bis dahin halten die Folien im Dunkeln bei 4 ° C.
4. Repräsentative Ergebnisse:
Das Rückenmark der Maus empfängt afferente projections von 8 Paaren von Gebärmutterhalskrebs, 13 Paar Brust-, 5 Paar Lenden-und 4 Paar sakralen DRG insgesamt auf 60 Spinalganglien. Nach einigem Training ein Rückenmark mit den meisten DRG noch befestigt werden aus einem Embryo in unter 5 Minuten isoliert werden. Dieses Verfahren ist für die Isolierung von Rückenmark mit angeschlossenem DRG ab E11.5 E13.5 auf Maus-Embryonen geeignet. Allerdings sind die besten Ergebnisse aus E12.5 erreicht. Beispielhafte Ergebnisse der Kennzeichnung hier beschriebene Verfahren sind in Abbildung 3 dargestellt. Die Beschriftung der DRG über die gesamte Länge des Rückenmarks kann dann verwendet werden, um axonale Verzweigung Verhalten bei verschiedenen Wirbelkörper Ebenen (Abb. 4) zu quantifizieren.

Abbildung 1. Scheme Darstellung der beiden wichtigsten Arten der axonalen Verzweigung. (A) Branching durch die Aktivitäten des Wachstums Kegel, die zu einer Bifurkation führen könnte - wie hier angedeutet - ebenso wie komplexe Klemme Lauben oder(B) Sicherheiten Formation in das Axon Welle (interstitielle Verzweigung). Letzterer Modus ist die dominierende Verzweigung Art der Projektion kortikalen und thalamokortikalen Axone 6,7.

Abbildung 2 afferente Projektionen von DRG-Neuronen in den embryonalen Rückenmark zeigen beide Arten von axonalen Verzweigung:. Axone erste Filiale an der Drez durch Bifurkation (1) und aus dem resultierenden Tochter Niederlassungen Sicherheiten Form nach einer Wartezeit von interstitiellen Verzweigung (2).
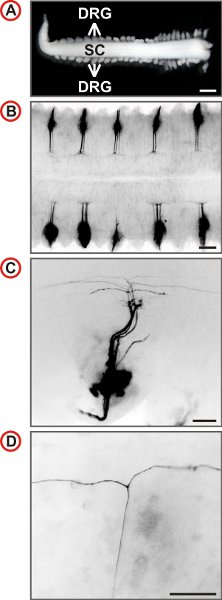
Abbildung 3. Visualisierung der einzelnen axonalen Bahnen von embryonalen Maus-DRG-Neuronen. (A) des Rückenmarks mit angeschlossenem DRG aus einer E12.5 Maus-Embryo vorbereitet. (Scale bar, 1 mm.) (BD) Dorsale Ansichten von DiI-markierten DRG von Wildtyp-Mäusen bei zunehmender Vergrößerung dargestellt. In B jeden zweiten DRG ist labeled von DiI. Fluoreszenzbilder invertiert werden, ist caudal auf der linken Seite und in C und D, lateral ist am Boden. In C eine kleine Anzahl von Axonen gekennzeichnet ist und bei höherer Vergrößerung der Präsenz von T-like Zweige können in der Drez des Rückenmarks gekennzeichnet. (Scale Bars, 250 pm (B), 100 pm (C) und 50 um (D).)
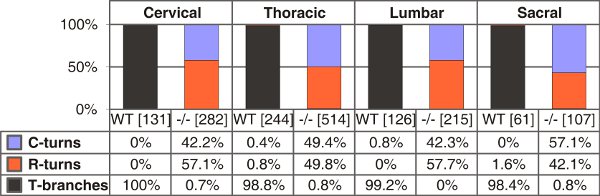
Abbildung 4. Quantifizierung von T-förmige Verzweigungen, single rostralen oder kaudalen wird in Wildtyp-und C-Typ natriuretische Peptid (CNP)-defizienten Mäusen bei E13.5. Die Zahl der einzelnen Axone gezählt sind in Klammern für die verschiedenen Stamm Ebenen für jeden Genotyp gegeben. C-oder R-Kurven - Wachstum nur in caudal oder rostral Richtung.
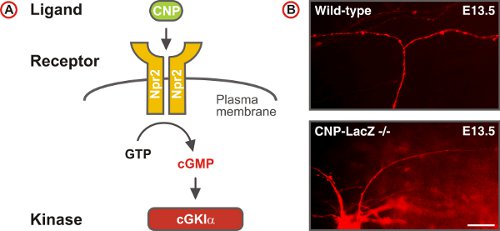
Abbildung 5. A cGMP-Signalweg auslöst sensorischen Axon Bifurkation an der Drez des Rückenmarks. (A) Schema derdes cGMP-Signalweges des Liganden CNP, der Rezeptor Guanylylcyclase Npr2 und der Serin / Threonin-Kinase cGKIα in embryonalen DRG-Neuronen zusammen. Npr2 erzeugt cGMP aus GTP nach Stimulation durch CNP. (B) DiI Tracing einzelner Axone der DRG-Neuronen in Wildtyp-und CNP-defizienten Mäusen. (Scale bar, 25 um.)
Diskussion
Stereotype Projektionsmuster aus beiden Arten von axonalen Verzweigung Bildung zusammen mit einfachen Herstellung in Kombination mit der Verwendung von fixiertem Gewebe für DiI Kennzeichnung macht die embryonalen Rückenmarks mit angeschlossenem DRG ein günstiges Modell zu studieren axonale Verzweigung. Die Anwendung von kleinsten Mengen an DiI mit beschichtetem Glas Nadeln ermöglicht - im Gegensatz zu den Bulk-Kennzeichnung von DRG - die Visualisierung von kleinen Gruppen von DRG-Neuronen und damit die Analyse einze...
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Die Autoren danken Dr. Alistair Garratt (Max-Delbrück-Centrum, Berlin) für hilfreiche Kommentare. Diese Arbeit wurde von der SFB (SFB665) von der Deutschen Forschungsgemeinschaft (DFG) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare (optional) |
| Stereomikroskop Stemi DR Kongo | Zeiss | ||
| Phosphat-gepufferte Lösung (PBS) | Biochrom AG | L182-50 | |
| Paraformaldehyd | Merck | 8.18715.1000 | |
| Standard-OP-Schere | Feine Science Tools | 14001-13 | |
| Zahnriemen Standard Pinzette | Feine Science Tools | 11021-14 | |
| Extra fine Iris Schere | Feine Science Tools | 14088-10 | |
| Gebogene Pinzette | Feine Science Tools | 11003-13 | |
| Dumont No.5 feinen Spitzen einer Pinzette | Feine Science Tools | 11254-20 | |
| Dumont No.5 Hochglanz Zange | Feine Science Tools | 11252-23 | |
| Vannas-Tübingen Frühjahr Schere | Feine Science Tools | 15008-08 | |
| Filterpapier | Fisher Scientific | FB59041 | |
| Sylgard 184 | Welt Precission Instruments | SYLG184 | |
| 100-mm-Petrischalen | Greiner | 663102 | |
| 12-ml Polypropylen-Röhrchen | Carl Roth GmbH | ECO3.1 | |
| 12-Well-Zellkulturplatten | Becton Dickinson | 35-3043 | |
| Ethanol | Merck | 1.00983.2500 | |
| Flaming / Brown Mikropipette Puller P-97 | Sutter Instrument Co. | ||
| Borosilikatglas Kapillaren | Harvard Apparatus | 30-0066 | |
| DiI (1,1 '-Dioctadecyl-3, 3,3', 3'-tetramethyl - indocarbocyanine Perchlorat) | Sigma-Aldrich | 468495 | |
| Objektträger SuperFrost Plus | Carl Roth GmbH | H867.1 | |
| Glasdeckgläschen | Carl Roth GmbH | 1870,2 |
Referenzen
- Honig, M. G., Hume, R. I. Dil and diO: versatile fluorescent dyes for neuronal labelling and pathway tracing. Trends. Neurosci. 12 (9), 333-333 (1989).
- Acebes, A., Ferrus, A. Cellular and molecular features of axon collaterals and dendrites. Trends. Neurosci. 23 (11), 557-557 (2000).
- Ozaki, S., Snider, W. D. Initial trajectories of sensory axons toward laminar targets in the developing mouse spinal cord. J. Comp. Neurol. 380 (2), 215-215 (1997).
- Schmidt, H. The receptor guanylyl cyclase Npr2 is essential for sensory axon bifurcation within the spinal cord. J. Cell Biol. 179 (2), 331-331 (2007).
- Gibson, D. A., Ma, L. Developmental regulation of axon branching in the vertebrate nervous system. Development. 138 (2), 183-183 (2011).
- O'Leary, D. D., Terashima, T. Cortical axons branch to multiple subcortical targets by interstitial axon budding: implications for target recognition and "waiting periods". Neuron. 1 (10), 901-901 (1988).
- Portera-Cailliau, C. Diverse modes of axon elaboration in the developing neocortex. PLoS. Biol. 3 (8), e272-e272 (2005).
- Gan, W. B. Vital imaging and ultrastructural analysis of individual axon terminals labeled by iontophoretic application of lipophilic dye. J. Neurosci. Methods. 93 (1), 13-13 (1999).
- Schmidt, H. C-type natriuretic peptide (CNP) is a bifurcation factor for sensory neurons. Proc. Natl. Acad. Sci. U. S. A. 106 (39), 16847-16847 (2009).
- Zhao, Z. Regulate axon branching by the cyclic GMP pathway via inhibition of glycogen synthase kinase 3 in dorsal root ganglion sensory neurons. Journal of Neuroscience. 29 (5), 1350-1350 (2009).
- Zhao, Z., Ma, L. Regulation of axonal development by natriuretic peptide hormones. Proc. Natl. Acad. Sci. U. S. A. 106 (42), 18016-18016 (2009).
- Schmidt, H., Rathjen, F. G. Signalling mechanisms regulating axonal branching in vivo. Bioessays. , (2010).
- Feng, G. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28 (1), 41-41 (2000).
- Livet, J. Transgenic strategies for combinatorial expression of fluorescent proteins in the nervous system. Nature. 450 (7166), 56-56 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten