JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
마우스 배아 척수의 전체 마운트 준비 분기 Axonal 공부 DRG 뉴런의 DiI - 라벨링
요약
쥐 척수로 감각 afferents의 틀에 박힌 예상 단일 axons의 추적을 통해 axonal 분기를 공부하기 위해 쉽게 액세스할 실험 시스템을 제공합니다.
초록
여기서 우리는 lipophilic 추적 1,1 '- dioctadecyl - 3, 3,3', 퍼클로레이트 (DiI 1) 3' - tetramethylindocarbocyanine를 사용하여 잘 퍼지는 얼룩하여 배아 척수로 DRG 뉴런의 작은 그룹의 탄도를 레이블에 기술을 제시 . 유전자가 변이된있는 마우스 라인의 사람과 야생 타입의 axonal 경로의 비교는 신경 시스템의 배선에 필수적인 메커니즘입니다 axonal 분기의 제어 후보 단백질의 기능 역할에 대한 테스트를하실 수 있습니다. Axonal 분기되므로 정보의 병렬 처리를위한 물리적 기초를 제공하고, 복수의 타겟과 연결하는 개별 신경 세포 수 있습니다. axonal 성장의 중간 타겟 지역에 파급 효과가 터미널 arborization 구분할 수 있습니다. 또한, axonal 지점 형성의 다른 모드는 성장 원추의 활동 (분할 또는 지연 브래지어의 여부 분기 결과에 따라 분류있을 수 있습니다nching) 또는 과정에서 축삭 축에서 민간인 피해의 신진부터 중간 분기 2 (그림 1)했다.
DRG에서 뉴런의 중심 예상 axonal 분기 두 가지 유형의 연구를하는 유용한 실험 시스템을 제공합니다 : 자신의 수입 성의 axons시 10 분 13 일 (E10 - E13) 배아 일 사이에 척수의 지느러미 루트 항목 영역 (DREZ)를 도달할 때 틀에 박힌 패턴의 T 또는 Y 형 분기를 표시합니다. 두 결과의 딸 axons 다음 코드의 dorsolateral 여백에서 각각 주동이의 또는 꼬리 방향으로 진행하고 대기 기간 민간인 피해는 특정의 릴레이 뉴런에 회색 물질 (중간 분기) 및 프로젝트를 침투 이러한 줄기 axons에서 새싹 후에만 그들은 더 이상 (터미널 분기) 3 arborize 척수의 laminae. DiI의 tracings은 PR에 나타나 척수의 지느러미 루트 항목 영역에서 성장 콘 감을 잡을수있다그 분기점을 제안 분할의 ocess이 성장 원추 자체 4 (그림 2) 분할로 인해 발생하지만, 다른 옵션은 물론 5 논의되었습니다.
이 비디오는 DRG가 첨부된 떠나는 E12.5 생쥐의 척수를 해부하다하는 방법을 첫째 보여줍니다. DiI의 표본 작은 금액의 다음 고정은 모세관 튜브에서 나온 유리 바늘을 사용하여 DRG에 적용됩니다. 부화 단계 후, 표시된 척수는 형광 현미경을 사용하여 개별 axons을 분석 거꾸로 오픈 책을 준비로 마운트됩니다.
프로토콜
1. 해부 절차
참고 : 마우스의 실험적 사용이 공식적으로 실험실 동물 관리 및 사용에 대한 지침을 승인 따라야합니다.
- 준비하기 전에, 해부 현미경을 설정하고 집게를 (내부 - 광택 조언을 두 중) 해부 크고 작은 가위, 큰 톱니 포셉, 곡선 포셉 및 뒤몽 제 5의 4 세트를 포함하여 해부에 필요한 수술 도구를하다 ( 자세한 내용은)는 특정 시약 및 장비의 테이블을 참조하십시오. 100 mm Sylgard - 코팅 배양 접시에있는 필터 종이를 놓습니다. 12 잘 판, 100 mm 페트리 접시와 12 ML 관의 우물에서 차가운 PBS를 붓고 얼음을 두십시오. 얼음 두 번째 12 잘 플레이트와 장소의 각 우물에 고정 버퍼의 피펫 2ml (PBS, pH를 7.4에서 4 % paraformaldehyde).
- anesthetization 후, E12.5 (질 플러그 감지 E0.5로 지정)에 초과 임신 댐을 희생, 마우스를 장소세 종이 수건의 시트 및 70 % 에탄올로 복부 영역을 흡수에 미치는 복부 측면까지 함께.
- abdominopelvic 구멍을 열고, 양국 자궁 뿔을 분리하고 차가운 PBS로 100 mm 요리 중 하나에 그들을 전송합니다.
- 미세한 통제, 소형, 바로 가위로 이번에는 질 벽에의 세로 절개를하고 태반에서 각 amniotic SAC 버려야.
- 벗겨내는 amniotic 각 배아에서 SAC와 탯줄은 자르고.
- 작은 가위를 사용하여 배아를 참살하고 genotyping가 필요해야하는 경우 게놈 DNA의 격리를 위해 별도로 머리 또는의 일부를 넣어. 그 후, 차가운 PBS로 12 잘 판의 각 우물에 torsi을 전송.
- PBS 몇 방울로 Sylgard 접시에 필터 용지를 습식 및 종이의 지느러미 측면과 배아 몸통을 위치. 더 나은 안정성을 위해, 시체에서 떨어진 꼬리와 사지를 펴.
- 일하는약 16X의 확대와 해부 현미경, 신중하게 좋은 밀고 집게의 두 쌍이있는 척수 위의 배아의 피부를 꼬집어 부드럽게 그것을 갈가리 찢어. 중간에부터 꼬리 방향으로 첫째 진행 후 앞쪽에 편으로의 중간에서 다시 시작.
- 건조하지 않도록 PBS의 두세 방울과 함께 수시로 배아가 젖었어.
- 그것이 내부 - 광택 팁을 벌금 포셉의 날개와 수평 슬라이딩 운동에 의해 주변의 연골이 척추 칼럼에서 DRG와 척수를 분리 배아에서 제거됩니다 때 DRG를 방지하기 위해이 척수에서 출발 시끄러운 쓰레기 오토바이 경찰입니다. 배의 오른쪽 가운데에 시작, 앞쪽에 끝에 다음 꼬리쪽으로 길을 작동합니다. 그 후, 반대편에있는 절차를 반복합니다. 관련 DRG를 다 뜯어내고하지 않도록주의하십시오.
- 배아에서 완전히 느슨하게 척수를 분리하려면 해당 cervic 데리러야외 미세 집게로 부분과 꼬리 끝 부분 한 조각에서 빼낸다.
- 분리된 척추 고정 버퍼 가득 12 - 음 판의 우물에 첨부 DRG와 코드와 남은 배아에서 척수 코드의 준비와 진행 잠수함.
- 척추 코드에게 얼음에 적어도 두 시간을 수정.
2. DRG의 뉴런의 DiI - 라벨링
- 표시되는 각 척수 들어, micropipette를 끌어당기는 두 개의 유리 바늘을 준비합니다. ..., 2 열 = 600 벨 = 25 시간 = 175, 3 열 = 630, 벨 = 1 열 = 625, 벨 = 35 시간 = 175 : 우리는 셔터 모델 P - 97 전극 풀러 (프로그램 설정을 사용 30 시간 = 150).
- 미세한 통제하에 3-5 시간은 에탄올에 DiI의 5 % (W / V) 솔루션의 각 유리 바늘의 끝부분을 찍어. 에탄올의 증발은 바늘에 DiI 크리스털의 얇은 레이어를 만듭니다.
- 약 40x의 배율과 해부 현미경 작업, 그 V와 척수를 배치슬라이드에 entral 측면까지. 스프링 가위를 사용하여 나중에 (섹션 C를 참조) 거꾸로 개방 책 모드에서 준비 장착 있도록 floorplate을 통해 절단하여 전체 길이의 복부 측면에있는 코드를 엽니다.
- 슬라이드에 지느러미 측면과 척수를 놓습니다. 그런 다음 수동으로 미세한 시각화에서 유리 바늘의 DiI 덮인 팁 및 척수의 한쪽 신중하게 피어스는 매초마다 DRG와 코드를 접근한다. DiI의 거의 흔적은 뉴런만이 소수의 라벨을 보장하기 위해 뚫었 DRG에서 볼 수 없습니다. 코드의 다른 측면에 대한 두 번째 바늘을 가져가라. 단 매초 DRG를 목표로하는 것은 개별 axons의 차별 복잡 수도 인근에서 DRG 분류 axonal 계획의 중복 방지.
- 최소한 6 주위 온도에서 시간 또는 4 하룻밤 동안 짙은 어둠 속에서 고정 버퍼와 부화 척수를 반환 ° C가 디로 염색 시간을주고플라즈마 막 내의 축삭을 따라 ffuse. 척수에 부수적인 성장의 분석이 필요한 경우 긴 잠복기 (4 시에하는 데 이틀 ° C)에 대한 허용합니다.
3. 마운트 및 현미경 분석
- 그 지느러미 면을 하나의 척수는 PBS의 드롭에서 coverslip에 아래 염료 확산, 위치 다음. 첨부된 DRG가 옆으로 올바르게 지향적이며, 뒤섞이다하지 않는 조심해. 초과 액체를 기음과 집게를 사용하여 거꾸로 오픈 책을 모드에서 코드를 버리고.
- PBS를 사용하여 현미경 슬라이드에 대한 준비를 탑재합니다.
- 분류 axonal 계획의 불필요한 배경 얼룩 형광 현미경 분석의 증가를 방지하기 위해서 마운트의 하루를 실시한다. 다음 4 어둠의 슬라이드를 유지까지 ° C.
4. 대표 결과 :
마우스의 척수는 수입 성의 PR를받습니다자궁 경부의 8쌍에서 ojections, 흉부의 13쌍, 60 척추 신경에 총 성례의 DRG의 요추와 4쌍 5쌍. 훈련 후에도 연결된 대부분의 DRG와 척수는 5 분 안에 배아에서 격리 수 있습니다. 이 절차는 E11.5에서 E13.5 마우스 배아에 연결된 DRG와 척수 코드의 격리에 적합합니다. 그러나, 최상의 결과는 E12.5에서 달성하고 있습니다. 여기에서 설명한 상표 절차의 전형적인 결과는 그림 3에 표시됩니다. 척수의 전체 길이 이상의 DRG의 라벨은 다음 여러 척추 레벨 (그림 4)에서 axonal 분기 동작을 계량하는 데 사용할 수 있습니다.

그림 1. 제도 axonal 분기의 두 주요 모드를 묘사. 여기에 표시된대로 - - (A) 분기점으로 이어질 수 성장 원추의 활동에 의해 분기뿐만 아니라 복잡한 터미널 arbors 또는축삭 샤프트에서 (B) 부수 형성 (중간 분기). 후자 모드는 6,7 대뇌 피질과 thalamocortical axons을 예상의 지배 분기 유형입니다.

그림 2 배아 척수로 DRG 뉴런의 수입 성의 전망은 axonal 분기 두 가지 유형의 표시 :. 분기점에 의해 DREZ (1)에서와 중간 분기 (2)에 의해 대기 기간 후에 발생하는 딸 지점의 민간인 피해 양식에서 axons 첫번째 지점을.
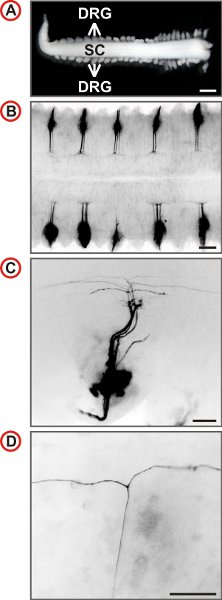
그림 3. 배아 마우스 DRG의 신경의 단일 axonal 궤도의 시각화. (A) 첨부 DRG와 척수는 E12.5 마우스의 배아에서 준비했습니다. 증가 확대에 야생 형 생쥐의 DiI - 레이블 DRG의 (스케일 바, 1mm.) (BD) 등의 전망이 표시됩니다. B의 모든 초 DRG는 labele입니다DiI로 D. 형광 이미지가 거꾸로 있으며, 꼬리는 왼쪽에 있으며, 측면 C와 D에서 맨 아래에 있습니다. C에서 axons의 작은 번호가 표시되고 더 높은 배율에서 T와 같은 가지의 존재는 척수의 DREZ에서 확인할 수 있습니다. (스케일 바, 250 μm의 (B), 100 μm의 (C)와 50 μm의 (D).)
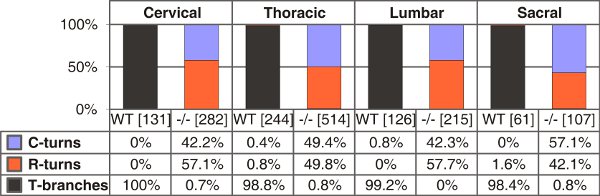
그림 4. T - 모양의 가지, 야생 형에서 단일 주동이의 혹은 꼬리 전환 및 C - 타입 natriuretic 펩티드 (CNP) - 결함 E13.5에서 생쥐의 부량. 계산 한 axons의 숫자는 각 유전자형에 대해 서로 다른 트렁크 수준 꺾쇠 괄호로 묶어 주어집니다. C 또는 R은 - 전환 - 전용 꼬리 또는 주동이의 방향으로 성장을, 각각.
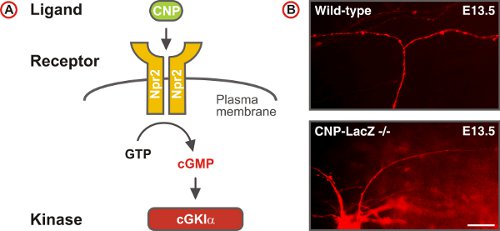
그림 5. cGMP 신호 통로는 척수의 DREZ에서 감각 축삭의 분기점을 트리거합니다. 의 (A) 제도리간드 CNP, 수용체 guanylyl cyclase Npr2와 세린 / 배아 DRG의 뉴런에서 트레오닌 키나제의 cGKIα 구성된 cGMP 신호 경로. Npr2는 CNP에 의해 자극시 GTP로부터 cGMP 생성합니다. (B) DiI 야생 유형과 CNP - 결함 생쥐의 뉴런을 DRG의 단일 axons의 추적. (스케일 바, 25 μm의.)
토론
DiI 라벨에 대한 고정 조직의 사용과 함께 준비의 용이성과 함께 axonal 지점 형성의 두 가지 유형으로 구성된 틀에 박힌 프로젝션 패턴 분기 axonal 연구에 유리한 모델을 DRG 붙어있는 배아 척수를합니다. 코팅 유리 바늘을 사용하여 DiI 미세한의 응용 프로그램이 있습니다 - DRG 뉴런의 작은 그룹의 시각화함으로써 개별 axons과 분기 패턴의 분석 - DRG의 대량 라벨과는 달리 인치 설명한 방법은 더욱 더 ?...
공개
저자는 공개 아무것도 없어.
감사의 말
저자가 도움이 덧글에 대한 박사 알리스 테어 Garratt을 (최대 Delbrück 센터, 베를린) 감사하고 싶습니다. 이 작품은 독일 연구 협회 (DFG)의 공동 연구 센터 (SFB665)에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | 댓글 (옵션) |
| Stereomicroscope Stemi DRC | 자이스 혈구 | ||
| 인산 버퍼 용액 (PBS) | Biochrom AG | L182 - 50 | |
| Paraformaldehyde | 머크 | 8.18715.1000 | |
| 표준 외과 가위 | 파인 과학 도구 | 14001-13 | |
| 톱니 표준 포셉 | 파인 과학 도구 | 11021-14 | |
| 추가 벌금 홍채 가위 | 파인 과학 도구 | 14088-10 | |
| 곡선 포셉 | 파인 과학 도구 | 11003-13 | |
| 뒤몽 5 번 좋은 팁 포셉 | 파인 과학 도구 | 11254-20 | |
| 뒤몽 제 5 미러 마무리 포셉 | 파인 과학 도구 | 11252-23 | |
| Vannas - 튀빙겐 봄 가위 | 파인 과학 도구 | 15008-08 | |
| 필터 종이 | 피셔 과학 | FB59041 | |
| Sylgard 184 | 세계 Precission 악기 | SYLG184 | |
| 100 mm 배양 접시 | Greiner | 663,102 | |
| 12 ML의 폴리 프로필렌 튜브 | 칼 로스 GmbH의 | ECO3.1 | |
| 12 물론 문화 플레이트 | Becton 디킨슨 | 35-3043 | |
| 에탄올 | 머크 | 1.00983.2500 | |
| / 브라운 micropipette 풀러 P - 97을 불타는 | 셔터 악기 (주) | ||
| Borosilicate 유리 모세관 | 하버드 장치 | 30-0066 | |
| DiI는 (1,1 '- Dioctadecyl - 3, 3,3', 3' - tetramethyl - 퍼클로레이트를 indocarbocyanine) | 시그마 - 올드 리치 | 468,495 | |
| 현미경 SuperFrost 플러스를 슬라이드 | 칼 로스 GmbH의 | H867.1 | |
| 유리 커버 풀렸는데 | 칼 로스 GmbH의 | 1870.2 |
참고문헌
- Honig, M. G., Hume, R. I. Dil and diO: versatile fluorescent dyes for neuronal labelling and pathway tracing. Trends. Neurosci. 12 (9), 333-333 (1989).
- Acebes, A., Ferrus, A. Cellular and molecular features of axon collaterals and dendrites. Trends. Neurosci. 23 (11), 557-557 (2000).
- Ozaki, S., Snider, W. D. Initial trajectories of sensory axons toward laminar targets in the developing mouse spinal cord. J. Comp. Neurol. 380 (2), 215-215 (1997).
- Schmidt, H. The receptor guanylyl cyclase Npr2 is essential for sensory axon bifurcation within the spinal cord. J. Cell Biol. 179 (2), 331-331 (2007).
- Gibson, D. A., Ma, L. Developmental regulation of axon branching in the vertebrate nervous system. Development. 138 (2), 183-183 (2011).
- O'Leary, D. D., Terashima, T. Cortical axons branch to multiple subcortical targets by interstitial axon budding: implications for target recognition and "waiting periods". Neuron. 1 (10), 901-901 (1988).
- Portera-Cailliau, C. Diverse modes of axon elaboration in the developing neocortex. PLoS. Biol. 3 (8), e272-e272 (2005).
- Gan, W. B. Vital imaging and ultrastructural analysis of individual axon terminals labeled by iontophoretic application of lipophilic dye. J. Neurosci. Methods. 93 (1), 13-13 (1999).
- Schmidt, H. C-type natriuretic peptide (CNP) is a bifurcation factor for sensory neurons. Proc. Natl. Acad. Sci. U. S. A. 106 (39), 16847-16847 (2009).
- Zhao, Z. Regulate axon branching by the cyclic GMP pathway via inhibition of glycogen synthase kinase 3 in dorsal root ganglion sensory neurons. Journal of Neuroscience. 29 (5), 1350-1350 (2009).
- Zhao, Z., Ma, L. Regulation of axonal development by natriuretic peptide hormones. Proc. Natl. Acad. Sci. U. S. A. 106 (42), 18016-18016 (2009).
- Schmidt, H., Rathjen, F. G. Signalling mechanisms regulating axonal branching in vivo. Bioessays. , (2010).
- Feng, G. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28 (1), 41-41 (2000).
- Livet, J. Transgenic strategies for combinatorial expression of fluorescent proteins in the nervous system. Nature. 450 (7166), 56-56 (2007).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유