Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
DII-etiquetado de las neuronas DRG para el Estudio de ramificación axonal en una preparación Todo el montaje del cable del ratón embrionario espinal
En este artículo
Resumen
Las proyecciones estereotipadas de aferencias sensoriales en la médula espinal de roedores ofrecen un sistema experimental de fácil acceso para estudiar la ramificación axonal a través del rastreo de los axones individuales.
Resumen
Aquí se presenta una técnica para marcar la trayectoria de los pequeños grupos de neuronas DRG en la médula espinal de embriones mediante la tinción difusa con el trazador lipofílico 1,1 '-dioctadecil-3, 3,3', 3'-tetramethylindocarbocyanine perclorato (DII) 1 . La comparación de las vías axonal de tipo salvaje con los de las líneas de ratón en el que los genes están mutados permite realizar pruebas para un papel funcional de las proteínas candidatas en el control de la ramificación axonal, que es un mecanismo esencial en el cableado del sistema nervioso. Ramificación axonal permite una neurona individual para conectarse con múltiples objetivos, proporcionando así la base física para el procesamiento paralelo de la información. Ramificaciones en las regiones objetivo intermedio de crecimiento axonal puede ser distinguida de arborización terminal. Además, los diferentes modos de formación de ramas axonal puede ser clasificado en función de si los resultados de la ramificación de las actividades del cono de crecimiento (división o un sostén retrasonching) o desde la brotación de las garantías del eje del axón en un proceso llamado intersticial ramificación 2 (Fig. 1).
Las proyecciones centrales de las neuronas de los DRG ofrecer un sistema útil experimental para el estudio de ambos tipos de ramificación axonal: cuando sus axones aferentes llegar a la zona de la raíz dorsal de entrada (DREZ) de la médula espinal entre los días embrionarios 10 a 13 (E10 - E13) que muestran un patrón estereotipado de T o bifurcación en forma de Y. Los dos axones que resulta hija a continuación, proceder en sentido rostral o caudal, respectivamente, en el margen dorsolateral de la médula y sólo después de un período de espera colaterales brotan de estos axones madre para penetrar en la materia gris (intersticiales de ramas) y el proyecto de las neuronas de relevo en determinados láminas de la médula espinal donde se ramifican más (terminal de ramificación) 3. Trazados DII han revelado los conos de crecimiento en la zona de la raíz dorsal de entrada de la médula espinal que parecía estar en el proceso de dividir lo que sugiere que la bifurcación se produce por la división del cono de crecimiento en sí mismo 4 (Fig. 2), sin embargo, otras opciones han sido discutidos y 5.
Este video muestra primero cómo diseccionar la médula espinal de los ratones E12.5 salir de la DRG adjunto. Después de la fijación de las cantidades pequeñas de muestra de DII se aplican a DRG el uso de agujas de cristal sacados de los tubos capilares. Después de una etapa de incubación, la médula espinal etiqueta se monta como un libro abierto invertido preparación para analizar los axones individuales mediante microscopía de fluorescencia.
Protocolo
1. Disección de procedimiento
Nota: El uso experimental de ratones deben seguir las directrices aprobadas oficialmente por el cuidado y uso de animales de laboratorio.
- Antes de preparar, configurar el microscopio de disección y diseñar los instrumentos quirúrgicos necesarios para la disección como tijeras grandes y pequeñas, grandes pinzas dentadas, pinzas curvas y cuatro juegos de Dumont N º 5 Pinzas de disección (dos de los cuales en el interior pulido consejos) ( para más detalles ver la tabla de reactivos y equipos específicos). Coloque una hoja de papel de filtro en una de 100 mm con recubrimiento Sylgard placa de Petri. Vierta PBS frío en los pocillos de una placa de 12 pocillos, un plato de Petri de 100 mm y un tubo de 12 ml y dejar en el hielo. Pipetear 2 ml de solución tampón de fijación (4% de paraformaldehído en PBS, pH 7,4) en cada pocillo de un segundo de 12 y placa y el lugar en el hielo.
- Después de anestesia, el sacrificio de la presa embarazada a tiempo E12.5 (detección de tapón vaginal fue designado como E0.5), coloque el ratóncon su lado ventral hasta en tres hojas de papel de cocina y disfrutar de la zona abdominal con etanol al 70%.
- Abrir la cavidad abdominopélvica, aislar a los cuernos uterinos bilaterales y transferirlos a uno de los platos de 100 mm con helado de PBS.
- Bajo control microscópico, hacer una incisión longitudinal de la pared del útero con una tijera pequeña, recta y corte cada saco amniótico de la placenta.
- Retire la bolsa de líquido amniótico de cada embrión y cortar el cordón umbilical.
- Utilizando unas tijeras pequeñas, decapitar a los embriones y poner la cabeza o una parte de ellos a un lado para el aislamiento de ADN genómico, si genotipado se debe exigir. Posteriormente, la transferencia de la quirú a los respectivos pozos de la placa de 12 pocillos con PBS frío.
- Moje el papel de filtro en el plato Sylgard con unas gotas de PBS y la posición de un tronco embrionarias, con su cara dorsal hasta en el papel. Para una mejor estabilidad, enderezar la cola y las extremidades del cuerpo.
- De trabajoen un microscopio con un aumento de aproximadamente 16x, cuidadosamente pellizcar la piel del embrión por encima de la médula espinal, con dos pares de pinzas de punta fina y suavemente lo desgarran. A partir de la media, proceder en primer lugar hacia la cola y luego reanudar la actividad desde el centro hacia el lado anterior.
- Mojar el embrión de vez en cuando con dos o tres gotas de PBS para evitar que se seque.
- Para evitar que DRG se llenaron de lágrimas de la médula espinal cuando es removido del embrión separar el DRG y la médula espinal de los alrededores de la columna vertebral cartilaginosa por movimientos de deslizamiento horizontal con la hoja de una pinza fina con el interior pulido consejos. A partir de la mitad del lado derecho del embrión, su forma de trabajo hacia la cola y luego a la parte anterior. A continuación, repita el procedimiento en el otro lado. Tenga cuidado de no arrancar la DRG asociados.
- Para desconectar por completo el cable aflojado la columna vertebral del embrión, recoger sus cervical participar con unas pinzas finas y tire de ella en una sola pieza hacia su extremo caudal.
- Sumerja el cable aislado espinal con DRG adjunto en un pocillo de la placa de 12 pocillos llenos de tampón de fijación y proceder con la preparación de la médula espinal de los embriones sobrantes.
- Fijar la médula espinal por lo menos dos horas en hielo.
2. DII-etiquetado de las neuronas DRG
- Para cada una de la médula espinal que ser etiquetados, preparar dos agujas de cristal con un extractor de micropipeta. Utilizamos un modelo de Sutter P-97 electrodo extractor (ajuste del programa: 1 CALOR = 625, = 35 VEL, TIEMPO = 175, 2 CALOR = 600, = 25 VEL, TIEMPO = 175, 3 CALOR = 630, = VEL... 30, TIEMPO = 150).
- Bajo control microscópico que moje la punta de la aguja de vidrio cada tres a cinco veces en un 5% (w / v) de DII en etanol. La evaporación del etanol crea una fina capa de cristales de DII en la aguja.
- Trabajo en un microscopio con un aumento de aproximadamente 40x, un lugar de la médula espinal con sus ventral lado hasta en una diapositiva. El uso de tijeras de primavera, abra el cable en la parte ventral en toda su longitud, cortando a través de la placa del piso para permitir el posterior montaje de la preparación de un libro abierto invertido modo (véase la sección C).
- Posición de la médula espinal con la cara dorsal hasta en una diapositiva. Luego manualmente el enfoque de la cuerda con la punta de la DII-cubierta de la aguja de vidrio bajo visualización microscópica y cuidadosamente perforar cada DRG segundo en un lado de la médula espinal. Casi no hay rastros de DII debe ser visible en el DRG perforado para asegurar el etiquetado de sólo un pequeño número de neuronas. Tomar una segunda aguja para el otro lado de la cuerda. Con el objetivo sólo uno de cada GRD segundo evita la superposición de la etiqueta proyecciones axonales de DRG vecinos que puedan complicar la diferenciación de los axones individuales.
- Volver a la médula espinal en el búfer de fijación y se incuban en la oscuridad durante al menos seis horas a temperatura ambiente o durante la noche a 4 ° C para dar tiempo a que el tinte se diffuse lo largo del axón en la membrana plasmática. Permitir un período de incubación más largo (hasta dos días a 4 ° C) si el análisis del crecimiento de las garantías en la médula espinal que se desea.
3. Análisis microscópico de montaje y
- A raíz de la difusión del colorante posición, un solo cordón espinal con la cara dorsal hacia abajo en un cubreobjetos en una gota de PBS. Tenga cuidado de que el DRG adjunto estén orientados lateralmente y no se mezclan. Aspirar el exceso de líquido y aplanar el cable en un libro abierto invertido el modo de uso de fórceps.
- Monte la preparación en un portaobjetos con PBS.
- Para evitar el aumento de la tinción de fondo no deseados análisis de fluorescencia microscópica de la etiqueta proyecciones axonales debe llevarse a cabo el día de montaje. Hasta entonces, mantener las diapositivas de la oscuridad a 4 ° C.
4. Los resultados representativos:
La médula espinal del ratón recibe aferentes projections de 8 pares de cuello de útero, 13 pares de tórax, 5 pares de pares lumbares y 4 de la DRG sacra un total de 60 ganglios espinales. Después de algún entrenamiento la médula espinal con la mayoría de DRG todavía unido puede ser aisladas de un embrión de menos de cinco minutos. Este procedimiento es adecuado para el aislamiento de la médula espinal con el DRG adjunto de E11.5 E13.5 de embriones de ratón. Sin embargo, mejores resultados se obtienen a partir de E12.5. Resultados ejemplares del procedimiento de etiquetado descritos aquí se muestran en la Figura 3. El etiquetado de los GRD en toda la longitud de la médula espinal puede entonces ser utilizada para cuantificar el comportamiento de ramificación axonal en los diferentes niveles vertebrales (Fig. 4).

Figura 1. Esquema que representa los dos principales modos de ramificación axonal. (A) La ramificación de las actividades del cono de crecimiento que podría conducir a una bifurcación - como se indica aquí - así como pérgolas complejo de la terminal o(B) la formación de colaterales en el eje del axón (ramificación intersticial). Este último modo es el tipo dominante de ramificación de la proyección de los axones corticales y tálamo-corticales 6,7.

Figura 2 proyecciones aferentes de las neuronas DRG en la médula espinal de embriones de visualización de ambos tipos de ramificación axonal:. Poder axones por primera vez en la DREZ por la bifurcación (1) y de la hija resultante ramas colaterales forma después de un período de espera por la ramificación intersticial (2).
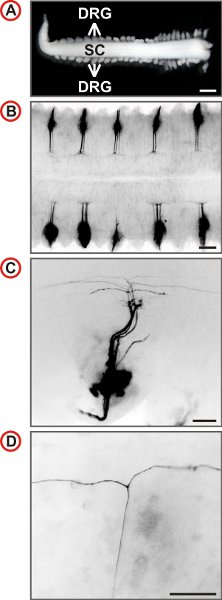
Figura 3. Visualización de trayectorias individuales axonal de las neuronas embrionarias del ratón DRG. (A) de la médula espinal con el DRG adjunto, preparado a partir de un embrión de ratón E12.5. (Barra de escala, de 1 mm.) (BD) vista dorsal del DII-etiquetados DRG de ratones de tipo salvaje con un aumento cada vez se muestran. En B cada DRG segundo labeled de DII. Imágenes de fluorescencia se invierten, caudal está a la izquierda y en el C y D, es lateral en la parte inferior. En C un pequeño número de axones se etiqueta y en un mayor aumento de la presencia de T-como las ramas se pueden identificar en el DREZ de la médula espinal. (Las barras de escala, a 250 micras (B), 100 m (C) y 50 micras (D).)
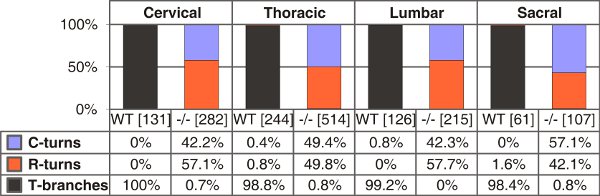
Figura 4. Cuantificación de las ramas en forma de T, solo se convierte rostral o caudal en la naturaleza y tipo C-péptido natriurético tipo (CNP) de ratones deficientes en E13.5. El número de axones individuales se cuentan entre paréntesis para los niveles de tronco diferentes para cada genotipo. C o R gira - el crecimiento sólo en dirección caudal o rostral, respectivamente.
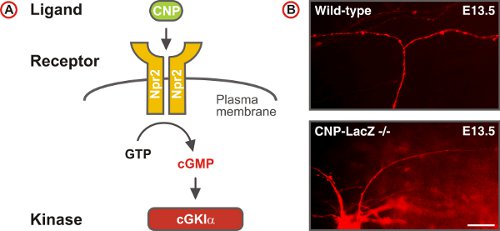
Figura 5. A GMPc señalización activa bifurcación axón sensorial en el DREZ de la médula espinal. (A) Plan dela vía de señalización de cGMP formado por los CNP ligando, el receptor de guanilato ciclasa Npr2 y la serina / treonina kinasa cGKIα en las neuronas DRG embrionarias. Npr2 genera cGMP de GTP a la estimulación por el CNP. (B) DII seguimiento de los axones de las neuronas DRG solo en ratones de tipo salvaje y CNP deficiente. (Barra de escala, de 25 micras).
Discusión
Patrones estereotipados de proyección compuesto por dos tipos de formación de ramas axonal, junto con la facilidad de preparación en combinación con el uso de tejido fijado para DII etiquetado hace que la médula espinal de embriones con DRG adjunta un modelo favorable a estudiar la ramificación axonal. La aplicación de pequeñas cantidades de DII el uso de agujas de vidrio recubiertas permite - en contraste con el etiquetado mayor parte de DRG - la visualización de pequeños grupos de neuronas DRG y por lo tanto...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores desean agradecer al Dr. Alistair Garratt (Centro Max Delbrück, en Berlín) por sus valiosos comentarios. Este trabajo fue apoyado por el centro de investigación en colaboración (SFB665) del Consejo Alemán de Investigaciones (DFG).
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios (opcional) |
| Estereomicroscopio Stemi República Democrática del Congo | Zeiss | ||
| Solución tampón de fosfato (PBS) | Biochrom AG | L182-50 | |
| Paraformaldehído | Merck | 8.18715.1000 | |
| Estándar de tijeras quirúrgicas | Herramientas de Bellas Ciencia | 14001-13 | |
| Dientes de pinzas estándar | Herramientas de Bellas Ciencia | 11021-14 | |
| Extra fino tijeras iris | Herramientas de Bellas Ciencia | 14088-10 | |
| Pinzas curvas | Herramientas de Bellas Ciencia | 11003-13 | |
| Dumont N º 5 puntas finas pinzas | Herramientas de Bellas Ciencia | 11254-20 | |
| Dumont No.5 acabado de espejo fórceps | Herramientas de Bellas Ciencia | 11252-23 | |
| Vannas-Tübingen primavera tijeras | Herramientas de Bellas Ciencia | 15008-08 | |
| Papel de filtro | Fisher Scientific | FB59041 | |
| Sylgard 184 | Instrumentos del Mundo Precisión | SYLG184 | |
| De 100 mm cajas de Petri | Greiner | 663102 | |
| 12 ml de polipropileno tubo | Carl Roth GmbH | ECO3.1 | |
| De 12 y cultivo en placa | Becton Dickinson | 35-3043 | |
| Etanol | Merck | 1.00983.2500 | |
| Flaming / Brown extractor micropipeta P-97 | Sutter Instrument Co. | ||
| Vidrio de borosilicato capilares | Harvard Apparatus | 30-0066 | |
| DII (1,1 '-dioctadecil-3, 3,3', 3'-tetrametil - indocarbocyanine perclorato) | Sigma-Aldrich | 468495 | |
| Portaobjetos Superfrost Plus | Carl Roth GmbH | H867.1 | |
| Vidrio cubreobjetos | Carl Roth GmbH | 1870.2 |
Referencias
- Honig, M. G., Hume, R. I. Dil and diO: versatile fluorescent dyes for neuronal labelling and pathway tracing. Trends. Neurosci. 12 (9), 333-333 (1989).
- Acebes, A., Ferrus, A. Cellular and molecular features of axon collaterals and dendrites. Trends. Neurosci. 23 (11), 557-557 (2000).
- Ozaki, S., Snider, W. D. Initial trajectories of sensory axons toward laminar targets in the developing mouse spinal cord. J. Comp. Neurol. 380 (2), 215-215 (1997).
- Schmidt, H. The receptor guanylyl cyclase Npr2 is essential for sensory axon bifurcation within the spinal cord. J. Cell Biol. 179 (2), 331-331 (2007).
- Gibson, D. A., Ma, L. Developmental regulation of axon branching in the vertebrate nervous system. Development. 138 (2), 183-183 (2011).
- O'Leary, D. D., Terashima, T. Cortical axons branch to multiple subcortical targets by interstitial axon budding: implications for target recognition and "waiting periods". Neuron. 1 (10), 901-901 (1988).
- Portera-Cailliau, C. Diverse modes of axon elaboration in the developing neocortex. PLoS. Biol. 3 (8), e272-e272 (2005).
- Gan, W. B. Vital imaging and ultrastructural analysis of individual axon terminals labeled by iontophoretic application of lipophilic dye. J. Neurosci. Methods. 93 (1), 13-13 (1999).
- Schmidt, H. C-type natriuretic peptide (CNP) is a bifurcation factor for sensory neurons. Proc. Natl. Acad. Sci. U. S. A. 106 (39), 16847-16847 (2009).
- Zhao, Z. Regulate axon branching by the cyclic GMP pathway via inhibition of glycogen synthase kinase 3 in dorsal root ganglion sensory neurons. Journal of Neuroscience. 29 (5), 1350-1350 (2009).
- Zhao, Z., Ma, L. Regulation of axonal development by natriuretic peptide hormones. Proc. Natl. Acad. Sci. U. S. A. 106 (42), 18016-18016 (2009).
- Schmidt, H., Rathjen, F. G. Signalling mechanisms regulating axonal branching in vivo. Bioessays. , (2010).
- Feng, G. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28 (1), 41-41 (2000).
- Livet, J. Transgenic strategies for combinatorial expression of fluorescent proteins in the nervous system. Nature. 450 (7166), 56-56 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados