このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
マウスにおけるモデリング脳出血:自己血または細菌性コラゲナーゼの注入
要約
脳内出血(ICH)の臨床的に関連する動物モデルは、出血性脳卒中の知識を拡張し、新たな治療戦略を検討するために必要とされる。そこで本研究では、記述し、マウスの大脳基底核(線条体)に自家全血または細菌コラゲナーゼのどちらかの一方的な注射を実装した2つのICHのモデルを比較検討する。
要約
自発脳内出血(ICH)はすべての脳卒中関連入院の10-15%を占めており、そのための効果的な治療法は1,2を最新に利用できない生命を脅かす可能性の神経学的な病気を定義します。なぜなら、ヒトにおけるICHの異質性は、様々な前臨床モデルを3前向きな治療戦略を徹底的に探求するために必要とされる。実験的な無形文化遺産は、一般的に自己血または細菌コラゲナーゼ4のいずれかの実質内注射することにより、げっ歯類で誘導される。適切なモデルは、出血の誘導と傷害の進行の病態生理に基づいて選択されます。血液注入モデルが急速に進んで出血を模倣しています。あるいは、細菌コラゲナーゼは、酵素的に、一般的に数時間かけて5を進化させ、アクティブな出血を引き起こし、脳の毛細血管の基底膜を破壊する。結果perihematomal浮腫とneurofunctional赤字はあちこちに定量化することができるメートルの両モデル。そこで本研究では、説明と自己全血6の修正されたダブルインジェクションモデルと同様に細菌性コラゲナーゼ7のICHのインジェクションモデル、どちらもターゲットの雄CD-1マウスの大脳基底核(線条体)を評価我々は24でneurofunctional赤字と脳浮腫を評価したICH誘導後72時間。自己血の線条体注入量(μl30)または細菌コラゲナーゼ(0.075U)は、24および72手術後の時間(P <0.05)で、マウスで再現neurofunctional赤字と大幅に増加した脳浮腫を引き起こした。結論としては、両方のモデルは、一貫性の出血性梗塞を生じ、前臨床ICHの研究のための基本的な方法を表しています。
プロトコル
すべての手順は、 実験動物の管理と使用のためのNIHのガイドに準拠して実施し、ロマリンダ大学での動物実験委員会によって承認された。
1。術前準備
無菌技術は、すべての外科的処置のために推薦されます。定位装置を消毒し、手術前に無菌の手術器具を準備する。すべての動物の取扱い中に個人用保護具(PPE)を着用してください。動物の生理的な体温を維持するために、手術中に加熱パッドを使用しています。
- トリプルビーム動物のスケールを使用して、8〜12週齢のマウスの重量を量る。
- 共同注入ケタミン(100 mg / kg)およびキシラジン(10 mg / kg)を腹腔内投与した後、麻酔のための7-10分は(適切な鎮静のためのモニタ)を有効にすることができます。
- サーマルブランケットの上にマウスを置き、頭皮を剃る。
- 両眼に眼軟膏を適用します。
- 確保する気道は、優しく丁寧に横方向に舌を動かすと、によって定位装置の上にマウスの頭部を固定します。注:頭部は定位フレームの基礎に水平に固定しなければなりません。
- ベタジンで手術領域を消毒し、70%エタノールですすぎます。 3回の合計ベタジンと70%エタノールのアプリケーションを交互に繰り返します。綿棒のアプリケーターは、この目的のために使用することができます。
2。血液インジェクションモデル
- 第10位メスの刃で頭皮から1cm長い正中切開を行います。
- 冠状および矢状縫合(ブレグマ)の垂直交点を露出させるために、頭蓋骨を覆う軟組織を一掃するために綿棒のアプリケーターを使用しています。
- 噴射ポンプにハミルトンシリンジ(250μl)をマウントして、定位ブレグマ上針(26ゲージ)に指示。
- 次に、針0.2ミリメートル前部と2位に定位マニピュレータアームを調整横方向に右にミリメートル。これらの座標に1 mmのドリルビットで速度可変ドリルを使用して、小さな頭蓋穿頭孔を作る。
- 動物の尾を一時停止し、70%エタノールで、その下面を消毒。
- 穿刺滅菌針を持つ中央尾動脈( 例えば 26ゲージ)とunheparinizedキャピラリーチューブに動脈血を採取。
- ハミルトンシリンジのガラスバレルに毛細管から迅速に血液を移し、その後、プランジャーを挿入します。
- 噴射ポンプにハミルトンシリンジを含む動脈血の今を30μl以上を取り付け、そのベベルが見えなくなる直前まで削り穴を通して針を(矢状縫合に面した斜めのエッジを持つ)を挿入します。
- この時点で、事前から腹側に針3ミリメートルと2μl/分の速度で、自己血5μlを注入します。
- 第1噴射あらかじめ深さで、針0.7ミリメートルの完了後。
- 待つ5分、右線条体への血液25μlを注入します。
- 二回目の注射が完了した時点で、1ミリメートル/分の速度でそれを撤回する前に、追加の10分の位置に針を残す。
- 骨ワックスで削り穴を密封し、皮膚を縫合する。
- 術後鎮痛のためにあらかじめ温めておいた液(生理食塩水)の皮下にブプレノルフィンの0.05 mg / kgを注入します。
3。コラゲナーゼインジェクションモデル
- 血液注入モデルで説明したように術前の準備の後、繰り返して手順1〜4を繰り返します。
- 生理食塩水0.5μlに溶解し、細菌(クロストリジウム)コラゲナーゼVII-Sの0.075Uでハミルトンシリンジ(10μl)を記入してください。気泡の生成を避けること。
- 噴射ポンプにハミルトンシリンジを取り付け、そのベベルが見えなくなる直前まで削り穴を通して針(26ゲージ)を挿入します。
- 腹針3.7ミリメートルを進め、コラゲナーゼiの0.075Uを注入NTO2μl/分の速度で右線条体。
- 注入が完了した時点で、1ミリメートル/分の速度でそれを撤回する前に、追加の10分の位置に針を残す。
- 骨ワックスで削り穴を密封し、皮膚を縫合する。
- 予め温めておいた術後流体の皮下にブプレノルフィンの0.05 mg / kgを注入します。
4。偽手術
- 血液注入モデルで説明したように術前の準備の後、繰り返して手順1〜4を繰り返します。
- バリ穴から3.7ミリメートル腹針(26ゲージ)を挿入します。針は1mm /分の速度で引き抜かれる前に、10分間の位置のままにする必要があります。
- 骨ワックスで削り穴を密封し、皮膚を縫合する。
- 予め温めておいた術後流体の皮下にブプレノルフィンの0.05 mg / kgを注入します。
5。代表的な結果
実験的な線条体出血は、形態学的連想させるげっ歯類ではなく、行動の変化。これらの変更は、手続きの適正な執行を確保するために、あるいは潜在的な治療法の効果を調べるために評価することができます。ターゲットを絞った脳の領域( 例えば 、大脳基底核)にブリードを生成すると、再現性のあるアプローチのために最も必要不可欠であり、肉眼的あるいは組織学的に染色された脳切片( 図1-2)で確認することができます。様々な行動の評価を介して定量化することができる感覚障害、大脳基底核での結果への傷害。コーナーのターンテストの結果は、実験的な右サイドのICHの後、マウスが( 図3)偽手術後24および72時間後に動物を操作するのではなく、障害の反対側(左側)から同側と離れて有意に多くなったことを示した。さらに、十分に鼻毛刺激後、表面に障害(左)前肢を配置する機能は、前肢置き試験により評価した。 24および72時間で手術後、マウスのサブ右サイドICHにjectedと偽手術動物よりも有意に少なかっメントを示した。脳浮腫の測定は頻繁に実験的なICHの後の脳損傷の程度を定量化するために採用されている。自己血(30μl)を、または最下位24( 図4)で同側の大脳皮質と大脳基底核の脳含水量の増加、手術後72時間( 図4B)につながった細菌性コラゲナーゼ(0.075 U)(脳内に注射)偽と比較されます。動作テストの結果( 図3)、脳浮腫の程度( 図4)指定されたボリュームで、血液やコラゲナーゼ注射モデル間の差はみられなかった。
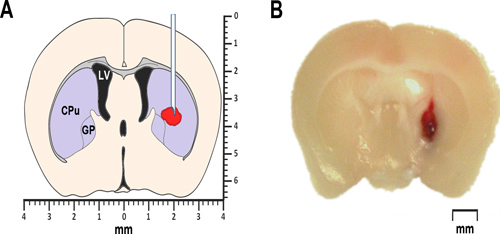
図1。マウスでのモデリングのICH(A)ブレグマの前方冠状脳切片0.2ミリメートルの簡略図がPRを示し自己血またはコラゲナーゼ注入の場所をoposed。側脳室は、LVのマークが付けられます。 CPUは、尾状核被殻、線条体の一部の略で、GPは淡蒼球を識別します。両方、線条体だけでなく、淡蒼球はまた、大脳基底核として知られる皮質下核のグループに属します。 (B)は自己全血の線条体注射後24時間後に得られたブレグマの冠状脳切片0.2ミリメートルの前部、の代表顕微鏡写真。
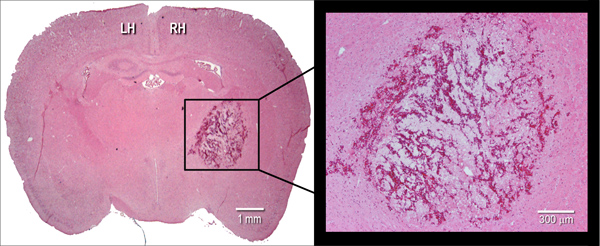
図2。血腫の組織学的症状。代表ヘマトキシリンおよびエオシン(H&E)マウス脳のステンド冠状凍結切片(10μm)を、細菌性コラゲナーゼの注入線条(0.075 U)は24時間後に血腫の大きさを示す。 LH =左半球は、RH =右半球。
< IMGのalt = "図3は" src = "/ files/ftp_upload/4289/4289fig3.jpg" />
図3。マウスでの実験的な無形文化遺産。自己血の線条体注入(30μl)を、または細菌コラゲナーゼ(0.075 U)は次のNeurofunctional評価は再現neurofunctional赤字が発生していました。 (A)は実験のICHの後のマウスは、手術後24および72時間後に偽手術動物よりもはるかに多くの右ターンを示した。左下肢の(B)は前足置く能力は、手術後24および72時間後に、ICHの後に障害されていた。値は平均±SEMとして表され、スチューデント·ニューマン·クールズ法に続いてランク上の分散のクラスカル·ウォリス片道分析を用いて分析した。 <0.05のp値は、統計的に有意であると考えられた; N = 6月12日あたりのグループ、* P <0.05は偽に比べて大きい図を表示するには、ここをクリックしてください 。
igure 4 "SRC =" / files/ftp_upload/4289/4289fig4.jpg "/>
図4。マウスでの実験的な無形文化遺産を後の脳含水量の評価。自己血の脳内注入(30μl)を、または最下位24(A)で同側の大脳皮質と大脳基底核の脳含水量の増加および72時間につながった細菌性コラゲナーゼ(0.075 U) (B)はICH-誘導後。値は平均±SEMとして表さおよびTukey事後検定に続く分散の一方向分析を用いて分析した。 <0.05のp値は統計的に有意であると考えていたし、n = 6月10日あたりのグループ、* P <0.05は偽に比べて大きい図を表示するには、ここをクリックしてください 。
ディスカッション
脳内出血(ICH)の動物モデルは、疾患の病態生理学の高度な理解に大きく貢献する、と一般的に前臨床設定において新たな治療戦略を開発し、評価するために使用されます。自家血液または細菌コラゲナーゼの実質内注射は、げっ歯類におけるICHを生成するために十分に確立されたメソッドです。どちらの方法も、当初はラットで開発されたが、トランスジェニックマウスおよびノックアウ?...
開示事項
特別な利害関係は宣言されません。
謝辞
本研究では、部分的にJH張にNIHの助成金RO1NS053407によってサポートされていました。我々は彼の貴重な貢献のための氏デイモンクレーベに感謝したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| 材料 | 会社 | カタログ番号 | コメント |
| 定位ヘッドフレーム | Stoelting株式会社 | 51600 | |
| Nanomiteシリンジポンプ | ハーバード装置 | PY2 70から2217 | |
| ハミルトンシリンジ | ハミルトン株式会社 | 1725RN(250μL) 1701 RN(10μL) | 250μlと10μlのシリンジ用26ゲージ針。 |
| マイクロドリル | ファイン科学ツール | 18000から17 | |
| マイクロドリルバリ | ファイン科学ツール | 19007から09 | 0.9mmの直径 |
| コラゲナーゼタイプVII-S | シグマアルドリッチ | C2399 | |
| 毛細管をMicrohematocrit | フィッシャー·サイエンティフィック | 22-362-574 | unheparinized |
| 骨ろう | エチコン | W31 | |
| 縫合 | エチコン | 1676G | |
| ケタミン | JHP医薬品 | 42023-115-10 | Ketalar |
| キシラジン | LLOYD研究所 | 139から236 | AnaSed |
参考文献
- Broderick, J. P. Guidelines for the management of spontaneous intracerebral hemorrhage: A statement for healthcare professionals from a special writing group of the Stroke Council, American Heart Association. Stroke. 30, 905-915 (1999).
- Qureshi, A. I., Mendelow, A. D., Hanley, D. F. Intracerebral haemorrhage. Lancet. 373, 1632-1644 (2009).
- MacLellan, C. L., Silasi, G., Auriat, A. M., Colbourne, F. Rodent models of intracerebral hemorrhage. Stroke. 41, 95-98 (2010).
- James, M. L., Warner, D. S., Laskowitz, D. T. Preclinical models of intracerebral hemorrhage: a translational perspective. Neurocrit Care. 9, 139-152 (2008).
- MacLellan, C. L. Intracerebral hemorrhage models in rat: comparing collagenase to blood infusion. J. Cereb. Blood Flow Metab. 28, 516-525 (2008).
- Belayev, L. Experimental intracerebral hemorrhage in the mouse: histological, behavioral, and hemodynamic characterization of a double-injection model. Stroke. 34, 2221-2227 (2003).
- Clark, W., Gunion-Rinker, L., Lessov, N., Hazel, K. Citicoline treatment for experimental intracerebral hemorrhage in mice. Stroke. 29, 2136-2140 (1998).
- Nakamura, T. Intracerebral hemorrhage in mice: model characterization and application for genetically modified mice. J. Cereb. Blood Flow Metab. 24, 487-494 (2004).
- Schallert, T. Behavioral tests for preclinical intervention assessment. NeuroRx. 3, 497-504 (2006).
- Hartman, R., Lekic, T., Rojas, H., Tang, J., Zhang, J. H. Assessing functional outcomes following intracerebral hemorrhage in rats. Brain Res. 1280, 148-157 (2009).
- Hua, Y. Behavioral tests after intracerebral hemorrhage in the rat. Stroke. 33, 2478-2484 (2002).
- Tang, J. Mmp-9 deficiency enhances collagenase-induced intracerebral hemorrhage and brain injury in mutant mice. J. Cereb. Blood Flow Metab. 24, 1133-1145 (2004).
- Ma, Q. Vascular adhesion protein-1 inhibition provides antiinflammatory protection after an intracerebral hemorrhagic stroke in mice. J. Cereb. Blood Flow Metab. , (2010).
- Bullock, R., Mendelow, A. D., Teasdale, G. M., Graham, D. I. Intracranial haemorrhage induced at arterial pressure in the rat. Part 1: Description of technique, ICP changes and neuropathological findings. Neurol Res. 6, 184-188 (1984).
- Yang, G. Y., Betz, A. L., Chenevert, T. L., Brunberg, J. A., Hoff, J. T. Experimental intracerebral hemorrhage: relationship between brain edema, blood flow, and blood-brain barrier permeability in rats. J. Neurosurg. 81, 93-102 (1994).
- Rosenberg, G. A., Mun-Bryce, S., Wesley, M., Kornfeld, M. Collagenase-induced intracerebral hemorrhage in rats. Stroke. 21, 801-807 (1990).
- Alkayed, N. J. Gender-linked brain injury in experimental stroke. Stroke. 29, 159-165 (1998).
- Saha, J. K., Xia, J., Grondin, J. M., Engle, S. K., Jakubowski, J. A. Acute hyperglycemia induced by ketamine/xylazine anesthesia in rats: mechanisms and implications for preclinical models. Exp Biol Med. (Maywood). 230, 777-784 (2005).
- Fujiwara, N. Effect of normobaric oxygen therapy in a rat model of intracerebral hemorrhage. Stroke. 42, 1469-1472 (2011).
- Khatibi, N. H. Isoflurane posttreatment reduces brain injury after an intracerebral hemorrhagic stroke in mice. Anesth Analg. 113, 343-348 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved