Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Hémorragie intracérébrale chez la souris Modélisation: L'injection de sang autologue ou collagénase bactérienne
Dans cet article
Résumé
Modèles animaux cliniquement pertinentes de l'hémorragie intracérébrale (HIC) sont nécessaires pour étendre notre connaissance des accidents vasculaires cérébraux hémorragiques et d'examiner de nouvelles stratégies thérapeutiques. Dans cette étude, nous décrivons et évaluons deux modèles ICH qui mettent en œuvre des injections unilatérales soit du sang total autologue ou la collagénase bactérienne dans les noyaux gris centraux (corpus striatum) de souris.
Résumé
Hémorragie intracérébrale spontanée (ICH) définit une maladie potentiellement mortelle neurologique qui représente 10-15% de toutes les hospitalisations liés à l'AVC et pour laquelle aucun traitement efficace n'est disponible à ce jour 1,2. En raison de l'hétérogénéité de l'ICH chez l'homme, divers modèles précliniques sont nécessaires pour explorer en profondeur les stratégies thérapeutiques potentiels 3. ICH expérimentale est généralement induite chez des rongeurs par injection intra-parenchymateux de sang autologue soit la collagénase bactérienne ou 4. Le modèle approprié est choisi en fonction de la physiopathologie de l'induction et la progression de l'hémorragie des blessures. Le modèle simule l'injection de sang d'une hémorragie à progression rapide. Alternativement, la collagénase bactérienne par voie enzymatique perturbe la membrane basale des capillaires cérébraux, entraînant un saignement actif qui évolue généralement sur plusieurs heures 5. Résultante oedème perihematomal et les déficits neurofonctionnels peuvent être quantifiés en arrièrem les deux modèles. Dans cette étude, nous avons décrit et évalué un modèle d'injection double modifiée de sang total autologue 6, ainsi que d'un modèle d'injection de collagénase bactérienne ICH 7, les deux qui ciblent les noyaux gris centraux (corpus striatum) des hommes souris CD-1. Nous avons évalué les déficits neurofonctionnels et un œdème cérébral à 24 et 72 heures après l'induction de l'ICH. Injection intrastriatale de sang autologue (30 pi) ou la collagénase bactérienne (0.075U) a provoqué des déficits neurofonctionnels reproductibles chez les souris et un œdème cérébral significativement augmenté à 24 et 72 h après la chirurgie (p <0,05). En conclusion, les deux modèles donnent des uniformes infarctus hémorragiques et représentent méthodes de base pour la recherche préclinique ICH.
Protocole
Toutes les procédures ont été menées en conformité avec le Guide du NIH pour le soin et l'utilisation des animaux de laboratoire et approuvé par le Comité de protection des animaux et l'utilisation à Loma Linda University.
1. Les préparatifs préopératoires
Des techniques aseptiques sont recommandés pour toutes les interventions chirurgicales. Désinfecter l'appareil stéréotaxique et préparer les outils chirurgicaux stériles avant la chirurgie. Porter un équipement de protection individuelle (EPI) pendant toute la manipulation des animaux. Utilisez un coussin chauffant pendant la chirurgie pour maintenir la température du corps de l'animal physiologique.
- Peser la souris 8-12 semaine vieux en utilisant une échelle triple faisceau animal.
- Co-injection de kétamine (100 mg / kg) et de xylazine (10 mg / kg) par voie intrapéritonéale puis laisser 7-10 min pour l'anesthésie de prendre effet (moniteur pendant une sédation adéquate).
- Placez la souris sur une couverture thermique et raser le cuir chevelu.
- Appliquer une pommade ophtalmique à deux yeux.
- Fixez ledes voies aériennes, par un léger mouvement de la langue latéralement, et sécuriser soigneusement la tête de la souris sur l'appareil stéréotaxique. Remarque: La tête doit être fixé horizontalement à la base du cadre stéréotaxique.
- Désinfecter la zone chirurgicale avec de la Bétadine, et rincer avec de l'éthanol à 70%. Répétez alternance applications de Bétadine et de l'éthanol à 70% pour un total de trois fois. Coton-tige peut être utilisé à cette fin.
2. Modèle injection de sang
- Faire un 1 cm longue incision médiane du cuir chevelu avec une lame de bistouri n ° 10.
- Utiliser le coton-tige pour nettoyer les tissus mous recouvrant le crâne, de manière à exposer le point d'intersection perpendiculaire de la suture coronale et sagittale (bregma).
- Monter la seringue Hamilton (250 pi) sur la pompe d'injection, et diriger l'aiguille stéréotaxique (26 Gauge) sur bregma.
- Ensuite, ajuster les bras manipulateurs stéréotaxiques pour positionner l'aiguille 0,2 mm antérieure et 2mm latéralement vers la droite. A ces coordonnées faire un petit trou crânienne bavures, à l'aide d'une perceuse à vitesse variable avec un foret de 1 mm.
- Suspendre la queue de l'animal et de désinfecter sa surface inférieure avec de l'éthanol à 70%.
- Ponction de l'artère caudale centrale avec une aiguille stérile (par exemple 26 Gauge) et recueillir le sang artériel dans un tube capillaire unheparinized.
- Transférer le sang rapidement du tube capillaire dans le tube de verre de la seringue Hamilton, puis insérez le piston.
- Remettez le ul maintenant 30 ou plus de sang artériel contenant une seringue Hamilton sur la pompe à injection et insérer l'aiguille (avec son bord biseauté face à la suture sagittale) à travers le trou de trépan jusqu'à ce que son biseau n'est plus visible.
- De ce point de l'avance de l'aiguille 3 mm ventralement et injecter 5 ul de sang autologue à un taux de 2 pi / min.
- Après l'achèvement de la première injection avance l'aiguille de 0,7 mm plus en profondeur.
- Attendre5 min puis injecter 25 ul de sang dans le striatum droit.
- À la fin de la seconde injection, laissez l'aiguille en position pour 10 minutes supplémentaires, avant de le retirer à une vitesse de 1 mm / min.
- Sceller le trou de trépan avec de la cire d'os et de suturer la peau.
- Pour l'analgésie postopératoire injecter 0,05 mg / kg de buprénorphine sous-cutanée dans préchauffées liquides (sérum physiologique).
3. Modèle injection de collagénase
- Après les préparatifs préopératoires, répétez les étapes 1-4 comme décrit pour le modèle d'injection de sang.
- Remplir la seringue Hamilton (10 pi) avec 0.075U des bactéries (Clostridium) collagénase VII-S dissous dans 0,5 ul de solution saline. Eviter la formation de bulles d'air.
- Remettez la seringue Hamilton sur la pompe à injection et insérer l'aiguille (26 Gauge), à travers le trou de trépan jusqu'à ce que son biseau n'est plus visible.
- Avancer l'aiguille 3,7 mm ventralement et injecter le 0.075U de la collagénase into le striatum droit à un taux de 2 pi / min.
- À la fin de l'injection, laissez l'aiguille en position pour encore 10 minutes, avant de le retirer à une vitesse de 1 mm / min.
- Sceller le trou de trépan avec de la cire d'os et de suturer la peau.
- Injecter 0,05 mg / kg par voie sous cutanée à la buprénorphine préchauffées post-opératoires fluides.
4. Opération Sham
- Après les préparatifs préopératoires, répétez les étapes 1-4 comme décrit pour le modèle d'injection de sang.
- Insérez l'aiguille (26 Gauge) 3,7 mm ventralement à travers le trou de trépan. L'aiguille doit rester en place pendant 10 min avant d'être retiré à une vitesse de 1 mm / min.
- Sceller le trou de trépan avec de la cire d'os et de suturer la peau.
- Injecter 0,05 mg / kg par voie sous cutanée à la buprénorphine préchauffées post-opératoires fluides.
5. Les résultats représentatifs
Expérimentale hémorragie intrastriatale évoque morphologiqueainsi que des changements de comportement chez les rongeurs. Ces changements peuvent être évalués pour assurer une bonne exécution de la procédure, ou pour enquêter sur les effets des traitements potentiels. Génération de purge dans une région du cerveau ciblée (par exemple, les noyaux gris centraux) est le plus essentiel d'adopter une approche reproductible et peut être vérifiée sur des coupes de cerveau brut ou teinté histologique (figure 1-2). Blessures aux résultats des noyaux gris centraux des déficits sensori-motrices, qui peuvent être quantifiés par l'intermédiaire de diverses évaluations comportementales. Les résultats du test ont montré que son tour d'angle, après expérimentale du côté droit ICH, souris s'est significativement plus souvent ipsilatérale et loin de l'altération controlatéral (à gauche), à une opération fictive animaux à 24 et 72 h après la chirurgie (Figure 3). En outre, la capacité de bien placer le affaiblies (à gauche) membre antérieur sur une surface, suite à une stimulation des vibrisses, a été évaluée par le test de patte avant de placer. À 24 et 72 heures après la chirurgie, les souris sousrejeté à droite face ICH a montré placements nettement moins nombreuses que les animaux une opération fictive. Mesure de l'œdème cérébral est fréquemment utilisée pour quantifier l'étendue des lésions cérébrales après ICH expérimentale. Injections intracérébrales de sang autologue (30 pi) ou la collagénase bactérienne (0,075 U) conduit à une augmentation significative de la teneur en eau du cerveau dans le cortex ipsilatéral et ganglions de la base à 24 (Figure 4) et 72 h (figure 4 B) après la chirurgie ( par rapport à fictive). Les résultats des tests de comportement (figure 3) et l'étendue de l'œdème cérébral (figure 4) n'a montré aucune différence entre le sang et les modèles à injection de collagénase à des volumes donnés.
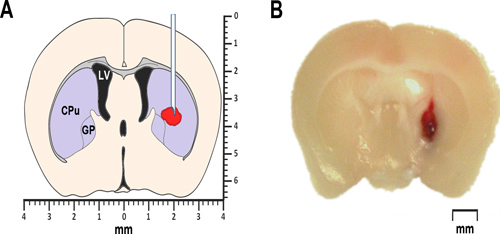
Figure 1. ICH modélisation chez la souris. (A) Le schéma simplifié d'une section coronale du cerveau antérieur de 0,2 mm du bregma illustre la proposed emplacement de sang autologue ou l'injection de collagénase. Le ventricule latéral est marqué LV. CPu signifie caudé-putamen, une partie du striatum, et GP identifie le globus pallidus. À la fois, le striatum ainsi que le globus pallidus appartiennent à un groupe de sous-corticale noyaux, également connu sous le nom ganglions de la base. Microphotographie représentant (B) d'une section coronale du cerveau antérieur de 0,2 mm du bregma, a obtenu 24 h après l'injection intrastriatale de sang total autologue.
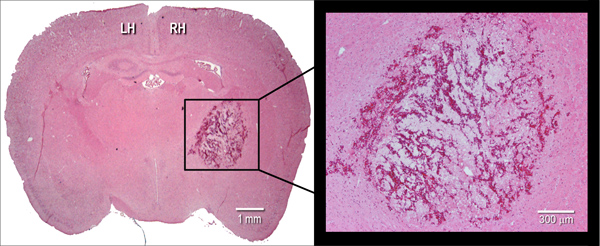
Figure 2. Manifestation histologique de l'hématome. Représentant hématoxyline et l'éosine (H & E) teinté cryosection coronale (10 um) d'un cerveau de souris, illustrant la taille hématome à 24 h après l'injection de collagénase bactérienne intrastriatale (0,075 U). LH = hémisphère gauche, HR = hémisphère droit.
< img alt = "Figure 3" src = "/ files/ftp_upload/4289/4289fig3.jpg" />
Figure 3. Neurofonctionnels évaluations suivantes ICH expérimentale chez la souris. Intrastriatale injection de sang autologue (30 pi) ou la collagénase bactérienne (0,075 U) a provoqué des déficits neurofonctionnels reproductibles. (A) Les souris après ICH expérimentale a montré tour à tour nettement plus à droite que les animaux sham fonctionnant à 24 et 72 heures après la chirurgie. (B) la capacité de placer des pattes avant de la jambe gauche a été altéré après l'ICH à 24 et 72 heures après la chirurgie. Les valeurs ont été exprimées en moyenne ± SEM et analysées avec Kruskal-Wallis Une analyse de variance sur les rangs, suivis par la méthode de Student-Newman-Keuls. Valeur P <0,05 était considérée comme statistiquement significative, n = 6-12 par groupe, * p <0,05 par rapport au trompe-l'œil. Cliquez ici pour agrandir la figure .
igure 4 "src =" / files/ftp_upload/4289/4289fig4.jpg "/>
Figure 4. Évaluation de la teneur en eau du cerveau après l'ICH expérimentale chez la souris. Injection intracérébrale de sang autologue (30 pi) ou la collagénase bactérienne (0,075 U) conduit à une augmentation significative de la teneur en eau du cerveau dans le cortex ipsilatéral et ganglions de la base à 24 (A) et 72 h (B) après ICH-induction. Les valeurs ont été exprimées en moyenne ± SEM et analysées avec une analyse de variance, suivie par Tukey test post hoc. Valeur P <0,05 était considérée comme statistiquement significative, n = 6-10 par groupe, * p <0,05 par rapport au trompe-l'œil. Cliquez ici pour agrandir la figure .
Discussion
Les modèles animaux d'hémorragie intracérébrale (HIC) contribuent largement à une compréhension approfondie de la physiopathologie de la maladie, et sont couramment utilisés pour développer et évaluer de nouvelles stratégies thérapeutiques dans un cadre préclinique. Injections intra-parenchymateuses de sang autologue ou la collagénase bactérienne sont bien établies méthodes pour générer ICH chez les rongeurs. Les deux méthodes ont été initialement développées chez le rat, mais en raison de l&#...
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Cette étude a été financée en partie par NIH RO1NS053407 à JH Zhang. Nous tenons à remercier M. Damon Klebe pour ses précieuses contributions.
matériels
| Name | Company | Catalog Number | Comments |
| Matériel | Entreprise | Numéro de catalogue | Commenter |
| Cadre Tête stéréotaxique | Stoelting Co. | 51600 | |
| Pousse-seringue Nanomite | Harvard Apparatus | PY2 70-2217 | |
| Seringue Hamilton | Entreprise Hamilton | 1725RN (250 pi) RN 1701 (10 pl) | Aiguille de 26 Gauge pour 250 pi et 10 pi de seringues. |
| Micro-foret | Outils Fine Science | 18000-17 | |
| Micro-foret fraise | Outils Fine Science | 19007-09 | 0,9 mm de diamètre |
| Collagénase de type VII-S | Sigma-Aldrich | C2399 | |
| Microhématocrite Tubes capillaires | Fisher Scientific | 22-362-574 | unheparinized |
| Cire osseuse | Ethicon | W31 | |
| Suturer | Ethicon | 1676G | |
| La kétamine | JHP Pharmaceuticals | 42023-115-10 | Ketalar |
| Xylazine | Laboratoires LLOYD | 139-236 | AnaSed |
Références
- Broderick, J. P. Guidelines for the management of spontaneous intracerebral hemorrhage: A statement for healthcare professionals from a special writing group of the Stroke Council, American Heart Association. Stroke. 30, 905-915 (1999).
- Qureshi, A. I., Mendelow, A. D., Hanley, D. F. Intracerebral haemorrhage. Lancet. 373, 1632-1644 (2009).
- MacLellan, C. L., Silasi, G., Auriat, A. M., Colbourne, F. Rodent models of intracerebral hemorrhage. Stroke. 41, 95-98 (2010).
- James, M. L., Warner, D. S., Laskowitz, D. T. Preclinical models of intracerebral hemorrhage: a translational perspective. Neurocrit Care. 9, 139-152 (2008).
- MacLellan, C. L. Intracerebral hemorrhage models in rat: comparing collagenase to blood infusion. J. Cereb. Blood Flow Metab. 28, 516-525 (2008).
- Belayev, L. Experimental intracerebral hemorrhage in the mouse: histological, behavioral, and hemodynamic characterization of a double-injection model. Stroke. 34, 2221-2227 (2003).
- Clark, W., Gunion-Rinker, L., Lessov, N., Hazel, K. Citicoline treatment for experimental intracerebral hemorrhage in mice. Stroke. 29, 2136-2140 (1998).
- Nakamura, T. Intracerebral hemorrhage in mice: model characterization and application for genetically modified mice. J. Cereb. Blood Flow Metab. 24, 487-494 (2004).
- Schallert, T. Behavioral tests for preclinical intervention assessment. NeuroRx. 3, 497-504 (2006).
- Hartman, R., Lekic, T., Rojas, H., Tang, J., Zhang, J. H. Assessing functional outcomes following intracerebral hemorrhage in rats. Brain Res. 1280, 148-157 (2009).
- Hua, Y. Behavioral tests after intracerebral hemorrhage in the rat. Stroke. 33, 2478-2484 (2002).
- Tang, J. Mmp-9 deficiency enhances collagenase-induced intracerebral hemorrhage and brain injury in mutant mice. J. Cereb. Blood Flow Metab. 24, 1133-1145 (2004).
- Ma, Q. Vascular adhesion protein-1 inhibition provides antiinflammatory protection after an intracerebral hemorrhagic stroke in mice. J. Cereb. Blood Flow Metab. , (2010).
- Bullock, R., Mendelow, A. D., Teasdale, G. M., Graham, D. I. Intracranial haemorrhage induced at arterial pressure in the rat. Part 1: Description of technique, ICP changes and neuropathological findings. Neurol Res. 6, 184-188 (1984).
- Yang, G. Y., Betz, A. L., Chenevert, T. L., Brunberg, J. A., Hoff, J. T. Experimental intracerebral hemorrhage: relationship between brain edema, blood flow, and blood-brain barrier permeability in rats. J. Neurosurg. 81, 93-102 (1994).
- Rosenberg, G. A., Mun-Bryce, S., Wesley, M., Kornfeld, M. Collagenase-induced intracerebral hemorrhage in rats. Stroke. 21, 801-807 (1990).
- Alkayed, N. J. Gender-linked brain injury in experimental stroke. Stroke. 29, 159-165 (1998).
- Saha, J. K., Xia, J., Grondin, J. M., Engle, S. K., Jakubowski, J. A. Acute hyperglycemia induced by ketamine/xylazine anesthesia in rats: mechanisms and implications for preclinical models. Exp Biol Med. (Maywood). 230, 777-784 (2005).
- Fujiwara, N. Effect of normobaric oxygen therapy in a rat model of intracerebral hemorrhage. Stroke. 42, 1469-1472 (2011).
- Khatibi, N. H. Isoflurane posttreatment reduces brain injury after an intracerebral hemorrhagic stroke in mice. Anesth Analg. 113, 343-348 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon