A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
نزف الدماغي الداخلي النمذجة في الفئران: حقن الدم الذاتي أو البكتيرية كولاجيناز
In This Article
Summary
وهناك حاجة إلى نماذج حيوانية ذات الصلة سريريا من نزيف داخل المخ (ICH) لتوسيع نطاق معرفتنا السكتة النزفية ودراسة استراتيجيات علاجية جديدة. في هذه الدراسة، فإننا وصف وتقييم النماذج ICH اللذين تنفيذ حقن الدم إما من طرف واحد أو كلها ذاتي كولاجيناز البكتيرية في العقد القاعدية (الجسم المخطط) من الفئران.
Abstract
نزف داخل المخ عفوية (ICH) يعرف العلة يحتمل أن تكون مهددة للحياة العصبية التي تشكل 10-15٪ من جميع المستشفيات السكتة الدماغية ذات الصلة والتي لا تتوفر علاجات فعالة حتى الآن 1،2. بسبب عدم تجانس ICH في البشر، وهناك حاجة إلى نماذج مختلفة قبل السريرية لاستكشاف الاستراتيجيات العلاجية بدقة المحتملين 3. هو فعل شائع التجريبية ICH في القوارض عن طريق الحقن إما intraparenchymal من الدم الذاتي أو البكتيرية كولاجيناز 4. يتم تحديد النموذج المناسب بناء على الفيزيولوجيا المرضية الحث نزف وتقدم الإصابة. نموذج حقن الدم يحاكي نزف بخطى حثيثة. بدلا من ذلك، كولاجيناز البكتيرية يعطل إنزيمي على الصفيحة القاعدية من المخ الشعيرات الدموية، مما تسبب في نزيف النشطة التي تتطور بشكل عام خلال عدة ساعات 5. يمكن كميا ذمة perihematomal والعجز الناتجة neurofunctional جيئة وذهابام كلا النموذجين. في هذه الدراسة، وصف لنا وتقييمها وتعديل نموذج حقن مزدوج من الدم الكامل ذاتي 6 وكذلك نموذج حقن ICH من كولاجيناز البكتيرية 7، وكلاهما هدف العقد القاعدية (الجسم المخطط) من الفئران الذكور CD-1. قمنا بتقييم العجز وذمة الدماغ neurofunctional في 24 و 72 ساعة بعد الاستقراء ICH. تسبب حقن الدم الذاتي Intrastriatal من (30 ميكرولتر) أو كولاجيناز البكتيرية (0.075U) العجز neurofunctional استنساخه في الفئران وذمة الدماغ زيادة كبيرة في الموارد البشرية 24 و 72 بعد الجراحة (ع <0.05). في الختام، كلا النموذجين تسفر عوائق النزفية متسقة وتمثل الأساليب الأساسية للبحث ICH قبل السريرية.
Protocol
وأجريت كافة الإجراءات وفقا لدليل المعاهد الوطنية للصحة لرعاية واستخدام الحيوانات المختبرية والتي وافقت عليها اللجنة ورعاية الحيوان في الاستخدام لوما ليندا جامعة.
1. سابق للجراحة الاستعدادات
ويوصى التقنيات العقيم لجميع العمليات الجراحية. تطهير جهاز المجسم وإعداد الأدوات الجراحية المعقمة قبل الجراحة. ارتداء معدات الوقاية الشخصية (PPE) خلال جميع التعامل مع الحيوانات. استخدام وسادة التدفئة أثناء الجراحة للحفاظ على درجة حرارة الجسم الحيوان الفسيولوجية.
- وزن الماوس الأسبوع 8-12 القديمة باستخدام حيوان شعاع ثلاثية النطاق.
- شارك في حقن الكيتامين (100 ملغ / كغ) وزيلازين (10 ملغ / كغ) الغشاء البريتونى ثم السماح 7-10 دقيقة للتخدير نافذة المفعول (راصد لتخدير كاف).
- ضع الماوس على بطانية الحرارية ويحلق فروة الرأس.
- تطبيق مرهم عيني لكلتا العينين.
- تأمينالهوائية، وذلك بلطف تتحرك أفقيا اللسان، وتأمين بعناية رئيس الماوس، على جهاز المجسم. ملاحظة: يجب أن تكون آمنة وأفقيا لرئيس أساس الإطار المجسم.
- تطهير المنطقة الجراحية مع Betadine، وشطف مع الايثانول 70٪. كرر بالتناوب تطبيقات Betadine والإيثانول 70٪ ليصبح المجموع ثلاث مرات. ويمكن استخدام القطن ذات الرؤوس تطبيقها لهذا الغرض.
2. حقن الدم الموديل
- جعل شق خط الوسط 1 سم من فروة الرأس طويلة مع شفرة مشرط رقم 10.
- استخدام القطن ذات الرؤوس تطبيقها لمسح بعيدا الأنسجة الرخوة التي تغطي الجمجمة، من أجل فضح نقطة تقاطع عمودي من الدرز الإكليلي والسهمي (bregma).
- تحميل حقنة هاميلتون (250 ميكرولتر) على مضخة الحقن، وتوجيه الإبرة stereotaxically (26 مقياس) على bregma.
- المقبل، وضبط الأسلحة تتلاعب المجسم لوضع إبرة 0.2 ملم الأمامي و 2مم أفقيا إلى اليمين. في هذه الإحداثيات جعل ثقب صغير في الجمجمة لدغ، وذلك باستخدام الحفر متغيرة السرعة مع مثقاب 1 مم.
- تعليق ذيل الحيوان وتطهير السطح السفلي مع الايثانول 70٪.
- ثقب الشريان الذيل المركزية بإبرة معقمة (مثل قياس 26) وجمع الدم في الشرايين في أنبوب شعري وunheparinized.
- نقل الدم بسرعة من الأنبوب الشعري في برميل كوب من الحقنة هاميلتون، ثم إدراج المكبس.
- أعد الآن 30 ميكرولتر أو أكثر من الدم الشرياني يحتوي على حقنة هاميلتون في مضخة حقن ويدخل الإبرة (مع قدرتها مشطوف التي تواجه خياطة السهمي) من خلال ثقب فقط حتى لدغ شطبة لها لم يعد مرئيا.
- من هذا التقدم نقطة الإبرة 3 مم بطنيا وحقن 5 ميكرولتر من الدم الذاتي بمعدل من 2 ميكرولتر / دقيقة.
- بعد الانتهاء من الحقن الأولى قبل الإبرة 0.7 مم كذلك في العمق.
- انتظر5 دقائق ثم 25 حقن ميكرولتر من الدم إلى الجسم المخطط الصحيح.
- وعند الانتهاء من الحقنة الثانية، وترك المنصب لمدة إبرة في 10 دقيقة إضافية، قبل سحبه بمعدل 1 ملم / دقيقة.
- ختم بالشمع لدغ حفرة العظم وخياطة الجلد.
- لتسكين بعد العملية الجراحية لضخ 0.05 مغ / كغ من البوبرينورفين تحت الجلد في مرحلة ما قبل حرارة السوائل (ملحي).
3. كولاجيناز حقن الموديل
- بعد التحضيرات سابق للجراحة، كرر الخطوات من 1-4 كما هو موضح لدماء نموذج الحقن.
- ملء المحاقن هاميلتون (10 ميكرولتر) مع 0.075U من كولاجيناز (المطثية) البكتيرية VII-S حل في 0.5 ميكرولتر من المياه المالحة. تجنب تشكيل فقاعات الهواء.
- أعد حقنة هاميلتون على ضخ الحقن وإدخال إبرة (26 مقياس)، من خلال ثقب فقط حتى لدغ شطبة لها لم يعد مرئيا.
- دفع إبرة 3.7 ملم بطنيا وحقن 0.075U من كولاجيناز طn لفي المخطط حق بمعدل من 2 ميكرولتر / دقيقة.
- وعند الانتهاء من الحقن، وترك المنصب لمدة إبرة في 10 دقيقة إضافية، قبل سحبه بمعدل 1 ملم / دقيقة.
- ختم بالشمع لدغ حفرة العظم وخياطة الجلد.
- حقن 0.05 مغ / كغ من البوبرينورفين تحت الجلد في السوائل بعد الجراحة قبل تحسنت.
4. عملية الشام
- بعد التحضيرات سابق للجراحة، كرر الخطوات من 1-4 كما هو موضح لدماء نموذج الحقن.
- أدخل الإبرة (26 مقياس) 3.7 مم بطنيا من خلال ثقب لدغ. ينبغي أن تظل في موقف إبرة لمدة 10 دقيقة قبل أن يتم سحب بمعدل 1 ملم / دقيقة.
- ختم بالشمع لدغ حفرة العظم وخياطة الجلد.
- حقن 0.05 مغ / كغ من البوبرينورفين تحت الجلد في السوائل بعد الجراحة قبل تحسنت.
5. ممثل النتائج
نزف intrastriatal التجريبية تثير المورفولوجية كماكذلك التغيرات السلوكية في القوارض. ويمكن تقييم هذه التغييرات لضمان التنفيذ الملائم للإجراءات، أو للتحقيق في الآثار المترتبة على العلاجات المحتملة. توليد تنزف في منطقة الدماغ المستهدفة (مثل العقد القاعدية) هي الأكثر أهمية لنهج استنساخه، ويمكن التحقق من أقسام الدماغ على جسيم أو الملون تشريحيا (الشكل 1-2). إصابة لنتائج العقد القاعدية في العجز الحسية، والتي يمكن كميا عن طريق التقييمات السلوكية المختلفة. وأظهرت نتائج الاختبار الزاوية بدوره أنه بعد ICH في الجانب الأيمن التجريبية والفئران تحولت بشكل ملحوظ في كثير من الأحيان ipsilaterally وبعيدا عن الجانب (اليسار) ضعف المقابل، من يعمل الشام الحيوانات في 24 و 72 ساعة بعد الجراحة (الشكل 3 A). وعلاوة على ذلك، فإن القدرة على وضع وافية ضعف (إلى اليسار) على سطح forelimb، بعد التحفيز vibrissae، تم تقييم الاختبار عن طريق وضع forelimb. في 24 و 72 ساعة بعد الجراحة، دون الفئرانjected إلى الجانب الأيمن ICH أظهرت مواضع أقل بكثير من الحيوانات الشام تعمل. وكثيرا ما يستخدم قياس ذمة الدماغ لتحديد مدى إصابة الدماغ بعد ICH التجريبية. الحقن داخل المخ من الدم الذاتي (30 ميكرولتر) أو كولاجيناز البكتيرية (0.075 U) أدى إلى زيادة كبيرة في محتوى الماء في المخ في القشرة المماثل والعقد القاعدية في 24 (الشكل 4 أ) و 72 ساعة (الشكل 4 B) بعد الجراحة ( مقارنة الشام). وأظهرت نتائج الاختبارات السلوك (الشكل 3) ومدى وذمة الدماغ (الشكل 4) لا فرق بين الدم والحقن نماذج كولاجيناز في مجلدات معينة.
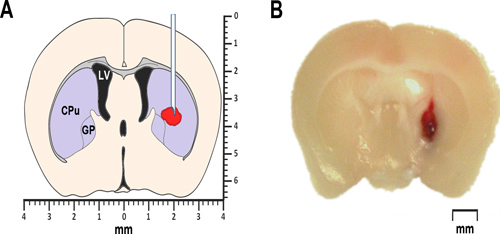
الشكل 1. ICH النمذجة في الفئران. (A) والتخطيطي مبسطة من الدماغ الاكليلية 0،2 مم الباب الأمامي للbregma يوضح العلاقات العامةoposed موقع أو حقن الدم الذاتي كولاجيناز. تم وضع علامة LV بطين الوحشي. وحدة المعالجة المركزية لتقف على المذنبة-putamen، وهي جزء من المخطط، وتحدد GP الشاحبة غلوبوس. على حد سواء، والجسم المخطط وكذلك الشاحبة غلوبوس تنتمي إلى مجموعة فرعية القشرية النوى، والمعروف أيضا باسم العقد القاعدية. (B) صورة مجهرية من الممثل الأمامي الدماغ الاكليلية 0.2mm قسم bregma، التي تم الحصول عليها في 24 ساعة بعد الحقن intrastriatal ذاتي من الدم الكامل.
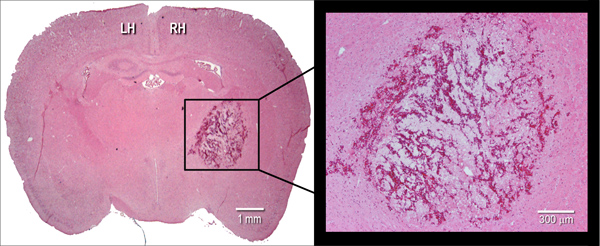
الشكل 2. مظاهر نسيجية للورم دموي. الممثل hematoxylin و eosin (H & E) cryosection الاكليلية الملون (10 ميكرون) من مخ الفأر، وهو ما يدل على حجم الورم الدموي 24 ساعة بعد الحقن intrastriatal من كولاجيناز البكتيرية (0.075 U). LH = اليسار نصف الكرة، RH = النصف الأيمن.
< IMG ALT = "الشكل 3" SRC = "/ files/ftp_upload/4289/4289fig3.jpg" />
الشكل 3. تقييم Neurofunctional بعد ICH التجريبية في الفئران. تسبب حقن الدم الذاتي Intrastriatal من (30 ميكرولتر) أو كولاجيناز البكتيرية (0.075 U) العجز neurofunctional استنساخه. (A) وأظهرت الفئران بعد ICH التجريبية يتحول بشكل ملحوظ أكثر من حق الحيوانات الشام تعمل في 24 و 72 ساعة بعد الجراحة. أضطرب (B) القدرة Forepaw وضع الطرف الأيسر من بعد ICH في 24 و 72 ساعة بعد الجراحة. وأعرب عن القيم يعني ± SEM كما وتحليلها مع كروسكال واليس تحليل طريقة، واحدة من الفرق على المراكز، تليها الطريقة على الطلاب نيومان Keuls. واعتبر AP قيمة <0.05 ذات دلالة إحصائية، ن = 6-12 لكل مجموعة، * P <0.05 مقارنة مع الشام. اضغط هنا لمشاهدتها بشكل اكبر شخصية .
igure 4 "SRC =" / files/ftp_upload/4289/4289fig4.jpg "/>
الشكل 4. تقييم المحتوى المائي الدماغ بعد ICH التجريبية في الفئران. الدماغي الداخلي حقن الدم الذاتي (30 ميكرولتر) أو كولاجيناز البكتيرية (0.075 U) أدت إلى زيادة كبيرة في محتوى الماء في المخ في القشرة المماثل والعقد القاعدية في 24 (A) والموارد البشرية 72 (B) بعد ICH-التعريفي. وأعرب عن القيم يعني ± SEM كما وتحليلها مع تحليل طريقة واحدة من الفرق، تليها اختبار توكي مخصصة آخر. واعتبر AP قيمة <0.05 ذات دلالة إحصائية، ن = 6-10 لكل مجموعة، * P <0.05 مقارنة مع الشام. اضغط هنا لمشاهدتها بشكل اكبر شخصية .
Discussion
نماذج حيوانية من نزيف داخل المخ (ICH) يسهم إلى حد كبير في فهم الفيزيولوجيا المرضية متقدمة من المرض، وتستخدم عادة لتطوير وتقييم استراتيجيات علاجية جديدة في محيط قبل السريرية. حقن الدم الذاتي من Intraparenchymal أو البكتيرية هي كولاجيناز راسخة طرق لتوليد ICH في القوارض. وقد وضعت ?...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
وأيد هذه الدراسة من قبل جزئيا NIH منحة RO1NS053407 لتشانغ JH. نود أن نشكر السيد دامون Klebe لمساهماته القيمة.
Materials
| Name | Company | Catalog Number | Comments |
| مادة | شركة | كتالوج رقم | تعليق |
| المجسم رئيس الإطار | شركة Stoelting | 51600 | |
| Nanomite الحقنة مضخة | جهاز هارفارد | PY2 70-2217 | |
| هاميلتون الحقنة | هاميلتون الشركة | 1725RN (250 ميكرولتر) RN 1701 (10 ميكرولتر) | إبرة قياس 26 ل 250 ميكرولتر و 10 ميكرولتر الحقن. |
| Microdrill | أدوات العلوم الجميلة | 18000-17 | |
| Microdrill لدغ | أدوات العلوم الجميلة | 19007-09 | 0.9 مم قطر |
| كولاجيناز نوع VII-S | سيغما الدريخ | C2399 | |
| مكداس مكروي أنابيب شعرية | فيشر العلمية | 22-362-574 | unheparinized |
| الشمع العظام | Ethicon | W31 | |
| خاط | Ethicon | 1676G | |
| الكيتامين | JHP الصيدلة | 42023-115-10 | Ketalar |
| زيلازين | LLOYD المختبرات | 139-236 | AnaSed |
References
- Broderick, J. P. Guidelines for the management of spontaneous intracerebral hemorrhage: A statement for healthcare professionals from a special writing group of the Stroke Council, American Heart Association. Stroke. 30, 905-915 (1999).
- Qureshi, A. I., Mendelow, A. D., Hanley, D. F. Intracerebral haemorrhage. Lancet. 373, 1632-1644 (2009).
- MacLellan, C. L., Silasi, G., Auriat, A. M., Colbourne, F. Rodent models of intracerebral hemorrhage. Stroke. 41, 95-98 (2010).
- James, M. L., Warner, D. S., Laskowitz, D. T. Preclinical models of intracerebral hemorrhage: a translational perspective. Neurocrit Care. 9, 139-152 (2008).
- MacLellan, C. L. Intracerebral hemorrhage models in rat: comparing collagenase to blood infusion. J. Cereb. Blood Flow Metab. 28, 516-525 (2008).
- Belayev, L. Experimental intracerebral hemorrhage in the mouse: histological, behavioral, and hemodynamic characterization of a double-injection model. Stroke. 34, 2221-2227 (2003).
- Clark, W., Gunion-Rinker, L., Lessov, N., Hazel, K. Citicoline treatment for experimental intracerebral hemorrhage in mice. Stroke. 29, 2136-2140 (1998).
- Nakamura, T. Intracerebral hemorrhage in mice: model characterization and application for genetically modified mice. J. Cereb. Blood Flow Metab. 24, 487-494 (2004).
- Schallert, T. Behavioral tests for preclinical intervention assessment. NeuroRx. 3, 497-504 (2006).
- Hartman, R., Lekic, T., Rojas, H., Tang, J., Zhang, J. H. Assessing functional outcomes following intracerebral hemorrhage in rats. Brain Res. 1280, 148-157 (2009).
- Hua, Y. Behavioral tests after intracerebral hemorrhage in the rat. Stroke. 33, 2478-2484 (2002).
- Tang, J. Mmp-9 deficiency enhances collagenase-induced intracerebral hemorrhage and brain injury in mutant mice. J. Cereb. Blood Flow Metab. 24, 1133-1145 (2004).
- Ma, Q. Vascular adhesion protein-1 inhibition provides antiinflammatory protection after an intracerebral hemorrhagic stroke in mice. J. Cereb. Blood Flow Metab. , (2010).
- Bullock, R., Mendelow, A. D., Teasdale, G. M., Graham, D. I. Intracranial haemorrhage induced at arterial pressure in the rat. Part 1: Description of technique, ICP changes and neuropathological findings. Neurol Res. 6, 184-188 (1984).
- Yang, G. Y., Betz, A. L., Chenevert, T. L., Brunberg, J. A., Hoff, J. T. Experimental intracerebral hemorrhage: relationship between brain edema, blood flow, and blood-brain barrier permeability in rats. J. Neurosurg. 81, 93-102 (1994).
- Rosenberg, G. A., Mun-Bryce, S., Wesley, M., Kornfeld, M. Collagenase-induced intracerebral hemorrhage in rats. Stroke. 21, 801-807 (1990).
- Alkayed, N. J. Gender-linked brain injury in experimental stroke. Stroke. 29, 159-165 (1998).
- Saha, J. K., Xia, J., Grondin, J. M., Engle, S. K., Jakubowski, J. A. Acute hyperglycemia induced by ketamine/xylazine anesthesia in rats: mechanisms and implications for preclinical models. Exp Biol Med. (Maywood). 230, 777-784 (2005).
- Fujiwara, N. Effect of normobaric oxygen therapy in a rat model of intracerebral hemorrhage. Stroke. 42, 1469-1472 (2011).
- Khatibi, N. H. Isoflurane posttreatment reduces brain injury after an intracerebral hemorrhagic stroke in mice. Anesth Analg. 113, 343-348 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved