È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Modellazione emorragia intracerebrale in Mouse: iniezione di sangue autologo o collagenasi batterica
In questo articolo
Riepilogo
Modelli animali clinicamente rilevanti di emorragia intracerebrale (ICH) sono necessari per ampliare la nostra conoscenza di ictus emorragico e di esaminare nuove strategie terapeutiche. In questo studio, abbiamo descrivere e valutare due modelli ICH che implementano iniezioni unilaterali di ciascuna sangue autologo intero o collagenasi batterica nel gangli della base (corpo striato) di topi.
Abstract
Spontanea emorragia intracerebrale (ICH) definisce una malattia potenzialmente pericolosa per la vita neurologica che rappresenta il 10-15% di tutti i ricoveri legati a ictus e per i quali non sono disponibili trattamenti efficaci ad oggi 1,2. A causa della eterogeneità delle ICH negli esseri umani, diversi modelli preclinici sono necessari per esplorare a fondo i potenziali strategie terapeutiche 3. ICH sperimentale è comunemente indotta in roditori da iniezione intraparenchimale sia di sangue autologo o collagenasi batterica 4. Il modello appropriato viene selezionato in base alla fisiopatologia di induzione emorragie e lesioni progressione. Il modello di iniezione sangue imita una emorragia rapida progressione. In alternativa, collagenasi batterica enzimaticamente sconvolge la lamina basale dei capillari cerebrali, causando un sanguinamento attivo che si evolve in genere per diverse ore 5. Risultante edema perihematomal e deficit neurofunzionali possono essere quantificati from entrambi i modelli. In questo studio abbiamo descritto e valutato un modello modificato doppia iniezione di sangue intero autologo 6 così come un modello ICH iniezione di collagenasi batterica 7, entrambi bersaglio gangli della base (corpo striato) di maschi topi CD-1. Abbiamo valutato deficit neurofunzionali ed edema cerebrale a 24 e 72 ore dopo l'induzione ICH. Intrastriatal iniezione di sangue autologo (30 microlitri) o collagenasi batterica (0.075U) causata riproducibili deficit neurofunzionali in topi e edema cerebrale significativamente aumentata a 24 e 72 ore dopo l'intervento (p <0,05). In conclusione, entrambi i modelli producono consistenti infarti emorragici e rappresentano metodi di base per la ricerca preclinica ICH.
Protocollo
Tutte le procedure sono state effettuate in conformità con la Guida NIH per la cura ed uso di animali da laboratorio e approvato dalla cura degli animali e del Comitato uso della Loma Linda University.
1. Preparazioni prechirurgica
Tecniche asettiche sono raccomandati per tutte le procedure chirurgiche. Disinfettare l'apparato stereotassico e preparare sterili strumenti chirurgici prima dell'intervento. Indossare dispositivi di protezione individuale (DPI) durante tutto il trattamento degli animali. Utilizzare una piastra elettrica durante l'intervento chirurgico per mantenere la temperatura fisiologica del corpo dell'animale.
- Pesare il 8-12 vecchio mouse settimana utilizzando una tripla scala animale fascio.
- Co-iniezione di ketamina (100 mg / kg) e xilazina (10 mg / kg) per via intraperitoneale quindi consentire 7-10 minuti per l'anestesia abbia effetto (monitor per un sedazione adeguata).
- Posizionare il mouse su una coperta termica e radersi il cuoio capelluto.
- Applicare una pomata oftalmica a entrambi gli occhi.
- Fissare ilvie aeree, delicatamente muovere la lingua lateralmente, e con attenzione fissare la testa del mouse sul dispositivo stereotassico. Nota: La testa deve essere fissato orizzontalmente alla base del telaio stereotassico.
- Disinfettare l'area chirurgica con Betadine, e risciacquare con etanolo al 70%. Ripetere alternando applicazioni di Betadine e etanolo al 70% per un totale di tre volte. Punte di cotone può essere utilizzato per questo scopo.
2. Sangue iniezione Modello
- Fai un cm 1 lunga incisione mediana del cuoio capelluto con una lama di bisturi # 10.
- Utilizzare punte di cotone per rimuovere il tessuto molle che copre il cranio, in modo da esporre il punto di intersezione perpendicolare della sutura coronale e sagittale (bregma).
- Montare la siringa Hamilton (250 microlitri) sulla pompa di iniezione, e stereotaxically dirigere l'ago (26 Gauge) sopra bregma.
- Quindi, regolare i bracci manipolatori stereotassica per posizionare l'ago di 0,2 millimetri anteriore e 2millimetri lateralmente a destra. A queste coordinate fare un piccolo foro cranica bave, utilizzando un trapano a velocità variabile, con una punta da 1 mm.
- Sospendere coda dell'animale e disinfettare la superficie inferiore con etanolo 70%.
- Puntura l'arteria centrale della coda con un ago sterile (ad esempio, 26 Gauge) e raccogliere il sangue arterioso in un tubo capillare unheparinized.
- Trasferire il sangue rapidamente dal tubo capillare nel cilindro in vetro della siringa Hamilton, quindi inserire il pistone.
- Ricollegare il 30 microlitri ora o più di sangue arterioso contenente una siringa Hamilton sulla pompa di iniezione e inserire l'ago (con il bordo smussato rivolto verso la sutura sagittale) attraverso il foro cranico solo fino alla sua smussatura non è più visibile.
- Da questo punto anticipo l'ago 3 millimetri ventralmente e iniettare 5 ml di sangue autologo ad una velocità di 2 ml / min.
- Dopo il completamento della prima iniezione anticipo l'ago di 0,7 millimetri ulteriormente in profondità.
- Attendere5 min quindi iniettare 25 pl di sangue nello striato destro.
- Al termine della seconda iniezione, lasciare l'ago in posizione per altri 10 minuti, prima di prelevare ad un tasso di 1 mm / min.
- Sigillare il foro cranico con cera ossea e suturare la pelle.
- Per l'analgesia postoperatoria iniettare 0,05 mg / kg di buprenorfina per via sottocutanea in pre-riscaldate liquidi (soluzione fisiologica).
3. Collagenasi iniezione Modello
- Dopo i preparativi preoperatori, ripetere i passaggi 1-4 come descritto per il modello iniezione sangue.
- Riempire la siringa Hamilton (10 pl) con 0.075U di batteri (clostridi) collagenasi VII-S disciolti in 0,5 ml di soluzione fisiologica. Evitare la formazione di bolle d'aria.
- Ricollegare la siringa Hamilton sulla pompa di iniezione e inserire l'ago (26 Gauge), attraverso il foro cranico solo fino alla sua smussatura non è più visibile.
- Far avanzare il 3,7 millimetri ago ventralmente e iniettare il 0.075U di collagenasi into striato destra ad una velocità di 2 ml / min.
- Al termine dell'iniezione, lasciare l'ago in posizione per altri 10 minuti, prima di prelevare ad un tasso di 1 mm / min.
- Sigillare il foro cranico con cera ossea e suturare la pelle.
- Iniettare 0,05 mg / kg di buprenorfina per via sottocutanea in preriscaldate postoperatorie fluidi.
4. Sham Funzionamento
- Dopo i preparativi preoperatori, ripetere i passaggi 1-4 come descritto per il modello iniezione sangue.
- Inserire il (26 Gauge) ago 3,7 millimetri ventralmente attraverso il foro cranico. L'ago deve rimanere in posizione per 10 min prima di essere ritirato ad una velocità di 1 mm / min.
- Sigillare il foro cranico con cera ossea e suturare la pelle.
- Iniettare 0,05 mg / kg di buprenorfina per via sottocutanea in preriscaldate postoperatorie fluidi.
5. Risultati rappresentativi
Sperimentale emorragia intrastriatal evoca morfologicocosì come cambiamenti comportamentali nei roditori. Queste modifiche possono essere valutati per garantire una adeguata esecuzione della procedura, o per studiare gli effetti di possibili trattamenti. Generazione di spurgo in una zona del cervello mirata (ad esempio nuclei della base) è più essenziale per un approccio riproducibile, e può essere verificata su sezioni di cervello lordi o istologicamente tinto (Figura 1-2). Lesioni ai risultati dei gangli della base in deficit sensomotori, che possono essere quantificati attraverso varie valutazioni comportamentali. Risultati della prova turn angolo mostrato che, dopo sperimentale lato destro ICH, topi trasformato significativamente più spesso ipsilaterale e dalla ridotta controlaterale (sinistro), di animali sham operati a 24 e 72 ore dopo l'intervento (Figura 3). Inoltre, la possibilità di posizionare adeguatamente la compromissione (sinistra) forelimb su una superficie, dopo stimolazione vibrisse, è stata valutata mediante il test forelimb immissione. A 24 e 72 ore dopo l'intervento, i topi subproiettate a destra lato ICH ha mostrato un numero significativamente inferiore di posizionamenti animali finti operati. Misura di edema cerebrale è spesso impiegato per quantificare l'entità del danno cerebrale dopo ICH sperimentale. Iniezioni intracerebrali di sangue autologo (30 microlitri) o collagenasi batterica (0,075 U) ha portato ad un notevole aumento del contenuto di acqua nel cervello corteccia ipsilaterale e gangli basali a 24 (Figura 4 A) e 72 ore (Figura 4 B) dopo l'intervento ( rispetto alla sham). Il risultato delle prove di comportamento (Figura 3) e il grado di edema cerebrale (Figura 4) ha mostrato alcuna differenza tra il sangue e modelli iniezione collagenasi in volumi dati.
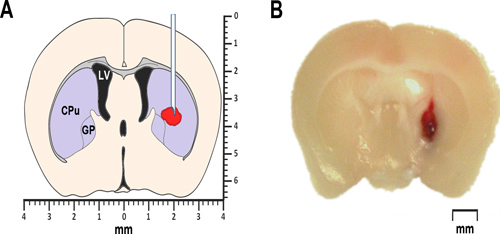
Figura 1. ICH modellazione nei topi. (A) Lo schema semplificato di una sezione coronale cervello 0,2 millimetri anteriore bregma illustra la proposed posizione di sangue autologo o iniezione collagenasi. Il ventricolo laterale è segnato LV. CPu sta per caudato-putamen, una parte del corpo striato, e GP identifica il globo pallido. Entrambi, il corpo striato e il globo pallido appartiene ad un gruppo di sub-corticale nuclei, noto anche come gangli basali. (B) microfotografia Rappresentante di una sezione del cervello coronale anteriore 0,2 millimetri di bregma, ottenuto a 24 ore dopo l'iniezione di sangue autologo intrastriatal sangue intero.
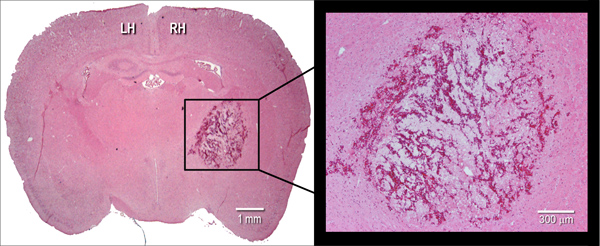
Figura 2. Manifestazione istologica dell'ematoma. Rappresentante ematossilina ed eosina (H & E) tinto cryosection coronale (10 micron) di un cervello di topo, illustrando dimensione ematoma a 24 ore dopo l'iniezione di collagenasi batterica intrastriatal (0,075 U). LH = emisfero sinistro, RH = emisfero destro.
< img alt = "Figura 3" src = "/ files/ftp_upload/4289/4289fig3.jpg" />
Figura 3. Valutazioni neurofunzionali seguenti ICH sperimentale nei topi. Intrastriatal iniezione di sangue autologo (30 pl) o collagenasi batterica (0,075 U) causato riproducibili deficit neurofunzionali. (A) I topi dopo ICH sperimentale ha mostrato curve molto più a destra di quelle degli animali finti operati a 24 e 72 ore dopo l'intervento chirurgico. (B) capacità zampa anteriore ponendo l'arto sinistro è stato alterato dopo la ICH a 24 e 72 ore dopo l'intervento chirurgico. I valori sono espressi come media ± SEM e analizzati con Kruskal-Wallis Una analisi della varianza su ranghi, seguita dalla Student-Newman-Keuls Method. Un valore di p <0.05 è stato considerato statisticamente significativo; n = 6-12 per gruppo, * P <0.05 rispetto al sham. Clicca qui per ingrandire la figura .
igura 4 "src =" / files/ftp_upload/4289/4289fig4.jpg "/>
Figura 4. Valutazione del contenuto di acqua in seguito ICH cerebrale sperimentale nei topi. Iniezione intracerebrale di sangue autologo (30 microlitri) o collagenasi batterica (0,075 U) ha portato ad un significativo aumento del contenuto di acqua nel cervello corteccia ipsilaterale e gangli basali a 24 (A) e 72 hr (B) dopo ICH-induzione. I valori sono espressi come media ± SEM ed analizzate con una analisi della varianza, seguita da test di Tukey post hoc. Un valore di p <0.05 è stato considerato statisticamente significativo; n = 6-10 per gruppo, * P <0.05 rispetto al sham. Clicca qui per ingrandire la figura .
Discussione
Modelli animali di emorragia intracerebrale (ICH) contribuiscono notevolmente a una conoscenza avanzata della fisiopatologia della malattia, e sono comunemente utilizzati per sviluppare e valutare nuove strategie terapeutiche in un ambiente preclinica. Iniezioni intraparenchimali di sangue autologo o collagenasi batterica sono consolidati metodi per generare ICH nei roditori. Entrambi i metodi sono stati sviluppati inizialmente nel ratto, tuttavia, a causa della disponibilità rapida crescita di ceppi transgenici e knoc...
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Questo studio è stato in parte sostenuto da NIH sovvenzione RO1NS053407 a JH Zhang. Vorremmo ringraziare il signor Damon Klebe per i suoi preziosi contributi.
Materiali
| Name | Company | Catalog Number | Comments |
| Materiale | Azienda | Numero di catalogo | Commento |
| Testa telaio stereotassica | Stoelting Co. | 51600 | |
| Nanomite pompa a siringa | Harvard Apparatus | PY2 70-2217 | |
| Hamilton Siringa | Hamilton Azienda | 1725RN (250 microlitri) 1701 RN (10 microlitri) | 26 gauge per 250 microlitri e 10 siringhe pl. |
| Microdrill | Strumenti Scienza Belle | 18000-17 | |
| Microdrill bava | Strumenti Scienza Belle | 19007-09 | 0,9 millimetri di diametro |
| Collagenasi di tipo VII-S | Sigma-Aldrich | C2399 | |
| Microematocrito tubi capillari | Fisher Scientific | 22-362-574 | unheparinized |
| Bone Wax | Ethicon | W31 | |
| Suturare | Ethicon | 1676G | |
| Ketamina | JHP Pharmaceuticals | 42023-115-10 | Ketalar |
| Xylazina | LLOYD Laboratories | 139-236 | AnaSed |
Riferimenti
- Broderick, J. P. Guidelines for the management of spontaneous intracerebral hemorrhage: A statement for healthcare professionals from a special writing group of the Stroke Council, American Heart Association. Stroke. 30, 905-915 (1999).
- Qureshi, A. I., Mendelow, A. D., Hanley, D. F. Intracerebral haemorrhage. Lancet. 373, 1632-1644 (2009).
- MacLellan, C. L., Silasi, G., Auriat, A. M., Colbourne, F. Rodent models of intracerebral hemorrhage. Stroke. 41, 95-98 (2010).
- James, M. L., Warner, D. S., Laskowitz, D. T. Preclinical models of intracerebral hemorrhage: a translational perspective. Neurocrit Care. 9, 139-152 (2008).
- MacLellan, C. L. Intracerebral hemorrhage models in rat: comparing collagenase to blood infusion. J. Cereb. Blood Flow Metab. 28, 516-525 (2008).
- Belayev, L. Experimental intracerebral hemorrhage in the mouse: histological, behavioral, and hemodynamic characterization of a double-injection model. Stroke. 34, 2221-2227 (2003).
- Clark, W., Gunion-Rinker, L., Lessov, N., Hazel, K. Citicoline treatment for experimental intracerebral hemorrhage in mice. Stroke. 29, 2136-2140 (1998).
- Nakamura, T. Intracerebral hemorrhage in mice: model characterization and application for genetically modified mice. J. Cereb. Blood Flow Metab. 24, 487-494 (2004).
- Schallert, T. Behavioral tests for preclinical intervention assessment. NeuroRx. 3, 497-504 (2006).
- Hartman, R., Lekic, T., Rojas, H., Tang, J., Zhang, J. H. Assessing functional outcomes following intracerebral hemorrhage in rats. Brain Res. 1280, 148-157 (2009).
- Hua, Y. Behavioral tests after intracerebral hemorrhage in the rat. Stroke. 33, 2478-2484 (2002).
- Tang, J. Mmp-9 deficiency enhances collagenase-induced intracerebral hemorrhage and brain injury in mutant mice. J. Cereb. Blood Flow Metab. 24, 1133-1145 (2004).
- Ma, Q. Vascular adhesion protein-1 inhibition provides antiinflammatory protection after an intracerebral hemorrhagic stroke in mice. J. Cereb. Blood Flow Metab. , (2010).
- Bullock, R., Mendelow, A. D., Teasdale, G. M., Graham, D. I. Intracranial haemorrhage induced at arterial pressure in the rat. Part 1: Description of technique, ICP changes and neuropathological findings. Neurol Res. 6, 184-188 (1984).
- Yang, G. Y., Betz, A. L., Chenevert, T. L., Brunberg, J. A., Hoff, J. T. Experimental intracerebral hemorrhage: relationship between brain edema, blood flow, and blood-brain barrier permeability in rats. J. Neurosurg. 81, 93-102 (1994).
- Rosenberg, G. A., Mun-Bryce, S., Wesley, M., Kornfeld, M. Collagenase-induced intracerebral hemorrhage in rats. Stroke. 21, 801-807 (1990).
- Alkayed, N. J. Gender-linked brain injury in experimental stroke. Stroke. 29, 159-165 (1998).
- Saha, J. K., Xia, J., Grondin, J. M., Engle, S. K., Jakubowski, J. A. Acute hyperglycemia induced by ketamine/xylazine anesthesia in rats: mechanisms and implications for preclinical models. Exp Biol Med. (Maywood). 230, 777-784 (2005).
- Fujiwara, N. Effect of normobaric oxygen therapy in a rat model of intracerebral hemorrhage. Stroke. 42, 1469-1472 (2011).
- Khatibi, N. H. Isoflurane posttreatment reduces brain injury after an intracerebral hemorrhagic stroke in mice. Anesth Analg. 113, 343-348 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon