Method Article
免疫沈降およびアシル-ビオチン所(阿部)による培養海馬神経細胞におけるタンパク質パルミトイル化の検出
要約
タンパク質へのパルミチン酸の可逆的付加は、細胞内タンパク質輸送の重要な調節因子である。これは、多くのシナプス蛋白質はパルミトイルているニューロンで特に重要である。我々は、複数の種類の細胞や組織に適応することができる培養神経細胞において、パルミトイル化タンパク質を検出するための簡単な生化学的方法を利用しています。
要約
パルミトイル化は、不安定なチオエステル結合を介して基質タンパク質のシステイン残基〜16炭素飽和脂肪酸、パルミチン酸塩、の添付ファイルを含む翻訳後脂質修飾である[1日]。基質タンパク質のパルミトイル化は、その疎水性を増加させ、一般的に細胞膜に向かってその売買を容易にします。最近の研究では、パルミチン酸売上高は、これらの細胞はタンパク質のターゲティングや人身売買を調節することで、重要なメカニズムであることを示唆し、ニューロン1、2の中で最も一般的な脂質修飾の一つであるパルミトイル化を示している。パルミトイル化基質の同定および検出は、したがって、神経細胞におけるタンパク質輸送の我々の理解を改善することができます。
過去におけるタンパク質パルミトイル化の検出は技術的に基質タンパク質間のコンセンサス配列の欠如、および代謝labeliへの依存により妨げられてきた3 H-パルミチン酸、低感度で時間のかかる生化学アッセイによるパルミトイル-タンパク質のNG。アシル-ビオチン所(阿部)アッセイの開発はパルミトイル化タンパク質2-4のより迅速かつ高感度検出が可能となり、ニューロンタンパク質上のパルミチン酸の動的ターンオーバーを測定するための最適です。阿部アッセイは3つの生化学的手順( 図1)で構成されています:1)N ethylmaliemide(NEM)、2を使用して変更されていないシステインのチオール基の不可逆封鎖)ヒドロキシルアミン(HAM)によりパルミトイル化システインのチオール基の特異的切断とマスキング、およびチオール反応性ビオチン化試薬を用いたパルミトイル化システインの3)選択的標識、ビオチン-BMCC。阿部手順に従ってチオールビオチン化タンパク質の精製は、実験の全体的な目標に応じて、異なっている。
ここでは、一次hippocampに興味のあるパルミトイル化タンパク質を精製するための方法を説明直接IP-ABEアッセイと呼ばれているタンパク質のパルミトイル化レベルを測定するために阿部ブロッティングアッセイおよび西部に続くタンパク質に対する抗体を用いて、初期免疫沈降(IP)工程によってらはニューロン。ラット胎児海馬ニューロンの低密度培養は広く、IP-阿部アッセイを用いて神経タンパク質のパルミトイル化を研究するため、それらを理想的に適してい、ローカリゼーション、機能、および神経タンパク質の輸送を研究するために使用されてきた。 IP-阿部アッセイは、主に標準的なIPおよびウェスタンブロッティング試薬を必要とし、唯一のターゲット基板に対する抗体の利用可能性によって制限されています。このアッセイは、容易に異種の細胞培養、マウスおよびラットの両方の様々な脳組織由来の初代神経細胞培養、さらには主要な脳組織自体にトランスフェクトされたパルミトイル化タンパク質の精製および検出に適合させることができる。
プロトコル
1。初代培養海馬ニューロンから標的タンパク質の抽出
- プロテアーゼ阻害剤、原発海馬細胞からの内因性タンパク質を採取する前に、溶解緩衝液( 表1 LB)を準備します。溶解緩衝液10mlに、10mMの最終濃度に0.1mlのフェニルメタンスルホニルフルオリド溶液(PMSF)を追加して、1プロテアーゼ阻害剤カクテル錠剤を追加します。
- 凍結乾燥粉末からN-エチルマレイミド(NEM)溶液( 表1)を準備します 。穏やかに室温(RT)で100%EtOHに溶解する。常に実験の日のために新鮮なNEMの溶液を調製します。
- 次に溶解緩衝液およびNEMを兼ね備えています。新鮮な50mlコニカルチューブに2M NEMの溶液0.5mlを加える。 20ミリリットル上上のLB、および迅速な場所LBを追加する+ 4でロッキングプラットフォーム上NEM(50mmの最終濃度)℃が完全に5分間混合すること。常に正しく2を混在させるように、NEM / EtOHのソリューション第一及び第二のLBを追加します。
- インキュベーターと氷*上の場所からの培養神経細胞を取り除きます。そっと携帯メディアを取り外し、ゆっくりと生理食塩水(PBS)1xをバッファリングされた冷リン酸で2回洗浄する。使い捨てセルリフターを使用して海馬ニューロン、およびスクレープ細胞の第一のウェルにLB + 50mMのNEMの300ミリリットルを追加します。細胞溶解物を収集し、そのグループの次のウェルにライセートを放電してください。セルリフターを使用して第2ウェル内の細胞をこすり落とし、収集し、さらに溶解液を濃縮するために必要に応じて、第3ウェルを用いて繰り返す。
- あらかじめ冷却した(氷上)、1.5 mlマイクロチューブに細胞溶解液を収集します。残りの細胞溶解液を収集するためにLB + 50mMのNEMの100μlを用いて1.4の手順を繰り返します。溶液中に泡を吹かないように注意しながら、機械的な溶解を助けるために26半ゲージシリンジ5-6回通って全細胞溶解物を渡します。機器が使用可能な場合、一つではなく、氷の上で15秒間超音波処理することができます。 4℃、≥30分間細胞ライセートをうなだれる
- セルlysaを明確に16000×gでペレット非溶解細胞と界面活性剤不溶性の材料にするための/ 30分の遠心分離によってTE。
- 氷の上に新しい予め冷却し、1.5 mlチューブでクリア細胞ライセート(上清)を収集します。セルのすべてのグループの収穫のプロトコルを繰り返します。測定タンパク質BCAアッセイを使用して、すべてのライセート試料中の濃度、および500μgの推奨最小値で、正確に等しい総タンパク質を持っている細胞のグループからすべてのライセートサンプルの音量を正規化します。 500μlの全体積にLB + 50mMのNEMで、すべてのサンプルを補充して下さい。
- 溶解物サンプルのそれぞれに標的タンパク質に対して向け、一次抗体の1から5μgを追加します。一晩4抗体溶解液混合試料℃をうなだれる
以前に5を用いて説明し、欲望のために成長したとして*初代ラット海馬ニューロンは、ニューロンのB27サプリメントを含む無血清培地中で、6ウェル皿に約250,000細胞/ウェルの密度で培養すべきである成熟度を達成するために、時間の長さdは、一般的に14から16日間·イン · ビトロ (DIV)。全タンパク質の500μgの最小は正常に免疫沈降し、通常6ウェル皿の2-3井戸を必要とするターゲット神経タンパク質をビオチン化することをお勧めします。
2。抗体が結合した標的タンパク質の沈殿
- 標的タンパク質を沈殿させると固定化する前に、タンパク質、またはプロテインG-セファロースコーティングされたビーズの50%スラリーを準備します。具体的には、すべてのサンプルは、ビーズの同量を持っていることを確認し、1.5 mlチューブにサンプルあたりセファロースビーズの≥60μlを添加する。機器が使用可能な場合、磁性ビーズも適している。
- 各抗体溶解液試料に50%スラリーの等量を追加し、4℃で≥1時間うなだれる℃、
3。アシル-ビオチン為替:ヒドロキシルアミン(HAM)の胸の谷間
- 手順2.2を実行している間、二の溶解緩衝液(LB)と管の数を準備fferentのpH。 pHは、これらの手順のために非常に重要であり、常にpHメーターを用いて調整されるべきである。 LBのサンプルあたりのpHは7.2、サンプルあたりの厳格なバッファ( 表1)の0.5ミリリットルの2ミリリットルを用意します。また、ステップ1.1から1.3に示すように、サンプルあたり0.5 mlのLB + 10mMのNEMを準備します。ステップ1.1のように、すべての溶解バッファーにPMSFおよびプロテアーゼ阻害剤の錠剤を追加します。
- ヒドロキシルアミン(HAM)とは、その開裂パルミチン酸のシステインからビオチン化( 図1)に必要とされる強力な還元剤であり、HAMの切断の不作為は、ネガティブコントロールとして機能します。 2サンプル、HAMの切断工程(-HAM)を省略1、およびHAMステップ(+ HAM)などのいずれかにビーズの各サンプルを分割します。 HAMの治療によって引き起こされるタンパク質の分解のために正規化するには、1は、+、HAMの治療のために使用される-HAMの制御に使用されるビーズは、残りの2/3の1/3、3分割に各サンプルを分割する必要があります。
- 追加の準備1。各サンプルの-HAMコントロールとしてラベル氷上で5 mlチューブ、。ステップ2.2に続いて、穏やかに4℃(この速度、持続時間、特に断らない限り、すべての残りの手順のための温度で遠心分離機)で0.5 XG / 1分で、すべてのサンプル 'ビーズを遠心分離し、氷の上にチューブを配置し、上清を除去し、 LB + 10mMのNEMの600μlのビーズを再懸濁する。
- 溶解バッファー+ NEM 10mmの再懸サンプル "ビーズの後、直ちに氷上にそのサンプルの-HAMのチューブに200サンプルのライセートビーズスラリーの添加、および放電を収集します。各試料中の500μlの合計は、+ HAMサンプルにLB +-HAMサンプルに10mMのNEM、追加100μlの液追加300を追加します。氷上で10分間チューブをインキュベートする。
- 再懸濁する(洗う)-HAMと+ HAMサンプルそっと0.5ミリリットル厳しいバッファを持つ、サンプルあたり。長くSDSのインキュベーションはから結合した抗体の除去になりますように、迅速に、このステップを実行しビーズ。
- そっとのLB液(pH7.2)を0.5ml /サンプルのすべてのサンプルを三回洗って、ステップ3.2bのように、洗浄の間にスピンダウンします。
- ステップ3.5を実行している間、HAMバッファ( 表1)を作成します 。 0.5ミリリットルのLB液(pH7.2)、一人当たり+ HAMの試料の体積の1Mの最終濃度を達成するために、新しいチューブにヒドロキシルアミン溶液の適切なボリュームを追加します。常に実験の日のために新鮮なHAMバッファを準備します。すべての-HAMサンプル、およびすべての+ HAMサンプルへHAM緩衝液0.5ml /サンプルにLBのpH 7.2の0.5ミリリットル/サンプルを追加します。
- 室温(RT)で1時間のすべてのサンプルをうなだれる。 1時間を超えないようにしてください。
4。アシル-ビオチン為替:ビオチン-BMCCラベリング
- ステップ3.6を実行している間は、ステップ3.1のように、サンプルあたりのLB pHを6.2( 表1)、2 mlを準備します。必要になるまで氷上でのLB pHを6.2に配置します。また、使用直前にビオチン-BMCC( 表1)のストック溶液を調製します。 exacを秤量ビオチン-BMCCのTLY 2.1ミリグラム、1.5 mlチューブに集め、ゆっくりと8mmの濃度を(粉を分割するピペットを使用していない達成するために、RTでロッキングプラットフォーム上に配置することにより、0.5ミリリットルジメチルスルホキシド(DMSO)に溶解)。
- 3.6ステップが完了すると、静かに残留HAMバッファを削除するには、pHを6.2溶解バッファーで一度ビーズを洗浄。上清を除去し、サンプルを氷上に置きます。
- ビオチン-BMCCはシステインの遊離チオール基( 図1)に対して高い親和性を有する共役maliemideビオチン分子である。ステップ4.2を実行している間、5μM〜0.5μMの間の作業濃度のサンプルあたりのビオチン-BMCCバッファ( 表1)、0.5mlの準備をします。 5μMの濃度を超える可能性が高い標的蛋白質6飽和し、典型的に超えてはならないが、これは所望の標的タンパク質に応じて異なる場合があります。各サンプルにビオチン-BMCC緩衝液0.5mlを追加し、&4で丁度1時間うなだれる度、C. 1時間を超えないようにしてください。
5。ビオチン結合標的タンパク質とSDS-PAGEの溶出
- 4.3ステップが完了したら、優しくしたLB pHを6.2に一度、すべてのサンプルを洗う。洗浄の間に氷の上で、すべてのサンプルを保持します。 -20°C貯蔵から無還元剤( 表1)と2×SDSサンプルバッファーを外し、ゆっくりと氷の上で解凍します。
- ゆっくりしたLB(pH7.5)にサンプルを三回洗浄+ PMSF /阻害剤、および洗浄の間でサンプルを氷上で保管してください。
- チューブの底に残っているバッファーでスラリー中に沈殿させたビーズを残して、第三の洗浄の上清を取り除きます。スラリーを通してチューブの一番下に小径チップ(ゲルローディングチップまたはP2ピペットチップでも十分です)とピペットを浸し、すぐに任意のビーズを取ることをしないように注意して、任意のバッファの残りのデータを収集します。
- 5mmの最終濃度を達成するために、DL-ジチオスレイトール(DTT)と2×SDSサンプルバッファーを補足するものです。加える2×サンプルバッファー40から50μL+各サンプルに5mMのDTT。必要であれば、渦ビーズが完全にサンプルバッファーと混合し、直ちに試料緩衝液中に浸漬ペレット内のすべてのビーズを収集するために高速で遠心する。
- 75から80℃で10分間、全てのサンプルを沸かす℃に完全にビーズを沈殿16,000≥10ベンチトップのmin、遠心XG / 3分間室温に冷却し、サンプルをみましょう。
- 西部は、SDS-PAGE 7を使用して 、ブロッティングに適したポリアクリルアミドゲル内の単一の車線に各試料から溶出されたタンパク質(上清)を完全にボリュームを追加します。単一サンプルの-HAM制御溶離液と+ハムの溶離液をSDS-PAGE(図2)の間にお互いにすぐ隣接して実行されるように、すべてのサンプルを整理します。 SDS-PAGE後、PVDFまたはニトロセルロース膜に移します。
6。ブロッティングと標的タンパク質のパルミトイル化の検出西部
- ステップ5.6が完了した後、メンブレンを洗浄2回に分けて、RTでロッキングプラットフォーム上で10分間生理食塩水(TBS 1x)をトリス緩衝。
- TBS 1xのボリュームで3%の重量を達成するために、(BSA)、ウシ血清アルブミンを秤量することにより非特異的標識を遮断するブロッキングバッファーを準備+完全に水没膜をするのに十分であるTween-20を0.05%(TBS-T) 。ストレプトアビジンは、ブロッティングのために、常にBSAでブロックしていない粉ミルク。ロッキングプラットフォーム上で室温で1時間、膜をブロックします。
- TBS-Tで+0.3%BSAの抗体溶液を調製します。ストレプトアビジン-HRP抗体追加1:5,000-1:10,000で希釈し、蒸留水で1 mg / mlの、で再構成した。一度ステップ6.2が終了し、10分間、TBS-Tで一度メンブレンを洗浄し、4℃で一晩、室温で1時間のどちらかのためにロッキングプラットフォーム上でストレプトアビジン抗体溶液に膜をインキュベートするか、
- ロッキングプラットフォーム上で10分間メンブレンをTBS-Tで3回洗浄する。パルミトイル化シグナルを検出するためには、化学を用いてHRPの発光を公開iluminescent基質キット。
- 免疫沈降させ、目的のタンパク質の量にパルミトイル化レベルを正常化するために、RTでロッキングプラットフォーム上で5〜10分間ウェスタンブロットストリッピングバッファーを用いた膜を取り除くことにしました。もともと免疫沈降のために使用された目的のタンパク質に対する一次抗体を用いて6.4 - 6.1の手順を繰り返します。
- 画像解析ソフトウェアを使用して、目的のタンパク質のパルミトイル化を定量化し、免疫沈降したタンパク質の量にパルミトイル化レベルを正規化します。
結果
IP-阿部アッセイは、特に基質タンパク質に沿ってシステイン残基のチオール-パルミトイル化を検出し、 図1に示された方法で免疫沈降された神経細胞のタンパク質のパルミトイル化を検出するために使用することができます。 HAM( 図1)を用いて免疫沈降神経タンパク質の治療は続いてウエスタンブロット法を用いて検出することができる新たに利用可能なチオール基にビオチン-BMCCの特異的な取り込みを可能にする、パルミチン酸とシステインのチオール基との間にチオエステル結合を切断する。 HAM(マイナスHAM)の開裂の省略はプラスHAMサンプルの特定パルミトイル-ビオチンのネガティブコントロールとしてビオチン-BMCCと機能の取り込みを防ぐため、常に西側はプラス-HAMサンプルに隣接実行する必要がありますSDS-PAGE( 図2)によってブロッティング。
最適化された実験( 図2A)、パルミトイル化で神経タンパク質のδ-カテニン2の信号は、容易に並列マイナスとプラス-HAMサンプルに対して、HRPで標識ストレプトアビジンを用いて、1μMの濃度でビオチン-BMCCブロット法により検出することができる。 δ-カテニンのための特定のパルミトイル化信号が唯一プラス-HAMサンプルでは、160kDのその予測サイズで表示されます。この信号の特異性は、当初予測された同じサイズで両方HAM治療法の信号で、その結果、それを免疫沈降するために使用された特異的抗体でのδ-カテニンのためのプロービングにより確認された。 IP-阿部アッセイ( 図2A)の最適化には プラス-HAMサンプルから容易に区別されるマイナスHAMサンプルのウェスタンブロットプロファイルになり、無パルミトイル化信号に最小限の展示になります。
パルミトイル化システインを標識するために用いたビオチン-BMCCの濃度は、慎重な最適化が必要であり、双方向の超飽和濃度の場合otin-BMCCが見えるようになります阿部化学工程( 図2B)、過剰なバックグラウンドや非特異的シグナルの間に使用されます。ビオチン-BMCCを使用パルミトイル神経タンパク質、α7ニコチン性アセチルコリン受容体、ビオチン化のための線形応答曲線は以前に6を決定し、5〜10μMの濃度で完全に飽和近くを示してきた。ビオチン-BMCCの最適濃度はわずかに神経標的タンパク質に応じて異なることがありますが、5μMの過剰の濃度のビオチン-BMCCによる治療は、おそらく目に見える背景とウェスタンブロットプロファイル内の標的タンパク質、結果を超飽和状態になりと非特異的シグナル。ビオチン-BMCCは0.5μMの濃度は、以前のSNAP-25を含む他の神経細胞のタンパク質のパルミトイル化を検出するために使用した、チンチン、AMPA受容体サブユニットGluA1とGluA2、とparalemmin 8、小説のための最適な濃度の決定標的タンパク質は、私たちがここで説明することを0.5から5μMの範囲で始めて、直線的に試行錯誤することによって達成することができる。結果としてストレプトアビジンウェスタンブロットプロファイルの間では、δ-カテニンパルミトイル化のためにマイナスとプラス-HAMサンプルは、不適切なビオチン化が発生したことを示し、異なるサイズ、で追加の背景信号と、4μMのビオチン-BMCC( 図2B)で処理したときに同じように見えます。
ヒドロキシルアミンは、チオエステル結合の効率的な開裂に加えて、標的タンパク質の限定分解の結果、その強力な還元剤である。その結果、阿部化学の最適化は、マイナスとプラス-HAMサンプル( - 3.3ステップ3.2)に使用される免疫沈降されたタンパク質の量を正常化するために1つを必要とする。正規化は、実際には区別できないウェスターもたらすプラス対マイナスHAM試料中に固定化された標的タンパク質の二量の使用を必要とするδ-カテニン( 図2A、B)に示すように、n、標的タンパク質のプロファイルをブロット。固定化された標的タンパク質の量はマイナスとプラス-HAMサンプル間で正規化されていない場合は、プラスHAMサンプル中の標的タンパク質の結果ウェスタンブロットシグナルがδ-カテニンのために示されているように、失われる可能性がありますときに等量のタンパク質は、HAMの治療法( 図2C)の両方で使用されていた。
パルミトイル化タンパク質を標識するための阿部化学の特異性は非常に敏感であり、最適化が必要です。 IP-阿部アッセイ中に遭遇する一般的な落とし穴は次善図2B及び図2Cに示された結果、一般的に古い試薬および緩衝液によって引き起こされるHAMの治療や、誤ったpHに依存せず、標的タンパク質の分解を含む。これらの落とし穴を回避し、次善の阿部化学に必要な試薬の鮮度と濃度を補正するために表1に記載されているバッファは常に検討されるべきであり、すべてのバッファのpH調整は常に実験を実行する前にチェックする必要があります。
| バッファ | 作業濃度 | 注釈 | |
| のLysis Buffer(LB) | 1パーセントIGEPAL CA-630、50mMのトリス-HCl pH7.5 150mMのNaCl、10%グリセロール:蒸留H 2 O中 | N / A | 4で実験や店舗前に準備°C |
| NEMのソリューション | NEMの凍結乾燥粉末:100%EtOH中 | 2 M | 使用直前に、新鮮な準備をします。 |
| 厳しいバッファ | 10mMのMEM 0.1%のSDS(ポンド) | N / A | 使用直前に調製し、氷上で保存する。 |
| LBのpHは7.2 | LB中:正確に7.2にpHを調整 | N / A | 使用直前にpHを調整するpH計を使用しています。 |
| HAMのバッファ | ストックHAM液:LBのpHは7.2で | 1 M(最終HAM濃度) | 使用直前に準備します。 |
| LBのpHを6.2 | LB中:正確に6.2にpHを調整する | N / A | LBのpHが7.2の場合と同じ |
| 株式ビオチン-BMCCソリューション | 2.1 mgのビオチン-BMCC液:DMSO中 | 8mMの | 使用直前に準備します。 |
| ビオチン-BMCCバッファ | LBのpHは6.2で:ビオチン-BMCCソリューションを追加 | 1から5μM(最終濃度ビオチン-BMCC) | 使用直前に準備します。 |
| 2X SDSサンプルバッファー、ノー還元剤 | 5%SDS、5%グリセロール125mmのトリス-HCl pH6.8で0.01%ブロモフェノールブルー:蒸留H 2 O中 | N / A | 実験では、使用時まで-20℃で保存する前に準備します。使用前に5mMのDTTで補う。 |
表1。 IP-阿部アッセイに必要なバッファーと試薬。溶解バッファーの多くは阿部化学の成功を確実にするために、pH計で使用する前に、pHをチェックし、すぐに調整されるべきであるが、実験を始める前に準備することができます。ストック溶液の大部分は、使用直前に、全ての実験のために新たに調製しなければならない。バッファーの多くは生化学のために装備最も研究所に共通の試薬を必要とし、ベンダー情報を持つ特殊試薬は試薬や機器の表に記載されている。
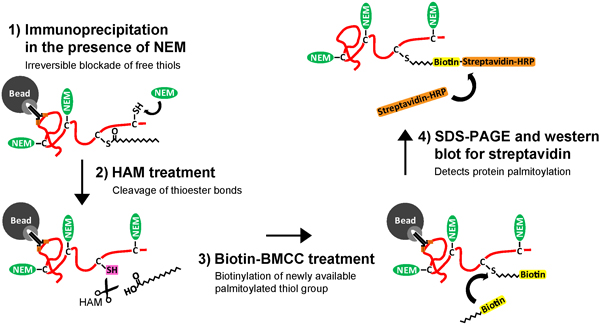
図1。神経タンパク質のパルミトイル化を浄化し、検出するために免疫沈降およびアシル-ビオチン所(IP-ABE)アッセイの概略。培養海馬神経細胞が溶解される、(1)標的タンパク質は、その後、標的に特異的な抗体を用いて精製し、セファロースに固定化されているプロテインGまたはA精製した標的タンパク質でコーティングされたビーズは、その後、(2)不可逆的に変更されていないシステイン(C)に沿って遊離チオール(-SH)基を結合してブロックし、N-ethylmaliemide(NEM)で処理する。標的タンパク質は、その後、(3)パルミトイル化システインと無料パルミトイル化チオール基(-SH)のマスキングでのチオエステル結合の特異的切断、その結果、ヒドロキシルアミン(HAM)での治療が施されている。次に、標的タンパク質は、(4)treateですパルミトイル化システインの特定のビオチン化をもたらしチオール反応性ビオチン分子、ビオチン-BMCCとD。最後に、(5)のビオチン化標的タンパク質を溶出した抗体とビーズから除去されます。ビオチンでタグ付けされ、そのパルミトイル化システイン(s)と標的タンパク質は今や、SDSポリアクリルアミドゲル電気泳動(SDS-PAGE)、および精製された神経タンパク質のパルミトイル化を検出するために、ストレプトアビジンとウェスタンブロッティングに適しています。 拡大図を表示するにはここをクリック 。
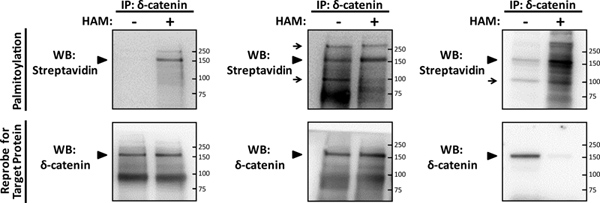
図2。 IP-阿部アッセイを用いて神経タンパク質のδ-カテニンのパルミトイル化の検出。初代ラット海馬ニューロンは、事前に成長させたviously、14DIVで満期まで130細胞/ mm 2の密度で、5説明次に溶解し、最近同定された神経細胞のパルミトイル化基板は、δ-カテニン2のパルミトイル化を検出するために、IP-阿部アッセイに供した。 δ-カテニン(標的タンパク質)の精製された免疫は(IPS)のサンプルあたりのδ-カテニン抗体(BD伝達研究所)5μgを用いて単離された、パラレルマイナスとプラスヒドロキシルアミン(HAM)をSDS-PAGEに供したサンプル。パルミトイル化は、西洋ではストレプトアビジン-HRP(パルミトイル)と(WB)ブロッティングにより検出した、膜を剥がし、δ-カテニンのために再プローブWBに供した。 (A)は、パルミトイル化、δ-カテニンのために最適化された代表的なIP-阿部結果(矢印)は、IPサンプルからチオールパルミトイル化タンパク質を検出するための阿部化学の特異性を示す、1μMビオチン-BMCCで処理した。 (B)のサブ最適REPREδ-カテニンのためsentative IP-阿部結果、4μMのビオチン-BMCCの過剰濃度はマイナスとプラス-HAM両方のサンプル(矢印)で非特異的シグナルとバックグラウンドで、その結果、使用されていた場所。 (C)は、ビオチン-BMCCの過度の4μMの濃度が使用されたδ-カテニン、およびプラスHAM IPのサンプルに使用されるタンパク質の量のための別のサブ最適の代表IP-ABE WBはHAM-A仲介のために正規化されませんでしたδ-カテニンのための再プローブのWBで失われた信号で得られたタンパク質の分解は、。 拡大図を表示するには、ここをクリックしてください 。
ディスカッション
ここに提示され、IP-阿部アッセイは、ほとんどが標準的な生化学的方法を用いて、初代培養海馬神経細胞におけるパルミトイル化タンパク質を検出するための簡便で高感度な方法である。これは、すでにウェスタンブロッティング材料装備ラボのためのアッセイを簡単に適応できる。 IP-阿部アッセイは迅速に基質タンパク質にパルミチン酸のレベルを検出するために、前述の阿部化学2月4日に続いて1の標的タンパク質を分離し、固定化するための標準的な免疫沈降プロトコルを組み合わせたものです。阿部技術は大規模パルミトイル-プロテオミクスグローバルパルミトイル化プロファイルのスクリーニング、および単一の標的タンパク質のパルミトイル化レベルの迅速な検出を含む、種々の組織および細胞株でパルミトイル化タンパク質を調べるためのアプリケーションの広い範囲を持っています。
阿部化学の前の説明では、異なる方法で細胞溶解および神経protの界面活性剤抽出を利用してきたeins 2,9、遊離チオール-封鎖10、11、ビオチン、実験の用途に応じて標的タンパク質4の精製。それらの細胞膜に向かっターゲティング、標的タンパク質のパルミトイル化画分の検出におけるニューロンタンパク結果にパルミチン酸を添加すると、これらの膜からの抽出が必要になります。前述の阿部方法論は、所望の標的タンパク質を抽出し、イオン9および非イオン性界面活性剤8のさまざまなを利用していると、特定の洗剤の使用は、標的タンパク質とその既知の膜輸送に依存しています。ここでは、非変性および非イオン性界面活性剤は私たちがパルミトイル神経タンパク質のδ-カテニン( 図2)の抽出および検出のために検証していパルミトイル化タンパク質を抽出するIGEPAL CA-630を利用しています。 IGEPAL CA-630の構造はしないかさばるし、硬質の非極性頭部基を含むネイティブなタンパク質の立体構造や相互作用を破壊するが、それによって、それらに混和性を付与し、その抽出を可能にして、膜関連タンパク質の疎水性領域との関連付けを可能にする。シナプス膜またはシナプスのシナプス後密度に局在する多くの神経タンパク質はIGEPAL CA-630を使用して抽出する必要がありますが、いくつかは完全に可溶化しない可能性があり、持ってトリトンX-100のような別の非変性洗剤の使用を必要とするかもしれません以前阿部化学2,8のために利用されて。
阿部化学のいくつかの説明もまた、タンパク質精製4のさまざまな手段を必要とするビオチンHPDP(サーモサイエンティフィック)と呼ばれる私たちがここで説明する分子は、異なるチオール反応性ビオチン化試薬を利用してきた。ビオチンHPDPは、構造的にD maliemideリンカーアーム内にジスルフィド結合を含む別のチオール反応、maliemide共役ビオチン分子であるこのジスルフィド結合が含まれていませんビオチン-BMCC、からそれをifferentiating。ビオチンHPDPによるタンパク質の無料またはパルミトイル化システインのチオールビオチン化に続いて、標的タンパク質とビオチン基との間に生じるジスルフィド結合は、ビオチンを作って、ビオチン基を放出し、その変更されていない形態のタンパク質を再生成するための試薬を低減することにより切断することができるビオチンHPDP過渡的かつ可逆で。したがって、このビオチン化試薬の使用は、例えばストレプトアビジンでコーティングされたビーズのような固定化アビジン試薬による標的タンパク質の精製を必要とします。しかし、ビオチン-BMCCによる標的タンパク質のチオールビオチン、私たちがここで説明するように、安定的かつ比較的永続的であり、抗体標的に対して向けられた、とセファロースビーズ上に固定化することにより、標的タンパク質の精製を必要とする。 ABEのテクニック以前に大規模な画面用に利用されている、単一タンパク質2、8-10、12、のパルミトイル化の検出の両方私たちがここで説明するIP-阿部アッセイは、単一ニューロンの標的タンパク質のパルミトイル化を迅速に検出するための最適です。
携帯パルミトイル化の圧倒的多数はシステインのチオール基(我々は、このプロトコルで "パルミトイル化"として一般化、S-パルミトイル化と呼ばれる)へのパルミチン酸の可逆的付加を伴う、タンパク質のしかし非常に限られたグループはグリシンで不可逆的なパルミトイル化に供されると安定したアミド結合の形成を介してシステイン残基は、N-パルミトイル13と呼ばれる。阿部化学の一つの制限は、アミド結合の安定性に、N-パルミトイル化によりを検出することができない点であるので、パルミトイル化のための新規標的タンパク質のスクリーニングは、3H-パルミチン酸代謝標識1を使用して確認されるべきである。
前述したように、IP-ABEアッセイが容易にTRANを含む複数のソースからのタンパク質抽出にパルミトイル化を検討するために適合させることができる異種細胞株、初代組織、および複数の脳領域からの一次ニューロン培養をsfected。 IP-ABEアッセイは、基底の条件下で培養されたニューロンのシナプス蛋白上で動的パルミチン酸の離職率を調べるために、10の標的タンパク質8に沿ってパルミトイル化システインの位置を識別するために変異システインツーセリンタンパク質のパルミトイル化の充足を調べるために利用されているおよび神経タンパク質のパルミトイル化レベルの変化は、神経活動9の誘導に従う。 IP-阿部アッセイの感度と適応性は、神経細胞のタンパク質のパルミトイル化プロファイルを調べ、パルミトイル化のダイナミックな変化を検出するための最適なため、それが理想的に適しています。
開示事項
特別な利害関係は宣言されません。
謝辞
この作品は、ヘルスリサーチMOP-81158のカナダの協会からの補助金によって支えられている。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名称 | 会社 | カタログ番号 | 注釈 |
| IGEPAL CA-630 | シグマ | I8896 | |
| PMSF | フルカ | 93482 | |
| プロテアーゼインヒビターカクテル | ロシュコンプリートミニ | 11 836 153 001 | |
| NEM | シグマ | E3876 | |
| HAMのソリューション | シグマ | 46780から4 | |
| BCAタンパク質アッセイキット | サーモサイエンティフィック | 23225 | 選択された洗剤との互換性を確保 |
| プロテインG /コーティングされたセファロースビーズ | GEヘルスケア | 17から6002-35 | |
| ビオチン-BMCC | サーモサイエンティフィック | 21900 | |
| ストレプトアビジン-HRP | サーモサイエンティフィック | 21126 | 水中で1 mg / mlの再構成 |
| ウエスタンブロットストリッピングバッファー | サーモサイエンティフィック | 21059 |
参考文献
- Fukata, Y., Fukata, M. Protein palmitoylation in neuronal development and synaptic plasticity. Nat. Rev. Neurosci. 11, 161-175 (2010).
- Kang, R., et al. Neural palmitoyl-proteomics reveals dynamic synaptic palmitoylation. Nature. 456, 904-909 (2008).
- Drisdel, R. C., Green, W. N. Labeling and quantifying sites of protein palmitoylation. Biotechniques. 36, 276-285 (2004).
- Wan, J., Roth, A. F., Bailey, A. O., Davis, N. G. Palmitoylated proteins: purification and identification. Nat. Protoc. 2, 1573-1584 (2007).
- Xie, C., Markesbery, W. R., Lovell, M. A. Survival of hippocampal and cortical neurons in a mixture of MEM+ and B27-supplemented neurobasal medium. Free Radic. Biol. Med. 28, 665-672 (2000).
- Drisdel, R. C., Alexander, J. K., Sayeed, A., Green, W. N. Assays of protein palmitoylation. Methods. 40, 127-134 (2006).
- Eslami, A., Lujan, J. W. e. s. t. e. r. n. Blotting: Sample Preparation to Detection. J. Vis. Exp. (44), e2359 (2010).
- Huang, K., et al. Neuronal palmitoyl acyl transferases exhibit distinct substrate specificity. FASEB J. 23, 2605-2615 (2009).
- Noritake, J., et al. Mobile DHHC palmitoylating enzyme mediates activity-sensitive synaptic targeting of PSD-95. J. Cell Biol. 186, 147-160 (2009).
- Thomas, G. M., Hayashi, T., Chiu, S. L., Chen, C. M., Huganir, R. L. Palmitoylation by DHHC5/8 Targets GRIP1 to Dendritic Endosomes to Regulate AMPA-R Trafficking. Neuron. 73, 482-496 (2012).
- Hayashi, T., Thomas, G. M., Huganir, R. L. Dual palmitoylation of NR2 subunits regulates NMDA receptor trafficking. Neuron. 64, 213-226 (2009).
- Ho, G. P., et al. S-Nitrosylation and S-Palmitoylation Reciprocally Regulate Synaptic Targeting of PSD-95. Neuron. 71, 131-141 (2011).
- Iwanaga, T., Tsutsumi, R., Noritake, J., Fukata, Y., Fukata, M. Dynamic protein palmitoylation in cellular signaling. Prog. Lipid Res. 48, 117-127 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved