Method Article
Обнаружение белка Palmitoylation в культуре нейронов гиппокампа на Иммунопреципитация и ацил-биотин бирже (ABE)
В этой статье
Резюме
Обратимые добавлением пальмитат с белками является важным регулятором внутриклеточных белков торговли. Это представляет особый интерес в нейронах, где много синаптические белки palmitoylated. Мы используем простой биохимический метод для обнаружения palmitoylated белков в культивируемых нейронах, которые могут быть адаптированы для различных типов клеток и тканей.
Аннотация
Palmitoylation это пост-трансляционной модификации липидов с участием крепление 16-углеродной насыщенные жирные кислоты, пальмитат, чтобы остатков цистеина субстрата белков через лабильный тиоэфир связь [отзывы в 1]. Palmitoylation подложки белка повышает его гидрофобность, и, как правило облегчает торговлю на клеточные мембраны. Недавние исследования показали, palmitoylation одним из наиболее распространенных липидных модификаций в 1 нейронами, 2, предполагая, что пальмитат оборота является важным механизмом, с помощью которого эти клетки регулируют адресности и торговли белков. Идентификации и обнаружения palmitoylated субстратов может поэтому лучше нашего понимания белка торговли в нейронах.
Обнаружение белка palmitoylation в прошлом был технически затруднено из-за отсутствия консенсуса между подложкой последовательности белков, а также опора на метаболические labeliнг пальмитоил-белки с 3 H-пальмитат, времени биохимического анализа с низкой чувствительностью. Развитие ацил-биотин бирже (ABE) анализ позволяет более быструю и высокую чувствительность обнаружения palmitoylated белки 2-4, и является оптимальным для измерения динамических оборот пальмитата на нейрональных белков. Анализ ABE состоит из трех биохимических этапов (рис. 1): 1) необратимой блокады немодифицированных группы тиоловых цистеина использованием N-ethylmaliemide (NEM), 2) специфическое расщепление и разоблачение тиоловых групп palmitoylated цистеина путем гидроксиламина (HAM), и 3) селективная маркировки palmitoylated цистеина помощью тиоловых-реактивного биотинилирование реагента, биотин-BMCC. Очистка тиол-биотинилированных белков после ABE шаги были различны, в зависимости от общей цели эксперимента.
Здесь мы опишем метод, чтобы очистить palmitoylated белка в первичном гиппокампадр. нейронов начальной иммунопреципитации (IP) шаг, используя антитела, направленные против белков, а затем с помощью анализа ABE и западных промокательной непосредственно измерить palmitoylation уровня этого белка, который называется IP-ABE анализа. Низкая плотность культур эмбриональных нейронов гиппокампа крысы были широко используется для изучения локализации, функции и торговли нейронов белки, что делает их идеально подходит для изучения нейронных palmitoylation белка использованием IP-ABE анализа. IP-ABE анализа основном требуется стандартный IP и западных промокательной реагентов и ограничивается только наличием антител против целевой подложки. Этот анализ может быть легко адаптирована для очистки и обнаружения трансфицированных palmitoylated белков в клеточных культурах гетерологичного, первичных нейронов культур, полученных из различных тканей мозга мыши и крысы, и даже первичная ткань мозга сама.
протокол
1. Добыча целевого белка из культивируемых первичных нейронов гиппокампа
- Перед уборкой эндогенного белка из первичных клеток гиппокампа, подготовить буфер для лизиса (LB; табл. 1) с ингибиторами протеазы. К 10 мл буфера для лизиса, добавить 0,1 мл phenylmethanesulfonyl раствор фторида (PMSF) до конечной концентрации 10 мМ, и добавить 1 ингибитора протеазы коктейль таблетки.
- Подготовка N-этилмалеимид (NEM) решения (табл. 1) из лиофилизированного порошка. Мягко растворить в 100% этанола при комнатной температуре (RT). Всегда готовьте свежее решение NEM на день эксперимента.
- Далее объединить буфера для лизиса и NEM. Добавить 0,5 мл 2М раствора NEM в свежем 50 мл коническую трубку. Добавить 20 мл LB над верхней, и быстро месту LB + NEM (конечная концентрация 50 мМ) на качающейся платформе при 4 ° С, чтобы полностью перемешать в течение 5 мин. Всегда добавляйте NEM / EtOH решения первой и второй LB, чтобы правильно смешивать два.
- Удалить культивируемых нейронов из инкубатора и место на льду *. Аккуратно удалите сотовой средства массовой информации, и осторожно мыть дважды с холодным фосфатным буферным раствором (PBS) 1x. Добавить 300 мл LB + 50 мм NEM в первую лунку нейронов гиппокампа, а также лом клеток с использованием одноразовых спортсмена клетки. Сбор клеточный лизат, а затем разрядить лизат в следующий же этой группы. Очистите клеток в течение второго и использовании ячейки спортсмена, собирать, и повторить с помощью третьей хорошо, если это необходимо для дальнейшей концентрации лизата.
- Сбор клеточный лизат в предварительно охлажденную (на льду), 1,5 мл трубки микроцентрифуге. Повторите шаг 1,4 с использованием 100 мкл LB + 50 мм NEM собрать оставшиеся лизат клеток. Передайте общего лизат клеток через 26 ½ калибровочного шприца 5-6 раз, чтобы помочь в механическую лизис, будьте осторожны, чтобы не пускать мыльные пузыри в раствор. Можно вместо разрушать ультразвуком в течение 15 секунд на льду, если оборудование. Клеточный лизат колебаться в течение ≥ 30 мин при 4 ° C.
- Уточнить клетки ЛысаяТе центрифугированием при 16000 мкг / 30 мин для того, чтобы гранулы не-лизированных клеток и моющих средств нерастворимого материала.
- Сбор очищены клеточный лизат (супернатанта) в новом предварительно охлажденный 1,5 мл пробирку на льду. Повторить урожай протокол для всех групп клеток. Измерение концентрации белка во всех лизатов образцов с использованием BCA анализа и нормализации объема всех лизатов образцов из группы клеток, чтобы в точности равна общего белка, рекомендуется не менее 500 мкг. Долить все образцы с LB + 50 мм NEM до 500 мкл общего объема.
- Добавить 1-5 мкг первичного антитела, направленные против белка-мишени для каждой из лизата образца. Кивать антитело-лизат смешанных образцов в течение ночи при 4 ° C.
* Первичная гиппокампа крыс нейроны должны быть культивировали при плотности около 250.000 клеток / лунку в 6-луночных блюдо, в бессывороточной среде, содержащей B27 нейронов добавки, как описано выше 5, и выращивали в течение желанияD отрезка времени, обычно 14-16 дней, в пробирке (DIV), чтобы достичь зрелости. Не менее 500 мкг общего белка рекомендуется успешно иммунопреципитации и biotinylate целевой нейронов белки, которые обычно требуется 2-3 скважины 6-а блюдо.
2. Осадки из антиген-антитело белка-мишени
- Перед осаждения и иммобилизации белка-мишени, готовить 50% суспензии белка или белка G-покрытием бисера сефарозе. В частности, добавить ≥ 60 мкл сефарозе бисера на пробу в пробирки на 1,5 мл, убедившись, что все образцы имеют равное количество бусин. Магнитные шарики также подходит, если оборудование.
- Добавить равный объем 50% суспензии для каждого антитела лизата образца, и колебаться в течение ≥ 1 ч при 4 ° C.
3. Ацил-биотин Exchange: гидроксиламина (HAM) Расщепление
- При выполнении шага 2.2, подготовить ряд труб с буфером для лизиса (LB) диfferent рН. РН является очень важным для этих шагов и всегда должны быть скорректированы с помощью рН-метра. Подготовьте 2 мл LB рН 7,2 на пробу, и 0,5 мл буфера Строгие в образце (табл. 1). Также подготовить 0,5 мл LB + 10 мМ NEM на образец, как в шагах 1.1-1.3. Добавить PMSF и таблетках ингибитор протеазы для всех лизис буфера, как в пункте 1.1.
- Гидроксиламина (HAM) является мощным восстановителем, которые расщепления пальмитат из цистеина необходим для биотинилирование (рис. 1), и бездействие HAM расщепления служит в качестве отрицательного контроля. Сплит каждого образца из бисера на два образца, один опуская HAM шаг расщепления (-HAM), в том числе и один HAM шагом (+ HAM). Для нормализации для деградации белка вызвано HAM лечения, следует разделить каждую пробу в третьих, с 1/3 из бусин используются для управления-HAM, а оставшиеся 2/3 используется для лечения HAM +.
- Подготовить дополнительные 1.5 мл труб на льду, помечены как HAM-контроль для каждого образца. Следующим шагом 2,2, мягко центрифуги бисер всех образцов "на уровне 0,5 мкг / 1 мин при 4 ° C (центрифуг на такой скорости, продолжительности и температуры для всех остальных шагов, если не указано иное), разместите трубы на льду, удалить супернатант, и повторно приостанавливать бисером в 600 мкл LB + 10 мМ NEM.
- После повторного приостановления образцы "бусины в буфере для лизиса + NEM 10мм, немедленно собрать 200 мкл лизатов-шарик суспензии образца, и разряд в эту образца-HAM пробирку на льду. Добавить дополнительные 300 мкл LB + 10 мМ NEM к образцу-HAM, и дополнительно 100 мкл на образец + HAM на общую сумму в 500 мкл каждого образца. Инкубировать пробирки в течение 10 минут на льду.
- Повторное приостановить (мыть)-ХАМ и образцы + HAM мягко 0,5 мл строгие буфера, на пробу. Выполните этот шаг быстро, так как больше SDS инкубации приведет к удалению связанного антитела сбисером.
- Осторожно промыть все образцы три раза в 0,5 мл / образец LB рН 7,2, и спином вниз между промывками, как в шаге 3.2b.
- При выполнении шага 3.5, подготовить HAM буфера (табл. 1). Добавить соответствующий объем раствора гидроксиламина в новую пробирку, для достижения конечной концентрации 1 М в объеме 0,5 мл LB рН 7,2, в + HAM образца. Всегда готовьте HAM буфера свежей в течение дня эксперимента. Добавить 0,5 мл / образец LB рН 7,2 для всех-HAM образцов и 0,5 мл / образец HAM буфер для всех образцов + HAM.
- Кивать всех образцов в течение 1 часа при комнатной температуре (RT). Не превышать 1 час.
4. Ацил-биотин Exchange: биотин-BMCC маркировки
- При выполнении шага 3.6, подготовить 2 мл LB рН 6,2 в образце (табл. 1), как и в шаге 3.1. Поместите LB рН 6,2 на льду пока нет необходимости. Также приготовьте раствор из биотин-BMCC (табл. 1) непосредственно перед использованием. Взвесить exacTLY 2,1 мг Биотин-BMCC, собирают в 1,5 мл трубки и аккуратно растворить в 0,5 мл диметилсульфоксида (ДМСО), поместив на качающейся платформе при комнатной температуре, чтобы достичь концентрации 8 мм (не используйте пипетку, чтобы разбить порошок ).
- После шагом 3,6 завершена, аккуратно мыть раз в бисер рН 6,2 буфере для лизиса, чтобы удалить остатки буфера HAM. Удалить супернатант и поместить образцы на льду.
- Биотин-BMCC является maliemide сопряженной молекуле биотина, который имеет высокое сродство к бесплатным тиоловых групп цистеина (рис. 1). При выполнении шага 4.2, подготовить 0,5 мл Биотин-BMCC буфера (табл. 1) в образце, в рабочей концентрации от 0,5 до 5 мкм. Концентрациях, превышающих 5 мкм, скорее всего, насыщать белка-мишени 6, и, как правило, не должны превышаться, однако это может отличаться в зависимости от желаемого целевого белка. Добавить 0,5 мл Биотин-BMCC буфера для каждого образца, и кивать ровно 1 ч при 4 &град; C. Не превышать 1 час.
5. Элюирование Биотин-сопряженных белка-мишени и SDS-PAGE
- После шагом 4,3 завершена, аккуратно вымыть всех образцах один раз в LB рН 6,2. Храните образцы на льду между стирок. Удалить 2x SDS буфера для образца, не восстановителей (табл. 1) от -20 ° C хранения и медленно таять на льду.
- Осторожно промыть Образцы три раза в LB рН 7,5 + PMSF / ингибиторы, и сохранить образцы на льду между стирок.
- Удалить супернатант третьего мытья, оставив гранулированный бусины в виде суспензии с остальными буфера в нижней части трубы. Опустите пипетку с малым диаметром наконечника (чаевых гель погрузки или кончиком пипетки P2 достаточно) в самой нижней части трубы через суспензию, и быстро собрать оставшиеся буфера, будучи осторожным, чтобы не занимать любые бусы.
- Дополнение 2x образец SDS буфера с DL-Dithiothreitol (DTT) для достижения конечной концентрации 5 мм. Добавлять40-50 мкл 2х буфера для образцов + 5 мМ DTT для каждого образца. Если необходимо, вихрь бисера, чтобы полностью смешать с буфером для образца, и сразу же центрифуги на высокой скорости, чтобы собрать все бусины в гранулах, погруженная в образце буфера.
- Варить все образцы в течение 10 мин при 75-80 ° C. Пусть образцы охлаждают до комнатной температуре в течение ≥ 10 мин на скамейке сверху, и центрифуге при 16000 мкг / 3 мин, чтобы полностью гранул бисера.
- Добавить полном объеме Элюированную белка (супернатант) из каждого образца к одной полосе в полиакриламидном геле подходит для вестерн-блоттинга, используя SDS-PAGE 7. Организовать все образцы, так что-HAM элюента контроля и элюента + HAM для одного образца выполняются непосредственно примыкающих друг к другу во время SDS-PAGE (рис. 2). После SDS-PAGE, передать PVDF или нитроцеллюлозные мембраны.
6. Вестерн-блоттинга и выявление Palmitoylation целевого белка
- После шагом 5,6 завершена, мыть мембраныДважды в трис-буферном растворе (TBS 1x) в течение 10 мин на качающейся платформе при комнатной температуре.
- Подготовка блокирующего буфера, чтобы блокировать неспецифические маркировки путем взвешивания бычьего сывороточного альбумина (БСА), чтобы достичь 3% веса в объеме TBS 1x + Твин-20 0,05% (TBS-T), что является достаточным, чтобы полностью погрузиться мембраны . Для стрептавидин блоттинга, всегда блокировать с BSA, а не сухое молоко. Блок мембраны в течение 1 часа при комнатной температуре на качающейся платформе.
- Подготовка антитела решения TBS-T + 0,3% BSA. Добавить стрептавидин-HRP антител восстановленного в дозе 1 мг / мл в дистиллированной воде, разбавленной в 1:5,000-1:10,000. После шагом 6,2 завершена, мыть мембраны раз в TBS-T в течение 10 мин, затем инкубировать мембраны в раствор антител Стрептавидин на качающейся платформе либо в течение 1 часа при комнатной температуре или в течение ночи при 4 ° C.
- Вымойте мембраны три раза в TBS-T в течение 10 мин на качающейся платформе. Для того, чтобы обнаружить palmitoylation сигнал, подвергать люминесценции HRP использованием химическихiluminescent Комплект подложки.
- Для того, чтобы нормализовать palmitoylation уровней на сумму интерес белка, который был иммунопреципитировали, лишить мембраны использованием вестерн-блот зачистки буфера в течение 5-10 мин на качающейся платформе при комнатной температуре. Повторите шаги 6,1 - 6,4 с использованием первичных антител против белка интереса, который изначально использовался для иммунопреципитации.
- Количественная palmitoylation белка интереса с использованием программного обеспечения для анализа изображений, нормализуют palmitoylation уровней на сумму иммунопреципитации белков.
Результаты
IP-ABE анализа конкретно определяет тиол-palmitoylation остатков цистеина вдоль подложки белков, и могут быть использованы для обнаружения palmitoylation из иммунопреципитации нейронов белки таким образом, изображенной на рисунке 1. Лечение иммунопреципитации нейронов белки с ветчиной (рис. 1) расщепляет тиоэфир связь между пальмитат и тиоловой группы цистеина, что позволяет для конкретного включения биотин-BMCC на вновь доступны тиоловых групп, которые могут быть впоследствии обнаружены с помощью вестерн-блоттинга. Бездействие HAM (минус-HAM) расщепления предотвращает включение биотин-BMCC и функций в качестве отрицательного контроля для конкретных пальмитоил-биотинилирования плюс-HAM образца, и поэтому должны всегда работать рядом с плюс-HAM образцом для западных блоттинга на SDS-PAGE (рис. 2).
В оптимизированных эксперимента (рис. 2а), palmitoylationСигнал нейронов белки δ-катенина 2 может быть легко обнаружен блоттинга для биотин-BMCC в концентрации 1 мкМ, с помощью стрептавидин сопряженных с HRP, против параллельной минус-и плюс-HAM образцов. Определенный сигнал palmitoylation для δ-катенина появляется на его предсказать размер 160kD, только в плюс-HAM образца. Специфика этот сигнал был подтвержден reprobing для δ-катенина с конкретными антитела, которые изначально предназначался для иммунопреципитации его, в результате чего сигнал в обоих HAM лечения, в то же предсказал размер. Оптимизация IP-ABE анализа (рис. 2A) приведет к западной промокательной профиль минус-HAM образца, который легко отличить от плюс-HAM образца, и обладает минимальным, чтобы не palmitoylation сигнала.
Концентрация биотина BMCC используется для обозначения palmitoylated цистеина требует тщательной оптимизации, и если супер-насыщающей концентрации биОтин-BMCC используется в химии ABE шагов (рис. 2В), чрезмерные фон и неспецифические сигналы будут видны. Линейную кривую ответа на биотинилирования palmitoylated нейронов белки, α7 никотинового рецептора ацетилхолина, используя биотин-BMCC ранее были определены 6, и показывает почти полное насыщение при концентрации 5-10 мкМ. Хотя оптимальная концентрация биотина BMCC будет несколько отличаться в зависимости от нейронов белка-мишени, лечение с биотин-BMCC в концентрации более 5 мкм, скорее всего, супер-насыщения белка-мишени, и в результате западной профиль пятно с видимым фоном и неспецифические сигналы. Концентрации 0,5 мкМ для биотин-BMCC был ранее использован для обнаружения palmitoylation других нейронов белки, включая SNAP-25, гентингтина, АМРА подразделений GluA1 и GluA2, и paralemmin 8, и определение оптимальной концентрации для романабелка-мишени может быть достигнуто путем проб и ошибок в линейном порядке, начиная в диапазоне 0.5-5 мкм, что мы описываем здесь. В результате стрептавидин вестерн-блот профилей среди минус-и плюс-HAM образцов для δ-катенина palmitoylation кажутся похожими, когда обрабатывали 4 мкМ биотин-BMCC (рис. 2В), с дополнительными сигналами фона в различных размерах, что свидетельствует о нарушении биотинилирование произошло.
Гидроксиламин является мощным восстановителем, что приводит к ограниченной деградации белка-мишени, в дополнение к его эффективному расщеплению тиоэфир связи. Следовательно, оптимизация ABE химии требует от одного до нормализации количества иммунопреципитации белков используются для минус-и плюс-HAM образцов (шаг 3,2 - 3,3). Нормализация требует использования двойного количества иммобилизованного белка-мишени в плюс по сравнению с минус-HAM образца, который фактически приводит к неотличимы западныйп-блоттинга профили для белка-мишени, как показано на δ-катенина (рис. 2A, B). Однако, если количество иммобилизованного белка-мишени не нормируется между минус-и плюс-HAM образцов, полученный западной сигнал пятном для целевого белка в плюс-HAM образцы могут быть потеряны, как показано на δ-катенина при равных количествах белки были использованы в обоих HAM лечения (рис. 2).
Специфика ABE химии для маркировки palmitoylated белки очень чувствительна и требует оптимизации. Распространенных ошибок, возникших в ходе IP-ABE анализа включают суб-оптимальные результаты показаны на рис 2Б и 2В, и деградации белка-мишени, независимо от HAM лечение, которое, как правило, вызваны старше реагентов и буферов, и неправильный рН. Для того, чтобы избежать этих ошибок и исправлять неоптимальной химии ABE, свежести и концентрации реагентов, необходимых длябуферы приведены в таблице 1 всегда должно быть рассмотрено, и рН настройки все буферы всегда должны быть проверены перед запуском эксперимента.
| Буфер | Рабочая концентрация | Комментарии | |
| Буфера для лизиса (LB) | В дистиллированной H 2 O: 1% IGEPAL CA-630 50 мМ Трис-HCl, рН 7,5 150 мМ NaCl, 10% глицерина | N / A | Подготовка перед экспериментом и хранить при 4 ° C |
| Решение NEM | В 100% EtOH: NEM лиофилизированный порошок | 2 M | Подготовить свежие, непосредственно перед применением. |
| Строгие буфера | В LB: 10 мМ MEM 0,1% SDS | N / A | Подготовка непосредственно перед использованием, держать на льду. |
| LB рН 7,2 | В LB: Отрегулируйте рН до 7,2 раз | N / A | Использование рН-метра для регулирования рН непосредственно перед употреблением. |
| HAM буфера | В LB рН 7,2: Фото со HAM решения | 1 M (конечная концентрация HAM) | Подготовка непосредственно перед употреблением. |
| LB рН 6,2 | В LB: Отрегулируйте рН до 6,2 раз | N / A | То же, что и для LB рН 7,2 |
| Со биотин-BMCC решение | В ДМСО: 2,1 мг Биотин-BMCC решения | 8 мМ | Подготовка непосредственно перед употреблением. |
| Биотин-BMCC буфера | В LB рН 6,2: Добавить биотин-BMCC решения | 1 - 5 мкМ (конечная биотин-BMCC концентрации) | Подготовка непосредственно перед употреблением. |
| 2х SDS буфера для образца, не восстановителей | В дистиллированной H 2 O: 5% SDS 5% глицерина 125 Трис-HCl, рН 6,8 0,01% Bromophenol синий | N / A | Подготовка перед экспериментом, и хранить при температуре -20 ° С до использования. Дополнение 5 мМ DTT перед использованием. |
Таблица 1. Буферы и реагенты, необходимые для IP-ABE анализа. Многие из лизис буфера могут быть подготовлены до начала эксперимента, однако рН должна быть проверена и скорректирована непосредственно перед использованием с помощью рН-метра, чтобы обеспечить успех химии ABE. Большинство фондовых решения должны быть подготовлены свежей для каждого эксперимента, непосредственно перед применением. Многие из буфера требует реагентов, общих для большинства лабораторий, оснащенных для биохимии и специальных реагентов с поставщиком информации, перечисленные в таблице реактивов и оборудования.
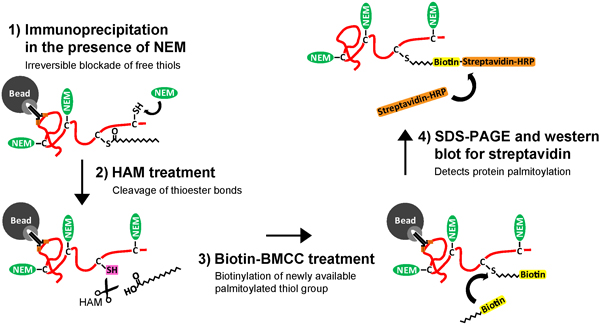
Рисунок 1. Схема Иммунопреципитация и ацил-биотин бирже (IP-ABE) анализа для очистки и обнаружения palmitoylation нейронов белки. Искусственный нейронов гиппокампа лизируются, (1) белка-мишени, затем очищают, используя мишень-специфических антител, иммобилизованных на сефарозе гранул, покрытых белком G и А. очищенной целевой белок является то (2) обрабатывают N-ethylmaliemide (NEM) необратимо связывается и блокирует свободный тиол (-SH) группы по немодифицированных цистеина (С). Белка-мишени, затем (3) подвергались лечению с гидроксиламин (HAM), в результате специфического расщепления тиоэфир облигаций на palmitoylated цистеина и разоблачение бесплатно palmitoylated тиоловой группы (-SH). Далее, белка-мишени (4) treateD с тиол-реактивных молекул биотин, биотин-BMCC, в результате конкретной биотинилирования palmitoylated цистеина. И, наконец, (5) биотинилированного белка-мишени вымывают и удаляют из антитела и шарик. Белка-мишени с palmitoylated цистеина (ы) с тегом биотин сейчас подходят для SDS поли-акриламида гель-электрофореза (SDS-PAGE) и вестерн-блоттинга с стрептавидином для обнаружения palmitoylation очищенной нейронов белки. Нажмите, чтобы увеличить рисунок .
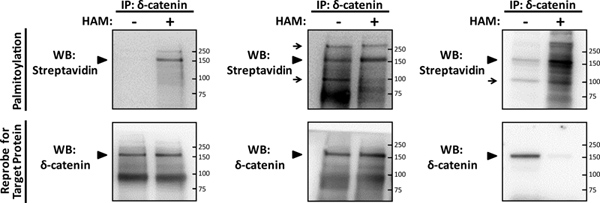
Рисунок 2. Обнаружение palmitoylation нейронных белка δ-катенина использованием IP-ABE анализа. Первичная гиппокампа крыс нейроны были выращены в качестве предварительногоviously описал 5, при плотности 130 клеток / мм 2 до погашения в 14DIV, затем лизируются, и подвергаются IP-ABE анализа для выявления palmitoylation из недавно идентифицированных нейронов palmitoylated подложки, δ-катенина 2. Очищенный иммунопреципитатах (КП) из δ-катенина (белка-мишени) были выделены с использованием 5 мкг δ-катенин антитела в образце (лабораторий BD Transduction), а затем подвергали SDS-PAGE в параллельном минус-и плюс-гидроксиламина (HAM) образцам. Palmitoylation был обнаружен вестерн-блоттинга (ВБ) со стрептавидин-HRP (palmitoylation), и мембрана была раздета и подвергают reprobe ВБ для δ-катенина. (A) оптимизированный представителя IP-ABE результат для palmitoylated δ-катенина (стрелки) обрабатывают 1 мкМ биотин-BMCC, иллюстрирующие специфику ABE химии для обнаружения тиол-palmitoylated белков из IP образцов. (B) неоптимальной предтель IP-ABE результат для δ-катенина, где избыточной концентрации 4 мкМ биотин-BMCC был использован, в результате неспецифических сигналов и фона в обоих минус-и плюс-HAM образцов (стрелки). (C) Еще один неоптимальной представителя IP-ABE ВБ для δ-катенина, где чрезмерная 4 мкМ концентрация биотина BMCC был использован, и количество белка, используемого для плюс-HAM IP выборка не была нормирована для HAM-опосредованной деградации белков, в результате чего потери сигнала в reprobe ВБ для δ-катенина. Нажмите, чтобы увеличить показатель .
Обсуждение
IP-ABE анализа, представленные здесь, простой и очень чувствительный метод для обнаружения palmitoylated белков в культивируемых первичных нейронов гиппокампа, который обычно используется для стандартных биохимических методов. Это делает анализ легко адаптируется для лабораторий уже оснащены западных промокательной материалов. IP-ABE анализа сочетает в себе стандартный протокол иммунопреципитации, чтобы изолировать и обездвижить своего белка-мишени, а затем описанной ранее ABE химии 2-4 для быстрого выявления уровня пальмитата на подложке белка. Техника ABE имеет широкий спектр применения для изучения palmitoylated белков в различных тканях и клеточных линий, в том числе крупномасштабных пальмитоил-протеомных скрининг глобальных профилей palmitoylation, и быстрое обнаружение palmitoylation уровня одного белка-мишени.
Предыдущее описание ABE химии использовали различные методы лизис клетки и моющие средства извлечения нейронов прот2 Eins, 9, свободный тиол-блокады 10, 11, биотинилирование и очистки целевого белка 4, в зависимости от применения эксперимента. Кроме того пальмитата в нейронных результаты белки в их таргетинг на клеточные мембраны, и обнаружение palmitoylated доля белка-мишени будет требовать его извлечения из этих мембран. Ранее описанный ABE методологии использовались различные ионные 9 и неионные детергенты 8 до извлечения желаемого белков-мишеней, а также использование конкретного моющего средства зависит от белка-мишени и ее известные мембраны с торговлей людьми. Здесь мы используем неденатурирующем и неионогенных моющих средств IGEPAL CA-630 для извлечения palmitoylated белки, которые мы утверждена для добычи и обнаружения palmitoylated нейронов белки δ-катенина (рис. 2). Структура IGEPAL CA-630 включает в себя громоздкой и жесткой неполярных головной группы, которые ненарушать нативную конформацию белка или взаимодействий, но позволяет его связь с гидрофобными участками мембранных белков, связанных, тем самым присвоении смешиваемость с ними и позволяет их добычи. Многие нейронов белки локализованы в постсинаптической мембраны или пост-синаптические плотность синапсов должны быть извлечены при помощи IGEPAL CA-630, однако некоторые из них не может полностью растворить, и может потребовать использования различных неденатурирующем моющих средств, как Тритон Х-100, который имеет ранее использована для ABE химия 2, 8.
Несколько описаний ABE химии также используются различные тиол-реактивного биотинилирование реагента от молекулы мы описываем здесь, называется биотин-HPDP (Thermo Scientific), которая также требует различных способов очистки белков 4. Биотин-HPDP другой тиол-реактивный, maliemide конъюгированных биотин молекула, которая содержит дисульфидные связи в maliemide руку компоновщик, структурно-Differentiating его из биотин-BMCC, которые не содержат этот дисульфидных связей. После тиол-биотинилирования бесплатно или palmitoylated цистеина белка по биотин-HPDP, в результате дисульфидные связи между белком-мишенью и группа биотина может быть расщеплены за счет сокращения реагентов, чтобы освободить биотин группы и регенерации белков в его исходной форме, что делает биотинилирование Биотин по-HPDP переходных и обратимы. Таким образом, использование этого реагента биотинилирование требует очистки целевого белка авидина иммобилизованных реагентов, таких как покрытых стрептавидином шарики. Тем не менее, тиол-биотинилирования целевого белка биотин-BMCC, как мы описываем здесь, является стабильной и относительно постоянной, и требует очистки целевого белка антитела, направленные против цели, и иммобилизованными на сефарозе бисера. Оба ABE методы были ранее использованы для крупномасштабного экраны, и обнаружение palmitoylation одного белков 2, 8-10, 12 иIP-ABE анализа мы опишем здесь является оптимальной для быстрого обнаружения palmitoylation одного нейрона белки-мишени.
Подавляющее большинство сотовых palmitoylation связано с обратимой добавлением пальмитата в тиоловой группой цистеина (называется S-palmitoylation, которые мы обобщаем как «palmitoylation» в этом протоколе), однако очень ограниченная группа белков подвергается необратимым palmitoylation на глицин и остатков цистеина посредством формирования стабильной амидных связей, называемых N-palmitoylation 13. Одним из ограничений ABE химии является ее неспособность обнаружить N-palmitoylation благодаря стабильности амидной связи, и поэтому показ новой белка-мишени для palmitoylation должно быть подтверждено с помощью 3Н-пальмитат метаболических маркировке 1.
Как упоминалось ранее, IP-ABE анализ может быть легко адаптирована для изучения palmitoylation в белковых экстрактов из различных источников, в том числе переходsfected гетерологичных клеточных линий, основной ткани и первичных нейронов культур из различных областей мозга. IP-ABE анализа была использована для изучения palmitoylation достаточности мутировал цистеин-на-серин белков для определения местоположения palmitoylated цистеина по белку-мишени 8, для изучения динамической оборот пальмитата в синаптических белков в культивируемых нейронов в базальных условиях 10, и изменения в palmitoylation уровне нейронов белки после индукции нейронной активности 9. Чувствительность и адаптируемость IP-ABE анализа делают его идеально подходящим для изучения palmitoylation профилей нейронов белки, оптимальные для выявления динамических изменений в palmitoylation.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Эта работа была поддержана грантами от Канадского института исследований в области здравоохранения MOP-восемьдесят одна тысяча сто пятьдесят-восемь.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии |
| IGEPAL CA-630 | Сигма | I8896 | |
| PMSF | Fluka | 93482 | |
| Коктейль ингибитор протеазы | Roche Полное мини | 11 836 153 001 | |
| NEM | Сигма | E3876 | |
| HAM решения | Сигма | 46780-4 | |
| BCA Protein Assay Kit | Thermo Scientific | 23225 | Обеспечение совместимости с выбранным моющим средством |
| Белки G / покрытием бисера сефарозе | GE Healthcare | 17-6002-35 | |
| Биотин-BMCC | Thermo Scientific | 21900 | |
| Стрептавидин-HRP | Thermo Scientific | 21126 | Развести в 1 мг / мл в воде |
| Вестерн-блот зачистки буфера | Thermo Scientific | 21059 |
Ссылки
- Fukata, Y., Fukata, M. Protein palmitoylation in neuronal development and synaptic plasticity. Nat. Rev. Neurosci. 11, 161-175 (2010).
- Kang, R., et al. Neural palmitoyl-proteomics reveals dynamic synaptic palmitoylation. Nature. 456, 904-909 (2008).
- Drisdel, R. C., Green, W. N. Labeling and quantifying sites of protein palmitoylation. Biotechniques. 36, 276-285 (2004).
- Wan, J., Roth, A. F., Bailey, A. O., Davis, N. G. Palmitoylated proteins: purification and identification. Nat. Protoc. 2, 1573-1584 (2007).
- Xie, C., Markesbery, W. R., Lovell, M. A. Survival of hippocampal and cortical neurons in a mixture of MEM+ and B27-supplemented neurobasal medium. Free Radic. Biol. Med. 28, 665-672 (2000).
- Drisdel, R. C., Alexander, J. K., Sayeed, A., Green, W. N. Assays of protein palmitoylation. Methods. 40, 127-134 (2006).
- Eslami, A., Lujan, J. W. e. s. t. e. r. n. Blotting: Sample Preparation to Detection. J. Vis. Exp. (44), e2359 (2010).
- Huang, K., et al. Neuronal palmitoyl acyl transferases exhibit distinct substrate specificity. FASEB J. 23, 2605-2615 (2009).
- Noritake, J., et al. Mobile DHHC palmitoylating enzyme mediates activity-sensitive synaptic targeting of PSD-95. J. Cell Biol. 186, 147-160 (2009).
- Thomas, G. M., Hayashi, T., Chiu, S. L., Chen, C. M., Huganir, R. L. Palmitoylation by DHHC5/8 Targets GRIP1 to Dendritic Endosomes to Regulate AMPA-R Trafficking. Neuron. 73, 482-496 (2012).
- Hayashi, T., Thomas, G. M., Huganir, R. L. Dual palmitoylation of NR2 subunits regulates NMDA receptor trafficking. Neuron. 64, 213-226 (2009).
- Ho, G. P., et al. S-Nitrosylation and S-Palmitoylation Reciprocally Regulate Synaptic Targeting of PSD-95. Neuron. 71, 131-141 (2011).
- Iwanaga, T., Tsutsumi, R., Noritake, J., Fukata, Y., Fukata, M. Dynamic protein palmitoylation in cellular signaling. Prog. Lipid Res. 48, 117-127 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены