Method Article
Immunoprecipitation 및 아실-비오틴 거래소 (아베)에 의한 양식 Hippocampal 뉴런의 단백질 Palmitoylation의 감지
요약
단백질 palmitate의 치료뿐만 아니라이 세포 내 단백질 인신 매매의 중요한 조절기입니다. 이것은 많은 시냅스 단백질이 palmitoylated 아르 뉴런에 특별한 관심입니다. 우리는 여러 세포 유형과 조직에 적용 할 수 있습니다 교양 뉴런에 palmitoylated 단백질을 감지하는 간단한 생화학 방법을 사용합니다.
초록
Palmitoylation는 불안정한 thioester 결합을 통해 기판 단백질의 시스테인 잔류 물에 16 탄소 포화 지방산, palmitate의 첨부 파일을 포함하는 사후 병진 지질 수정입니다 [1 검토]. 기판 단백질의 Palmitoylation은 소수성을 증가 시키며, 일반적으로 세포의 세포막 대한의 거래를 용이하게한다. 최근 연구는 palmitate의 매출이 세포가 단백질의 타겟팅과 거래를 규제하는이 중요한 메커니즘입니다 제안, 뉴런 1, 2에서 가장 일반적인 지질 수정 중 하나 palmitoylation을 보여 주었다. palmitoylated 기판의 식별 및 탐지 따라서 뉴런의 단백질 인신 매매에 대한 우리의 이해를 발전 할 수 있습니다.
과거에 단백질 palmitoylation의 검출은 기술적으로 인해 기판 단백질 간의 합의 순서의 부족에 방해하고, 신진 대사 labeli에 대한 의존도되었습니다3 H-palmitate, 낮은 감도와 시간이 많이 소요되는 생화학 분석과의 NG palmitoyl - 단백질. 아실-비오틴 거래소 (아베) 분석의 개발은 palmitoylated 단백질을 2-4 빠르고 고감도 검출이 가능하고, neuronal 단백질에 palmitate의 동적 매출을 측정하기위한 최적입니다. 아베 분석은 세 생화학 단계 (그림 1)로 구성되어 있습니다 : 1) 수정되지 않은 시스테인 thiol 그룹의 돌이킬 수없는 봉쇄 N-ethylmaliemide (NEM), 2) 특정 절단 및 히드 록실 아민 (햄)로부터 palmitoylated 시스테인의 thiol 그룹의 unmasking을 사용하고, thiol 반응 biotinylation 시약을 사용하여 palmitoylated 시스테인 3) 선택적 라벨, 비오틴 - BMCC. 아베 단계를 수행 thiol-biotinylated 단백질의 정제는 실험의 전반적인 목표에 따라 다릅니다 있습니다.
여기, 우리는 기본 hippocamp의 관심 palmitoylated 단백질을 정화하는 방법을 설명초기 immunoprecipitation (IP) 아베 분석 및 서부 직접 IP-아베 분석을이라고한다되는 단백질의 palmitoylation 수준을 측정 할 수 blotting 다음 단백질, 대한 감독 항체를 사용하여 단계로 야외 뉴런. 배아 쥐 hippocampal 뉴런의 낮은 밀도 문화가 널리 IP-아베 분석을 사용하여 neuronal 단백질 palmitoylation를 공부에이를 이상적으로 적합하고, 현지화, 기능, 그리고 neuronal 단백질의 인신 매매를 연구하는 데 사용되었습니다. IP-아베 분석은 주로 표준 IP와 서양 blotting 시약을 필요로하며, 대상 기판에 대한 항체의 가용성에 의해 제한됩니다. 이 분석을 쉽게 heterologous 셀 문화, 마우스 및 쥐 모두의 다양한 뇌 조직에서 파생 된 기본 neuronal 문화, 심지어는 주요 뇌 조직 자체 transfected palmitoylated 단백질의 정화 및 검출을위한 적응 할 수 있습니다.
프로토콜
1. 양식 기본 Hippocampal 뉴런에서 대상 단백질의 추출
- 단백 분해 효소 억제제로, 기본 hippocampal 세포 내생 단백질을 수확하기 전에 용해 완충액 (표 1 LB)를 준비합니다. 용해 버퍼의 10 ML에, 10mM의 최종 농도에 0.1 ML의 phenylmethanesulfonyl 불화 솔루션 (PMSF)를 추가, 1 프로테아제 억제제 칵테일 태블릿을 추가합니다.
- 동결 건조 된 분말에서 N-ethylmaleimide (NEM) 솔루션을 (표 1) 준비합니다. 부드럽게 실온 (RT)에 100 % EtOH에 용해. 항상 실험 날짜에 신선한 NEM 솔루션을 준비합니다.
- 다음 용해 버퍼와 NEM 조화를 이루고 있습니다. 신선한 50 ML 원뿔 튜브에 200 NEM 솔루션의 0.5 ML를 추가합니다. 상위 20여 ML의 LB, 빠르게 장소 LB를 추가합니다 4에 흔들 플랫폼 ° C가 완전히 5 분에 혼합에 + NEM (50mM의 최종 농도). 항상 제대로 두 혼합 할 수 있도록, NEM / EtOH 솔루션 첫 번째와 LB 초를 추가합니다.
- 보육과 얼음의 *의 장소에서 배양 된 뉴런을 제거합니다. 부드럽게 세포 미디어를 제거하고 부드럽게 감기에 인산을 두 번 씻어 염분 (PBS) 1X는 버퍼. 일회용 휴대 리프터를 사용하여 hippocampal 뉴런, 그리고 흠집 셀의 첫 번째 우물 LB 300 ML + 50mM NEM을 추가합니다. 세포 lysate를 수집 한 다음 해당 그룹의 다음 잘에 lysate를 방전. 셀 리프터를 사용하여 잘 두 번째 내에서 세포를 긁어 수집, 그리고 더 lysate을 집중하기 위해 필요한 경우, 세 번째도를 사용하여 반복합니다.
- 예비 냉각 (얼음), 1.5 ML의 microcentrifuge 튜브에 세포 lysate를 수집합니다. 남아있는 세포 lysate를 수집하는 LB 100 μl + 50mM NEM을 사용하여 1.4 단계를 반복합니다. 솔루션에 거품을 날려 버리지 않도록 조심하는 것 기계 용해에 도움 26 ½ 게이지 주사기 5-6 시간을 통해 총 세포 lysate를 전달합니다. 장비를 사용할 수있는 경우 하나는 대신 얼음에 15 초에 sonicate 수 있습니다. 4 ° C.에서 ≥ 30 분에 세포 lysate를 Nutate
- 셀 lysa을 명확히테 순서에 따라 펠릿을 취소 lysed 세포와 세제 - 불용성 물질로 16,000 XG / 30 분에서 원심 분리에 의해.
- 얼음에 새로운 미리 냉각 1.5 ML 튜브에 세포 lysate (표면에 뜨는)를 해제 수집합니다. 셀의 모든 그룹에 대한 수확 프로토콜을 반복합니다. 측정 단백질 BCA 분석을 사용하는 모든 lysate 샘플의 농도, 500 μg의 권장 최소 정확히 같은 총 단백질을 가지고 세포의 그룹에서 모든 lysate 샘플의 볼륨을 정상화. 모든 샘플 LB + 50mM NEM 500 μl 전체 볼륨을 맨.
- lysate 시료의 각 대상 단백질에 대한 감독 차 항체의 1-5 μg을 추가합니다. 4에 밤새 항체 - lysate 혼합 샘플 ° C.를 Nutate
* 기본 쥐 hippocampal 뉴런은 B27 neuronal 보충제를 포함하는 혈청이없는 미디어 / 잘 6 잘 접시에 약 250,000 세포의 밀도에 배양해야 이전과 욕망에 대해 5 설명하고, 성장시간의 d 개의 길이, 성숙을 달성하기위한 일반적 14~16일 인 체외 (DIV). 총 단백질 500 μg의 최소 성공적으로 immunoprecipitate 일반적으로 6 잘 접시로부터 2-3 우물을 필요로하는 대상 neuronal 단백질을 biotinylate하는 것이 좋습니다.
2. 항체 바인딩 된 대상 단백질의 강수량
- 대상 단백질을 precipitating과 immobilizing하기 전에, 단백질, 또는 단백질 G-코팅 세 파로스 비즈의 50 % 슬러리를 준비합니다. 특히, 모든 샘플은 구슬의 동등한 양을 수 있도록, 1.5 ML 튜브에 샘플 당 세 파로스 비즈 ≥ 60 μl를 추가합니다. 장비를 사용할 수있는 경우 자기 구슬도 적합합니다.
- 각 항체 - lysate 샘플의 50 % 슬러리의 동일한 볼륨을 추가, 4에서 ≥ 1 시간에 nutate ° C.
3. 아실 - 비오틴 교류 : 히드 록실 아민 (햄) 절단
- 단계 2.2을 수행하는 동안, 디의 용해 버퍼 (LB)와 튜브의 수를 준비fferent PHS. pH는 다음과 같이 매우 중요하며 항상 산도 측정기를 사용하여 조정해야합니다. LB 샘플 당 산도 7.2, 및 샘플 당 엄격한 버퍼 (표 1)의 0.5 ML의 2 ML을 준비합니다. 또한 단계 1.1-1.3에서와 같이, 0.5 ML의 LB에게 샘플 당 + 10mM NEM을 준비합니다. 단계 1.1에서와 같이, 모든 용해 버퍼에 PMSF 및 프로테아제 억제제의 정제를 추가합니다.
- 히드 록실 아민 (햄)는 그의 절단 palmitate의 cysteines에서 biotinylation (그림 1)가 필요합니다 강력한 환원제이다, 그리고 햄 절단의 누락이 대조군 역할을합니다. 샘플 두개, 햄 절단 단계를 (-햄) 생략 하나, 햄 단계 (+ 햄)를 포함 하나에 구슬의 각 샘플을 분할. 햄 치료로 인한 단백질의 저하에 정상화하기 위해, 하나는 - 햄 제어에 사용되는 구슬의 1 / 3과 3 가지로 각각의 샘플을 분할하고, 나머지 3분의 2는 + 햄 치료에 사용됩니다.
- 추가 1 준비합니다.각 샘플에 대한 - 햄 제어로 분류 얼음 5 ML 튜브. 단계 2.2 후, 부드럽게 4 ° C (이 속도, 기간 및 달리 명시되지 않은 모든 나머지 단계 온도에서 원심 분리기)에서 0.5 XG / 1 분에 모든 샘플 '구슬을 원심 분리기, 얼음에 튜브를 삽입, 표면에 뜨는을 제거하고 LB + 10mM NEM 600 μl의 구슬을 다시 일시 중지합니다.
- 용해 버퍼 + NEM 10mM에서 다시 일시 중지 샘플 '구슬 후, 즉시 얼음에 그 샘플의 - 햄 관에 200 샘플의 lysate - 비즈 슬러리의 μl, 그리고 퇴원를 수집합니다. LB의 추가 300 μl + - 햄 샘플에 10mM NEM, 각 샘플 500 μl의 총 + 햄 샘플에 대한 추가 100 μl를 추가합니다. 얼음에 10 분 동안 튜브를 품다.
- 다시 일시 중지 (세탁) - 햄과 + 햄 샘플을 부드럽게 0.5 ML 엄격한 버퍼와, 샘플 당. 더 이상 SDS의 부화가에서 바인딩 된 항체의 제거 될 것이기 때문에 빨리이 단계를 수행구슬.
- 부드럽게 LB의 산도 7.2의 0.5 ML / 샘플의 모든 샘플을 세 번 씻어하고, 단계 3.2b에서와 같이 세차 사이에 스핀 다운.
- 단계 3.5을 수행하는 동안, 햄 버퍼 (표 1) 준비합니다. 0.5 ML LB의 산도 7.2, 당 + 햄 샘플의 볼륨에서 1M의 최종 농도를 달성하기 위해, 새로운 튜브로 히드 록실 아민 용액의 적절한 볼륨을 추가합니다. 항상 실험 일의 신선한 햄 버퍼를 준비합니다. 모든 햄 샘플, 모든 + 햄 샘플에 햄 버퍼의 0.5 ML / 샘플에 LB의 산도 7.2의 0.5 ML / 샘플을 추가합니다.
- 실온 (RT)에서 1 시간에 대한 모든 샘플을 Nutate. 1 시간을 초과하지 마십시오.
4. 아실 - 비오틴 교류 : 비오틴 - BMCC 라벨링
- 단계 3.6을 수행하는 동안, LB의 pH를 2 ML을 준비 단계 3.1에서와 같이 샘플 당 6.2 (표 1). 필요한 때까지 얼음에 LB의 pH를 6.2 배치합니다. 또한 사용하기 전에 바로 비오틴 - BMCC (표 1)의 주식 솔루션을 준비합니다. 정확히는를 달다비오틴 - BMCC의 tly 2.1 MG는 1.5 ML 튜브에 수집하고, 부드럽게 필름 농도를 (분말을 깨고 피펫을 사용하지 않는 달성하기 위해, RT에서 흔들 플랫폼에 배치하여 0.5 ML 디메틸 sulfoxide (DMSO)에 용해 ).
- 단계 3.6가 완료되면 부드럽게 잔류 햄 버퍼를 제거하는, 산도 6.2 용해 버퍼에 한 번 구슬을 씻는다. 표면에 뜨는을 제거하고 얼음에 샘플을 배치합니다.
- 비오틴 - BMCC는 cysteines 무료 thiol 그룹 (그림 1)에 대한 높은 친화력을 가지고 maliemide 복합 비오틴 분자입니다. 단계 4.2 수행하는 동안, 5 μM으로는 0.5 μM 사이의 작업 농도에서 샘플 당 비오틴 - BMCC 버퍼의 0.5 ML (표 1) 준비합니다. 5 μm의 초과 농도 가능성이 대상 단백질 6 포화되며, 일반적으로 초과하지 말아야하지만이 원하는 대상 단백질에 따라 다를 수 있습니다. 각 샘플에 비오틴 - BMCC 버퍼의 0.5 ML를 추가하고, 4에서 정확히 1 시간에 nutate℃ 일, C. 1 시간을 초과하지 마십시오.
5. 비오틴 - 복합 대상 단백질과 SDS-PAGE의 용출
- 단계 4.3가 완료되면 부드럽게 LB의 pH를 6.2에 한 번 모든 샘플을 씻는다. 세차 사이에 얼음에 모든 샘플을 보관. -20 ° C 저장로부터 환원제 (표 1) 배 SDS 샘플 버퍼를 제거하고 천천히 얼음을 녹여.
- 부드럽게 LB의 pH를 7.5에서 샘플을 세 번 씻어 + PMSF / 억제제 및 세차 사이에 얼음 샘플을 유지.
- 튜브의 바닥에 남아있는 버퍼와 슬러리의 pelleted 구슬을두고, 세 번째 세척 표면에 뜨는을 제거합니다. 슬러리를 통해 관의 맨 아래에 작은 직경 팁 (겔 로딩 팁이나 P2 피펫 팁은 충분)와 피펫을 찍어, 신속하게 모든 구슬을 차지하지 않도록주의하는 것 남아있는 버퍼를 수집합니다.
- 5mM의 최종 농도를 달성 할 수 DL-Dithiothreitol (DTT)의 2 배 SDS 샘플 버퍼를 보완. 추가각 샘플에 2 배 샘플 버퍼의 40-50 μl가 + 5mM DTT. 필요 소용돌이 구슬이 완전히 샘플 버퍼와 섞어 경우, 즉시 샘플 버퍼에 잠겨 펠릿의 모든 구슬을 수집하는 고속 원심 분리기.
- 75-80시 10 분에 대한 모든 샘플을 삶아 ° C. 완전히 펠릿 구슬로 16,000에서 ≥ 10 벤치 위에 분, 및 원심 분리기 XG / 3 분에 RT로 시원한 샘플을 보자.
- 서쪽은 SDS-PAGE 7을 사용, blotting에 적합한 polyacrylamide 젤에서 단일 차선 각 샘플에서 용출 단백질 (표면에 뜨는)의 전체 볼륨을 추가합니다. 하나의 샘플에 대한 - 햄 제어 eluent와 + 햄의 eluent는 SDS-PAGE (그림 2) 동안 서로에 즉시 옆에 실행되도록 모든 샘플을 구성합니다. SDS-PAGE 후, PVDF 또는 니트로 셀룰로스 막에 전송할 수 있습니다.
6. Blotting 및 대상 단백질의 Palmitoylation의 검색 서양
- 단계 5.6이 완료되면, 멤브레인을 씻어두 번에 RT에서 흔들 플랫폼에서 10 분에 식염 (TBS 1X)를 트리스 버퍼.
- TBS 1X의 볼륨에 3 % 무게를 달성하기 위해, (BSA) 소 혈청 알부민을 무게가 아닌 특정 라벨을 차단하기 위해 차단 버퍼를 준비 + 완전히 잠기 멤브레인을에 충분합니다 초반-20 0.05 % (TBS-T) . streptavidin이 blotting를 들어, 항상 BSA를 차단 아니라 분유. 흔들 플랫폼에서 RT에서 1 시간 동안 멤브레인을 차단합니다.
- TBS-T + 0.3 % BSA의 항체 솔루션을 준비합니다. Streptavidin-HRP 항체 추가 1:5,000-1:10,000에 희석 증류수 1 MG / ML에서 재구성. 일단 단계 6.2이 완료되고, 10 분에 TBS-T에 한 번 멤브레인을 씻고 다음 4 ° C.에 박 RT에서 1 시간에 하나의 흔들 플랫폼에 Streptavidin 항체 솔루션의 멤브레인을 품다, 또는
- 흔들 플랫폼에서 10 분에 TBS-T에 막 세 번 씻으십시오. palmitoylation 신호를 감지하기 위해, 화학을 사용하여 HRP의 발광을 노출iluminescent 기판 키트.
- immunoprecipitated 된 관심 단백질의 양에 palmitoylation 수준을 정상화하기 위해, RT에서 흔들 플랫폼에서 5-10 분 동안 서부 얼룩 잎 버퍼를 사용하여 멤브레인을 제거. 6.4 원래 immunoprecipitation에 사용 된 관심의 단백질에 대한 기본 항체를 사용하여 - 단계 6.1를 반복합니다.
- 이미지 분석 소프트웨어를 사용하여 관심있는 단백질 palmitoylation을 수량화하고, immunoprecipitated 단백질의 양에 palmitoylation 수준을 정상화.
결과
IP-아베 분석은 특별히 기판 단백질을 따라 시스테인 잔류의 thiol-palmitoylation를 감지하고, 그림 1에 묘사하는 방식으로 immunoprecipitated neuronal 단백질의 palmitoylation를 감지하는 데 사용할 수 있습니다. 햄 (그림 1)과 함께이 immunoprecipitated neuronal 단백질의 치료는 이후 서쪽 blotting을 사용하여 검색 할 수있는 새로 사용 가능한 thiol 그룹에 비오틴 - BMCC의 특정 결합을 허용하는, palmitate 및 시스테인의 thiol 그룹 사이의 thioester의 연동을 cleaves. 햄 (마이너스 - 햄) 절단의 누락은 비오틴 - BMCC의 설립 및 더하기 햄 샘플의 특정 palmitoyl - biotinylation에 대한 부정적인 제어 같은 기능을 방지하고, 따라서 항상 서쪽에있는 플러스 기호 (+) - 햄 샘플에 인접 해 실행해야합니다 SDS-PAGE (그림 2)에 의해 blotting.
최적화 실험 (그림 2A), palmitoylation에서neuronal 단백질 δ-catenin 2의 신호는 쉽게 병렬 빼기와 더하기 햄 샘플과 비교, HRP와 복합 streptavidin을 사용하여 1 μm의 농도에서 비오틴 - BMCC에 blotting에 의해 감지 할 수 있습니다. δ-catenin에 대한 특정 palmitoylation 신호는 더하기 햄 샘플에 160kD 자사의 예상 크기에 나타납니다. 이 신호의 특이성은 처음 같은 예측 크기로 모두 햄 트리트먼트의 신호 그 결과를 immunoprecipitate하는 데 사용 된 특정 항체와 δ-catenin에 대한 reprobing에 의해 확인되었다. IP-아베 검정 (그림 2A)의 최적화 더하기 햄 샘플에서 쉽게 구별이 마이너스 - 햄 샘플의 서쪽 blotting 프로필에 결과없이 palmitoylation 신호에 최소한의 전시합니다.
palmitoylated cysteines 라벨을 사용 비오틴 - BMCC의 농도는주의 최적화되어 있어야하고, 경우 양방향의 수퍼 포화 농도otin-BMCC은 아베 화학 단계 (그림 2B), 과도한 배경 및 비 특정 신호를하는 동안 사용되는이 표시됩니다. 비오틴 - BMCC을 사용하여 palmitoylated neuronal 단백질, α7 nicotinic 아세틸 콜린 수용체의 biotinylation을위한 선형적인 응답 곡선은 이전에 6 결정하고, 5-10 μm의 농도에서 완전 채도 근처에 표시되어 있습니다. 비오틴 - BMCC 최적의 농도가 약간 neuronal 대상 단백질에 따라 이탈 않지만, 5 μm의 초과 농도에서 비오틴 - BMCC 치료 가능성이 보이는 배경으로 서부 얼룩 프로필의 대상 단백질, 그리고 결과를 초 포화 것 및 비 특정 신호. 비오틴 - BMCC 0.5 μm의 농도는 이전에 SNAP-25, huntingtin, AMPA 수용체 subunits GluA1와 GluA2, 그리고 paralemmin 8, 소설에 대한 최적의 농도 결정 등 다른 neuronal 단백질의 palmitoylation를 감지하는 데 사용 된대상 단백질은 우리가 여기에 설명하는 0.5-5 μm의 범위 내에서 시작 시행 선형 패션 오류로 수행 할 수 있습니다. 다른 크기, 그 부적절한 biotinylation가 발생 나타냅니다에서 추가 배경 신호 4 μM 비오틴 - BMCC (그림 2B)로 처리 할 때 δ-catenin palmitoylation의 마이너스와 플러스 - 햄 샘플 간의 결과 streptavidin 서양 얼룩 프로필 비슷한 나타납니다.
히드 록실 아민은 강력한 환원제이다 thioester 연동의 효율적 절단에 추가하여 대상 단백질의 제한 저하의 결과가. 따라서, 아베 화학 최적화는 마이너스와 플러스 - 햄 샘플 (- 3.3 단계 3.2)에 사용 immunoprecipitated 단백질의 양을 정상화을 필요로. 정규화는 실제로 구분할 수 wester에 결과 더하기 대비 마이너스 - 햄 샘플에 고정 대상 단백질의 두 양의 사용을 필요로N으로 δ-catenin (그림 2A, B)에 도시 된 바와 같이, 대상 단백질에 대한 프로필을 blotting. 고정 타겟 단백질의 양이 마이너스와 플러스 - 햄 샘플 사이에 표준화되어 있지 않은 경우 그러나, 더하기 햄 예제에서 대상 단백질에 대한 결과 서부 얼룩 신호가 δ-catenin에 도시 된 바와 같이, 손실 될 수있는 경우 동일한 양의 단백질은 두 햄 트리트먼트 (그림 2C)에 사용되었습니다.
palmitoylated 단백질을 라벨에 대한 아베 화학의 특이성은 매우 민감하고 최적화가 필요합니다. IP-아베 분석에 발생한 일반적인 함정은 하위 최적 그림 2B와 2C에 표시된 결과, 일반적으로 나이가 시약 및 버퍼로 인해 발생하는 햄 치료, 그리고 잘못된 산도의 독립적 인 대상 단백질의 저하 등이 있습니다. 이 함정을 방지하고 하위 최적의 아베 화학에 대한 해결하기 위해, 시약의 신선함과 집중이 필요표 1에 나열된 버퍼는 항상 검토해야하고, 모든 버퍼의 pH 조정은 항상 실험을 실행하기 전에 확인해야합니다.
| 버퍼 | 작업 농도 | 코멘트 | |
| 용해 버퍼 (LB) | 1% IGEPAL CA-630 50mM 트리스 - HCL pH7.5 150mM NaCl 10 % 글리세롤 : 소주 H 2 O에서 | N / A | 4에 실험과 매장하기 전에 준비 ° C |
| NEM 솔루션 | NEM 동결 건조 된 분말 : 100 % EtOH에 | 2 M | 바로 사용하기 전에, 신선한 준비합니다. |
| 엄격한 버퍼 | 10 MM 가상 0.1 % SDS : LB에 | N / A | 사용하기 전에 바로 준비, 얼음 계속. |
| LB의 산도 7.2 | LB 년 : 정확히 7.2에 PH를 조정 | N / A | 바로 사용하기 전에 pH를 조정 산도 측정기를 사용하십시오. |
| 햄 버퍼 | 주식 햄 솔루션 : LB의 pH를 7.2에서 | 1 M (최종 햄 농도) | 사용하기 전에 바로 준비합니다. |
| LB 산도 6.2 | LB 년 : 정확히 6.2으로 pH를 조정 | N / A | LB의 산도 7.2에 대한 동일 |
| 주식 비오틴 - BMCC 솔루션 | DMSO에서 : 2.1 MG 비오틴 - BMCC 솔루션 | 8 MM | 사용하기 전에 바로 준비합니다. |
| 비오틴 - BMCC 버퍼 | LB의 산도 6.2에서 : 비오틴 - BMCC 솔루션을 추가 | 1-5 μM (최종 비오틴 - BMCC 농도) | 사용하기 전에 바로 준비합니다. |
| 이X SDS 샘플 버퍼, 아니 환원제 | 5% SDS 5% 글리세롤 125mM 트리스 - HCL 산도 6.8 0.01 % Bromophenol 블루 : 소주 H 2 O에서 | N / A | 사용 할 때까지 -20 ° C에서 실험하고, 저장하기 전에 준비합니다. 사용하기 전에 5 밀리미터 DTT를 보완. |
표 1. IP-아베 분석에 필요한 버퍼를하고 시약. 용해 버퍼의 대부분은 아베 화학의 성공을 보장하기 위해 실험, 그러나 산도을 선택해야하며 산도 측정기와 함께 사용하기 전에 바로 조정을 시작하기 전에 준비 할 수 있습니다. 재고 솔루션의 대부분은 바로 사용하기 전에 모든 실험을 위해 새로운 준비를해야합니다. 버퍼의 대부분은 생화학을위한 시설을 갖추고 대부분의 실험실에 공통적으로 시약을 필요로하고, 공급 업체 정보와 전문 시약은 시약 및 장비의 표에 나열되어 있습니다.
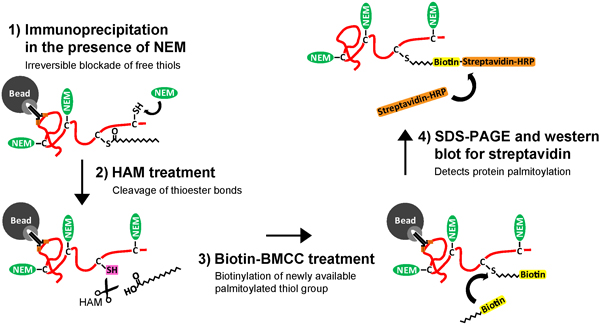
1 그림. neuronal 단백질의 palmitoylation을 정화하고 검색 할 수있는 Immunoprecipitation와 아실-비오틴 거래소 (IP-아베) 분석의 개략적. 양식 hippocampal 뉴런이 lysed 있으며, (1) 대상 단백질은 다음 대상 특정 항체를 사용하여 정제하고, 세 파로스에 고정되어 있습니다 구슬은 정화 대상 단백질 (2)가 돌이킬 바인딩하고 수정되지 않은 cysteines (C) 함께 무료 thiol (-SH) 그룹을 차단하는 N-ethylmaliemide (NEM)로 치료 단백질 G 또는 A.으로 코팅. 대상 단백질 그 다음 (3) palmitoylated cysteines, 무료 palmitoylated thiol 그룹 (-SH)의 unmasking에서 thioester 채권의 특정 절단의 결과로, 히드 록실 아민 (햄)의 치료를 받게됩니다. 다음 대상 단백질 (4) treate입니다palmitoylated 시스테인의 특정 biotinylation의 결과 thiol 반응 비오틴 분자, 비오틴-BMCC과 D. 마지막으로, (5) biotinylated 대상 단백질이 용출하고 항체와 구슬에서 제거됩니다. 비오틴 태그가 자사의 palmitoylated 시스테인 (들)과 대상 단백질은 이제 SDS 폴리 아크릴 아미드 겔 전기 영동 (SDS-PAGE) 및 정화 neuronal 단백질의 palmitoylation에 감지 할 수 streptavidin과 blotting 서쪽에 적합합니다. 큰 그림을 보려면 여기를 클릭하십시오 .
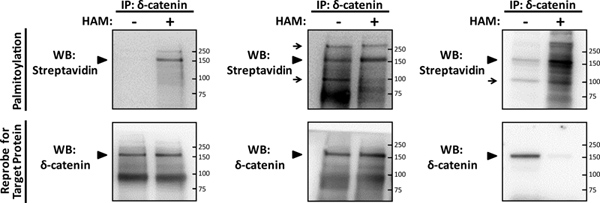
그림 2. IP-아베 분석을 사용하여 neuronal 단백질 δ-catenin의 palmitoylation의 검출은. 기본 쥐 hippocampal 뉴런은 사전으로 성장했다viously, 14DIV에서 성숙까지 130 세포 / mm 2의 밀도에, 5 설명 후 lysed되었고, 최근에 확인 된 palmitoylated neuronal 기판, δ-catenin 2 palmitoylation를 검색 할 IP-아베 검정을 받게. 정화는 (IPS) δ-catenin (타겟 단백질)의를 immunoprecipitates 샘플 당 δ-catenin 항체 5 μg (BD의 도입 실험실)을 사용하여 격리 된 후 병렬 빼기와 더하기 히드 록실 아민 (햄)에 SDS-PAGE를 받게되었습니다 샘플. Palmitoylation는 서부는 streptavidin-HRP (palmitoylation)와 (WB) blotting에 의해 감지 된, 그리고 막은 제거 및 δ-catenin에 대한 reprobe WB를 받게되었습니다. IP 샘플 thiol-palmitoylated 단백질을 검출하기위한 아베 화학의 특이성을 설명 palmitoylated δ-catenin (화살촉) 1 μM 비오틴 - BMCC로 치료에 대한 (A) 최적화 대표 IP-아베 결과입니다. (B) A 하위 최적의 repre모두 마이너스와 플러스 - 햄 샘플 (화살표)에 비 특정 신호와 배경의 결과로 4 μM 비오틴 - BMCC의 초과 농도가 사용 된 δ-catenin, 대한 sentative IP-아베 결과입니다. (C) 비오틴 - BMCC의 과도한 4 μM 농도가 사용 된 δ-catenin, 그리고 더하기 햄 IP 샘플에 사용되는 단백질의 양에 대한 또 다른 하위 최적의 대표 IP-아베 WB는 햄 - 매개을위한 표준화되지 않았습니다 δ-catenin에 대한 reprobe WB의 손실 신호의 결과로 단백질 저하는. 큰 그림을 보려면 여기를 클릭하십시오 .
토론
여기에 제시된 IP-아베 분석은 대부분 표준 생화학 기술을 사용하여, 교양 차 hippocampal 뉴런의 palmitoylated 단백질을 검출하기위한 간단하고 매우 민감한 방법입니다. 이 이미 서쪽 blotting 자료를 갖춘 실험실의 분석이 쉽게 적응합니다. IP-아베 분석이 빠른 속도로 기판 단백질에 palmitate의 수준을 감지 할 수 이전에 설명 된 아베 화학 2-4에 이어 사람의 대상 단백질을 분리하고 고정 할 수있는 표준 immunoprecipitation 프로토콜을 결합합니다. 아베 기술은 대규모 palmitoyl - proteomic 글로벌 palmitoylation 프로필 심사하고, 하나의 대상 단백질의 palmitoylation 수준의 급속한 탐지 등의 다양한 조직 및 세포 라인에 palmitoylated 단백질을 검사 용 응용 프로그램의 다양한 있습니다.
아베 화학 이전 설명은 다른 방법 셀 용해와 neuronal 제자의 세제 추출을 활용 한eins, 2, 9, 무료 thiol-길목 10, 11, biotinylation 및 대상 단백질 4 정화는 실험의 응용 프로그램에 따라 다릅니다. 대상 단백질의 palmitoylated 분수의 자신의 세포 멤브레인 대한 타겟팅 및 감지에 neuronal 단백질 결과 palmitate의 추가는 이러한 멤브레인로부터 추출해야합니다. 이전에 설명 된 아베 방법은 원하는 대상 단백질을 추출 할 이온 9 비 이온 세제 8 다양한 활용 한 결과, 특정 세제의 사용은 대상 단백질과 알려진 막 거래에 따라 달라집니다. 여기, 우리는 활용 비 denaturing 및 비 이온 세제 IGEPAL CA-630 우리가 palmitoylated neuronal 단백질 δ-catenin (그림 2)의 추출 및 검출을위한 검증 한 palmitoylated 단백질을 추출 할 수 있습니다.에게 IGEPAL CA-630의 구조는하지 않습니다 부피가 큰과 강성 비 극 헤드 그룹을 포함기본 단백질 형태 나 상호 작용을 방해하지만,이를 통해 그들에게 혼 화성을 부여하고 추출을 허용, 막 관련 단백질의 소수성 영역과의 연결을 허용하는. 시냅스의 신경 막 또는 포스트 시냅스 밀도로 지역화 많은 neuronal 단백질이 IGEPAL CA-630을 사용하여 추출해야하지만 일부는 완전히 solubilize하지 않을 수 있으며,이 트라이 튼 X-100과 같은 다른 비 denaturing 세제의 사용을 요구할 수 있습니다 이전에 아베 화학 2, 8 사용되어.
아베 화학 몇 가지 설명은 또한 단백질 정제 4 다른 수단을 필요로 비오틴 - HPDP (열 과학)라는 우리가 여기서 설명하는 분자,에서 다른 thiol 반응 biotinylation 시약을 활용하고 있습니다. 비오틴 - HPDP는 구조적으로 D, maliemide 링커 암의 이황화 결합을 포함하는 다른 thiol 반응, maliemide - 복합 비오틴 분자입니다이 이황화 결합을 포함하지 않습니다 비오틴 - BMCC,에서 ifferentiating. 비오틴 - HPDP하여 단백질의 무료 또는 palmitoylated 시스테인의 thiol-biotinylation 후, 대상 단백질과 비오틴 그룹 사이의 결과 이황화 결합은 biotinylation를 만드는 비오틴 그룹을 해제하고 수정되지 않은 형태의 단백질을 생성하기 위해 시약을 줄여 흘리고 할 수 있습니다 비오틴 - HPDP 과도하고 치료하여. 이 biotinylation 시약 이러한 streptavidin-코팅 구슬로 고정 아비딘의 시약에 의한 대상 단백질의 정화가 필요에 따라서 사용합니다. 그러나, 비오틴 - BMCC하여 대상 단백질의 thiol-biotinylation, 우리가 설명으로 안정적이고 상대적으로 영구적이며, 항체 대상에 대한 감독과 세 파로스 구슬에 고정하여 대상 단백질의 정화가 필요합니다. 모두 아베 기술은 이전에 대규모 스크린, 단일 단백질 2, 8-10, 12 palmitoylation의 검출에 활용하고, 한우리가 여기서 설명하는 IP-아베 분석은 하나의 neuronal 대상 단백질의 palmitoylation의 급속한 탐지를위한 최적입니다.
세포 palmitoylation의 압도적 인 다수가 cysteines의 thiol 그룹 (우리는이 프로토콜에 'palmitoylation'로 일반화 S-palmitoylation,이라고한다)에 palmitate의 치료 또한을 포함, 단백질의 그러나 매우 제한된 그룹은 글리신에 돌이킬 수없는 palmitoylation를 받게 아르 하고 안정적인 아미드 결합의 형성을 통해 시스테인 잔류 물은 N-palmitoylation 13 칭했다. 아베 화학 중 하나 한계는 아미드 결합의 안정성 N-palmitoylation의 기인을 감지하기위한 수 없다는 것입니다, 그래서 palmitoylation에 대한 새로운 대상 단백질의 심사는 3H-palmitate 신진 대사 라벨 1을 사용 확인해야합니다.
이전에 언급 한 바와 같이, IP-아베 분석을 쉽게 트란 등의 여러 소스에서 단백질 추출물에 palmitoylation을 조사에 적용 할 수heterologous 세포 라인, 기본 조직, 여러 뇌 영역에서 기본 neuronal 문화를 sfected. IP-아베 분석은 기초 조건 10 세 미만 교양 뉴런의 시냅스 단백질의 동적 palmitate 회전율을 검토를 들면, 대상 단백질 여덟 따라 palmitoylated 시스테인의 위치를 식별 할 수있는 변이 시스테인 - 투 - 세린 단백질의 palmitoylation의 자족을 조사에 활용 된 그리고 neuronal 단백질의 palmitoylation 수준의 변화는 neuronal 활동 9 유도에 따라. IP-아베 분석의 감도 및 적응성은 neuronal 단백질의 palmitoylation 프로파일을 검토하고, palmitoylation의 역동적 인 변화를 검출하기위한 최적의하기에 이상적으로 적합합니다.
공개
관심 없음 충돌이 선언 없습니다.
감사의 말
이 작품은 건강 연구 청소 - 81,158 캐나다 연구소에서 보조금에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | 코멘트 |
| IGEPAL CA-630 | 시그마 | I8896 | |
| PMSF | Fluka | 93,482 | |
| 프로테아제 억제제 칵테일 | 로슈 완벽한 미니 | 11 836 153 001 | |
| NEM | 시그마 | E3876 | |
| 햄 솔루션 | 시그마 | 46780-4 | |
| BCA 단백질 분석 키트 | 열 과학 | 23,225 | 선택한 세제와의 호환성을 보장 |
| 단백질 G / A-코팅 세 파로스 비즈 | GE 헬스 케어 | 17-6002-35 | |
| 비오틴 - BMCC | 열 과학 | 21,900 | |
| Streptavidin-HRP | 열 과학 | 21,126 | 물 1 MG / ML에서 Reconstitute |
| 서양 얼룩 옷 벗는 다든가 버퍼 | 열 과학 | 21,059 |
참고문헌
- Fukata, Y., Fukata, M. Protein palmitoylation in neuronal development and synaptic plasticity. Nat. Rev. Neurosci. 11, 161-175 (2010).
- Kang, R., et al. Neural palmitoyl-proteomics reveals dynamic synaptic palmitoylation. Nature. 456, 904-909 (2008).
- Drisdel, R. C., Green, W. N. Labeling and quantifying sites of protein palmitoylation. Biotechniques. 36, 276-285 (2004).
- Wan, J., Roth, A. F., Bailey, A. O., Davis, N. G. Palmitoylated proteins: purification and identification. Nat. Protoc. 2, 1573-1584 (2007).
- Xie, C., Markesbery, W. R., Lovell, M. A. Survival of hippocampal and cortical neurons in a mixture of MEM+ and B27-supplemented neurobasal medium. Free Radic. Biol. Med. 28, 665-672 (2000).
- Drisdel, R. C., Alexander, J. K., Sayeed, A., Green, W. N. Assays of protein palmitoylation. Methods. 40, 127-134 (2006).
- Eslami, A., Lujan, J. W. e. s. t. e. r. n. Blotting: Sample Preparation to Detection. J. Vis. Exp. (44), e2359 (2010).
- Huang, K., et al. Neuronal palmitoyl acyl transferases exhibit distinct substrate specificity. FASEB J. 23, 2605-2615 (2009).
- Noritake, J., et al. Mobile DHHC palmitoylating enzyme mediates activity-sensitive synaptic targeting of PSD-95. J. Cell Biol. 186, 147-160 (2009).
- Thomas, G. M., Hayashi, T., Chiu, S. L., Chen, C. M., Huganir, R. L. Palmitoylation by DHHC5/8 Targets GRIP1 to Dendritic Endosomes to Regulate AMPA-R Trafficking. Neuron. 73, 482-496 (2012).
- Hayashi, T., Thomas, G. M., Huganir, R. L. Dual palmitoylation of NR2 subunits regulates NMDA receptor trafficking. Neuron. 64, 213-226 (2009).
- Ho, G. P., et al. S-Nitrosylation and S-Palmitoylation Reciprocally Regulate Synaptic Targeting of PSD-95. Neuron. 71, 131-141 (2011).
- Iwanaga, T., Tsutsumi, R., Noritake, J., Fukata, Y., Fukata, M. Dynamic protein palmitoylation in cellular signaling. Prog. Lipid Res. 48, 117-127 (2009).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유