Method Article
ベンチトップリアクターの操作
要約
発酵槽は、生物工学、細胞の培養の収率および生産性を高めるために使用される。振盪フラスコ内で複数の微生物または動物細胞培養候補をスクリーニングした後、次の論理ステップは、選択された発酵槽培養物のバイオマスを増加させることである。このビデオでは、一般的なベンチトップ型バイオリアクターシステムのセットアップと操作を示しています。
要約
発酵系は、細胞培養物の多くの異なるタイプのための最適な成長環境を提供するために使用される。慎重に温度、pH、特に溶存酸素濃度を制御するための発酵槽によって与えられる機能は、効率的な大規模な増殖および発酵産物の発現にそれらが不可欠となる。このビデオでは、簡単に振とうフラスコ上で発酵槽の利点を説明します。また、一般的なベンチトップ発酵システムの重要な構成要素を特定し、そのプローブの容器やキャリブレーションの設定に基本的な指示を与える。視聴者は、滅菌プロセスに慣れ、培養容器中で増殖培地に接種する方法を示す。運転、サンプリング、および収穫の基本的な概念も実証される。簡単なデータ分析やシステムのクリーンアップについても説明します。
概要
基本的な発酵技術は、培養物を成長させるための単純な振盪フラスコ法の拡張である。それは、より完全かつ定量的な方法で生きた培養のための成長環境を制御したいという要望から生まれました。バッチ培養振とうフラスコは、通常、温度の不正確な制御によって制限されています。インキュベートシェーカーや暖かい部屋の温度の均一性は時々意図された目標値から5℃以上を逸脱、非常に可変である。振とうフラスコは、通常、一定速度で撹拌されるので、酸素摂取量およびガス交換が制限される。利用可能な周囲の酸素が枯渇したら、ほとんどの文化が繁栄することができない。振盪フラスコ内にpH制御は存在しない。培養物を供給原料に限定されるものではない場合に多くの場合、それは培養物に不利益点まで酸性になり、呼吸が劇的に遅くなる。ほとんどの振とうフラスコ培養はまた、彼らはinoculatioまたは文化の最初の方に一度だけ送られることを意味し「バッチ」として経営されていますN。この最初の炭素源が消費された後、培養物は成長が止まる。いくつかの場合において、その代謝はシフトし、培養液中に他の代謝産物を消費し始め、時には得られたバイオマスまたはタンパク質の特性を変更することができる。フラスコを37℃で、通常、24時間あたりの体積の通常10%の温暖な培養環境におけるメディアの蒸発損失の対象と振るこの損失は、文化の密度を変化させ、システムの長期的な操作を禁止している。最後に、ユーザーは、攪拌した後、メディアからの発泡が発生する場合があります。文化上のヘッドスペース中の泡の発生はガス交換し、さらに膝の成長を制限することになる。
基本的な発酵システムは、これらの制限のすべてに対処するように設計されている。慎重な温度制御は、インペラ攪拌および加熱ジャケットを用いて発酵容器で達成される。通常、このジャケットの加熱と冷却の容器とフィードバックコントロールに挿入されたセンサセットポイントの周り0.1℃±温度制御をもたらす。卓上型の発酵槽は、一般的にポンプを介して液体試薬添加によりpHを制御することができます。 pH値を連続的に細胞増殖のための最適な環境を維持する目的で監視される。適切な通気は、上記混合羽根によって、または培養物中に直接ガスを補充した空気または酸素の注入によって維持される。せん断に敏感な文化と、酸素を補充したガスは、培養中の酸素レベルを維持するための主要なメカニズムである。溶液中の酸素の測定は、通常、振盪フラスコ中で使用するのに通常は利用できないポーラログラフプローブによって達成される。これは、連続的または周期的に直鎖状または指数関数的成長を維持するために容器にフィードを追加することも可能である。出口ガス冷却器は、このように培養液量と濃度を維持し、凝縮する排気ガス流中の蒸気のための低温表面を提供する。消泡剤、界面活性剤の定期的な添加は、アクチュエートされている表面に泡を低減し、ガス交換を可能にする、培養中の導電率プローブによる。
容器は、全てのプローブ、付属品、インペラー、収穫パイプ、チューブで、組み立てと標準オートクレーブ滅菌。最終プローブ校正および動作環境に安定した後、培養容器に添加する。次に、システムは、振とうフラスコ法に比べてより定量的かつ正確な方法で培養物を特徴付けるために使用することができる。温度、pH、酸素含有量、飼料摂取量、液体の蒸発、及び泡のレベルの厳密な制御は、すべてのはるかに高いバイオマスおよび良好タンパク質収量に寄与する。
プロトコル
- 容器のセットアップを使用して操作を開始します。従来の発酵槽( 図1)をインストールする必要のある次のコンポーネントがあります。
- pHプローブ - ライブ、培養中のpHの測定のために。インストールの前にプローブを校正し、容器を滅菌する。ヘッドプレートにプローブを取り付けます。
- のpO 2プローブ-発酵中の容器内の溶存酸素量の測定のため。ヘッドプレートに取り付けます。
- 文化をサンプリングするための収穫パイプ。ヘッドプレートは、この高さ調節が可能なコンポーネントをインストールします。
- ガススパーは - 容器の底に存在し、文化へのガス注入を提供します。発酵槽でのガス源にスパーを接続し、ヘッドプレートにマウントします。
- インペラシャフトとインペラ - インペラは文化を撹拌し、容器内の培養均一性を維持するために重要である。
- 排気ガス冷却器 - 排気ガス通路を冷却することによって容器内の蒸発損失を抑制するための。
- pH制御や飼料添加のための試薬ポンプライン。
- 容器をきれいにし、石鹸と水でヘッドプレート。柔らかいブラシは、容器とヘッドプレートを洗浄するために推奨されている。塩素漂白剤や洗剤は、容器を洗浄するために使用することはできません。
- メディアは不安定な熱されていない場合は、清浄な容器に追加します。最大使用量に到達するまでにのみ追加します。この場合、最大使用量を5 Lの総容積容器3.3 Lである。
- Oリングシールが正しく取り付けられていることを確実にする、血管のヘッドプレートを取り付けます。
- 排気ガスコンデンサーを取り付けます。
- その10ミリメートルポートに消泡プローブを取り付けます。
- その10ミリメートルポートに収穫パイプを取り付けます。その上に、チューブの部分を入れて、それを固定します。
- 散布口にチューブと0.20μmのフィルターをインストールしてから、これをオフにクランプします。
- pHプローブを校正:
- 2小さなビーカー内のリファレンス·バッファ、洗浄瓶、スペアWAを集めるSHビーカー。
- 発酵槽にpHプローブを上にフックし、発酵槽、電源を入れます。
- pHのパラメータにスクロールして、メニューボタンを使って、「カル」オプションまでスクロールし、「Enter」キーを押し。
- 2点校正のための'2 'を選択します。
- プローブ先端を洗浄し、低基準バッファに沈める。発酵槽での値が安定します。 +を使用し、 - キー、pH比較バッファの値と一致するように表示される値を調整します。それが点滅を停止したら、「Enter」キーを押し。
- オフプローブを洗浄し、第二のリファレンス·バッファに挿入します。値が安定してから表示される値が高いリファレンス·バッファの値と一致しているように、キーパッドを使用することができます。押して確認しEnterキーを。
- プローブ先端を洗浄し、発酵槽から外し。接続時に保護キャップを入れて、ヘッドプレートに取り付けます。
- pO 2がプローブ先端を開き、そこに次のことを確認するためにチェックするチップを覆うために十分な電解質がある。そうでない場合、リザーバーにいくつかを追加して、それを閉じるBack。
- ヘッドプレートにはpO 2プローブをインストールし、オートクレーブキャップは、その電気的接続を保護するために装着されていることを確認してください。これは、滅菌後に校正されます。
- ディップチューブ、エアフィルターと試薬の供給のためのボトルを取得します。ディップチューブポートにポンプチューブを追加し、発酵槽に流入ポートにもう一方の端を取り付けます。
- すべての未使用のポートの上に置いてチューブを入れ直しチューブクランプ。
- 排気ガスコンデンサーに0.45μmのフィルターを取り付けます。このフィルタは、容器がオートクレーブ内で加圧しないことが保証されます。
- メディアのレベルを下回るすべてのチューブが出てくるからメディアを防ぐために、オフにクランプされていることを確認してください。
- 121℃、液体サイクルで30分間 - 25オートクレーブに容器を置きます。注意:それが出て来ると、それは非常に熱くなります。
- 発酵槽ベースに容器をインストールします。
- pHをつなぐケーブルを探る。
- のpO 2プローブケーブルを接続します。
- ガス添加ロータメータにスパーを上に引っ掛けます。
- 無菌ディップチューブをボトルに1MのNaOH試薬を追加し、基本ポンプヘッドスピンドルにポンプヘッドを取り付けてください。
- ヘッドプレートにサーモウェルに温度センサーを置く。それはサーモウェルの底に道のすべてを行くことを確認してください。
- 船インペラカップに攪拌アームを下げます。
- 発酵槽がオンになっていることを確認してください。
- 水は発酵槽に使用可能であることを確認してください。
- 発酵槽への空気供給をオンにします。
- 温度パラメータまでスクロールし、37℃に温度を設定温度制御を開始するためのボタンをEnterキーを押します。容器は15分以下に熱くなる。
- 分以下のメディアの1容器容積へのガス流をオンにします。このセットアップのために、ガス流は3リットル/分である。気泡が一番下に表示されます。
- 攪拌Pまでスクロールarameterおよび300 rpmに設定してください。 Enterキーを押して、攪拌をオンにする」と入力します '。
- 温度が37℃に達した後、pHをパラメータにスクロールして6.8に設定します。 「入力」ボタンを押して、pHコントロール、電源を入れます。
- 実行の1,000 rpmで最高速度に攪拌を設定します。
- はpO 2プローブは、適切な値を表示するために適切に偏光していることを確認してください。 2時間後のPO 2パラメータまでスクロールし、「キャリブレーション機能」を選択し、1点校正を選択するには「メニュー」ボタンを使用します。
- 15分後、100を押して値を設定するために、カーソルを使用」と入力します。 'これはのpO 2を校正します。
- 撹拌にスクロールして、300 rpmに設定してください。
- 「メニュー」ボタンを使用して、中の攪拌メニュー 'on'に 'カスケード」をオンにします。これは、気泡を切り刻む成長需要が増加するにつれて、溶液中に多くの酸素を強制する目的で、攪拌の速度を増加させる。
- pO 2がパラメータにスクロールし、値を30に設定してください。 pO 2が開始する「入力」ボタンを押してください。
- PC上の制御ソフトウェアパッケージを開始します。
- プローブが校正されると、攪拌を300rpmで安定している、温度は37℃であり、pHは6.8に近く、それは接種するための時間です。アルコールを用いて、接種に使用するポートを滅菌する。
- 注射器に接種物を描画し、滅菌ポートに追加します。ポートを閉じる。
- ログブックに接種時をマーク。
- これは、滅菌時間でサンプルを取ることも重要である。アルコールと収穫管管の端部を滅菌する。
- 収穫ポートをカバークランプを開き、サンプルを描画するための注射器を使用しています。それがパイプに座ってきたので、この最初のサンプルは、通常、廃棄される。
- 別のサンプルを引っ張って、別の注射器を使用してください。
- 第三の注射器で、できるだけ多くのデッドボリュームを削除するために、パイプを通って空気を押し出すラインからラインをオフにクランプします。
- 細胞密度およびpHを測定し、値を記録。微生物培養により、値が1時間ごとにログに記録するのに便利です。間隔は文化に依存しています。
- 成長が完了した後に収穫の方法論は、培養のために意図によって異なります。この場合には、培養の細胞密度および湿潤細胞重量の可能なpHまたは測定のためのエンドポイント値を受信するための最終的な時間をサンプリングする。漂白剤や他の抗菌剤との指定された「キルタンク」内のコンテンツ処分ヘッドプレートを開きます。
結果
バイオリアクターは、IRISソフトウェアの有無にかかわらず実行することができます。ただし、データをキャプチャするために、ソフトウェアを使用することをお勧めします。細菌の添加前に、pHおよび酸素センサは、インペラー速度セット及び温度設定を較正しなければならない。 図2において、バイオリアクターランのデータ出力が提示される。温度を30℃、200rpmのインペラ速度に設定した。パラメータは、各実験ごとに異なるかもしれないが、細菌の添加前に、システムが定常状態にあるべきである。 図3において、細菌培養物を添加した酸素濃度の変化が示されている。この実験のための設定点を37℃、200rpmで攪拌機70%のO 2である。時間19:20、供給ポンプはすぐに、O 2レベルの低下の原因0.1のODで細菌種培養を実現します。バイオリアクターは、空気の流れと羽根車の速度の増加に伴って変化するO 2レベルに応答します。 T増加する彼が設定点は、カスケード(ステップ35)で設定されている。反応器のpHは、pHは、経時的なpHライン変動( 図4)によって示されるように増加し、その後減少に伴って、リアルタイムでモニターした。ラン全体を分析することができ、パラメータは、その後の実験のために調整。

図1。標識され、接続されているすべての部品とのベンチトップバイオリアクターは、この図では、実行開始時の攪拌タンク反応を示しています。反応器の部品を標識し、センサー、羽根車、温度計、フィード·サンプリングボトル、排気口、空気圧力計、加熱マントル、凝縮塔、およびコントロールパネルが含まれる。

図2。バイオリアクターSOFの画面イメージ実行の開始時にtware。撹拌槽実行の開始時に、温度を30℃(黄色の線)に設定し、200回転(赤線)、6.5(緑の線)でのpH、及びPO 2のインペラ速度57.2%(青線)で。 大きな画像を見るにはここをクリックしてください 。
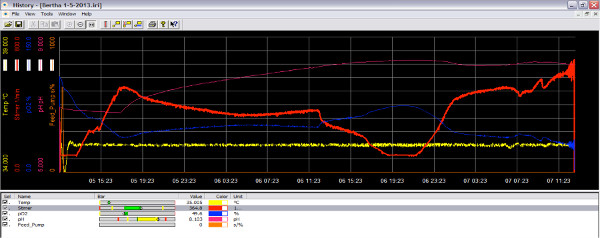
図3。酸素が 減少するにつれて、実行中のバイオリアクターソフトの画面イメージ。培養物は、活性成長期にある場合、それは酸素を消費し、反応器内の酸素量が減少する(青い線)。インペラー速度を上げることにより、より多くの酸素を培養(赤線)に追加することができます。 大きな画像を見るにはここをクリックしてください 。

図4。時間をかけてpH変化を示すバイオリアクターソフトウェアの画面イメージ。培養物のpHを連続的に監視され、乳酸が生成されるように時間をかけて、それが減少した後、基材としての増加は、バイオリアクター(青線)に追加されます。 大きな画像を見るにはここをクリックしてください 。
ディスカッション
攪拌タンクバイオリアクターは、バイオテクノロジー業界の標準であり、40年以上の1のために使用されている。小さな撹拌槽は、スケールアップ、スケールダウン、歪みの最適化、特性評価、およびプロセス開発のために重要であった。また、個別化医療2の開発において重要な役割を有することができる。それはランを通してモニターし、最適化することができるので、小規模のバイオリアクターは、細胞増殖のためのインサイチュー条件のに最も類似している。ほとんどの場合、最初の実験は、振盪フラスコを使用して実行されるが、小規模のバイオリアクターの条件は、振盪フラスコとは大きく異なる。 1実験では、 大腸菌の最適な成長のための条件ことを発見大腸菌および振とうフラスコ内の緑色蛍光タンパク質(GFP)の製造は、撹拌槽(未発表データ)に変換しなかった。
大規模に増殖する細胞の他の方法は、ローラーボトル、単一のuを含むSE 50〜5,000 Lからプラットフォームのバイオリアクター3と作業ボリュームを持つ大規模単回使用バイオリアクターロッキング各メソッドは、スケールアップのための課題を提供していますが、生産の場所を見つけました。プラットフォームのバイオリアクターロッキング回の使用は、撹拌槽に類似しており、規制環境を提供します。それは細胞の沈降を防止し、酸素化を提供するために波を発生させるための揺動運動を発生することで、混合攪拌槽と異なる。この方法のための流体力学は、攪拌タンク異なり、最大容積1,000 L.に限定される差異は、細胞増殖および生成物の産生に影響を与えることができる。他のシングルユースシステムは、インフラストラクチャおよび関連するオーバーヘッドを最小限に抑えながら、プラットフォームを提供するために、使い捨ての反応容器と撹拌槽を組み合わせて、高スループットのための機能は、4をバイオプロセス。
ベンチトップリアクターの新規ユーザーは、トラブルのpHのPO 2の初期設定値を決定し、TEMを持っている可能性peratureが、発表された研究は、この情報5、6、7、8、9のために参照することができる。特に細菌培養では、振とうフラスコと同じ設定温度と同じ速度で攪拌を開始することをお勧めします。以前の振盪フラスコランからの培養pHも出発点として使用することができる。のpO 2値の設定がより困難であり、典型的には経験的に決定される。しかし、50%のpO 2以降では推奨される出発点である。
開示事項
著者A.マグノは、この記事で使用した試薬や器具を生産ATRバイオテックの従業員である。
謝辞
このプロジェクトは、ジョンズ·ホプキンス大学、 ゲートウェイ科学イニシアティブを通じて学長のオフィスによって部分的にサポートしました。
資料
| Name | Company | Catalog Number | Comments |
| LB broth | Sigma | L3022 | |
| ampicillin | Sigma | A1593-25G | |
| LB broth | Sigma | L3022 | |
| antifoam 204 | Sigma | A8311 | |
| 1 M Sodium Hydroxide | Sigma | 38215-1EA-R | |
| Reference Buffer, pH 4.00 | Sigma | B5020 | |
| Reference Buffer, pH 7.00 | Sigma | B4770 | |
| pO2 probe electrolyte | Broadley James | AS-3140-C30-0025 | |
| 0.45 micron filter | Cole Parmer | EW-02915-22 | |
| 0.22 micron filter | Cole Parmer | EW-29950-40 | |
| Luer Lock syringe, 10 mL | Cole Parmer | EW-07940-12 | |
| Minifors Bioreactor | Infors HT | B-Pack 5.0 | |
| Air Admiral air pump | Cole Parmer | EW-79202-00 | |
| 1175 PD Chilling circulator | VWR | 13721-204 |
参考文献
- Shuler, M., Kargi, F. Bioprocess Engineering Basic Concepts. , 2nd, Prentice Hall. Upper Saddle River, NJ. (2002).
- Hambor, J. Bioreactor Design and Bioprocess Controls for Industrialized Cell Processing. BioProcess International. 10 (6), 22-33 (2012).
- Wave [Internet]. , GE Life Sciences. Available from: http://www.gelifesciences.com/webapp/wcs/stores/servlet/catalog/en/GELifeSciences-US/brands/wave (2012).
- Xcellerex [Internet]. , GE Life Sciences. Available from: http://www.xcellerex.com/platform-xdr-single-use-bioreactors.htm (2012).
- Julien, C., Whitford, W. Bioreactor, Monitoring, Modeling and Simulation. BioProcess International. 5 (01), S10-S17 (2007).
- Fike, R. Nutrient Supplementation Strategies for Biopharmaceutical Production. Part 1: Identifying a Formulation. BioProcess International. 7 (11), 46-52 (2009).
- Jana, S., Deb, J. K. Strategies for efficient production of heterologous proteins in Escherichia coli. Appl Microbiol Biotechnol. 67, 289-298 (2005).
- Wang, Z., Ly, M., Zhang, F., Zhong, W., Suen, A., Hickey, A. M., Dordick, J. S., Linhardt, R. J. E. coli K5 fermentation and the preparation of heparosan, a bioengineered heparin precursor. Biotechnol. Bioeng. 107, 964-973 (2010).
- Baltz, R. H., Demain, A. L., Davies, J. E. Manual of Industrial Microbiology and Biotechnology. , 3rd, ASM Press. Washington DC. (2010).
- Bioreactors [Internet]. , Applied Technical Resources. Available from: http://www.atrbiotech.com/pdfs/bioreactors.pdf (2012).
- Infors, H. T. Minifors operating Manual and user guide. , Bottmingen, Switzerland. Forthcoming.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved