Method Article
一个台式生物反应器的操作
摘要
发酵罐是用来增加培养产量生物工程化细胞和生产率。在摇瓶筛选多种微生物或动物细胞培养人选后,下一个合乎逻辑的步骤是增加了选择的文化的生物质发酵罐。该视频演示了一个典型的台式生物反应器系统的设置和操作。
摘要
发酵系统用于提供最佳的生长环境为许多不同类型的细胞培养物。通过发酵得到小心控制温度,pH值,特别是溶解的氧的浓度的能力使得它们必须有效地大规模生长和发酵产物的表达。此视频将简要地描述在摇瓶发酵的优点。它还将确定一个典型的台式发酵系统的重要组成部分,并给予基本的指令上设置了探头的容器和校准。观众将熟悉的灭菌过程,并展示了如何接种生长培养基与文化的容器。操作时,取样和收获的基本概念也将被证明。简单的数据分析和系统清理也将被讨论。
引言
基本发酵技术是用于生长培养物的简单摇瓶法的延伸。它的前身,以控制生长环境,以便在一个更完整,更定量的方式生活文化的愿望。分批培养摇瓶通常是由温度控制不精确的限制。温度均匀度在培养摇床或温暖的房间是充满变数,有时偏离5°C以上的预期设定值。由于摇瓶通常搅拌以固定的速度,耗氧量和气体交换是有限的。一旦环境提供氧气被耗尽,大多数文化无法茁壮成长。有在摇瓶没有pH控制。在许多情况下,如果文化不被原料的限制,它变成酸性,以损害的点到文化和呼吸减慢显着。最摇瓶培养物也可作为"批处理",这意味着它们在室温或接近的培养的开始inoculatio只喂一次运行Ñ。经过这一初步的碳源被消耗,将培养停止生长。在某些情况下,它的代谢可能会移动并开始消耗其它代谢物在培养液中,有时会改变所得到的生物量或蛋白质的特性。摇瓶通常也须在37°C在温暖的文化环境中,每24小时的量通常为10%介质蒸发损失这个损失改变培养的密度,并禁止该系统的较长期的操作。最后,用户可能会遇到的搅拌后,从介质起泡。泡沫在培养上面的顶部空间的出现会限制气体交换,并进一步抑止增长。
基本发酵系统旨在解决所有的这些限制。仔细的温度控制在发酵容器通过使用叶轮的搅拌和加热夹套来实现。通常插入加热这件夹克和冷却的容器和反馈控制的传感器结果在温度控制在±0.1℃下围绕设定值。台式发酵罐一般是通过泵通过液体试剂除了提供pH值的控制。 pH值在努力保持环境最佳的细胞生长持续监测。适当的通风是通过上述混合叶轮或通过空气或补充氧气直接加入培养物的输液维持。与剪切敏感的培养,补充氧气是主要的机制维护的在培养的氧气水平。氧在溶液中的测量通常是由极谱探针,其通常不是可用于在摇瓶中使用来实现。另外,也可以连续地或周期性地加入进料至容器保持增长以线性或指数方式。出口气体的冷凝器提供的废气流冷凝冷的表面为气相,从而维持培养物体积和密度。定期加消泡剂的表面活性剂是促动通过在培养的导电率探头,降低泡沫的表面上,并允许气体交换。
的容器中,与所有的探针,管件,叶轮,收获的管道,管,组装和灭菌的标准高压釜中。经过最后的探头校准和稳定经营环境,文化加入到容器中。该系统可以被用来向培养的方式,比用摇瓶法更加量化和精确的表征。温度,pH,氧含量,饲料消耗,液体的蒸发和泡沫水平的紧密控制所有向更高的生物量和更好的蛋白质产量。
研究方案
- 开始操作容器的设置。常规的发酵罐中具有需要安装的( 图1)包括以下组件:
- pH探头 - 用于pH在现场的文化测量。安装前校准探头和消毒用的容器。在磁头板安装探头。
- 氧分压pO 2探测-用于在所述容器内发酵过程中溶解氧含量的测量。安装在磁头板。
- 丰收管取样的文化。在磁头板安装此高度可调元件。
- 气体分布器 - 驻留在容器的底部,并提供气体注入到培养。钩鼓泡后至发酵罐的气源,并在磁头板安装。
- 叶轮的轴和叶轮 - 叶轮搅动培养,并维持培养的均匀性在容器中是至关重要的。
- 废气冷凝器 - 用于通过冷却所述废气通路抑制在容器中的蒸发损失。
- 试剂泵线,pH值控制或饲料添加。
- 清洁容器和磁头板用肥皂和水。软刷,建议擦洗容器和磁头板。漂白剂或清洁剂与氯不能用来清洁容器。
- 如果媒体不热不稳定,将其添加到干净的容器中。只添加,直到最大工作容积就达到了。在这种情况下,最大工作容积为3.3升的5升总体积的容器。
- 装入容器磁头板,确保O型密封圈正确就位。
- 安装在排气冷凝器。
- 安装消泡剂探入其10毫米端口。
- 安装管道收获到其10毫米端口。把一块管在它的顶部和夹紧它关闭。
- 安装管道和一个0.20微米的过滤器上的喷射入口,然后用镊子这一关。
- 校准pH探头:
- 聚集在小烧杯2基准缓冲器,一个洗瓶子,和一个备用娃sh的烧杯中。
- 钩pH探头到发酵罐并打开发酵罐上。
- 滚动到pH值的参数和使用菜单按钮,滚动到"CAL"选项,然后按"Enter"键。
- 选择'2'2点校准。
- 洗掉探头尖端和淹没在低参考缓冲器。在发酵罐中的值将趋于稳定。使用+和 - 键调整显示值相匹配的pH值的参考缓冲区的值。一旦它停止闪烁时,按下"Enter"键。
- 关闭冲洗探针并将其插入到所述第二基准缓冲器。允许值稳定,然后使用键盘来使显示的值相匹配的高基准电压缓冲值。按下"Enter"键确认。
- 关闭冲洗探头尖端和它从发酵罐断开。把保护帽连接上和在磁头板安装。
- 开宝2探头端部和检查,以确保有是足够的电解质以覆盖小费。如果没有,有些添加到水库和关闭它回来了。
- 在磁头板安装在PO 2探头,确保高压釜盖放在保护其电气连接。将灭菌后进行校准。
- 获得与汲取管和空气过滤器的瓶试剂饲料。添加泵管的浸管口,并连接另一端连接到发酵罐的进气口。
- 在所有未使用的端口地方油管接钳油管关闭。
- 在废气冷凝器安装一个0.45微米的过滤器。此过滤器可确保容器不会在高压釜加压。
- 检查了低于媒体的级别的所有管夹关闭,以防止脱落媒体。
- 把容器中的高压釜中进行25 - 30分钟,在121℃下,液体循环。注意:当它出来会很烫。
- 在发酵罐底座安装船。
- 胡克了pH值探头电缆。
- 附上宝2探头电缆。
- 钩鼓泡直至气体添加流量计。
- 无菌条件下加入1 M氢氧化钠试剂的瓶汲取管和在基体泵压头主轴上安装泵头。
- 把温度传感器热电偶套管上的磁头板。确保它去所有的方式,热电偶套管的底部。
- 降低搅拌臂到血管叶轮耦合。
- 确保发酵罐已打开。
- 检查是否有水供应到发酵罐中。
- 打开空气供应到发酵罐中。
- 滚动到温度参数和设定温度为37°C。按'回车'按钮来启动温度控制。该容器将加热在15分钟以下。
- 转气流,以每分钟或更少1容器体积的介质。为此设立,气体流量为3升/分。气泡应该出现在底部。
- 滚动到搅拌parameter并设定为300rpm。按"Enter"键打开搅拌。
- 一旦温度达到37℃时,滚动到pH值的参数,并将其设置为6.8。把pH控制在按'回车'键。
- 设置搅拌至1,000 rpm的转速运行的最大速度。
- 确保宝2探头极化正确显示正确的价值观。 2小时后,滚动到宝2参数,并使用"菜单"按钮,选择"校准功能",然后选择1点校准。
- 15分钟后,使用光标的值设置为100,然后按Enter键。这将校准2宝。
- 滚动到搅动,并设置为300rpm。
- 使用"菜单"按钮,打开"级联"在鼓动菜单'上'。这将增加在努力砍气泡,并迫使更多的氧进入溶液作为增长的需求增加搅拌速度。
- 滚动到宝2参数并将其值设置为30。按'回车'按钮开始2宝。
- 在PC上启动控制软件包。
- 一旦探针校准,搅动是稳定为300rpm,温度为37℃,pH值接近6.8,现在是时候来接种。使用酒精,消毒,将用于接种的端口。
- 绘制接种到一个注射器,并将其添加到灭菌的端口。关闭该端口。
- 标志着接种在日志的时间。
- 同样重要的是采取的试样,在灭菌时间。消毒收获管筒与醇的末端。
- 打开夹子覆盖收获端口,并使用注射器抽取样本。这第一个样品通常被丢弃,因为它已经坐在管子。
- 使用另一种注射器拉另一个样本。
- 与第三注射器,推回空气通过管道以去除尽可能多的死区容积从行和夹紧线断开。
- 确定细胞密度,pH,并记录该值。用微生物培养物,它每隔一小时记录的值是非常有用的。间隔是文化依赖。
- 收获方法取决于意图的文化发展完成后。在这种情况下,样品的培养,最后一次接收端点值,细胞密度和湿细胞重量尽可能的pH值或测量值。打开一个指定的"必杀槽"与漂白剂或其他抗菌药物处置内容的磁头板。
结果
生物反应器可以使用或不使用IRIS软件来运行。然而捕获数据,最好是使用该软件。除了细菌之前,将pH和氧传感器必须进行校准时,叶轮速度设定和设定温度。在图2中,数据输出为生物反应器运行呈现。将温度设定为30℃,搅拌速度为200rpm。该参数可以是不同的每个实验,但除了细菌之前,系统应该处于稳定状态。在图3中,示出了在氧浓度的变化与另外的细菌培养物。设定点对于本实验是在37℃,搅拌器在200rpm下,O 2在70%以上。在时间19:20,进料泵提供了菌种培养在0.1的OD造成立即在O 2水平下降。所述生物反应器来响应变化的O 2水平与增加的气流和叶轮速度。 Ŧ他设置点的增加是在级联(步骤35)设置。将反应器pH值进行实时监测,pH值下降,然后就证明了随着时间的推移将pH线波动( 图4)增大。在整个运行可以分析和参数调整后续实验。

图1。台式生物反应器与标记和连接所有部分。该图显示了搅拌罐反应器在运行开始。在反应器的部分被标记为与包括传感器,叶轮,温度计,进料和取样瓶,排气口,空气压力计,加热夹套,冷凝器塔,和控制面板。

图2。生物反应器SOF的屏幕图像tware在运行开始时,在一个搅拌罐运行开始时,将温度设置在30℃(黄线),叶轮转速为200rpm(红线),pH为6.5(绿线),和PO 2在57.2%(蓝线)。 点击这里查看大图 。
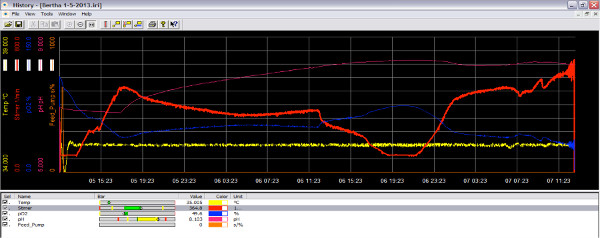
图3。生物反应器中的软件的运行为氧时屏幕图像而减小。当培养是在活跃的生长阶段,它消耗的氧气和氧气在反应器中的量减少(蓝线)。通过增加叶轮转速,更多的氧气可以被添加到文化(红线)。 点击这里查看大图 。

图4。文化的生物反应器软件显示随时间变化的pH值的 pH值屏幕图像的连续监测,并随着时间的推移它减少乳酸的产生,然后会随着碱加入到生物反应器(蓝线)。 点击这里查看大图 。
讨论
搅拌罐生物反应器在生物技术行业标准,并已被用于超过40年的1。小搅拌罐一直重要的比例增加,按比例缩小,应变优化,表征和工艺开发。它也可以具有在个体化用药2的发展中起重要作用。在小规模的生物反应器是最相似的原位条件下细胞的生长,因为它可以被监控并在整个运行优化。大多数情况下,最初的实验中所使用的摇瓶中进行,但在小规模的生物反应器的条件从摇瓶显著差异。在一个实验中,我们发现,对于大肠杆菌的最佳生长条件大肠杆菌 ,并在摇瓶中生产的绿色荧光蛋白(GFP)的未翻译到搅拌罐(未发表数据)。
生长的细胞在大规模的其它方法包括滚瓶,单U本身摇摆平台生物反应器3,以及较大的一次性使用的生物反应器具有工作体积从50到5,000 L。每个方法提供规模化的挑战,但已发现在生产中的地方。单次使用的摇摆平台生物反应器是相似的搅拌槽,并提供稳定的环境。其不同之处在于混合的搅拌釜的发生是由于摇摆运动,以产生波,以防止细胞沉淀,并提供氧气。流体力学此方法是不同的从搅拌罐,并限制最大音量,以1,000 L的差别会影响细胞的生长和产品生产。其它一次性使用的系统相结合的搅拌罐用一次性反应器中,以提供具有最小的基础结构和相关联的开销的平台,而对于高通量的能力,生物处理4。
台式生物反应器的新用户可能会遇到麻烦确定初始设定值pH值,PO 2和温温度,然而,发表的研究可以对这些信息5,6,7,8,9引用。与在特定的细菌培养物时,建议以相同的速度作为摇瓶中,并在同一给定的温度,开始搅拌。从前面的摇瓶培养的运行pH值也可以用来作为一个起点。设定宝2的值是比较困难的,通常是凭经验确定。然而,50%的PO 2开始是建议起点。
披露声明
作者答:木兰是ATR Biotech公司雇员产生在这篇文章中使用的试剂和仪器。
致谢
这个项目是支持部分由美国约翰霍普金斯大学,通过网关科学倡议办公室教务长。
材料
| Name | Company | Catalog Number | Comments |
| Name | Company | Catalog Number | |
| LB broth | Sigma | L3022 | |
| ampicillin | Sigma | A1593-25G | |
| LB broth | Sigma | L3022 | |
| antifoam 204 | Sigma | A8311 | |
| 1 M Sodium Hydroxide | Sigma | 38215-1EA-R | |
| Reference Buffer, pH 4.00 | Sigma | B5020 | |
| Reference Buffer, pH 7.00 | Sigma | B4770 | |
| pO2 probe electrolyte | Broadley James | AS-3140-C30-0025 | |
| 0.45 micron filter | Cole Parmer | EW-02915-22 | |
| 0.22 micron filter | Cole Parmer | EW-29950-40 | |
| Luer Lock syringe, 10 mL | Cole Parmer | EW-07940-12 | |
| Minifors Bioreactor | Infors HT | B-Pack 5.0 | |
| Air Admiral air pump | Cole Parmer | EW-79202-00 | |
| 1175 PD Chilling circulator | VWR | 13721-204 |
参考文献
- Shuler, M., Kargi, F. . Bioprocess Engineering Basic Concepts. , (2002).
- Hambor, J. Bioreactor Design and Bioprocess Controls for Industrialized Cell Processing. BioProcess International. 10 (6), 22-33 (2012).
- Julien, C., Whitford, W. Bioreactor, Monitoring, Modeling and Simulation. BioProcess International. 5 (01), S10-S17 (2007).
- Fike, R. Nutrient Supplementation Strategies for Biopharmaceutical Production. Part 1: Identifying a Formulation. BioProcess International. 7 (11), 46-52 (2009).
- Jana, S., Deb, J. K. Strategies for efficient production of heterologous proteins in Escherichia coli. Appl Microbiol Biotechnol. 67, 289-298 (2005).
- Wang, Z., Ly, M., Zhang, F., Zhong, W., Suen, A., Hickey, A. M., Dordick, J. S., Linhardt, R. J. E. coli K5 fermentation and the preparation of heparosan, a bioengineered heparin precursor. Biotechnol. Bioeng. 107, 964-973 (2010).
- Baltz, R. H., Demain, A. L., Davies, J. E. . Manual of Industrial Microbiology and Biotechnology. , (2010).
- Infors, H. T. . Minifors operating Manual and user guide. , .
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。