Method Article
Funcionamento de um biorreator de bancada
Neste Artigo
Resumo
Os fermentadores são usadas para aumentar o rendimento da cultura e da produtividade de células de bioengenharia. Após triagem vários microbianos ou animais de cultura de células candidatos em shaker, o próximo passo lógico é aumentar a biomassa da cultura selecionada com o fermentador. Este vídeo demonstra a instalação e operação de um sistema de bancada biorreator típico.
Resumo
Sistemas de fermentação são usados para proporcionar um ambiente de crescimento ideal para muitos tipos diferentes de culturas de células. A capacidade proporcionada pela fermentadores para controlar cuidadosamente a temperatura, o pH e as concentrações de oxigénio dissolvido, em particular, torna essencial para o crescimento em larga escala eficiente e da expressão de produtos de fermentação. Este vídeo vai descrever brevemente as vantagens do fermentador durante o balão de agitação. Ele também irá identificar os principais componentes de um sistema de fermentação típico de bancada e dar instruções básicas sobre a configuração do navio e calibração de suas sondas. O telespectador vai se familiarizar com o processo de esterilização e mostrado como inocular o meio de crescimento no vaso com a cultura. Conceitos básicos de operação, a amostragem, e colheita também será demonstrado. Também será discutida a análise de dados simples e limpeza do sistema.
Introdução
A tecnologia básica de fermentação é uma extensão da técnica frasco agitado simples para o cultivo de culturas. Ele cresceu a partir do desejo de controlar os ambientes de crescimento para culturas vivas de uma forma mais completa e quantitativa. Lote frascos agitados cultura são geralmente limitados pelo controle impreciso da temperatura. Uniformidade de temperatura em um shaker incubadas ou sala quente é altamente variável, às vezes desviando 5 ° C ou mais, do ponto de ajuste pretendido. Uma vez que o balão de agitação é normalmente agitada a uma velocidade fixa, a troca de oxigénio e absorção de gás é limitado. Uma vez que o oxigênio ambiente disponível se esgota, a maioria das culturas não conseguem prosperar. Não há nenhum controlo do pH em frascos de agitação. Em muitos casos, se a cultura não é limitada pela carga de alimentação, torna-se ácida até ao ponto de prejudicar a cultura e respiração diminui drasticamente. A maioria das culturas em balão de agitação também são executados como um "lote", o que significa que eles são alimentados apenas uma vez em ou perto do início das culturas inoculation. Após esta fonte de carbono inicial é consumida, a cultura pára de crescer. Em alguns casos, o seu metabolismo pode deslocar e começar a consumir outros metabolitos no caldo de cultura, por vezes, alterando as características da biomassa resultante ou proteína. Shaker também são geralmente sujeitos a mídia a perda por evaporação em ambientes de cultura mais quentes, geralmente 10% do volume por 24 horas a 37 ° C. Esta perda altera a densidade da cultura e proíbe o funcionamento a longo prazo do sistema. Por fim, o usuário pode encontrar a formação de espuma da mídia após agitação. A ocorrência de espuma no espaço de cabeça acima da cultura vai limitar as trocas gasosas e um maior crescimento do joelho.
O sistema básico de fermentação é projetado para lidar com todas essas limitações. Controle cuidadoso da temperatura é conseguido em recipientes de fermentação pela utilização de agitação do impulsor e uma camisa de aquecimento. Um sensor inserido no navio e feedback de controle de aquecimento e arrefecimento de uma jaqueta normalmenteresulta em controle de temperatura ± 0,1 ° C em torno do valor nominal. Fermentadores de bancada geralmente fornecem o controle de pH através de adição de reagentes líquidos através de uma bomba. O valor de pH é monitorado continuamente, em um esforço para manter o ambiente ideal para o crescimento celular. Arejamento adequado é mantido pelo impulsor de mistura acima mencionada ou pela infusão de ar ou oxigénio gasoso suplementado directamente na cultura. Com culturas sensíveis ao cisalhamento, o gás oxigênio complementada é o principal mecanismo para a manutenção do nível de oxigênio na cultura. A medição do oxigénio em solução é geralmente conseguido por uma sonda polarográfica que não está normalmente disponível para utilização em frascos de agitação. Também é possível adicionar de forma contínua ou periodicamente de alimentação para o recipiente para manter o crescimento de uma forma linear ou exponencial. O gás de saída do condensador fornece uma superfície fria de vapor no fluxo dos gases de escape para condensar, preservando assim o volume da cultura e densidade. Adição periódica de anti-espuma tensioactivo é actuadapor uma sonda de condutividade na cultura, a redução de espuma na superfície e permitindo a troca de gás.
O navio, com todas as sondas, acessórios, impulsores, tubos de colheita, e tubos, é montado e esterilizado num autoclave padrão. Após as calibrações de sonda final de estabilização e ao ambiente de operação, a cultura é adicionada ao recipiente. O sistema pode, então, ser utilizado para caracterizar a cultura de uma forma que é mais quantitativo e preciso do que com um método em frasco de agitação. O controlo rigoroso da temperatura, pH, teor de oxigénio, consumo de alimento, o líquido de evaporação, e níveis de espuma contribuem para uma biomassa muito mais elevada e melhor rendimento de proteína.
Protocolo
- Comece a operação com a configuração do navio. Um fermentador convencional tem os seguintes componentes que necessitam de ser instaladas (Figura 1):
- sonda de pH - para a medição do pH na cultura viva. Calibrar sonda antes da instalação e esterilizar com o navio. Instalar sonda no headplate.
- pO 2 sonda - para a medição do teor de oxigênio dissolvido no interior do navio durante a fermentação. Instalar na headplate.
- Tubo de colheita para a amostragem da cultura. Instale este componente altura ajustável na headplate.
- Aspersor de gás - reside na parte inferior do recipiente e fornece infusão de gás para a cultura. Gancho sparger até a fonte de gás no fermentador e montar no headplate.
- Veio do rotor e do rotor - do impulsor agita a cultura e é crítica para a manutenção da uniformidade da cultura no vaso.
- Dos gases de escape do condensador - para reduzir a perda por evaporação no reservatório de arrefecimento o caminho dos gases de escape.
- As linhas de bomba de reagentes para controle de pH ou adição na ração.
- Limpar o vaso e headplate com sabão e água. A escova macia é recomendada para esfregar o vaso e headplate. Lixívia ou produtos de limpeza com cloro não pode ser usado para limpar o vaso.
- Se a mídia não é o calor lábil, adicioná-lo ao recipiente limpo. Só adicionar até que o volume de trabalho máxima é atingida. Neste caso, o volume de trabalho máxima é de 3,3 L para uma embarcação volume total de 5 L.
- Monte o headplate navio, garantindo que o anel de vedação está bem encaixado.
- Instale o condensador de gases de escape.
- Instale a sonda antiespumante em sua porta de 10 mm.
- Instale o tubo de colheita em sua porta de 10 mm. Coloque um pedaço de tubo na parte de cima e prenda-o.
- Instale a tubulação e um filtro de 0,20 mM na entrada sparge e, em seguida, apertar esta off.
- Calibrar a sonda pH:
- Reúna dois buffers de referência em pequenos copos, uma garrafa de lavagem, e um wa reposiçãoproveta sh.
- Prenda o pH sonda até o fermentador e virar o fermentador diante.
- Vá até o parâmetro pH e usando o botão de menu, vá até a opção 'Cal', e pressione 'Enter'.
- Selecione '2 'para a calibração de 2 pontos.
- Lavar a ponta da sonda e submergir no buffer de referência baixo. O valor no fermentador irá estabilizar. Usando a teclas + e -, ajustar o valor exibido para coincidir com o valor do buffer de referência de pH. Uma vez que ele pára de piscar, pressione 'Enter'.
- Lave a sonda fora e inseri-lo no segundo tampão de referência. Permitir que o valor para estabilizar e, em seguida, utilize o teclado para fazer o valor apresentado corresponde ao valor do buffer de alta referência. Pressione "Enter" para confirmar.
- Lave a ponta da sonda e desconecte-o do fermentador. Coloque a tampa de proteção na conexão e instalá-lo no headplate.
- Abra a ponta da sonda pO 2 e verifique se háeletrólito é suficiente para cobrir a ponta. Se não, adicione um pouco para o reservatório e fechá-lo de volta.
- Instale a sonda pO 2 no headplate e certifique-se de que a tampa é colocada em autoclave para proteger suas conexões elétricas. Vai ser calibrado depois de esterilização.
- Obter uma garrafa para alimentação do reagente com um tubo de imersão e filtro de ar. Adicionar tubulação de bomba à porta de tubo de imersão e conecte a outra extremidade à porta de entrada no fermentador.
- Local tubulação em todas as portas não utilizadas, em seguida, apertar a tubulação fora.
- Instalar um filtro de 0,45 um no condensador os gases de escape. Este filtro assegura que o recipiente não é pressurizar na autoclave.
- Verifique se todos os tubos que vão abaixo do nível dos meios de comunicação são presas off para evitar que materiais de sair.
- Colocar o recipiente em autoclave durante 25 - 30 min a 121 ° C, ciclo de líquidos. Cuidado: Quando ele sai ele vai estar muito quente.
- Instale o navio na base fermentador.
- Ligue o pHsondar a cabo.
- Conecte o cabo da sonda pO 2.
- Prenda o pulverizador até o rotâmetro adição de gás.
- Esterilmente adicionar um reagente NaOH M para a garrafa com o tubo de imersão e instalar a cabeça da bomba sobre a cabeça do eixo da bomba de base.
- Coloque o sensor de temperatura no poço no headplate. Certifique-se de que ele vai todo o caminho até o fundo do poço.
- Abaixe o braço de agitação para o acoplamento vasos impulsor.
- Certifique-se de que o fermentador está ligado.
- Entrada de água que está disponível para o fermentador.
- Ligue o suprimento de ar para o fermentador.
- Vá até o parâmetro de temperatura e ajustar a temperatura para 37 ° C. Pressione o botão "Enter" para iniciar o controle de temperatura. O navio vai esquentar em 15 min ou menos.
- Vire o fluxo de gás para um volume do reservatório de mídia por minuto ou menos. Para esta configuração, o fluxo de gás é de 3 L / min. Bubbles deve aparecer na parte inferior.
- Vá até a agitação parameter e ajustado para 300 rpm. Pressione "Enter" para ligar a agitação.
- Quando a temperatura atingiu 37 ° C, vá até o parâmetro pH e configurá-lo para 6,8. Gire o controle de pH, pressionando o botão "Enter".
- Definir agitação à velocidade máxima de 1.000 rpm para a corrida.
- Certifique-se de que a sonda pO 2 é polarizado corretamente para exibir valores adequados. Depois de 2 horas, vá até o parâmetro pO 2 e use o botão "Menu" para selecionar o 'Função Calibrar "e selecione a calibração de 1 ponto.
- Após 15 min, use os cursores para definir o valor a 100 e pressione 'Enter'. Isto irá calibrar pO 2.
- Vá até a agitação e definido para 300 rpm.
- Usando o botão "Menu", rode o 'Cascata' para 'on' no menu agitação. Isto irá aumentar a velocidade de agitação, em um esforço para cortar-se bolhas de ar e forçar mais oxigênio em solução enquanto a demanda de crescimento aumenta.
- Vá até o parâmetro pO 2 e defina o valor para 30. Pressione o botão "Enter" para iniciar a pO 2.
- Inicie o pacote de software de controle no PC.
- Uma vez que as sondas são calibradas, a agitação é estável a 300 rpm, a temperatura é de 37 ° C e o pH é próximo de 6,8, isto é o tempo para inocular. A utilização do álcool, esterilizar a porta que vai ser utilizado para a inoculação.
- Desenhar o inoculo para uma seringa e adiciona-o à porta esterilizado. Feche a porta.
- Marque o tempo de inoculação em um livro de registro.
- Também é importante ter uma amostra em vez de esterilização. Esterilizar a extremidade do tubo do tubo de colheita com álcool.
- Abra o grampo que cobre a porta colheita e usar uma seringa para tirar uma amostra. Esta primeira amostra é geralmente descartado porque se tem sentado no tubo.
- Use outra seringa para puxar outra amostra.
- Com uma terceira seringa, empurrar o ar para trás através do tubo para remover o máximo volume mortoa partir da linha e prender a linha off.
- Determinar a densidade de células e pH e registrar os valores. Com culturas microbianas, é útil para registrar valores de cada hora. Intervalo é a cultura dependente.
- Metodologia de colheita depende da intenção para a cultura após o término do crescimento. Neste caso, experimentar a cultura uma última vez para receber valores de ponto final para a densidade celular e possível pH ou medição do peso celular molhado. Abra o headplate eliminados os conteúdos em um designado "tanque matar" com lixívia ou outros agentes antimicrobianos.
Resultados
O biorreactor pode ser executada com ou sem o software IRIS. No entanto, para capturar dados, é melhor usar o software. Antes de adição de bactérias, os sensores de pH e oxigênio deve ser calibrado, o conjunto de velocidade do rotor eo conjunto de temperatura. Na Figura 2, a saída de dados para um biorreactor de execução é apresentado. A temperatura foi ajustada para 30 ° C, a velocidade do impulsor de 200 rpm. Os parâmetros podem ser diferentes para cada experiência, mas antes da adição de bactérias, o sistema deve estar no estado estacionário. Na Figura 3, a variação da concentração de oxigénio, com a adição da cultura bacteriana é mostrado. Os pontos de ajuste para esta experiência são 37 ° C, agitação a 200 rpm, O 2 a 70%. No momento 19:20, a bomba de alimentação fornece a cultura semente bacteriana em um OD de 0,1 causando uma queda de imediato no nível de O 2. O biorreactor responde ao O 2 nível mudando com o aumento do fluxo de ar e velocidade do impulsor. Tele set-points para os aumentos são definidos em cascata (passo 35). O pH do reactor foi monitorizada em tempo real, com a diminuição do pH, em seguida, aumentando, como demonstrado pela linha de flutuação do pH ao longo do tempo (Figura 4). Toda a execução pode ser analisada e os parâmetros ajustados para os experimentos posteriores.

Figura 1. Biorreator de bancada com todas as partes marcadas e ligadas. Esta figura mostra o reactor de tanque agitado, no início de uma corrida. As partes do reator são rotulados e incluem os sensores, rotor, medidor de temperatura, garrafas de alimentação e de amostragem, porta de escape, medidor de pressão de ar, câmara de aquecimento, torre de condensador, e painel de controle.

Figura 2. Imagem da tela do biorreator software no início da corrida. No início de uma corrida de tanque com agitação, a temperatura foi fixada em 30 ° C (linha verde), a velocidade do rotor para 200 rpm (linha vermelha), pH 6,5 (linha verde), e pO 2 em 57,2% (linha azul). Clique aqui para ver maior figura .
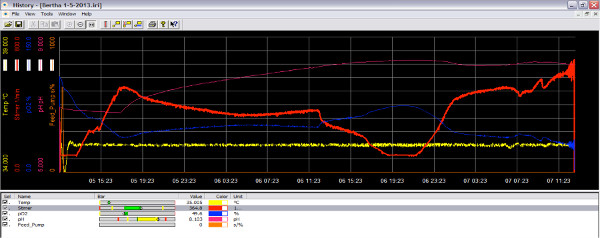
Figura 3. Imagem da tela do software biorreator durante a corrida como o oxigênio diminui. Quando a cultura está em fase de crescimento ativo, consome oxigênio ea quantidade de oxigênio no reator é reduzida (linha azul). Através do aumento da velocidade do rotor, mais oxigénio pode ser adicionado à cultura (linha a vermelho). clique aqui para ampliar figura .

Figura 4. A imagem do ecrã de software bioreactor que mostra a mudança do pH ao longo do tempo. Se o pH da cultura é monitorizado continuamente ao longo do tempo e diminui à medida que o ácido láctico é produzida e, em seguida, aumenta como base é adicionada ao bioreactor (linha azul). clique aqui para ampliar figura .
Discussão
Biorreatores de tanque agitado são o padrão da indústria de biotecnologia e têm sido utilizados por mais de 40 anos 1. O pequeno tanque agitado tem sido importante para o aumento de escala, escala-down, otimização de tensão, caracterização e desenvolvimento de processos. Também pode ter um papel importante no desenvolvimento da medicina individualizada 2. O biorreator de pequena escala é mais parecida com condições in situ para o crescimento celular, porque ele pode ser monitorado e otimizado ao longo de um prazo. Na maioria das vezes, as experiências iniciais são realizadas usando balões de agitação, mas as condições no biorreactor de pequena escala difere significativamente do balão de agitação. Em um experimento verificou-se que as condições para o crescimento ideal do E. coli e a produção de Proteína Fluorescente Verde (GFP) no frasco de agitação não se traduziu para o tanque agitado (dados não publicados).
Outros métodos de células cultivadas em larga escala incluem garrafas de rolo, único use balançando biorreatores plataforma 3 e maiores biorreatores de uso único com volumes de trabalho de 50 para 5.000 L. Cada método oferece desafios para scale-up, mas encontrou um lugar em produção. O uso único de balanço plataforma bioreactor é semelhante ao tanque agitado, e proporciona um ambiente regulado. Difere do tanque agitado em que a mistura ocorre devido um movimento de balanço para gerar ondas para impedir a sedimentação das células e fornecer oxigenação. A hidrodinâmica para este método são diferentes do tanque agitado e volume máximo é limitado a 1,000 L. As diferenças podem afectar o crescimento celular e produção de produto. Outros sistemas de uso único combinar o tanque agitado com o reator descartável para, fornecer uma plataforma com um mínimo de infra-estrutura e sobrecarga associada, ea capacidade de high-throughput Bioprocessing 4.
Novos usuários de biorreatores de bancada pode ter problemas para determinar valores nominais iniciais para pH, pO 2 e temperaturatura, no entanto, a pesquisa publicada pode ser referenciado por esta informação 5, 6, 7, 8, 9. Com culturas de bactérias, em particular, recomenda-se iniciar a agitação à mesma velocidade que o balão agitador e a temperatura ao mesmo ponto de ajuste. Cultura de pH a partir de frascos de agitação é executado anteriores também podem ser utilizadas como um ponto de partida. Ajuste do valor pO 2 é mais difícil e normalmente é determinado empiricamente. No entanto, começando com 50% pO 2 é um ponto de partida recomendado.
Divulgações
Autor A. Magno é um funcionário da ATR Biotech que produz reagentes e instrumentos utilizados neste artigo.
Agradecimentos
Este projeto foi o apoio em parte pela Johns Hopkins University, Gabinete do Reitor através da Iniciativa Ciência Gateway.
Materiais
| Name | Company | Catalog Number | Comments |
| LB broth | Sigma | L3022 | |
| ampicillin | Sigma | A1593-25G | |
| LB broth | Sigma | L3022 | |
| antifoam 204 | Sigma | A8311 | |
| 1 M Sodium Hydroxide | Sigma | 38215-1EA-R | |
| Reference Buffer, pH 4.00 | Sigma | B5020 | |
| Reference Buffer, pH 7.00 | Sigma | B4770 | |
| pO2 probe electrolyte | Broadley James | AS-3140-C30-0025 | |
| 0.45 micron filter | Cole Parmer | EW-02915-22 | |
| 0.22 micron filter | Cole Parmer | EW-29950-40 | |
| Luer Lock syringe, 10 mL | Cole Parmer | EW-07940-12 | |
| Minifors Bioreactor | Infors HT | B-Pack 5.0 | |
| Air Admiral air pump | Cole Parmer | EW-79202-00 | |
| 1175 PD Chilling circulator | VWR | 13721-204 |
Referências
- Shuler, M., Kargi, F. Bioprocess Engineering Basic Concepts. , 2nd, Prentice Hall. Upper Saddle River, NJ. (2002).
- Hambor, J. Bioreactor Design and Bioprocess Controls for Industrialized Cell Processing. BioProcess International. 10 (6), 22-33 (2012).
- Wave [Internet]. , GE Life Sciences. Available from: http://www.gelifesciences.com/webapp/wcs/stores/servlet/catalog/en/GELifeSciences-US/brands/wave (2012).
- Xcellerex [Internet]. , GE Life Sciences. Available from: http://www.xcellerex.com/platform-xdr-single-use-bioreactors.htm (2012).
- Julien, C., Whitford, W. Bioreactor, Monitoring, Modeling and Simulation. BioProcess International. 5 (01), S10-S17 (2007).
- Fike, R. Nutrient Supplementation Strategies for Biopharmaceutical Production. Part 1: Identifying a Formulation. BioProcess International. 7 (11), 46-52 (2009).
- Jana, S., Deb, J. K. Strategies for efficient production of heterologous proteins in Escherichia coli. Appl Microbiol Biotechnol. 67, 289-298 (2005).
- Wang, Z., Ly, M., Zhang, F., Zhong, W., Suen, A., Hickey, A. M., Dordick, J. S., Linhardt, R. J. E. coli K5 fermentation and the preparation of heparosan, a bioengineered heparin precursor. Biotechnol. Bioeng. 107, 964-973 (2010).
- Baltz, R. H., Demain, A. L., Davies, J. E. Manual of Industrial Microbiology and Biotechnology. , 3rd, ASM Press. Washington DC. (2010).
- Bioreactors [Internet]. , Applied Technical Resources. Available from: http://www.atrbiotech.com/pdfs/bioreactors.pdf (2012).
- Infors, H. T. Minifors operating Manual and user guide. , Bottmingen, Switzerland. Forthcoming.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados