Method Article
Эксплуатация настольной биореактора
В этой статье
Резюме
Ферментеры используются для повышения урожайности культуры и продуктивности биоинженерных клеток. После проверки нескольких микробных или животных кандидатов клеточных культур в колбах, следующим логическим шагом является увеличение биомассы от выбранной культуры с ферментер. Это видео демонстрирует настройку и работу типичной системе настольный биореактора.
Аннотация
Брожение системы используются для обеспечения оптимальных условий роста для многих различных типов клеточных культур. Возможность, предоставляемая ферментаторах тщательно контролировать температуру, рН и концентрации растворенного кислорода в частности делает их необходимо эффективного роста крупномасштабной и экспрессии продуктов брожения. Это видео будет кратко описать преимущества ферментер над вибрирующей колбе. Она также определит ключевые компоненты типичного настольного системы ферментации и дать базового обучения на установке судна и калибровки его зондов. Зритель будет ознакомился с процессом стерилизации и показали, как привить питательную среду в сосуде с культурой. Также будет продемонстрировано Основные понятия работы, отбора проб, и уборки урожая. Также будут обсуждаться Простой анализ данных и системы очистки.
Введение
Базовая технология ферментации является продолжением той простой встряски техники колбы для выращивания культур. Он вырос из желания контролировать среду роста для живых культур в более полной и количественно. Пакетные посеву колбы, как правило, ограничивается неточной контроля температуры. Однородность температуры в шейкер-инкубатор или теплом помещении сильно варьирует, иногда отклоняясь от 5 ° C или более от предполагаемого уставки. Поскольку вибрирующей колбе обычно перемешивают при фиксированной скорости, потребление кислорода и газообмен ограничено. Как только доступны окружающей среды кислород исчерпан, большинство культур не в состоянии процветать. Там нет никакого контроля рН в колбах. Во многих случаях, если культура не ограничивается сырья, становится кислым до точки ущерб культуре и дыхание резко замедляется. Большинство культур вибрирующей колбе также работать в качестве "партии", что означает, что они питаются только один раз на или вблизи начала культур inoculatioн. После этого первоначальный источник углерода потребляется, культура прекращает расти. В некоторых случаях его метаболизм может смещаться и начинают потреблять другие метаболиты в культуральном бульоне, иногда изменения характеристик полученного биомассы или белка. Колбах также обычно подлежат медиа потери испарения в теплых условиях культуры, как правило, 10% от объема, приходящегося на 24 часа при 37 ° С Эта потеря изменяет плотность культуры и запрещает длительный срок эксплуатации системы. Наконец, пользователь может столкнуться с пеной из средств массовой информации после агитации. Возникновение пены в приведенном выше культуре свободном пространстве будет ограничивать газообмен и дальнейший рост задушить.
Основная система ферментации предназначен для решения всех этих ограничений. Тщательный контроль температуры достигается в ферментационных сосудов с помощью крыльчатки перемешивания и нагревательной рубашкой. Датчик вставляется в емкость и обратной связи контроля нагрева и охлаждения этой куртке обычноРезультаты в температурного контроля ± 0,1 ° C вокруг уставки. Стационарные ферментеры как правило, обеспечивают контроль рН с помощью жидкостной того реагента через насос. Значение рН непрерывно контролируется в стремлении сохранить окружающую среду оптимальным для роста клеток. Правильное аэрации поддерживается вышеупомянутой смешивания рабочего колеса или с помощью инфузии воздух или кислород газа дополняться непосредственно в культуре. С сдвига чувствительных культур, кислород дополняется газ является основным механизмом для поддержания уровня кислорода в культуре. Измерение кислорода в растворе, как правило, достигается за счет полярографического зонда, который обычно не доступны для использования в колбах. Кроме того, можно непрерывно или периодически добавить канал в сосуд для поддержания роста в линейном или экспоненциальной форме. Выходящий газ конденсатор обеспечивает холодную поверхность для паров в потоке выхлопных газов для конденсации, таким образом, сохраняя объема культуры и плотность. Периодическое добавление противовспенивающего поверхностно приводитсяна датчик электропроводности в культуре, уменьшение пены на поверхности и позволяя газообмен.
Судно, со всеми зондами, фитинги, рабочие колеса, урожай трубы и трубки, собран и стерилизуют в стандартном автоклаве. После окончательного зонда калибровок и стабилизации к операционной среде, культура добавляется к судна. Затем система может быть использована, чтобы характеризовать культуру таким образом, что является более количественный и точным, чем с методом встряхивания флакона. Жесткий контроль температуры, рН, содержание кислорода, потребление корма, испарения жидкости и уровень пены способствуют гораздо более высокой биомассы и более высоким выходом белка.
протокол
- Начните работу с установки судна. Обычный ферментер имеет следующие компоненты, которые должны быть установлены (рис. 1):
- рН зонд - для измерения рН в живой культуры. Калибровка зонда перед установкой и стерилизовать с судна. Установите зонд в Headplate.
- рО 2 зонда - для измерения содержания растворенного кислорода внутри сосуда в процессе ферментации. Установите в Headplate.
- Урожай труба для отбора проб культуру. Установите это регулируемый компонент высоты в Headplate.
- Газ барботер - находится в нижней части сосуда и обеспечивает вливание газа в культуре. Крюк барботер до источника газа на ферментер и смонтировать в Headplate.
- Рабочее колесо вал и рабочее колесо - крыльчатка вызывает культуру и имеет решающее значение для поддержания культуры единообразия в сосуде.
- ОГ конденсатор - в пресечении потери за счет испарения в сосуде при охлаждении путь выхлопных газов.
- Реагент насосные линии для контроля рН или подачи того.
- Очистите судно и Headplate водой с мылом. Мягкая щетка рекомендуется для чистки судно и Headplate. Bleach или очистители с хлором не может быть использован для очистки судна.
- Если носитель не термолабильный, добавьте его в чистом сосуде. Только добавить до максимальный объем рабочего не будет достигнута. В этом случае максимальный рабочий объем составляет 3,3 л на 5 л общий объем судна.
- Установите Headplate сосудов, гарантируя, что уплотнительное кольцо правильно установлен.
- Установите конденсатор выхлопных газов.
- Установите пеногаситель зонд в его 10 мм порт.
- Установите урожая трубу в ее 10 мм порт. Положите кусок трубы на вершине ее и зажмите его.
- Установите трубку и фильтр 0,20 мкм на входе промывной а затем зажать это от.
- Калибровка рН электрод:
- Соберите 2 Ссылка буферы в небольших стаканах, бутылка мытья и запасной ваш стакан.
- Крюк рН зонда до ферментера и поверните ферментера на.
- Выделите параметра рН и с помощью кнопки меню, выделите опцию "CAL ', и нажмите" Enter ".
- Выберите '2 'для калибровки 2 точки.
- Смыть наконечник щупа и погрузите в низком базовом буфере. Значение на ферментер стабилизируется. Используя клавиши + и -, отрегулируйте значение на дисплее, чтобы соответствовать значению базового буфера рН. Как только он перестанет мигать, нажмите "Enter".
- Вымойте щуп с и вставить его в второй базового буфера. Разрешить значение для стабилизации и затем с помощью клавиатуры, чтобы отображаемое значение соответствует высокое значение буферной отсчета. Нажмите "Enter" для подтверждения.
- Промойте наконечник зонда и отсоедините его от ферментера. Положите защитный колпачок на связи и установить его в Headplate.
- Откройте щуп РО 2 и убедитесь, что тамдостаточно, чтобы покрыть электролит наконечник. Если нет, добавьте некоторые в резервуар и закрыть его обратно вверх.
- Установите рО 2 зонд в Headplate и убедитесь, что в автоклав крышка ставится на для защиты своих электрических соединений. Он будет откалиброван после стерилизации.
- Получение бутылку для подачи реагента с погружной трубкой и воздушного фильтра. Добавить трубки насоса к порту погружной трубкой и прикрепите другой конец к входному отверстию на ферментер.
- Место трубки на всех неиспользуемых портов, то зажим трубки выключен.
- Установите фильтр 0,45 мкм на конденсаторе выхлопных газов. Этот фильтр обеспечивает то, что судно не оказывать давление в автоклаве.
- Убедитесь, что все трубы, которые идут ниже уровня СМИ зажаты, чтобы предотвратить носитель из выходит.
- Поместите сосуд в автоклаве в течение 25 - 30 мин при 121 ° С, жидкого цикла. Внимание: Когда дело доходит, что это будет очень жарко.
- Установите сосуд на бродильного базы.
- Подключите рНисследовать кабель.
- Прикрепите зонд кабель рО 2.
- Крюк Барботер по итогам газа сложения ротаметра.
- Стерильно добавить 1 М NaOH реагента к бутылке с погружной трубкой и установить головку насоса на голову шпинделя база насоса.
- Положите датчик температуры в защитной гильзы на Headplate. Убедитесь, что она идет все пути к дну гильзы.
- Опустите агитационную руку на сосуды крыльчатки муфты.
- Убедитесь, что ферментер включен.
- Убедитесь, что вода доступна в ферментер.
- Включите подачу воздуха в ферментер.
- Выделите параметра температуры и установите температуру на 37 ° С Нажмите кнопку «Enter», чтобы начать контроль температуры. Судно будет нагреваться в 15 мин или меньше.
- Включите подачу газа до 1 объемом емкости носителя в минуту или меньше. Для этого созданы, поток газа 3 л / мин. Пузыри должен появиться в нижней части.
- Выделите агитационной рarameter и установить до 300 оборотов в минуту. Нажмите "Enter", чтобы включить агитации.
- Как только температура достигла 37 ° С, выделите параметр рН и установить его на 6,8. Поверните регулятор рН, нажав на кнопку "Enter".
- Установите агитацию к максимальной скоростью 1000 оборотов в минуту для бега.
- Убедитесь, что рО2 зонд поляризован правильно для правильного отображения значения. Через 2 часа, выделите параметр рО 2 и использовать кнопку 'Menu', чтобы выбрать "Калибровка Function" и выберите калибровку 1 очко.
- Через 15 мин, использовать курсоры для установки значения до 100 и нажмите «Enter». Это позволит откалибровать рО 2.
- Выделите агитации и установить до 300 оборотов в минуту.
- С помощью кнопки 'Menu', поверните 'Каскад', чтобы 'на' в меню агитации. Это позволит увеличить скорость агитации в попытке крошить пузырьки воздуха и заставить больше кислорода в растворе в виде увеличения спроса рост.
- Выделите параметра рО 2 и установите значение до 30. Нажмите кнопку «Enter», чтобы начать рО 2.
- Запустите программный пакет управления на ПК.
- После того, как зонды откалиброван, возбуждение стабилен при 300 оборотах в минуту, температура при 37 ° С и рН близка к 6,8, настало время для инокуляции. Прием алкоголя, стерилизовать порт, который будет использоваться для прививки.
- Нарисуйте посевной в шприц и добавить его в стерилизованные порт. Закройте порт.
- Отметить время прививки в журнале.
- Важно также, чтобы взять пробу во время стерилизации. Стерилизовать конец сбора урожая трубы трубы с алкоголем.
- Откройте зажим, закрывающую урожая порт и использовать шприц нарисовать образец. Этот первый образец обычно отбрасывают, так как он сидел в трубе.
- Используйте другой шприц, чтобы вытащить другого образца.
- С третьего шприца, толкать воздух обратно через трубу, чтобы удалить как можно больше мертвого объемаот линии и зажмите линию прочь.
- Определение плотности клеток и рН и записать значения. С микробных культур, полезно для регистрации значений каждый час. Интервал культуры зависит.
- Методология Урожай зависит от намерений к культуре после роста будет завершена. В этом случае образец культуре в последний раз на получение конечных значений плотности клеток и, возможно, рН или измерения веса влажной клеток. Откройте Headplate расположенный содержания в специально отведенном «убить танка» с отбеливателем или других противомикробных препаратов.
Результаты
Биореактор может работать с или без программного обеспечения IRIS. Однако для сбора данных, то лучше использовать программное обеспечение. Перед добавлением бактерий, рН и кислорода датчики должны быть откалиброваны, скорость набора рабочего колеса и заданной температуры. На рисунке 2, выходные данные для биореактора перспективе представлен. Температура была установлена на 30 ° C, скорость крыльчатки при 200 оборотах в минуту. Параметры могут быть различными для каждого эксперимента, но перед добавлением бактерий, система должна быть в стабильном состоянии. На фиг.3, изменение концентрации кислорода с добавлением бактериальной культуры показано. Установочные значения для этого эксперимента 37 ° С, мешалку при 200 оборотах в минуту, O 2 на 70%. Во время 19:20, подающий насос подает бактериальный посевной культуры на OD 0,1 вызывает сразу же падение уровня O 2. Биореактор отвечает на изменения O 2 уровня с увеличением воздушного потока и рабочего колеса скорости. Тон уставки для увеличения устанавливаются в каскаде (шаг 35). Реактор рН мониторинг в реальном времени, с рН уменьшается, то увеличивается, о чем свидетельствует рН линии флуктуации во времени (рис. 4). Вся трасса могут быть проанализированы и параметры скорректированы с учетом последующих экспериментов.

Рисунок 1. Настольная биореактор со всеми частями меченых и связаны между собой. Эта цифра показывает реактор с мешалкой в начале пробега. Части реактора помечены и включают в себя датчики, рабочее колесо, датчик температуры, кормовые и отбора проб бутылки, выпускное отверстие, датчик давления воздуха, отопления куртку, конденсатор башню и панель управления.

Рисунок 2. Изображение на экране из биореактора Софtware в начале перспективе. В начале с мешалкой перспективе, температура была установлена на уровне 30 ° C (желтая линия), скорость крыльчатки в 200 оборотов в минуту (красная линия), рН 6,5 (зеленая линия), и рО 2 на 57,2% (синяя линия). Нажмите здесь, чтобы увеличить рисунок .
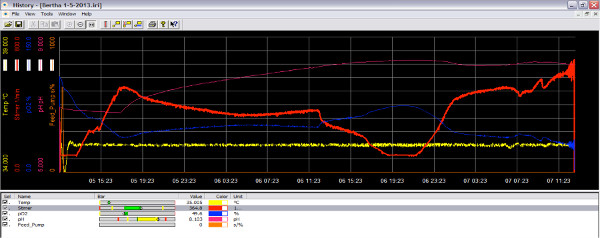
Рисунок 3. Изображение на экране из биореактора программного обеспечения во время бега как кислород уменьшается. Когда культура находится в активной фазе роста, он потребляет кислород и количество кислорода в реакторе уменьшается (синяя линия). Увеличивая скорость вращения крыльчатки, больше кислорода могут быть добавлены к культуре (красная линия). Нажмите здесь, чтобы увеличить рисунок .

Рисунок 4. Изображение на экране из биореактора программного обеспечения, показывающий изменение рН с течением времени. The рН среды постоянно контролируется и с течением времени уменьшается, как молочная кислота производится, а затем увеличивается как основание добавляют в биореактор (синяя линия). Нажмите здесь, чтобы увеличить рисунок .
Обсуждение
Stirred биореакторы бак являются стандартным в биотехнологической отрасли и были использованы на протяжении более 40 лет 1. Мешалкой Небольшой имело важное значение для МАСШТАБА, масштаб вниз, оптимизации деформации, описания, и процесс развития. Он также может играть важную роль в развитии индивидуального медицины 2. Мелкий масштаб биореактор, наиболее похожий на месте условий для роста клеток, потому что это можно контролировать и оптимизированы на протяжении пробега. Чаще всего, первые эксперименты выполняются с использованием колбах, но условия в малых масштабах биореакторе значительно отличаться от встряхивания флаконов. В одном эксперименте мы обнаружили, что условия для оптимального роста E. палочка и производство зеленого флуоресцентного белка (GFP) в вибрирующей колбе не перевести на перемешивающего резервуара (неопубликованные данные).
Другие методы выращивания клеток в больших масштабах включают роликовые бутылки, один Uсебе качающейся платформе биореакторы 3 и более крупные биореакторы одноразового использования с рабочими объемами от 50 до 5000 L. Каждый метод обеспечивает вызовы для его увеличения, но нашел место в производстве. Одноразовый биореактор качающейся платформе аналогична перемешивающего резервуара, и обеспечивает регулируемую среду. Он отличается от перемешивающего резервуара в этой перемешивания происходит за счет качания движение генерировать волны для предотвращения клеток оседание и обеспечивают кислородом. Гидродинамика для этого метода отличаются от перемешивающего резервуара и максимальный объем ограничен 1000 L. Различия могут повлиять на рост клеток и производство продукта. Другие системы одноразового использования сочетать с мешалкой с одноразовой реактора, обеспечить платформу с минимумом инфраструктуры и связанных с ними издержек, а также возможность для высокой пропускной Bioprocessing 4.
Новые пользователи настольных биореакторах могут иметь проблемы определения начальных уставки для рН, рО 2 и температурахтемпературы, однако опубликованных исследований можно ссылаться на эту информацию 5, 6, 7, 8, 9. С бактериальных культур, в частности, рекомендуется, чтобы начать перемешивание при той же скоростью, что и шейкер колбу и температуры, в то же заданного значения. Культура рН от предыдущих колбах трасс можно также использовать в качестве отправной точки. Установка значения рО 2 является более трудным и, как правило, определены эмпирически. Однако, начиная с 50% рО 2 является рекомендуемым отправной точкой.
Раскрытие информации
Автор А. Магно является сотрудником ATR Biotech, которая производит реагенты и инструменты, используемые в этой статье.
Благодарности
Этот проект был поддержку в части Университета Джонса Хопкинса, Управлением Прово рамках Инициативы шлюза Science.
Материалы
| Name | Company | Catalog Number | Comments |
| LB broth | Sigma | L3022 | |
| ampicillin | Sigma | A1593-25G | |
| LB broth | Sigma | L3022 | |
| antifoam 204 | Sigma | A8311 | |
| 1 M Sodium Hydroxide | Sigma | 38215-1EA-R | |
| Reference Buffer, pH 4.00 | Sigma | B5020 | |
| Reference Buffer, pH 7.00 | Sigma | B4770 | |
| pO2 probe electrolyte | Broadley James | AS-3140-C30-0025 | |
| 0.45 micron filter | Cole Parmer | EW-02915-22 | |
| 0.22 micron filter | Cole Parmer | EW-29950-40 | |
| Luer Lock syringe, 10 mL | Cole Parmer | EW-07940-12 | |
| Minifors Bioreactor | Infors HT | B-Pack 5.0 | |
| Air Admiral air pump | Cole Parmer | EW-79202-00 | |
| 1175 PD Chilling circulator | VWR | 13721-204 |
Ссылки
- Shuler, M., Kargi, F. Bioprocess Engineering Basic Concepts. , 2nd, Prentice Hall. Upper Saddle River, NJ. (2002).
- Hambor, J. Bioreactor Design and Bioprocess Controls for Industrialized Cell Processing. BioProcess International. 10 (6), 22-33 (2012).
- Wave [Internet]. , GE Life Sciences. Available from: http://www.gelifesciences.com/webapp/wcs/stores/servlet/catalog/en/GELifeSciences-US/brands/wave (2012).
- Xcellerex [Internet]. , GE Life Sciences. Available from: http://www.xcellerex.com/platform-xdr-single-use-bioreactors.htm (2012).
- Julien, C., Whitford, W. Bioreactor, Monitoring, Modeling and Simulation. BioProcess International. 5 (01), S10-S17 (2007).
- Fike, R. Nutrient Supplementation Strategies for Biopharmaceutical Production. Part 1: Identifying a Formulation. BioProcess International. 7 (11), 46-52 (2009).
- Jana, S., Deb, J. K. Strategies for efficient production of heterologous proteins in Escherichia coli. Appl Microbiol Biotechnol. 67, 289-298 (2005).
- Wang, Z., Ly, M., Zhang, F., Zhong, W., Suen, A., Hickey, A. M., Dordick, J. S., Linhardt, R. J. E. coli K5 fermentation and the preparation of heparosan, a bioengineered heparin precursor. Biotechnol. Bioeng. 107, 964-973 (2010).
- Baltz, R. H., Demain, A. L., Davies, J. E. Manual of Industrial Microbiology and Biotechnology. , 3rd, ASM Press. Washington DC. (2010).
- Bioreactors [Internet]. , Applied Technical Resources. Available from: http://www.atrbiotech.com/pdfs/bioreactors.pdf (2012).
- Infors, H. T. Minifors operating Manual and user guide. , Bottmingen, Switzerland. Forthcoming.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены