このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
新生児低酸素性虚血性脳症の子豚モデル
要約
Hypoxic-ischemic encephalopathy following perinatal asphyxia can be studied using animal models. We demonstrate the procedures necessary for establishing a piglet model of neonatal hypoxic-ischemic encephalopathy.
要約
低酸素性虚血性脳症(HIE)を引き起こす出生時仮死は、全世界で066万死亡、毎年、世界で290万新生児死亡の約四分の一を占めています。 HIEの動物モデルは、HIEにおける病態生理の理解に貢献した、とによる周産期仮死に脳損傷で発生する動的なプロセスを強調しています。したがって、動物試験は、ポスト侮辱の治療戦略のための時間窓を示唆しています。低体温はpdigletモデルのHIEの治療薬としてテストされ、その後、臨床試験で有効であることが証明されました。モデルのバリエーションは、補助的、神経を保護する方法の研究に応用されているとキセノンとメラトニンの子豚の研究は、臨床段階にIとIIの試験1,2をリードしてきました。子豚のHIEモデルは、さらに新生児resuscitation-と血行動態研究のためだけでなく、細胞レベルでの脳低酸素の調査で使用されています。しかし、それは技術的に困難であり、プロトコルでモデルおよび変形があまりにも軽度または厳しすぎる脳損傷のいずれかになることがあります。本稿では、新生児のHIEの安定した子豚のモデルを確立するために必要な技術的な手順を示しています。まず、新生児子豚(<24時間古い、中央値量1500 g)を、麻酔し、挿管し、新生児集中治療室で見られるものと同等の設定で監視されています。グローバル低酸素虚血は、グローバル低酸素症、低血圧を介して虚血および脳の低酸素症を示す平坦なトレース振幅集積EEG(aEEG)を達成するために、吸気の酸素割合を低下させることにより誘導されます。生存aEEG応答および血圧に応じて酸素供給を調整することによって促進されます。脳損傷は、72時間後に組織病理学および磁気共鳴イメージングによって定量化されます。
概要
周産期仮死は、低酸素性虚血性脳症(HIE)に伴う急性、しばしば予測できない状態です。このプロトコルの全体的な目標は、周産期の低酸素性虚血性脳症の子豚の生存モデルを実証することです。このモデルは、新生児の脳に、実験神経病理、磁気共鳴イメージング及び分光法に治療(MRIおよびMRS)と、血液、脳脊髄液および尿などの体液中のバイオマーカーの低酸素虚血の様々な程度の効果を調査するために使用することができ。モデルはまた、世界的な低酸素性虚血に影響を受けているのすべては心血管系、呼吸器系、腎臓および肝臓を、調査するのに有用であることが証明されました。
周産期仮死が損なわ酸素供給分娩のまたは即時産後期間で結果です。分娩低酸素イベントは、世界中066万死亡、毎年、世界で2.9ミルの約四分の一を占めます2012年3における新生児死亡をイオン。2010年には115万の赤ちゃんは、出生時仮死4以下の新生児脳症を開発したと推定されました。妊娠34週後に生まれた乳児に脳症のように定義されたHIEは、先進国および発展途上国4 8.5 / 1,000出生まで1-3 /千出生5で発生します。死亡リスクは10〜60%であり、生存者30から100までパーセント6,7における神経学的ハンディキャップのリスク。 5020万障害調整生存年数(DALYs)が分娩低酸素イベント4に起因しています。現在、HIEのための支援以外の唯一の治療は低酸素後低体温です。このように、診断手順と治療戦略の進歩は、HIE 8の管理を改善することが不可欠です。
周産期仮死と新生児の脳損傷の管理後の予後の改善は、基礎疾患メカニズムの知識を拡大するに基づいていますD可能な治療。異なる臨床イベントがHIEにつながる可能性があり、任意の単一の出産センターでの発生率が低い5であるとしてHIEの動物モデルは、特に有用です。新たな予後および診断ツールおよび治療戦略をテストする場合、生物学的変動の影響を最小限に抑えることが可能な実験装置は、不可欠です。動物モデルは、このように誘導された損傷および疾患it's結果9に関与する動的なプロセスの基礎となる病理学的メカニズムの理解に貢献し、可能な限り厳密に臨床状況に近づける必要があります。新生児のHIEの動物モデルは、齧歯類、ラム、およびブタなどの種の数を、含まれています。比較では、生まれたばかりの子豚は、配信11,12時の大きさに対して、心血管系10と脳の成熟度と人間の新生児に対して高い類似性を有しています。子豚モデルにおける監視、計測および結果の評価はTHAに似ていますHIEの乳児の臨床ケアに使用されるT。したがって、このモデルから新生児ケアへの翻訳の高度があります。
周産期の低酸素症とHIEの子豚のモデルは、多くのグループによって使用され、領域13の数が変化しています。実験の目的に応じて、細心の注意は、薬の選択に低酸素虚血、発作の持続期間と重症度を制御する方法であって、後の侮辱の蘇生とケア、およびアウトカム評価を誘導する方法を支払わなければなりません。バイアスを避けるために、ランダム化試験のデザインは常に介入の研究に使用されるべきです。
低酸素性虚血性損傷を誘導する際に適用される方法が重要です。 HIEにつながるグローバル低酸素症は、多くの場合、脳、心臓、肺、腎臓および肝臓を含む多臓器不全をもたらします。評価結果に応じて、HIEのモデルは、局所虚血、 例えばに頼るのではなく、グローバルな低酸素症および虚血に基づくべきである。、車を連結することによってotid動脈14。 > 40ミリメートルHgの2平均動脈血圧を維持しながら、最近の論文では、低酸素症(のFiO 2 12%)と頚動脈圧縮の組み合わせを適用しました。別のグループは、負の塩基過剰> 20ミリモル/ Lまでの8%O 2によってグローバル低酸素症を誘発したり、動脈血圧(MABP)<15ミリメートルHgのを意味し、4時間15で動物を犠牲にしました。低酸素症は、心臓出力によって滴定された、MABP(ベースラインの30〜40%)と動脈血のpH(6.95から7.05)16(30〜35ミリメートルHgまで)。
このレポートに表示されるものと同様のaEEG抑制により滴定グローバル低酸素虚血のモデルは、電気生理学的、臨床的である脳症を実証し、窒息用語の乳児17,18に見られる状態に神経病理学的に匹敵しています。
誘導されたHIEの程度は必要不可欠です。 HIEの有用な動物モデルは、新しいDIAのテストのために許可する必要がありますグノーシス主義手順や治療法の選択肢。これを可能にするために、モデルは、新しい治療法を評価する際にあまり関係であろうほとんど、あるいは全く治療の可能性を伴う重度の脳損傷などの治療可能性がある中程度のHIEを誘導するはずです。低酸素に対する耐性は、試験動物の間でかなり変化します。以前の研究は、より一貫性の脳損傷を達成することができることを示しており、より多くの動物は、振幅統合脳波(aEEG)によって評価し、それぞれの子ブタの脳応答に従って誘発される低酸素症の個別化ではなく、全体集合のFiO 2値を用いて17,19に耐えること低酸素性イベント。 aEEG抑制の持続時間は、いくつかの組織病理学的変化45分aEEG抑制<20分aEEG抑制および重度の発作がで増加>で、脳損傷の程度に相関します。 HIEのための神経保護治療の最近のレビューは、行動結果のMEASを可能にする生存モデルの必要性を確認し動物モデル20でURES。
提示HIEの子豚のモデルの多くの利点があります。これは、結果は人間の生理に変換可能性が高い種に基づいています。 aEEGによるグローバル低酸素性虚血モデル多臓器不全や低酸素虚血の滴定は、バイオマーカーは、MRIや行動が関連する時間点で評価することができるように、生存の臨床関連の転帰と脳損傷の一貫した度を誘導します。
周産期仮死とHIEのピグレットモデルはHIEの病態生理に現在の洞察力に大きく貢献しただけでなく、成功し、最終的にヒトでの新しい治療法で、その結果、臨床試験を先行しています。ピグレットモデル研究は、HIE 21の治療として低体温を確立する上で重要な役割を果たし、および新生児蘇生研究22で使用されています。窒息とHIE、AN内の研究を行う際に、様々なグループが子豚のモデルを使用していましたD研究は低体温23、α-メラニン細胞刺激ホルモン24、心停止25、チロシンヒドロキシラーゼ活性26、反復低酸素暴露27、NMDA受容体活性14を含み、近赤外分光法28。
手続きの過程で微調整があまりにも軽度または厳しすぎる脳損傷29,2のいずれかになることがあり、このレポートに表示される子豚HIEモデルは、で動作するように技術的に困難です。我々は、既存の文献は、以前に発行されたモデルを再現するために十分な詳細を欠いていたことがわかりました。そこで、ここではHIEの研究のためのこの高度なモデルを確立するために研究者を可能にする、このレポートの子豚72時間生存モデルの確立のために必要な技術的な手順の各ステップを示しています。
プロトコル
本プロトコルは、デンマークの動物実験検査官によって承認されました。すべての試験動物は、手順全体で麻酔しました。このプロトコルの再生は国家の倫理と動物福祉のガイドラインに従って行われ、地元の倫理委員会によって承認されなければなりません。
1.動物
- 2000グラム - 約1,500の重量を量るデンマークランドレースの子豚<24時間古いです。
2.麻酔とメンテナンス流体
- 生理食塩水、プロポフォール(5ミリグラム/ kg)を、フェンタニル(10μgの/ kg)を、およびプロカインのベンジルペニシリンとセボフルラン投与用のマスク、アルコール綿棒、末梢静脈カテーテル、ゴムバンド、注射器:麻酔のために必要な機器( 図1)を準備(15,000 IU / kg)を。
- 呼吸マスクを介して1〜2%のセボフルランを提供することにより、麻酔を誘導します。
- 眼瞼と撤退REFLのために評価することによって麻酔の深さを評価しますEXEファイル。子豚が深く麻酔されていることをすると、特定の、経皮的に耳静脈に末梢静脈カテーテルを挿入します。
- 末梢静脈カテーテルの開存性を確認するために、滅菌0.9%生理食塩水1〜2mlのでカテーテルをフラッシュします。プロポフォール(5mg / kg)およびフェンタニル(10μgの/ kg)をボーラス注射を管理します。ボーラス注射投与に続いて0.9%滅菌生理食塩水を1〜2mlの用いた静脈内カテーテルをもう一度フラッシュします。
- 二つの別々のシリンジ注入ポンプでプロポフォール(10 mg / mlの)とフェンタニル(10μg/ ml)で置きシリンジ。静脈内カテーテルに接続されている単一のラインに注入を接合する三方活栓に2つのシリンジポンプから静脈管を接続します。連続静脈プロポフォールの注入(4-12 / kg /時間)とフェンタニル(10μgの/ kg /時間)を起動します。連続注入が実行されると、プロポフォールとフェンタニルのさらなるボーラス注射を与えていません。
- セボフルランガスanestの投与を中止hesia。
- 抗生物質の予防のための局所的なガイドラインに従って、皮下または筋肉内にプロカインベンジルペニシリン(15,000 IU / kgで)注入します。毎日繰り返します。ビデオは、子ブタに筋肉内投与と比較した場合、より高い血漿濃度およびより長い半減期をもたらすことが示されている皮下投与を示しています。
- 目の乾燥を防ぐために、眼の潤滑剤軟膏を適用します。ポケット状の開口部を形成するために、静かに下まぶたを下に引き出します。内ポケット軟膏の少量を絞ります。閉じる目は軟膏を配布します。毎時乾燥度をチェックし、必要に応じて再適用します。
- 5%デキストロース/ 10ミリリットル/ kg /時間で0.45%のNaCl IVの連続速度の注入を開始します。中および低酸素後に5ミリリットル/ kg /時間の速度を低下させます。 2~10ミリモル/ Lの間の血中グルコースレベルを維持するために注入速度を調整します。
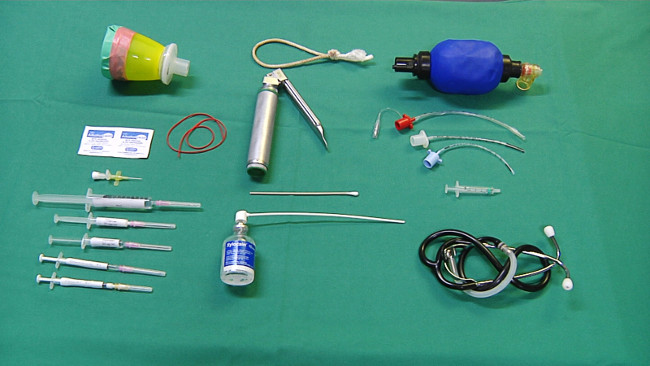
Figu麻酔および挿管1.機器再。 この図の拡大版を表示するには、こちらをクリックしてください。
3.挿管と換気
- オープニングのために筋弛緩、ロープスリング( 図1に示すように円を形成するために一緒に同じ4ミリメートルナイロンロープの両端を結ぶ)するため臭化ロクロニウム(1ミリグラム/ kg)を:挿管のために必要な機器( 図1)を準備口、綿(3.0ミリメートル、2.5ミリメートル、2.0ミリメートルのサイズ)、キシロカインスプレー(100 mg / mlの)、ストレート刃でカフを有する様々なサイズの気管内チューブを綿棒や獣医の喉頭鏡を傾け、500ミリリットル自己膨張バッグ(バッグバルブ換気、カフの膨張、および聴診器2 mlシリンジ用)マスク。
- 以下の手順で挿管:
- ストレート喉頭PASを確保するために、各側から首を支持する仰臥位で子豚を配置挿管用のセージ。
- 胸骨ノッチ(典型的には約13センチ)に鼻の先端から測定することによって、気管内チューブの長さを推定します。
- (下向きに)上顎の周りにロープスリングを置き、開いた口を維持するために上向きに下顎と舌を保持します。
- 筋弛緩を誘発するために臭化ロクロニウム(1ミリグラム/ kg)を静脈内投与します。
- 上向きに舌を持ち上げるために喉頭鏡を使用します。
- 食道に後方に曲がったか、軟口蓋の後ろにキャッチすることができるいずれかの子豚の長い喉頭蓋を、解放するために綿棒をひっくり返した綿を使用してください。
- 披裂軟骨と声帯の完全なビューを可能に舌根に対して持ち上げ喉頭蓋を維持するために喉頭鏡を進めます。
- 喉頭痙攣を防止するために、喉頭で局所的キシロカインスプレー(100 mg / mlの)を適用します。
- 声帯を通して気管内チューブを進めます。狭い気管軟骨の通過を補助するために回転運動を使用してください。アドバンス管アコ予め測定された距離にrding、手動換気のための自己膨張バッグ(バッグバルブマスク)に接続します。キシロカインスプレーで気管内チューブの遠位1/3に噴霧挿管中の摩擦を軽減します。
- 正しい気管内チューブの配置を確認するには、次の両方の肺への二国間の空気入口のリスニング胸をausculate、呼吸困難の兆候のための観察、視覚的に気管内チューブの近位側面に凝縮の存在を確認し、呼気終末炭素の存在を確認比色二酸化炭素検出器を備えた、または利用可能な場合、人工呼吸器の呼気CO 2読み取りにより二酸化。正常終末呼気二酸化炭素は約5%です。正常に見える波形と一緒に2%以上の値は、気管内チューブを気管内にあることを確認します。
- 誤嚥を防ぐために、気管内チューブカフを膨らませます。カフ膨張圧力は、虚血性損傷を避けるために、25未満センチH 2 Oであるべきです周囲組織へ。代わりに、気管内チューブを保持し、チューブの周りのテープ片を巻き、顎を閉じて所定の位置にチューブを固定するために鼻の周りにテーピング続けます。ゆっくりそれが所定の位置に留まることを確実にするために、チューブを引っ張ります。
- 人工呼吸器に気管内チューブを接続します。
- 人工呼吸器の設定を調整します。音量制御換気、一回換気量(TV):10ミリリットル/キログラム[または最大吸気圧(PIP)圧力制御換気で15 cm]で。呼気終末陽圧(PEEP)さ:5 cm。 I:E比1:2。呼吸数:35(4.5〜5.5キロパスカルの間に呼吸終期CO 2を維持するような速度を調整)。
4.監視と体液サンプリング
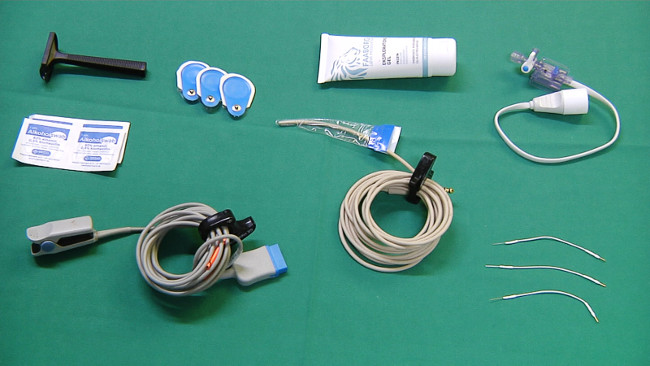
監視のため2.機器図。ANK ">この図の拡大版を表示するには、こちらをクリックしてください。
- 粘着テープ、滅菌潤滑剤、連続直腸温度測定用プローブ、心電図(ECG)電極、パルスオキシメータ、かみそり、およびEEG電極( 図2)を監視するために必要な機器を準備します。
- 後肢の上に置いて飽和プローブ、直腸温度プローブを潤滑し、直腸に6センチメートルを挿入し、38.5から39°Cの生理的レベルでの直腸温度を維持するためのオーバーヘッド放射ヒーターおよび/または加熱された膨張可能なエアマットレスを置き、場所ECG電極。
- 皮下注射針のEEG電極の配置は1センチ×1センチメートルの領域を剃るためにうつ伏せに子豚を配置。各耳の前の一つであり、ちょうど目の背後に正中線での参照電極。針電極を皮下に挿入し、アルコール綿棒で電極部位を清掃してください。仰向けPOに粘着テープと戻り子豚との安全な電極ジション。
- aEEGモニタの電源をオンにします。
注:EEG統合振幅は上下の余白との密なトレースから構成されています。このモデルでは、下部と上部の余白は、典型的には、乳児に見られるよりも高い場合が多い15〜50μVです。低酸素状態の間、それは注意することが重要である、ECGからのアーチファクトが誤ってaEEGトレースを高めることができます。ボーラス薬(プロポフォールやフェンタニル)は、一過aEEGトレースを抑制することができる、可能な場合、実験中に避けるべきです。薬物および臨床事象の投与はaEEGトレースの解釈を容易にするためにマークされる必要があります。
- 滅菌手袋、滅菌ドレープ、メス、アルコール綿棒、無菌ワイプ、臍帯静脈カテーテル(5 FR)、臍動脈カテーテル(3.5神父:中央動脈血圧監視および血液サンプリング( 図3)のための臍帯カテーテルを配置するために必要な機器を準備します)、縫合鉗子で設定し、湾曲したマイクロ鉗子、はさみ、針ホルダと縫合糸(例えば 、サイズ3-0)、透明接着剤パッチ、血液採取のために5ミリリットル注射器。
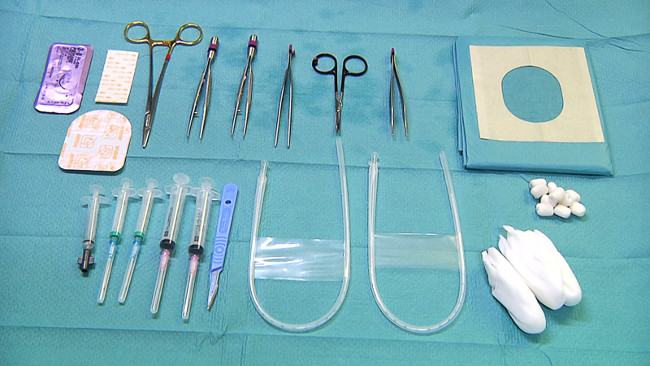
臍帯ラインと血液採取のため3.機器を図。 この図の拡大版を表示するには、こちらをクリックしてください。
- へその周りの領域を殺菌し、ドレープ。できるだけ皮膚に近い臍帯を切断するためにメスを使用してください。これは麻酔をかけ子豚で臍帯血管を公開しない場合には、血管を露出させるために2ミリメートル臍帯の下に臍の皮膚を切りました。二つの小さな臍動脈と1より大きい臍帯静脈( 図4)を特定します。
- 動脈( 図4)を拡張し、臍動脈カテーテルを挿入するために湾曲したマイクロピンセットを使用して(3.5 FR)。 3×体重(kg)を+ 10(剖検の腎動脈の上に下行大動脈に正しい配置に基づいて、実験式)のCMで推定挿入長。
- 5センチメートル臍帯静脈( 図4)に第5 Frのカテーテルを配置します。返血により血管内カテーテルの配置を確認してください。臍の周りに巾着縫合を配置することにより、カテーテルを固定し、縫合糸は臍カテーテルの周囲終了し、結び目を作る渡します。透明接着剤ドレッシングカテーテルをカバーしています。
- 予め指定された時点で血液サンプルを収集します。45分の低酸素侮辱4)低酸素発作後2時間の終わりに低酸素侮辱3)に1)直ちに低酸素前、2)30分。血液試料を実験のために他の時点の目的に応じて選択することができます。
- 低酸素虚血(表1)に起因する血液ガスの変化を確認するために、低酸素の間採取した血液試料から動脈血ガス分析を使用します。子豚は、低ヘモグロビンAを持っていることに注意してください(8グラム/ dLの周り)のt誕生と頻繁な採血から貧血になることがあります。 24時間以内にドローあたり2ml未満の血液/ kg体重未満、5ミリリットルの血液/ kg体重を撤回し、血液採取のために地元のガイドラインに準拠しています。貧血の兆候が減少ヘマトクリットおよび頻脈を含みます。
- 動脈内血圧モニタリング(MABP)を継続するためのモニターに動脈ラインを接続します。流体および薬物投与のための静脈ラインを使用してください。
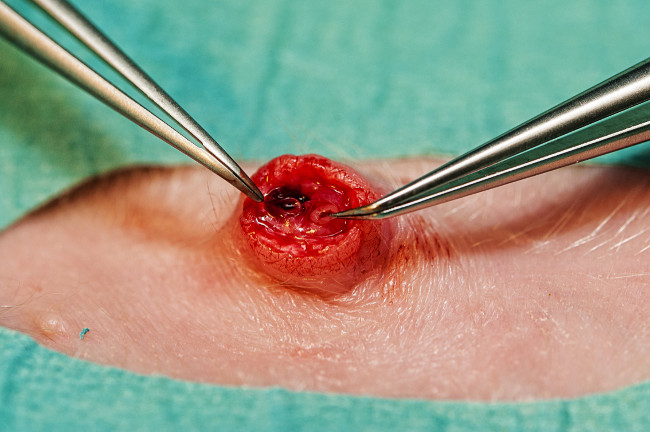
図4.臍帯血管。臍帯静脈(右)と2つの臍動脈(左)の一つ。 この図の拡大版を表示するには、こちらをクリックしてください。
5.低酸素
- 監視を完了した後60分を待ちます。 4%O 2へ切り替えることにより、低酸素を誘導 / 96%N 2のガス混合物。密接に重要なパラメータとaEEGを監視し、45分間低酸素状態を継続します。
- aEEGトレースは(上マージン<7μV)フラットになると、吸入酸素分画(のFiO 2)を変化させることによって、酸素を調整し、 図5に示すフローチャートに従ってフラットトレースaEEGを維持し、最高のFiO 2レベルに気道内圧を意味します。少なくとも10分間、および低血圧および虚血を確実にするために、下のFiO 2必要に応じてベースラインの70%未満にMABPを目指します。低血圧のレベルは、以前に記載の関連する低酸素性虚血性脳損傷を生成するために、他19,13,30によって示されています。
- 次のように重度の低血圧(MABP <25ミリメートルHgの)の場合、段階的に処理する:簡単に、1〜5%のFiOによって2を増加させる生理食塩水ボーラス(10ミリリットル/ kg)を、ドーパミンの点滴(5-20μgの/ kg /分)およびノルアドレナリンの注入(20 NG-を1μg/ kg /分)。
- > 10分(間代性、強直O持続発作の場合にはRミオクローヌス発作、一般的に限局またはaEEG振幅の急激な変化によって示されるように)()次の注射に進む前に30分を可能にして段階的に処理する:フェノバルビタールを静脈の遅いボーラスを20mg / kgを、フェノバルビタール静脈の20mg / kgのを繰り返し、ミダゾラムIVは0.5mg / kgです。
- 発作が開発し、薬物療法の安楽死に無反応である場合に表示されます。
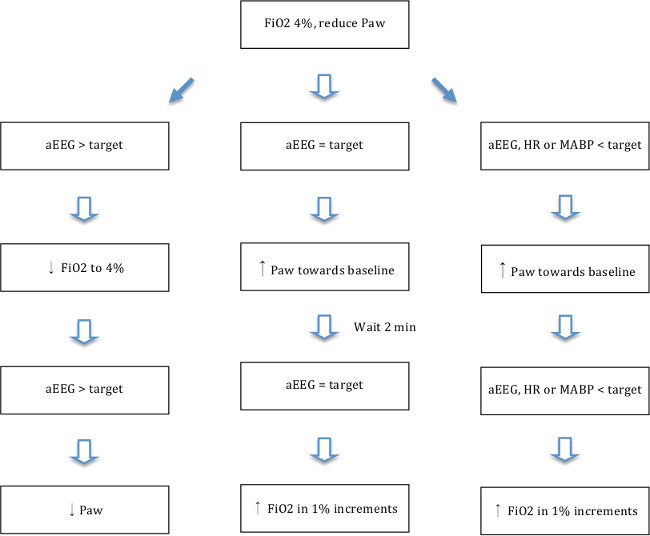
図5.低酸素性虚血フローチャート。フローチャートはaEEGの応答に応じて酸素の調整(F I O 2およびP AW)を示します。平均気道内圧(PのAW)は、(下のRRは下のP AWを与える)PIP / TVを変更する(下位PIPは、下部のP AWを与える)と呼吸数を調整しました。トレースの対象とaEEG =上部余白<5μVおよびトレースの下縁> 3μV(平均4μV)。ターゲット心拍数(HR)=> 80ターゲットは、平均動脈圧(MABP)= MABP> 25 この図の拡大版を表示するには、こちらをクリックしてください。
6. 72時間の生存
- 低酸素侮辱後に密接に子豚を監視し、徐々にプロポフォールとフェンタニルの点滴の速度を低下させます。動物が自発的に呼吸している時点で抜管。
- 生存期間中、集中治療およびモニタリングに訓練を受けた者が24時間時計で動物施設で子豚を保ちます。静脈グルコース点滴を20ミリリットルの管理/毎時2-3キロ。低酸素虚血部分ボトルの給餌後に26から48時間後に開始することができます。咽頭反射が存在しない場合、気管と肺への吸引は、ボトル送りによって発生することがあります。
- 実験に関連する場合、ソレセンらによって開発されたスコアリングシステムを使用して、神経学的状態を評価する。で説明初版発行17で詳細。
7.アウトカム評価
- 72時間後、セクション2および3に記載されるようにMunkeby ら 31など2で説明したように、MRIは、関連する撮像モダリティでスキャンを実行再び麻酔および換気。
- 実験の最後に(5グラム/ kg、静脈内)ペントバルビタールの致死量で子豚を安楽死させます。
- 実験の目的に応じて検査のために、脳を準備します。
- ホルマリン固定組織の脳組織学のために:ロバートソンによって記載されているようにら切開が続き、パラホルムアルデヒドで定着後、PBS中の4%パラホルムアルデヒドで心臓灌流を使用2、Chakkarapani ら 1またはLiu ら 18または脳を削除します。。アンドレらによって記載されているように、4%パラホルムアルデヒド中に浸す。32
- スナップ凍結組織( 例えば 、RNAを必要とする分析のため解析または酵素活性アッセイ33):対象の脳領域を解剖、脳を除去し、スナップ凍結最大1センチメートルの組織ブロックを液体窒素中でのx 1センチメートルMunkeby らによって記載されているように33
結果
誘導された侮辱の間に起こる脳の低酸素性虚血の影響がaEEGトレースを記録することによって文書化されています。代表aEEGトレースは、図6に示されています。
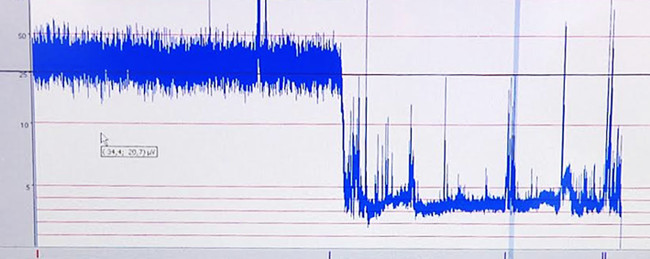
図6.代表aEEGトレース。による低酸素性虚血に低振幅。
ディスカッション
、その複雑さのために、記述されたモデルは、認定施設において実施することができ、動物の研究において経験します。地元の倫理委員会による承認は、実験開始前に取得する必要があり、最適な動物福祉は常に保証されなければなりません。モデルは、試験動物の生存に基づいているように、無菌環境での感染を防ぐために侵襲的処置の間、維持することが重要です。
開示事項
著者らは、開示することは何もありません。
謝辞
The authors would like to thank John Kristensen and Søren Braad Andersen from the Department of Communication, Aarhus University Hospital, Denmark, for their exceptional help with filming and editing. Animal technician Diana Gyldenløve and veterinarian Birgitte Kousgaard, Institute of Clinical Medicine Aarhus University Hospital, Denmark for assisting with animal care. This study was supported by the Lundbeck Foundation, the Laerdal Foundation for Acute Medicine, Central Denmark Region’s Research Foundation, Augustinus Foundation, Aase and Ejnar Danielsens Foundation, the Institute of Clinical Medicine Aarhus University Hospital, Brødrene Hartmanns Foundation, Karen Elise Jensens Foundation, Fonden til Lægevidenskabens Fremme, and Marie Dorthea og Holger From, Haderslevs Fond.
資料
| Name | Company | Catalog Number | Comments |
| Warm-touch-pediatric blanket | Covidien | 5030840 | |
| Adhesive Apertrue Drape | Barrier | 915447 | |
| Utility Drape (sterile) 75x80 cm | Barrier | 800530 | |
| Neoflon | BD - Luer | 391350 | |
| Laryngoscope | Miller | 85-0045 | |
| Endotracheal tube 2.5 mm | Covidien | 111-25 | |
| Endotracheal tube 3.0 mm with cuff | Unomedical | MM61110030 | |
| Endotracheal tube 3.5 mm with cuff | Unomedical | MM61110035 | |
| Anesthesia machine | GE Healthcare | 1009-9002-000 | |
| EEG - electrodes/disposable subdermal needle electrode | Cephalon | ACCE120550 | |
| ECG - electrodes | medtronic | 3010107-003 | |
| ECG-electrodes for MR | philips | ACCE120550 | |
| Arterial blood sampler - aspirator | Radiometer medical ApS | 956552 | |
| Polyurethane Umbilical vein catheter (5 Fr/Ch) | Covidien | 8888160341 | |
| Polyurethane Umbilical vein catheter (3,5 Fr/ch) | Covidien | 8888160333 | |
| Suture set (size 3-0) | Covidien | 8886 623341 | |
| BD Spinal needle 0.7x38mm | BD needles | 405254 | |
| Gas with 96% Nitrogen / 4% oxygen | Air Liquide | made on order | |
| NeuroMonitor (CFM) system | Natus Medical Incorporated | OBM70002 |
参考文献
- Chakkarapani, E., et al. Xenon enhances hypothermic neuroprotection in asphyxiated newborn pigs. Annals of. 68, 330-341 (2010).
- Robertson, N. J., et al. Melatonin augments hypothermic neuroprotection in a perinatal asphyxia model. Brain : a journal of neurology. 136, 90-105 (2013).
- Lawn, J. E., et al. Every Newborn: progress, priorities, and potential beyond survival. Lancet. 384, 189-205 (2014).
- Lee, A. C., et al. Intrapartum-related neonatal encephalopathy incidence and impairment at regional and global levels for 2010 with trends from 1990. Pediatric research. 74, 50-72 (2013).
- Kurinczuk, J. J., White-Koning, M., Badawi, N. Epidemiology of neonatal encephalopathy and hypoxic-ischaemic encephalopathy. Early human development. 86, 329-338 (2010).
- Shankaran, S., Woldt, E., Koepke, T., Bedard, M. P., Nandyal, R. Acute neonatal morbidity and long-term central nervous system sequelae of perinatal asphyxia in term infants. Early human development. 25, 135-148 (1991).
- Robertson, C. M., Finer, N. N., Grace, M. G. School performance of survivors of neonatal encephalopathy associated with birth asphyxia at term. The Journal of pediatrics. 114, 753-760 (1989).
- Bennet, L., Booth, L., Gunn, A. J. Potential biomarkers for hypoxic-ischemic encephalopathy. Seminars in feta., & neonatal medicine. 15, 253-260 (2010).
- Yager, J. Y., Ashwal, S. Animal models of perinatal hypoxic-ischemic brain damage. Pediatric neurology. 40, 156-167 (2009).
- Buckley, N. M. Maturation of circulatory system in three mammalian models of human development. Comparative biochemistry and physiology. A, Comparative. 83, 1-7 (1986).
- Dobbing, J., Sands, J. Comparative aspects of the brain growth spurt. Early human development. 3, 79-83 (1979).
- Dobbing, J., Sands, J. Quantitative growth and development of human brain. Archives of disease in childhood. 48, 757-767 (1973).
- Foster, K. A., et al. An improved survival model of hypoxia/ischaemia in the piglet suitable for neuroprotection studies. Brain research. 919, 122-131 (2001).
- LeBlanc, M. H., Li, X. Q., Huang, M., Patel, D. M., Smith, E. E. AMPA antagonist LY293558 does not affect the severity of hypoxic-ischemic injury in newborn pigs. Stroke; a journal of cerebral circulation. 26, 1908-1914 (1995).
- Andresen, J. H., et al. Nicotine affects the expression of brain-derived neurotrophic factor mRNA and protein in the hippocampus of hypoxic newborn piglets. J Perinat Med. 37, 553-560 (2009).
- Cheung, P. Y., Gill, R. S., Bigam, D. L. A swine model of neonatal asphyxia. Journal of visualized experiments : JoVE. , (2011).
- Thoresen, M., et al. A piglet survival model of posthypoxic encephalopathy. Pediatric research. 40, 738-748 (1996).
- Liu, X., Tooley, J., Loberg, E. M., Suleiman, M. S., Thoresen, M. Immediate hypothermia reduces cardiac troponin I after hypoxic-ischemic encephalopathy in newborn pigs. Pediatric research. 70, 352-356 (2011).
- Bjorkman, S. T., et al. Hypoxic/Ischemic models in newborn piglet: comparison of constant FiO2 versus variable FiO2 delivery. Brain research. 1100, 110-117 (2006).
- Robertson, N. J., et al. Which neuroprotective agents are ready for bench to bedside translation in the newborn infant. The Journal of pediatrics. 160, 544-552 (2012).
- Jacobs, S. E., et al. Cooling for newborns with hypoxic ischaemic encephalopathy. Cochrane Database Syst Rev. 1, CD003311 (2013).
- Andresen, J. H., et al. Resuscitation with 21 or 100% oxygen in hypoxic nicotine-pretreated newborn piglets: possible neuroprotective effects of nicotine. Neonatology. 93, 36-44 (2008).
- Karlsson, M., et al. Delayed hypothermia as selective head cooling or whole body cooling does not protect brain or body in newborn pig subjected to hypoxia-ischemia. Pediatric research. 64, 74-78 (2008).
- Kovacs, J., et al. Asphyxia-induced release of alpha-melanocyte-stimulating hormone in newborn pigs. Peptides. 22, 1049-1053 (2001).
- Varvarousi, G., et al. Asphyxial cardiac arrest, resuscitation and neurological outcome in a Landrace/Large-White swine model. Laboratory animals. 45, 184-190 (2011).
- Tammela, O., Pastuszko, A., Lajevardi, N. S., Delivoria-Papadopoulos, M., Wilson, D. F. Activity of tyrosine hydroxylase in the striatum of newborn piglets in response to hypocapnic hypoxia. Journal of neurochemistry. 60, 1399-1406 (1993).
- Cote, A., Barter, J., Meehan, B. Age-dependent metabolic effects of repeated hypoxemia in piglets. Canadian journal of physiology and pharmacology. 78, 321-328 (2000).
- Tichauer, K. M., et al. Assessing the severity of perinatal hypoxia-ischemia in piglets using near-infrared spectroscopy to measure the cerebral metabolic rate of oxygen. Pediatric research. 65, 301-306 (2009).
- Jasani, M. S., Salzman, S. K., Tice, L. L., Ginn, A., Nadkarni, V. M. Anesthetic regimen effects on a pediatric porcine model of asphyxial arrest. Resuscitation. 35, 69-75 (1997).
- Chakkarapani, E., Thoresen, M., Liu, X., Walloe, L., Dingley, J. Xenon offers stable haemodynamics independent of induced hypothermia after hypoxia-ischaemia in newborn pigs. Intensive care medicine. 38, 316-323 (2012).
- Munkeby, B. H., et al. A piglet model for detection of hypoxic-ischemic brain injury with magnetic resonance imaging. Acta radiologica. 49, 1049-1057 (2008).
- Andresen, J. H., et al. Newborn piglets exposed to hypoxia after nicotine or saline pretreatment: long-term effects on brain and heart. J Matern Fetal Neonatal Med. 22, 161-168 (2009).
- Munkeby, B. H., et al. Resuscitation with 100% O2 increases cerebral injury in hypoxemic piglets. Pediatric research. 56, 783-790 (2004).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved