Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Пятачок Модель новорожденных гипоксически-ишемическая энцефалопатия
В этой статье
Резюме
Hypoxic-ischemic encephalopathy following perinatal asphyxia can be studied using animal models. We demonstrate the procedures necessary for establishing a piglet model of neonatal hypoxic-ischemic encephalopathy.
Аннотация
Асфиксия рождения, который вызывает гипоксически-ишемическая энцефалопатия (HIE), составляет 0,66 миллиона смертей во всем мире каждый год, около четверти 2,9 млн смертей новорожденных в мире. Животные модели ГИЭ способствовали пониманию патофизиологии в ГИЭ, и подчеркнул динамический процесс, которые происходят в мозговой травмой из-за перинатальной асфиксии. Таким образом, исследования на животных показали, тайм-окно для стратегий лечения постинсультных. Переохлаждение был протестирован для лечения ГИЭ в pdiglet моделей, а затем доказали свою эффективность в клинических испытаниях. Вариации модели были применены в изучении вспомогательной нейропротективных методов и поросят исследований ксенона и мелатонина, привели к фазе клинических испытаний и я 1,2 II. Поросенок ГИЭ модель используется в дальнейшем для новорожденных resuscitation- и гемодинамики исследований, а также в исследованиях головного мозга гипоксии на клеточном уровне. Тем не менее, это технически сложнойМодель и вариации в протоколе могут привести либо слишком мягким или слишком тяжелой черепно-мозговой травмой. В этой статье мы покажем, технические процедуры, необходимые для установления стабильного поросят модель новорожденных ГИЭ. Во-первых, новорожденный поросенок (<24 ч назад, средний вес 1500 г) под наркозом, интубация, и контролируется в установке, сравнимой с найдены в отделении интенсивной терапии новорожденных. Глобальный ишемии-гипоксии индуцируется за счет снижения доли кислорода на вдохе для достижения глобальной гипоксии, ишемии через гипотензии и амплитуда плоской след интегрированной ЭЭГ (AEEG), указывающего гипоксии головного мозга. Выживание способствует регулировке оксигенации в соответствии с ответом аЭЭГ и кровяное давление. Черепно-мозговая травма количественно гистопатологией и магнитно-резонансной томографии после 72 часов.
Введение
Перинатальная асфиксия является острой и часто непредсказуемым состояние, связанное с гипоксически-ишемической энцефалопатии (HIE). Общая цель этого протокола является демонстрация модели поросят выживания перинатальной гипоксически-ишемической энцефалопатии. Эта модель может быть использована для изучения влияния различных степеней гипоксии-ишемии на новорожденных мозг и экспериментальных методов лечения на невропатологии, магнитно-резонансной томографии и спектроскопии (МРТ и МРС) и биомаркеров в жидкостях организма, таких как кровь, спинномозговая жидкость и моча , Модель также доказала свою полезность для исследования сердечно-сосудистой системы, дыхательной системы, почек и печени, все из которых пострадали в глобальной гипоксии-ишемии.
Перинатальная асфиксия является результатом скомпрометированных подачи кислорода интранатальной или в непосредственной послеродовой период. Родах гипоксии события зарегистрированы 0,66 миллиона смертей во всем мире каждый год, около четверти мирового 2,9 мельницыионные неонатальной смертности в 2012 году 3. В 2010 году 1,15 млн младенцев, по оценкам, были разработаны следующие неонатальной энцефалопатии асфиксии 4. ГИЭ определяется как энцефалопатия у детей, рожденных после 34 недель беременности происходит в 1-3 / 1000 родившихся живыми 5 в промышленно развитых странах и до 8,5 / 1000 живорожденных в развивающихся странах 4. Риск смерти 10-60%, а риск неврологических инвалидности у выживших 30-100% 6,7. 50,2 млн инвалидности лет жизни (DALYs) относятся к гипоксии в родах событий 4. В настоящее лечение только кроме поддержку для ГИЭ пост-гипоксического гипотермия. Таким образом, прогресс в диагностических процедур и стратегий лечения необходимы для улучшения управления ГИЭ 8.
Улучшения в прогнозе после перинатальной асфиксии и управления новорожденного травмы головного мозга основаны на расширении знаний о механизмах, лежащих болезниD возможные методы лечения. Животные модели ГИЭ особенно полезны в различных клинических событий может привести к ГИЭ и заболеваемость в любом одном центре рождении низка 5. Экспериментальная установка, в которой влияние биологических вариаций может быть сведено к минимуму, важно при тестировании нового прогностические и диагностические инструменты и стратегии лечения. Модель животное должно приблизить клиническую ситуацию, насколько это возможно, тем самым способствуя пониманию патологических механизмов, лежащих в основе индуцированного повреждения и динамический процесс, связанный с заболеванием и it's исхода 9. Животные модели новорожденных ГИЭ включили ряд видов, в том числе грызунов, баранина, и свиней. Для сравнения, новорожденный поросенок имеет более высокую сходство с человеческой новорожденных по отношению к размеру, сердечно-сосудистой системы 10 и зрелости мозга во время родов 11,12. Мониторинг, приборы и оценка результатов в модели поросят подобна тхат используется в клинической практике младенцев с ГИЭ. Таким образом, существует высокая степень перевода в ухода за новорожденными от этой модели.
Поросята модели перинатальной гипоксии и ГИЭ используются многими группами и варьируются в ряде областей 13. В соответствии с целью эксперимента, особое внимание должно быть уделено выбору лекарств, способ индукции гипоксия-ишемия, способ управления продолжительность и тяжесть оскорбления, постинсультных реанимации и ухода, и оценку результатов. Чтобы избежать предвзятости рандомизированное исследование дизайн всегда должны быть использованы в интервенционных исследований.
Метод применяется при индукции гипоксически-ишемического повреждения важно. Глобальный гипоксия приводит к ГИЭ часто приводит к полиорганной недостаточности с участием головного мозга, сердца, легких, почек и печени. В зависимости от результатов оцененных, модели ГИЭ должны быть основаны на глобальном гипоксии и ишемии, а не полагаться на фокальной ишемии, например., Перевязкой автомобиляotid артерии 14. Недавняя статья применяется сочетание гипоксии (FiO 2 12%) и сжатие сонной артерии при сохранении среднего артериального давления> 40 мм рт ст 2. Другая группа не индуцированной глобального гипоксии на 8% O 2 до отрицательной базовой избыточной> 20 ммоль / л или среднее артериальное давление (МАВР) <15 мм рт.ст., и в жертву животных в 4 часа 15. Гипоксия также титруют сердечного выброса (на 30-40% от исходного уровня), MABP (30-35 мм рт.ст.) и артериальной рН (6,95-7,05) 16.
Модели глобальной гипоксии-ишемии титруемой подавления аЭЭГ, подобной той, приведенные в данном отчете, продемонстрировали, что энцефалопатия клинически, электрофизиологически и neuropathologically сравнимо с состоянии, что в перспективе асфиксии ребенка 17,18.
Степень ГИЭ индуцированной важно. Полезная модель животное ГИЭ также должны позволить для тестирования нового диаметромгностической процедуры и методы лечения. Для включения этого модели должны побудить умеренный HIE, где есть потенциал как обработка тяжелой черепно-мозговой травмы с небольшим или никаким потенциалом лечения будут менее релевантными при оценке новых методов лечения. Толерантность к гипоксии значительно варьируется между подопытных животных. Предыдущие исследования показали, что более последовательным мозговая травма может быть достигнуто и что больше животных выжить 17,19 по индивидуализации гипоксии головного мозга в соответствии с каждого ответ поросят оценивается по амплитуде интегрированы электроэнцефалографии (AEEG), а не с помощью набора FiO 2 значение на протяжении гипоксическая событие. Продолжительность подавления аЭЭГ коррелирует со степенью повреждения мозга, с небольшими изменениями гистологических в <20 мин подавления аЭЭГ и тяжелых приступов увеличивается на 45 мин> подавления аЭЭГ. Недавний обзор нейропротективных лечения ГИЭ определили необходимость для моделей выживания позволяет поведенческие итоговые МПСОЭС в животных моделях 20.
Существуют многочисленные преимущества представленного HIE поросят модели. Он основан на видов, где результаты являются весьма вероятно, перевести на человеческой физиологии. Глобальные модели ишемии-гипоксии недостаточность многих органов и титрование гипоксии-ишемии в AEEG вызывает последовательную степень повреждения головного мозга с клиническими выживания соответствующих решений, таких, что биомаркеры, МРТ и поведение могут быть оценены на соответствующих временных точках.
Пятачок модели перинатальной асфиксии и ГИЭ не только внесли значительный вклад в понимание текущего HIE патофизиологии, но также успешно предшествует клинические испытания, в конечном счете, приводит к новым методам лечения на людях. Пятачок модельные исследования сыграли ключевую роль в создании гипотермии для лечения ГИЭ 21, и используются в неонатальной реанимации исследований 22. Различные группы использовали модели Пятачок при выполнении исследований в рамках асфиксии и ГИЭ, сD Исследования включают в себя гипотермию 23 альфа-меланоциты гормон 24, остановка сердца 25, тирозингидроксилазы активности 26, повторяется гипоксии 27, рецептор NMDA-активность 14 и ближней ИК-области спектроскопия 28.
Поросенок ГИЭ модель, представленная в данном отчете технически сложно работать, а незначительные изменения, в ходе процедуры может привести либо слишком мягким или слишком тяжелой черепно-мозговой травмой 29,2. Мы обнаружили, что имеющаяся литература не хватало деталей, чтобы воспроизвести ранее опубликованных моделей. Таким образом, мы здесь продемонстрировать каждый шаг технических процедур, необходимых для создания поросят модели выживания 72 ч в настоящем докладе, позволяет исследователям установить эту передовую модель для изучения ГИЭ.
протокол
Настоящий Протокол был одобрен датской экспериментах на животных инспекции. Все подопытные животные анестезировали всей процедуры. Воспроизведение данного протокола должны выполняться в соответствии с национальной этики и принципов защиты животных, и утверждаются местными комитетами по этике.
1. Животные
- Датский Ландрас поросят <24 ч старый весом примерно 1500 - 2000 г.
2. Анестезия и обслуживание Жидкости
- Подготовьте необходимое оборудование для анестезии (рис 1): маски для севофлурана администрации, спиртовые тампоны, периферической внутривенный катетер, резинкой, шприцы с физиологическим раствором, пропофола (5 мг / кг), фентанила (10 мкг / кг), и прокаин бензилпенициллин (15000 МЕ / кг).
- Вызвать анестезии, обеспечивая 1-2% севофлурана через дыхательную маску.
- Оценка глубины анестезии путем оценки для глазной и снятие Reflподопечных. При уверены, что поросенка глубоко под наркозом, чрескожно вставить периферического внутривенного катетера в ушную вену.
- Чтобы подтвердить проходимость периферической внутривенный катетер, промойте катетер с 1-2 мл стерильной 0,9% физиологического раствора. Администрирование болюса пропофола инъекции (5 мг / кг) и фентанила (10 мкг / кг). После болюсной инъекции администрации промойте внутривенный катетер второй раз с помощью 1-2 мл стерильной 0,9% физиологического раствора.
- Место шприцы с пропофолом (10 мг / мл) и фентанила (10 мкг / мл) в двух отдельных шприцев инфузионных насосов. Подключение внутривенно трубы из двух шприцевых насосов с трехходовым запорным краном, соединяющей вливаний в одну линию, которая соединена с внутривенным катетером. Начало непрерывного инфузии пропофола (4-12 мг / кг / ч) и фентанила (10 мкг / кг / ч). После того, как непрерывные инфузии работает, не дают дальнейших болюсные инъекции пропофола и фентанила.
- Прекратите введение севофлурана газовой ANESThesia.
- Вводите прокаин бензилпенициллин (15000 МЕ / кг) подкожно или внутримышечно в соответствии с местными руководящими принципами для антибиотикопрофилактики. Повторите ежедневно. Видео показывает подкожно администрацию, которая у поросят было показано, приводит к более высокой концентрации в плазме и более длительный период полувыведения по сравнению с внутримышечного введения.
- Применить глаз смазки мазь, чтобы предотвратить высыхание глаз. Вытяните нижнее веко вниз мягко, чтобы сформировать карман, как открытие. Выдавить небольшое количество мази в кармане. Закрыть глаза, чтобы распределить мазь. Проверьте сухости ежечасно и повторно по мере необходимости.
- Инициировать непрерывная инфузия ставки 5% декстроза / 0,45% NaCl внутривенно в 10 мл / кг / ч. Снижение скорости до 5 мл / кг / ч в течение и после гипоксии. Отрегулируйте скорость инфузии для поддержания уровня глюкозы в крови 2-10 ммоль / л.
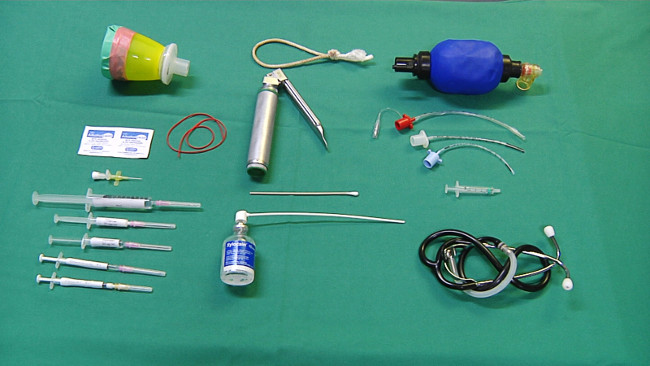
FIGURe 1. Оборудование для анестезии и интубации. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
3. Интубация и вентиляция
- Подготовьте необходимое оборудование для интубации (рисунок 1): рокурония бромид (1 мг / кг) для расслабления мышц, строп (связать оба конца же 4 мм нейлоновый канат вместе, чтобы сформировать круг, как показано на рисунке 1) для открытия рот, хлопок наконечником тампоном и ветеринарной ларингоскоп с прямым клинком, Xylocaine спрей (100 мг / мл), различных размеров эндотрахеальных трубок с манжетой (размеры 3,0 мм, 2,5 мм, 2,0 мм), 500 мл самонадувающийся мешок (мешок клапан маска) для вентиляции, 2 мл шприц для раздувания манжеты и стетоскоп.
- Интубация, следуя инструкциям ниже:
- Место поросенок в положении лежа на спине поддержки шеи с каждой стороны, чтобы обеспечить прямые гортани паМудрец для интубации.
- Оценить длину эндотрахеальной трубки путем измерения от кончика носа к грудине выемка (обычно около 13 см).
- Место строп вокруг верхней челюсти (вниз) и удерживайте нижнюю челюсть и язык вверх держать рот открытым.
- Администрирование Rocuronium бромид (1 мг / кг) внутривенно, чтобы вызвать расслабление мышц.
- Используйте ларингоскоп поднять язык вверх.
- Используйте ватную палочку тампон, чтобы освободить длинный надгортанник Поросенок, которая может быть либо загнутый в пищевод или перехвачена за мягкого нёба.
- Авансовые ларингоскоп, чтобы надгортанник поднял против языка базы, позволяющей полное представление о черпаловидного хрящей и голосовых связок.
- Применение Xylocaine аэрозоль (100 мг / мл) местно в гортани, чтобы предотвратить спазмы гортани.
- Авансовые эндотрахеальную трубку через голосовые связки. Используйте вращательное движение, чтобы помочь прохождение узких хрящей трахеи. Предварительная АККО трубкиВИДЕОЗАПИСЬ в предварительно измеренным расстоянием и подключиться к самонадувающийся мешок (мешок клапан маска) для ручной вентиляции. Чтобы уменьшить трение при интубации распыления дистальный 1/3 эндотрахеальной трубки с Xylocaine брызг.
- Чтобы подтвердить правильное размещение эндотрахеальной трубки: соблюдайте для любого указанием затрудненное дыхание, ausculate грудь прослушивания двустороннего входа воздуха в обоих легких, визуально подтвердить наличие конденсата в проксимальных аспект эндотрахеальной трубки, и проверить наличие конечного приливного углерода Диоксид с колориметрическим детектора двуокиси углерода или выдоха CO 2, чтения на механической вентиляции легких, если имеется. Нормальный конец диоксид углерода приливная около 5%. Значение выше 2% вместе с нормальный вид сигнала будет подтвердить, что эндотрахеальная трубка находится в трахее.
- Накачать трубки манжеты эндотрахеальной для предотвращения аспирации. Давление накачивания манжеты должно быть не менее 25 см H 2 O, чтобы избежать ишемического повреждения на окружающие ткани. Проведение эндотрахеальной трубки в месте, ветер кусок ленты вокруг трубы, закрыть челюсть и продолжать лентой вокруг морды, чтобы обеспечить трубку на место. Осторожно потяните трубки, чтобы убедиться, что он остается на месте.
- Подключите эндотрахеальную трубку к механическим вентилятором.
- Настройка параметров ИВЛ: объемно-вытяжной вентиляции, дыхательного объема (TV): 10 мл / кг [или пиковое давление на вдохе (PIP) 15 см с регулируемым давлением вентиляции]. Положительный конце выдоха давление (ПДКВ): 5 см. I: отношение E 1: 2. Частота дыхания: 35 (настроить скорость для поддержания конце выдоха CO 2 между 4,5-5,5 кПа).
4. Мониторинг и жидкость проб
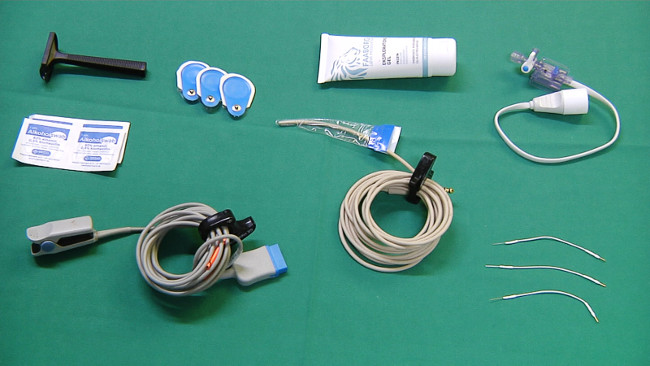
Рисунок 2. Оборудование для мониторинга.АНК "> Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
- Подготовьте необходимое оборудование для мониторинга (рис 2): клейкой ленты, стерильные смазки, зонд для непрерывного измерения температуры прямой кишки, электрокардиограмма (ЭКГ) электродов, электродов пульсоксиметр, бритва, и ЭЭГ.
- Место зонд насыщения на задней ноге, смазать прямой кишки датчик температуры и вставьте 6 см в прямую кишку, место над головой сияющий нагреватель и / или подогревом надувной воздушный матрац для поддержания ректальной температуры на физиологическом уровне 38.5-39 ° C, и место ЭКГ электроды.
- Поместите поросенка в положении лежа брить области 1 см х 1 см для размещения подкожных электродов игла ЭЭГ; один перед каждым ухом, а электрод на средней линии позади глаз. Очистите сайт электрода с тампоном, смоченным спиртом, а затем вставьте игольчатый электрод подкожно. Безопасные электроды с клейкой лентой и возвращения поросенка на спине роложение.
- Включите аЭЭГ монитора.
Примечание: Амплитуда интегрированы ЭЭГ состоит из плотной трассировки с верхним и нижним краями. Нижние и верхние края в этой модели, как правило, 15-50 мкВ, часто выше, чем видно на детей. Во время гипоксии важно отметить, что артефакт с ЭКГ может ложно поднять след AEEG. Bolus препараты (пропофол или фентанил) также могут временно подавить след AEEG и его следует избегать, если это возможно во время эксперимента. Администрация наркотиков и клинических событий должны быть отмечены, чтобы облегчить интерпретацию следа аЭЭГ.
- Подготовьте необходимое оборудование для размещения пупочной катетеры для центрального артериального мониторинга артериального давления и отбора проб крови (рисунок 3): стерильные перчатки, стерильные драпировки, скальпель, спиртовые тампоны, стерильные салфетки, пупочной вены катетер (5 Fr), катетер пупочной артерии (3,5 Fr ), шовный набор щипцами, изогнутыми щипцами микро, ножницы, иглодержатель и шва (например, размер 3-0), прозрачный клей патч, 5 мл шприцы для отбора проб крови.
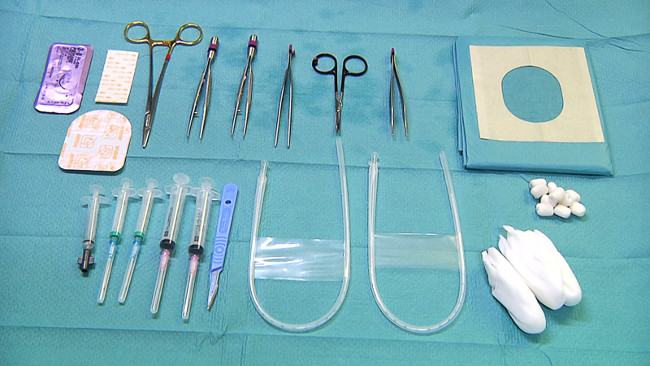
Рисунок 3. Оборудование для пупочной линии и забора крови. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
- Стерилизовать и драпировка область вокруг пупка. Используйте скальпель, чтобы перерезать пуповину как можно ближе к коже, как это возможно. Если это не подвергайте сосудов пуповины в анестезированной поросенка, сократить пуповины коже на 2 мм ниже пуповины подвергать сосуды. Определить два небольших пупочные артерии и одна большая пупочная вена (рисунок 4).
- Используйте изогнутые щипцы микро расширяются артерии (рисунок 4) и вставьте пупочного артериального катетера(3.5 Fr). Оценка длины вставки в см до 3 х вес (кг) + 10 (эмпирическая формула на основе правильного размещения в нисходящей аорты выше почечных артерий при аутопсии).
- Поместите вторую 5-FR катетер 5 см в пупочной вене (рис 4). Проверьте внутрисосудистого катетера по возвращении в крови. Безопасные катетеры путем размещения кошелек-строку шов вокруг пупка, пройти шов заканчивается вокруг каждого из пупочной катетеров и завяжите узел. Обложка катетеров с клейкой прозрачной повязки.
- Сбор образцов крови в заранее заданные моменты времени: 1) непосредственно перед гипоксии, 2) 30 мин в гипоксической инсульта 3) на конце 45 мин гипоксической инсульта 4) 2 ч после гипоксического инсульта. В зависимости от целей эксперимента других временных точках для образцов крови может быть выбран.
- Использование Анализ газов артериальной крови из образцов крови, полученных при гипоксии, чтобы проверить изменения в крови газов, вызванных гипоксией-ишемией (Таблица 1). Обратите внимание, что поросята имеют низкую Гемоглобинт о рождении (около 8 г / дл) и может стать анемией из выборки частой крови. Вывод менее 2 мл крови / кг массы тела в розыгрыше, менее чем 5 мл крови / кг массы тела в течение 24 ч и в соответствии с местными руководящими принципами для отбора проб крови. Признаки анемии включают уменьшение гематокрита и тахикардия.
- Подключите артериальную линию к монитору для продолжает внутриартериального мониторинга артериального давления (МАВР). Используйте венозную линию для жидкости и медикаментов.
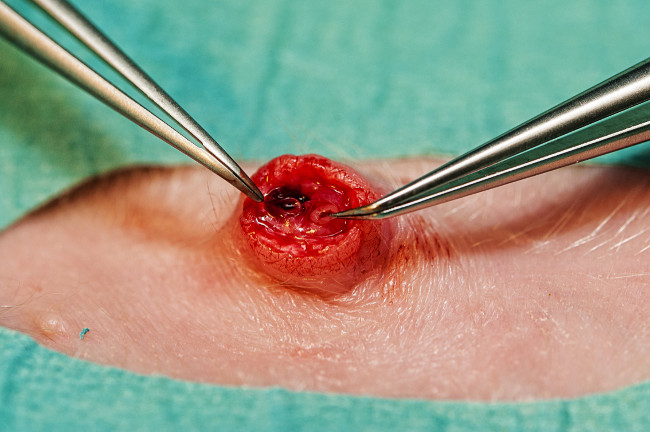
Рисунок 4. сосудов пуповины. Пупочной вены (справа) и один из двух пупочных артерий (слева). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
5. Гипоксия
- Подождите 60 минут после завершения мониторинга. Вызвать гипоксии путем переключения на 4% O 2 / 96% N 2 газовая смесь. Монитор жизненно важных параметров и AEEG тесно и продолжить гипоксии в течение 45 мин.
- После того, как след аЭЭГ плоская (верхний край <7 мкВ), регулировать, изменяя оксигенации вдохновенный фракцию кислорода (FiO 2) и среднее давление в дыхательных путях на наивысший уровень FiO 2, поддерживая плоский след аЭЭГ в соответствии с блок-схемой, показанной на фиг.5. Стремитесь к MABP ниже 70% от исходного уровня, по крайней мере, 10 минут и при необходимости ниже FiO 2, чтобы обеспечить гипотензии и ишемии. Описанный уровень гипотензии Ранее было показано, другие 19,13,30 производить соответствующую гипоксической-ишемического повреждения головного мозга.
- В случае тяжелой гипотензии (МАВР <25 мм рт.ст.) лечения ступенчато следующим образом: кратко увеличения FiO 2 на 1-5%, физиологический раствор болюса (10 мл / кг), вливание допамина (5-20 мкг / кг / мин), и вливание норадреналина (20 нг-1 мг / кг / мин).
- В случае изъятия продолжительностью> 10 мин (клонические, тоник ог миоклонические судороги, как правило, местного или как указано внезапных изменений амплитуды аЭЭГ) лечения ступенчато с (с учетом 30 мин, прежде чем приступить к следующей инъекции): медленный болюс фенобарбитал IV 20 мг / кг, повторите фенобарбитал внутривенно 20 мг / кг, а мидазолам IV 0,5 мг / кг.
- Если приступы развиваются и нечувствительность к лекарственной терапии эвтаназии указывается.
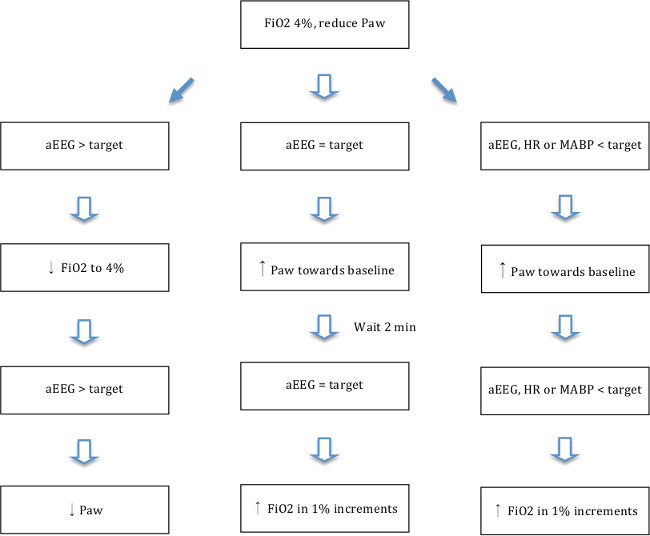
Рисунок 5. ишемии-гипоксии блок-схема. Схема, показывающая изменения в оксигенации (F I O 2 и Р AW) в соответствии с аЭЭГ ответ. Среднее давление в дыхательных путях (Р АВ) был регулировать путем изменения PIP / TV (PIP ниже дает меньшую P AW) и частоту дыхания (RR ниже дает меньшую P AW). Цель AEEG = верхний край следа <5 мкВ и нижнюю границу трассировки> 3 мкВ (в среднем 4 мкВ). Цельсердечных сокращений (ЧСС) => 80. Целевая среднего артериального давления (МАВР) = МАВР> 25. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Выживание 6. 72 ч
- Монитор поросенка внимательно после гипоксического оскорбление, и постепенно снизить ставки инфузии пропофола и фентанила. Экстубации в точке, при которой животное добровольно дыхание.
- Во время периода выживания, держать поросят на вивария с 24 ч часы обученным персоналом в реанимации и мониторинга. Администрирование вливания глюкозой 20 мл / кг 2-3 час. В 26-48 ч после кормления частичное бутылки ишемии-гипоксии может быть начато. Стремление к трахее и легких может происходить путем искусственного вскармливания, если рвотный рефлекс нет.
- Если отношение к эксперименту, оценить неврологический статус, используя систему оценки, разработанной Thoresen др., Описано вдеталь в оригинальной публикации 17.
7. Оценка результатов
- После 72 часов, обезболить и проветрите снова, как описано в разделе 2 и 3. Выполните МРТ с соответствующими методами визуализации, как описано Munkeby др 31 и другие 2.
- В конце эксперимента эвтаназии поросят с летальной дозой пентобарбитала (5 г / кг внутривенно).
- Подготовка мозг для экспертизы в соответствии с целью эксперимента.
- Для мозга гистологии на фиксированные формалином ткани:.. Использовать сердечной перфузии с 4% параформальдегидом в PBS, а затем путем рассечения и после фиксации в параформальдегиде, как описано Robertson и др 2, Chakkarapani др 1 или Лю и др 18 или извлечь мозг и погрузиться в 4% параформальдегида, как описано Андресен и др. 32
- Для анализа требует привязки заморозки ткани (например, РНКанализ или ферментативной активности анализы 33):. Снимите мозг, рассекают из мозга регионов интересов и оснастки заморозить ткани блоков максимум 1 см х 1 см в жидком азоте, как описано Munkeby др 33
Результаты
Последствия гипоксии-ишемии на мозг, которые происходят во время вынужденного оскорбление оформляются записи трассировки AEEG. Представитель аЭЭГ след показано на рисунке 6.
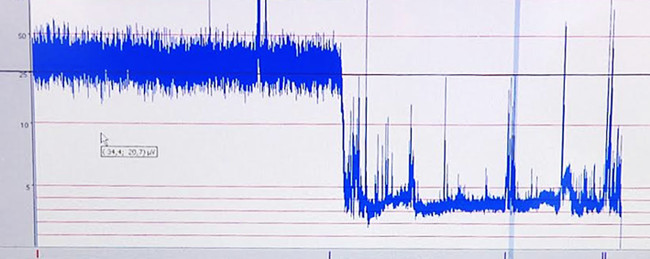
Рисунок 6. Представ?...
Обсуждение
Из-за своей сложности, описанная модель может быть реализована только в учреждениях, аккредитованных и опытных в ходе исследований на животных. Утверждение локальных этических комитетах должны быть получены до начала экспериментов, а оптимальная защита животных должна быть обеспече?...
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
The authors would like to thank John Kristensen and Søren Braad Andersen from the Department of Communication, Aarhus University Hospital, Denmark, for their exceptional help with filming and editing. Animal technician Diana Gyldenløve and veterinarian Birgitte Kousgaard, Institute of Clinical Medicine Aarhus University Hospital, Denmark for assisting with animal care. This study was supported by the Lundbeck Foundation, the Laerdal Foundation for Acute Medicine, Central Denmark Region’s Research Foundation, Augustinus Foundation, Aase and Ejnar Danielsens Foundation, the Institute of Clinical Medicine Aarhus University Hospital, Brødrene Hartmanns Foundation, Karen Elise Jensens Foundation, Fonden til Lægevidenskabens Fremme, and Marie Dorthea og Holger From, Haderslevs Fond.
Материалы
| Name | Company | Catalog Number | Comments |
| Warm-touch-pediatric blanket | Covidien | 5030840 | |
| Adhesive Apertrue Drape | Barrier | 915447 | |
| Utility Drape (sterile) 75x80 cm | Barrier | 800530 | |
| Neoflon | BD - Luer | 391350 | |
| Laryngoscope | Miller | 85-0045 | |
| Endotracheal tube 2.5 mm | Covidien | 111-25 | |
| Endotracheal tube 3.0 mm with cuff | Unomedical | MM61110030 | |
| Endotracheal tube 3.5 mm with cuff | Unomedical | MM61110035 | |
| Anesthesia machine | GE Healthcare | 1009-9002-000 | |
| EEG - electrodes/disposable subdermal needle electrode | Cephalon | ACCE120550 | |
| ECG - electrodes | medtronic | 3010107-003 | |
| ECG-electrodes for MR | philips | ACCE120550 | |
| Arterial blood sampler - aspirator | Radiometer medical ApS | 956552 | |
| Polyurethane Umbilical vein catheter (5 Fr/Ch) | Covidien | 8888160341 | |
| Polyurethane Umbilical vein catheter (3,5 Fr/ch) | Covidien | 8888160333 | |
| Suture set (size 3-0) | Covidien | 8886 623341 | |
| BD Spinal needle 0.7x38mm | BD needles | 405254 | |
| Gas with 96% Nitrogen / 4% oxygen | Air Liquide | made on order | |
| NeuroMonitor (CFM) system | Natus Medical Incorporated | OBM70002 |
Ссылки
- Chakkarapani, E., et al. Xenon enhances hypothermic neuroprotection in asphyxiated newborn pigs. Annals of. 68, 330-341 (2010).
- Robertson, N. J., et al. Melatonin augments hypothermic neuroprotection in a perinatal asphyxia model. Brain : a journal of neurology. 136, 90-105 (2013).
- Lawn, J. E., et al. Every Newborn: progress, priorities, and potential beyond survival. Lancet. 384, 189-205 (2014).
- Lee, A. C., et al. Intrapartum-related neonatal encephalopathy incidence and impairment at regional and global levels for 2010 with trends from 1990. Pediatric research. 74, 50-72 (2013).
- Kurinczuk, J. J., White-Koning, M., Badawi, N. Epidemiology of neonatal encephalopathy and hypoxic-ischaemic encephalopathy. Early human development. 86, 329-338 (2010).
- Shankaran, S., Woldt, E., Koepke, T., Bedard, M. P., Nandyal, R. Acute neonatal morbidity and long-term central nervous system sequelae of perinatal asphyxia in term infants. Early human development. 25, 135-148 (1991).
- Robertson, C. M., Finer, N. N., Grace, M. G. School performance of survivors of neonatal encephalopathy associated with birth asphyxia at term. The Journal of pediatrics. 114, 753-760 (1989).
- Bennet, L., Booth, L., Gunn, A. J. Potential biomarkers for hypoxic-ischemic encephalopathy. Seminars in feta., & neonatal medicine. 15, 253-260 (2010).
- Yager, J. Y., Ashwal, S. Animal models of perinatal hypoxic-ischemic brain damage. Pediatric neurology. 40, 156-167 (2009).
- Buckley, N. M. Maturation of circulatory system in three mammalian models of human development. Comparative biochemistry and physiology. A, Comparative. 83, 1-7 (1986).
- Dobbing, J., Sands, J. Comparative aspects of the brain growth spurt. Early human development. 3, 79-83 (1979).
- Dobbing, J., Sands, J. Quantitative growth and development of human brain. Archives of disease in childhood. 48, 757-767 (1973).
- Foster, K. A., et al. An improved survival model of hypoxia/ischaemia in the piglet suitable for neuroprotection studies. Brain research. 919, 122-131 (2001).
- LeBlanc, M. H., Li, X. Q., Huang, M., Patel, D. M., Smith, E. E. AMPA antagonist LY293558 does not affect the severity of hypoxic-ischemic injury in newborn pigs. Stroke; a journal of cerebral circulation. 26, 1908-1914 (1995).
- Andresen, J. H., et al. Nicotine affects the expression of brain-derived neurotrophic factor mRNA and protein in the hippocampus of hypoxic newborn piglets. J Perinat Med. 37, 553-560 (2009).
- Cheung, P. Y., Gill, R. S., Bigam, D. L. A swine model of neonatal asphyxia. Journal of visualized experiments : JoVE. , (2011).
- Thoresen, M., et al. A piglet survival model of posthypoxic encephalopathy. Pediatric research. 40, 738-748 (1996).
- Liu, X., Tooley, J., Loberg, E. M., Suleiman, M. S., Thoresen, M. Immediate hypothermia reduces cardiac troponin I after hypoxic-ischemic encephalopathy in newborn pigs. Pediatric research. 70, 352-356 (2011).
- Bjorkman, S. T., et al. Hypoxic/Ischemic models in newborn piglet: comparison of constant FiO2 versus variable FiO2 delivery. Brain research. 1100, 110-117 (2006).
- Robertson, N. J., et al. Which neuroprotective agents are ready for bench to bedside translation in the newborn infant. The Journal of pediatrics. 160, 544-552 (2012).
- Jacobs, S. E., et al. Cooling for newborns with hypoxic ischaemic encephalopathy. Cochrane Database Syst Rev. 1, CD003311 (2013).
- Andresen, J. H., et al. Resuscitation with 21 or 100% oxygen in hypoxic nicotine-pretreated newborn piglets: possible neuroprotective effects of nicotine. Neonatology. 93, 36-44 (2008).
- Karlsson, M., et al. Delayed hypothermia as selective head cooling or whole body cooling does not protect brain or body in newborn pig subjected to hypoxia-ischemia. Pediatric research. 64, 74-78 (2008).
- Kovacs, J., et al. Asphyxia-induced release of alpha-melanocyte-stimulating hormone in newborn pigs. Peptides. 22, 1049-1053 (2001).
- Varvarousi, G., et al. Asphyxial cardiac arrest, resuscitation and neurological outcome in a Landrace/Large-White swine model. Laboratory animals. 45, 184-190 (2011).
- Tammela, O., Pastuszko, A., Lajevardi, N. S., Delivoria-Papadopoulos, M., Wilson, D. F. Activity of tyrosine hydroxylase in the striatum of newborn piglets in response to hypocapnic hypoxia. Journal of neurochemistry. 60, 1399-1406 (1993).
- Cote, A., Barter, J., Meehan, B. Age-dependent metabolic effects of repeated hypoxemia in piglets. Canadian journal of physiology and pharmacology. 78, 321-328 (2000).
- Tichauer, K. M., et al. Assessing the severity of perinatal hypoxia-ischemia in piglets using near-infrared spectroscopy to measure the cerebral metabolic rate of oxygen. Pediatric research. 65, 301-306 (2009).
- Jasani, M. S., Salzman, S. K., Tice, L. L., Ginn, A., Nadkarni, V. M. Anesthetic regimen effects on a pediatric porcine model of asphyxial arrest. Resuscitation. 35, 69-75 (1997).
- Chakkarapani, E., Thoresen, M., Liu, X., Walloe, L., Dingley, J. Xenon offers stable haemodynamics independent of induced hypothermia after hypoxia-ischaemia in newborn pigs. Intensive care medicine. 38, 316-323 (2012).
- Munkeby, B. H., et al. A piglet model for detection of hypoxic-ischemic brain injury with magnetic resonance imaging. Acta radiologica. 49, 1049-1057 (2008).
- Andresen, J. H., et al. Newborn piglets exposed to hypoxia after nicotine or saline pretreatment: long-term effects on brain and heart. J Matern Fetal Neonatal Med. 22, 161-168 (2009).
- Munkeby, B. H., et al. Resuscitation with 100% O2 increases cerebral injury in hypoxemic piglets. Pediatric research. 56, 783-790 (2004).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены