Method Article
タイムラプス明実体顕微鏡でゼブラフィッシュ幼虫における組織修復をキャプチャ
要約
We present a protocol for capturing the dynamics of zebrafish larval tail fin regeneration on a whole-tissue scale using brightfield-based stereomicroscopy. This technique enables capturing the regeneration dynamics with single cell resolution. This methodology can be adapted to any stereomicroscope equipped with a CCD camera and time-lapse software.
要約
The zebrafish larval tail fin is ideal for studying tissue regeneration due to the simple architecture of the larval fin-fold, which comprises of two layers of skin that enclose undifferentiated mesenchyme, and because the larval tail fin regenerates rapidly within 2-3 days. Using this system, we demonstrate a method for capturing the repair dynamics of the amputated tail fin with time-lapse video brightfield stereomicroscopy. We demonstrate that fin amputation triggers a contraction of the amputation wound and extrusion of cells around the wound margin, leading to their subsequent clearance. Fin regeneration proceeds from proximal to distal direction after a short delay. In addition, developmental growth of the larva can be observed during all stages. The presented method provides an opportunity for observing and analyzing whole tissue-scale behaviors such as fin development and growth in a simple microscope setting, which is easily adaptable to any stereomicroscope with time-lapse capabilities.
概要
The ability of an organism to orchestrate tissue repair processes after injury is crucial for its survival 1. While all animals have the capacity to heal their wounds, the extent to which tissues regenerate differs greatly among species. Vertebrate species such as zebrafish, salamanders and frog tadpoles have the remarkable ability to regenerate lost tissues, including their appendages, portions of their eyes, heart, and central nervous system 2-4. Mammalian species, such as the African spiny mouse and rabbits, are capable of regenerating holes in their pinnae 5-7, and humans and mice regenerate portions of their liver as well as their digit tips during fetal and juvenile stages 8-12. Although it is not well understood yet why and how certain species regenerate tissues more effectively than others, the presence of similar genetic pathways suggests that these mechanisms may lie dormant in species without great regeneration potential 13,14. Thus elucidating tissue repair and regeneration mechanisms in species with satisfactory regeneration outcomes will benefit regeneration in humans.
We have chosen the larval zebrafish tail fin as a paradigm to demonstrate its regeneration with time-lapse brightfield stereomicroscopy. The zebrafish larval tail fin is anatomically simple as compared to the more complex adult structures, consisting of a two-layered, infolded epithelium with somatosensory axons innervating the skin that surrounds medially located mesenchymal cells 15. Despite the anatomical differences, larval tail fin regeneration is somewhat comparable to adult fin regeneration in terms of the molecular signatures and the outgrowth responses 16,17. As compared to the adult fin, imaging larval tail fin regeneration has however several advantages: 1) larval fin regeneration is completed within just 2-3 days 16, 2) larvae can be mounted in low-melt agarose, and 3) larvae do not require feeding until ~ 5 days post fertilization (dpf) due to the presence of the yolk sac. This makes zebrafish larvae ideal for observing tissue repair dynamics in vivo.
The presented method enables the capture of detailed dynamics underlying the early processes of fin regeneration. Many studies have utilized fluorescence-based confocal microscopy to study cellular and subcellular biological processes in embryonic and larval zebrafish. Sophisticated confocal imaging setups are however often not accessible to everyone and highly expensive as compared to other imaging techniques. In contrast, the presented methodology utilizes a Discovery V12 stereomicroscope equipped with Axiovision software and a time-lapse module, thus providing a more affordable alternative to expensive imaging equipment to examine tissue behaviors. We demonstrate that this method can be utilized for imaging tissue regeneration with high temporal resolution at a minimal cost. The implications for this method could extend beyond basic biology to advance mammalian regeneration studies using organ cultures, for therapeutic development through pharmacological and genetic screens, and it can serve as a teaching tool in a classroom setting.
プロトコル
ゼブラフィッシュ( 真珠層株 )が確立されたプロトコルに従って飼育し提起された。すべての努力は安楽死のための麻酔および1mMトリカインのために0.4 mMのトリカインを使用して、苦痛を最小限にするために行われた。適切な委員会(MDI生物学研究所の動物のコアIACUC番号13-20)によって承認されゼブラフィッシュ胚および幼生は、良好な動物の練習に厳密に従って取り扱われた。この研究は、プロトコル#14から09の下に国立ヒトゲノム研究所動物実験委員会、MDIBL機関保証#は、A-3562から01によって承認された。
注:幼虫のゼブラフィッシュでフィン再生を撮像する撮像手順は、以下のステップに要約されている:
幼虫期にゼブラフィッシュの1.調達
- 卵を収集し、0.00004パーセントメチレンブルーを補足した脱イオン水に0.03%のインスタントオーシャン塩を含有する100×25ミリメートルペトリ皿に約50卵を置きます。 28.5℃のインキュベーター中でO / Nインキュベートします。
- 翌朝、ガラスピペットで死んだ胚を除去し、脱イオン水(と呼ばれる胚培地)中で0.03%のインスタントオーシャン塩とストレーナーに卵をすすぐ。
注:好ましい可能性があるようなリンガー18、ハンクス18、E2 19、E3 20、及びDanieau 21の媒体。 - SUP>皿に新鮮胚培地を追加します。着色された菌株を使用する場合は、必要に応じてPTUとして、0.2mMの1-フェニル-2-チオ尿素(PTU)を追加し、メラニン形成を防止し、従って幼虫の色素沈着になる。胚がさらに2日後に受精または任意の他の所望の幼虫期まで、インキュベーター内で開発してみましょう。
イメージング商工の調製
- 方法1:PVCまたはテフロンチューブから作られたイメージングチャンバー( 図1)
注:このメソッドは、コンチャとアダムス(1998)22に似ています。- 25ミリメートル、外ANとハードウェアストアから飲料水用プラスチックまたはテフロンチューブを取得ダ20ミリメートルの内径。それぞれの側にあっても、表面に約10mmの厚さのリングを作るためにチューブを切断する。エッジを滑らかにするために> 200グリットサンドペーパーを使用してください。
- 暖かい水と70%エタノールリングをきれいにし、それらに空気乾燥してみましょう。
- ピペットチップで、リングの半分にシリコングリースを適用し、75ミリメートル×25 mmのガラスカバースリップにリングを取り付けます。また、シリコングリスの代わりに、ピペットチップで満たされた3ミリリットル注射器を使用しています。
注:、3 mlシリンジにシリコングリースを挿入する最初の30 mlシリンジにシリコングリースを加え、3 mlシリンジを充填するためにこれを使用することは困難であるからである。
- 方法2:撮像チャンバとしてペトリ皿の調製。
- 蓋( 図2A)に付着したガラスカバースリップで35または60ミリメートル直径のペトリ皿を取得。 DISTEL&ケスター(2007)23 図3に示すように、代替的に、時間に十分に小さい開口をドリル古い小さなペトリ皿の蓋にカバースリップと3ミリリットルシリンジで外部にシリコングリースを適用します。きれいなピペットチップを使用して、慎重に( 図2B)を外部に所望の厚さの円形または正方形のカバースリップを添付します。
- アガロースがしっかりと撮像手順の間に取り付けられた取り付けステーに使用されていることを確認するには、リングの内側に細かいプラスチックメッシュを取り付けます。まず、角度で細かいハサミを使用して、内側のリング径の大きさに、ハードウェアストアから取得したウィンドウ画面製のメッシュをカット。その後、メッシュの中央に>幼虫の倍のサイズに小さな長方形をカットします( 図1、2)。
- カバースリップとチャンバーリング( 図1A)との界面に非毒性のシリコングリースの四つの小ドットを適用する。
- カバーガラスの底にしっかりとメッシュを取り付けるために鉗子を使用してください。
3.マウントとプリINJのイメージング測定しまし幼虫(この手順はオプションです)
注:フィン再生後の切断面は、ゼブラフィッシュの幼虫で認識できないため、このステップは、切断され、再生フィン長さ間の比較に適しています。
- 試料の固定化のための胚培地中で0.5から1.2パーセント低融点アガロース溶液を準備します。
- 電子レンジでアガロースを加熱し、加熱ブロック中で42℃に予め温めている1.5ミリリットルチューブに液体アガロースを移す。
- ホットアガロースはこの温度で数週間にわたって維持することができ、42℃に冷却させ。これは、動物にとって有害であるように、42℃を超えるアガロースに幼虫をピペット避けるようにしてください。
- 直径60mmのペトリ皿に胚培地に0.4mMのトリカイン(pHが7)を10mlを使用して複数の幼虫を麻酔。ゼブラフィッシュブックのレシピ18に従ってトリカインを準備します。
- 99:1000希釈の代わりに、1の10ミリリットルを使用直径60mmのペトリ皿中で%2-フェノキシエタノール。先に進む前に、彼らのタッチレスポンスを評価するために蓋をしmicroloaderピペットチップで幼虫を突く。唯一の非応答幼虫を使用してください。
- ガラスパスツールピペットを用いて42℃でアガロース溶液に1幼虫を転送します。そうでなければ、アガロースがあまりにも希釈し、固化していないされ、アガロースに過度の液体を転送しないでください。
- ピペットから残留液を捨て、小さなペトリ皿(35または60ミリメートルの直径)にアガロースの一滴で幼虫を転送する。テールフィンの画像化のためにその側に幼虫を置きます。
- アガロースが固化することを許可する。プラスチックピペットチップでアガロースを評価する。それはあまりにも液体である場合には、先端をアガロース浸すます。アガロースが固化した後、小さなインデントはピペットチップで触れる時に表示されます。固化後、トリカインソリューションを追加し、タイムラプスイメージングのために後で使用します実体顕微鏡に進みます。 注:このステップは、胚培地中で1.5%アガロースでコーティングされたペトリ皿に麻酔した幼虫を配置することによって行われてもよい。
- タイムラプスソフトウェアと実体顕微鏡を使用してください。タイムラプスイメージングのために、後に使用される適切な目標と倍率を選択します。ここでは、実体顕微鏡で3.5×、16ミリメートル作動距離対物レンズを使用しています。必要に応じて、別の顕微鏡や対物レンズを利用しますが画像化手順の間に潜在的なXY-ドリフトとフィンの成長を考慮して適切な倍率を選択します。
- 顕微鏡上のカメラ検出モードを選択します。
- ソフトウェアでは、画面上の幼虫を表示するには、「ライブ」モードを選択します。
- 自動的に明るさを検出するために、「プロパティ」ウィンドウを開きます。
- 手動顕微鏡トランス照明ベースでのコントラストを調整します。
- 視野の外に幼虫を移動し、背景なしを最小限に抑えるためにシェーディング補正機能を選択ISE。
- バック視野に幼虫を置き、スナップショットを取る。画像を保存します。
- 第1のヘッドオフアガロースをこすることによって幼虫からアガロースを削除します。幼虫はそっと蓋をしmicroloaderピペットチップや虫ピンで残りのアガロースから離れて頭を引いてアガロースを抜け出しすることができますこの方法。
- ガラスパスツールピペットで新鮮トリカイン溶液中に幼虫を移す。
4.切断術アッセイ
- 胚培地を用いて1.5%アガロース溶液を調製し、ペトリ皿中に薄層を注ぐ。アガロースが固化してみましょう。
- 実体顕微鏡下では、固化したアガロース上に幼虫の側方に配置し、わずかな圧力( 図3A)と23 G注射針を持つテールフィンを切断する。
5.タイムラプスイメージングのための幼虫のマウント
- 3.5( 図3B) -ステップ3.1で説明したように実行します。
- 幼虫の向きを、アガロースを固化させて、画像化チャンバリング(ステップ2.1)に幼虫を含む42℃で0.5から1.2パーセント液体アガロースの低下を転送します。トリカイン溶液でリングを埋める。ペトリ皿室(ステップ2.2)が利用される場合あるいは、蓋カバースリップ上に幼虫をマウントし、トリカイン溶液を蓋を埋める。
- 適切な創傷治癒または組織再生が起こることを可能にするには、慎重に蓋をしmicroloaderピペットチップや虫ピンを使用して、遠位テールフィンを囲むアガロースを掻き。 ( 図3C)を繰り返しフィンを傷つけないようにしてください。
- アガロースを除去し、新鮮なトリカイン溶液でチャンバーリングを埋めるを含むトリカイン液をデカント。
- チャンバーリングのトップにシリコングリースを塗布し、75ミリメートル×25 mmのガラススライドを添付します。彼らは明視野イメージングと干渉し、時間をかけて幼虫を乾燥させるように、チャンバ内のエアポケットを避けるようにしてください。
- ペトリ皿などを使用している場合イメージング室、下部チャンバーの上部リムにシリコングリースを適用し、トリカイン溶液でボトム室を埋める。慎重にふたにトリカイン液をデカントし、エアポケットを避けるために、わずかな角度でボトム室のトリカイン溶液中に幼虫を浸すように蓋を裏返します。チャンバは、シリコングリースにより密封される。
6.タイムラプスイメージング
- 23,24( 図4)顕微鏡を中心にインキュベーションチャンバーを.Placeし、熱をオンに記載されているように加熱されたインキュベーションチャンバーを組み立てます。 20分、または温度が安定するまで - 約10のために28℃に温度を調整します。
- 加熱されたインキュベーションチャンバーの前面を開いて、目的に向かって上に向けカバーガラスで顕微鏡スタンドへの結像室を配置。
- 視野の2/3が空い残っている方法で、幼虫のフィンを配置します。これはの捕獲を保証します幼虫の位置を変更することなく撮像手順の過程でフィンの成長および再生。
- 事前の明視野強度またはアガロースの潜在的なシフトの変化を避けるために、タイムラプス撮影を開始する〜30分間28℃に取り付けられた幼虫を調整します。あるいは、短い調整時間後に撮影を開始するために予め温めたバッファを利用する。
- タイムラプス撮影を設定するには、Axiovisionソフトウェアの6D多次元取得ウィンドウを開き、zスタックとタイムラプスオプションを選択します。
- zスタックタブとスライスモード時)オプションの、スライス厚を選択し、[開始/停止モードを選択します。
- スタックの上下位置を定義する。
- タイムラプスタブで、間隔とムービーの継続時間を選択し、スタートボタンを押すことで、ムービーを開始します。我々は、30分間隔で十分であり、この間隔が過剰なデータを生成しないことを見出した。しかしshorterの間隔が使用されてもよい。
- 幼虫が事前に調整しなかった場合、最初の1時間の位置とzスタックの寸法を確認してください。必要に応じて、幼虫がずれているかもしれませんが、一日の後に再び幼虫の位置を変更。
- タイムラプス撮影の終了時にファイルを保存し、後処理などIMARIS 25やオープンソースのソフトウェア·パッケージの画像J 26、フィジー27として、利用可能な画像解析ソフトを用いて定量化を進める。
7.データ解析
- フィンの長さを決定する。
- イメージングソフトウェアにタイムラプスムービーを開き、ソフトウェアのパフォーマンスを向上させるために、独自のファイル形式でファイルを保存します。
- 投影スタックなど個々のセクションを表示するための直交ビューを選択します。ドリフト補正のために、フィジーのメニューの下に、プラグイン、その後、登録、及び「正しい3Dドリフト」を選択します。これはフィジーウィンドウを開き、ドリフト補正を実行します。正しいIMARISスポット機能で回転ドリフト。また、画像JにおけるSTACKREGとTurboRegプラグインをインストールし、フィジーにインポートします。 STACKREGプラグインで目的の変換アルゴリズムを選択してください。
- 距離( 例えば 、創傷直径またはフィン長さ)を測定するには、左上のツール·バーの[追加]新しい測定ポイント」オプションを選択します。
- 左下のメニューで「目に見える統計値の設定]リスト」の下では、統計値が表示されるように選択します。
- 設定タブの下の「ラインモード」で「ペア(AB、CDを...)」を選択します。
- 選択「名前」と「距離」「プロパティラベル」を、測定ラインの隣の点AとBとの間の距離を表示する。
- 「編集」モードに切り替えて、脊索の終わりに最初のポイントを選択するには、シフトボタンを押したままにします。その後、遠位フィンマージンで第2のポイントを選択するために同じ設定を使用しています。
- 「統計情報」タブで、画像内の距離を表示し、エクスポートする右下にディスクボタン(すべてエクスポート)を選択します。
- 右の画像の下のスライダを動かすことで選択された時間での測定を繰り返します。代わりに、新しい測定ポイントを作成するので、以前のものは、最初に新しい位置にシフトし、マウスの左ボタンを押すと同時に、次に、マウスの左ボタンでポイントを選択することで再配置することができる。
- あるいは、測定点オプションに、距離を測定するスライスビューアを利用する。スライスビューモードでは、所望の位置にスクロールして、マウスの左ボタンで第一と第二の位置をクリックしてください。距離が表示されます。このオプションでは、しかし、データのエクスポートを許可しません。
- ImageJのフィン長さと面積を決定する。
- .zviファイル形式を認識し、プラグインを使用してImageJのでタイムラプスムービーを開きます。また、屈原をロードickTimeファイルやTIFFシーケンス。
注:非圧縮のTIFFファイル形式を使用している場合、画像のサイズを指定する必要はありません。 - ファイル情報なしで別のファイル形式を開く場合は、最初の像距離と単位を定義するには、 '分析'メニューの下にある「設定するスケール」を選択します。 「ピクセル単位の距離」の「設定スケールメニュー」タイプでは、画素値の「既知の距離」を入力の下に(これは、イメージに追加されたスケールバー上の画素の数を測定することにより得ることができる、その後)の結果を得るために測定クリックして、「長さの単位「(通常は「ミクロン」)。 [OK]をクリックします。
- フィン面積の測定は、ツールバーの[フリーハンドの選択」ツールを選択し、フィンの輪郭に沿って描きながらマウスの左ボタンを押したことでフィン面積を概説。フィンの長さの測定のために、「ストレート」ラインツールを選択すること、所望の点の間に線を引く測定された。
- フィンの面積と長さを表示するには、「分析」の下に「メジャー」オプションをクリックします。映画の複数の時点のために必要に応じてこの手順を繰り返します。
- .zviファイル形式を認識し、プラグインを使用してImageJのでタイムラプスムービーを開きます。また、屈原をロードickTimeファイルやTIFFシーケンス。
- データをグラフィカルに表示することができる統計ソフトウェアを使用して。
結果
提示された技術は、切断に応答して組織修復の動態を解明するのに適している。映画は、フィンの切断が最初にフィン倍28( 図5 A、B)に存在するアクチン-ミオシンケーブルを介して収縮を特徴と、巾着効果をトリガーすることを実証している。付随して、細胞が傷(映画を参照)から押し出されている。収縮は、このように可能性の細胞死を受ける運命にある細胞を放出するための手段であってもよい。我々の結果はさらに、図5C(切断以下の36時間の時間経過にわたってフィン長さと面積によって測定されるようにフィン再生は約14時間後に切断されるまで開始しません一方、幼虫の発育成長は、独立して再生(映画)の発生することを示している、D)。 1.5日後の総再生フィン成長が元のフィンの長さ( 図5E)の約60%であった。まとめると、これらの結果は、切断さtrを実証フィン収縮、傷口からの細胞の押し出し、および時間的に遅延再生応答をiggers。押し出された細胞は、おそらく細胞死を受けるように運命づけられているが、これらの細胞の性質をさらに明確にする必要がある。

図1イメージング室リングアセンブリ
(A)示さシリコングリースカバースリップに取り付けられたプラスチックリングである。プラスチックメッシュは、シリコングリースの四つの小ドットチャンバ内に取り付けられている。 (B)が実装幼虫を含むチャンバは、トリカイン溶液を充填し、ガラススライドを上に取り付けられている。 (C)Aマウント2日齢幼虫(矢印)は、メッシュに関連してそのサイズを示すために高倍率で示されている。"_blank">この図の拡大版をご覧になるにはこちらをクリックしてください。

ペトリ皿から作られた図2のイメージングチャンバアセンブリ 。示されて(A)は、カバーガラスに付着したプラスチックメッシュを市販のガラストップのガラスボトムペトリ皿です。 (B)示さ蓋とシリコングリースを外側から取り付けられ、カバースリップに穿孔された穴を有する自己構築シャーレチャンバである。メッシュおよび幼虫トリカイン溶液を含むチャンバの内側に取り付けられている。室を密封するために、シリコングリースは下部チャンバーの上部、外側のリムと添付の上蓋に適用されます。 この図の拡大版をご覧になるにはこちらをクリックしてください。

イメージングのための幼虫の切断と取り付けの図3.スキーム 。 (A)は、切断は、アガロースでコーティングされたペトリ皿に麻酔した幼虫を置き、注射針とテールフィンを切断する。 42℃の液体アガロースで満たさ1.5ミリリットルチューブに転送ピペットで幼虫を転送し、画像化室に幼虫を含むドロップをピペットで、魚の向きを、胚培地でアガロース固化さをカバーし、実装するための(B)。 (C)蓋をしmicroloaderピペットチップまたは同様のツールを使用してテールフィンからアガロースを削り取ると新鮮な培地で胚培地を交換してください。 (D)画像実体顕微鏡下のテールフィン。 この図の拡大版をご覧になるにはこちらをクリックしてください。

4.自己構築加熱インキュベーションチャンバー図 。 (AC)示すのは、段ボール、プチプチとベルクロで作られた加熱されたインキュベーションチャンバーです。 (もともと鶏卵インキュベーションのために設計された)、有線ドームヒーターはアルミテープを用いてチャンバに接続されている。 この図の拡大版をご覧になるにはこちらをクリックしてください。
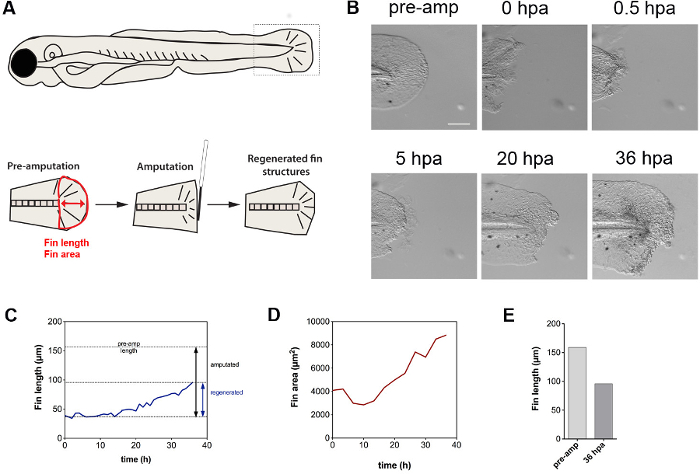
5.フィン再生のダイナミクスを図 。フィン長さ(赤矢印)と面積(フィンの赤いアウトライン)を決定する(A)を利用テールフィン切断アッセイおよび定量法のスキーム。 (B)テールフィン切断は最初レゲ続いて、フィンの収縮をトリガーnerative組織伸長。フィンはまた、横方向のサイズの増加によって証明されるように、発育成長を受ける。 (C)示さは、〜14ヘクトパスカルから始まる線形回生成長を明らかに、時間の関数としてのフィン長さである。 (D)フィン面積の定量化は、最初に、フィンの収縮に起因することができる、サイズの減少を明らかにする。 〜14時間後、リニアレートでフィンサイズが大きくなる。切断前にフィン長さのと36時間後(E)比較〜60%の成長を示しています。スケールバー:100μmの略語:プリアンプ、事前切断。営業時間は、切断、HPAを投稿。リジェネ、再生。アンプは、切断 この図の拡大版をご覧になるにはこちらをクリックしてください。
映画 。 36の時間経過にわたってフィン再生時間。示さは、再生の過程で2.5日齢幼虫のテールフィンです。開始30分後に切断回生成長は3.5倍対物レンズを用いて実体顕微鏡で30分間隔で撮像される。
ディスカッション
提示された方法は、比較的簡単なセットアップを使用して、明視野実体顕微鏡でのin vivoタイムラプスイメージングとゼブラフィッシュの幼虫を生きている創傷治癒および組織再生を観察することができます。この手順では、結果を最適化します我々がテストしている特定の重要な側面、必要です:1)低アガロース濃度(〜0.5%)を継続的に成長している幼虫のゼブラフィッシュの成長阻害要因を最小限に抑えることができます、2)フィンの周りのアガロースの除去は重要ではありません治癒過程を不明瞭にし、3)プラスチックメッシュでアガロースをトラップする手順を通じて安定した位置にアガロース及び動物を維持し、そして4)幼虫の生存に必須である適切な温度制御された環境。私たちは、段ボールの上にテープで留めているプチプチ、との間に最小限の変動に温度及び適切な空気循環を制御するための有線ドームヒーターを利用して加熱されたインキュベーションチャンバー23,24を 、適 応している撮像手順。この簡単で費用効率的なチャンバは、任意の顕微鏡に適合するように調製することができる。同様の加熱されたインキュベーションチャンバーは、撮像マウスおよびニワトリの開発24,29のために利用されている。
私たちは、事前に切断幼虫が事前切断のイメージのために搭載されていることを示唆し、切断のために取り外され、タイムラプスイメージングのために再マウント。それは、最終的な画像化チャンバ内の単一のステップでこれらの手順を実行することが可能ですが、私たちの経験では、我々はそれが組織を涙ときれいにカットを生じないように、ガラスカバースリップ上のテールフィンをamputatingことは、最適ではないことがわかった。注射針を用いてアガロースベースの切断方法は、もともと川上ら(2004)16によって記載され、切断術を行うのに理想的な我々の経験でもありました。したがって、我々が提示ステップのかなり複雑シリーズはよく正当化されると、最適な再生結果を保証します。
私たちは、そのlarvを示した2 DPFでのアルゼブラフィッシュは、アガロース及びトリカイン溶液中の1.5日まで撮像することができる。我々は、提示された撮像期間検体の健康を妨害しないインスタントオーシャン塩を用いて調製したpH最適化トリカイン(pH7で)溶液を用いた。我々は以前しかしまたDanieau媒体にトリカインを使用すると、少なくとも2日間、30のための共焦点顕微鏡で幼虫のゼブラフィッシュDPF 2.5のタイムラプスイメージングを可能とすることを実証した。このように、最適な緩衝液条件は、幼虫の健康とイメージングの長さを延長することができます。あるいは、より低いトリカイン濃度は麻酔のために使用され得る、または我々が発見2-フェノキシエタノールは、十分に少なくとも60時間、28℃、幼虫および成体段階で許容される。
フィン再生中の欠陥を避けるために、我々は、イメージングの前に尾びれのアガロースを除去した。我々のデータは、1.5日以内にフィンが約60%に再生したことを示している。この再生速度は、3日間aを定義する先の研究と一致している16 DPF 6にゼブラフィッシュ幼生までのテールフィン再生のための平均時間は、S。アガロースする別の方法は、しかしながら、画像化のために魚をマウントするために利用することができる。例えば、31またはフッ素化エチレンプロピレン(FEP)チューブメチルセルロースでコーティングされ、非常に低いアガロース濃度(0.1%)を充填した薄い血漿クロット光シート顕微鏡32に推奨されており、我々の提示された方法のために適切であり得る。彼らは試料によるこれらの培地の固化の不足のために、チャンバの底にマウントされていることを必要とするようにしかし、我々は、メチルセルロース、0.1%アガロースはお勧めしません。メチルセルロースの非常に高い濃度は、また我々の経験に基づいてエアポケットを生成し、これらは、撮像手順を妨害し得る。これらの媒体は、下部チャンバーを使用して好適である場合には、対物レンズと試料との間の適切な作動距離が存在することが重要である。これは、mのことに留意すべきであるそれは幼虫の健康32と干渉する可能性がある封入剤としてエチルセルロースは、わずか1日までにお勧めします。
ふたに試料をマウントする遅い重力下方向にドリフトすることがあります。したがって、いずれの単一面または最終的なムービーを組み立てるために抽出することができる焦点面内にある唯一の画像に投影することができる各時点、での画像、複数のセクションに推奨されます。ボトム室で試料を画像化することは潜在的な下向きのドリフトを回避するための代替の方法論である可能性があります。プラズマは外側の被覆層(EVL、周皮)31に固執するため、試料を安定化させることができるように、プラズマの塊は、ドリフトを避けるために役立つ可能性があります。しかし、これは、幼虫のゼブラフィッシュは、幼生の健康またはフィンの再生に干渉することなく血漿クロットに維持することができる期間を試験する必要があるだけでなく、。
私たちの映画は個々のセクション(26ミクロン)を利用し組み立てた撮像手順の間、フィンの可能性をzドリフトを占めフィン(〜10ミクロン)との完全な厚さをカバーして記録されたzスタック、の。 3-Dの情報を保持するためには、単一の画像へのzスタックを投影することも可能である。これは、画像のぼけにつながる可能性があるため、明視野デコンボリューションが望ましい場合がある。そのようなデコンボリューションまたはAutoquant X3などのソフトウェアは、この目的のために利用することができる。あるいは、(Tadrous 33に記載)の数学的ア ルゴリズムは、高い信号対雑音比(SNR)の点広がり関数を得るために適用することができる。高いSNRを得ることが明デコンボリューションの主要なハードルの一つを表している。この方法は、高コントラスト、薄い試料の厚さを必要とするが、それは、その減少幅に尾びれのイメージングのために適切であろう。
提示された撮像方法の明確な利点は、CCDカメラANを備えたすべての実体顕微鏡に迅速に適応可能であることであるDタイムラプスソフトウェアとは、低コストの代替に、より高価な共焦点イメージングシステムを提供しています。この方法は、細胞を検出するための蛍光を利用しないが、それはシャッター制御とポストイメージングデコンボリューションソフトウェア34のための自動化システムを利用してこのような用途のために拡張することができる。これは、さらにより長い期間にわたって、単一の細胞または細胞下解像度を有する創傷修復および再生プロセスを観察するユーザーを可能にする。
光学的透明性と使いやす胚および幼虫ゼブラフィッシュでは取り扱うことができ、いずれの実体顕微鏡にこの方法の適応性は、教室の設定で基本的な脊椎動物の生物学を教えるために適しています。この方法は、組織の修復および再生の基礎となる基本的な生物学的プロセスのより良い理解を学生に提供することができます。同様の方法で撮影してきた他の生物学的プロセスは、ゼブラフィッシュの胚発生23,34および心臓である機能(未発表)。この方法は、遺伝的および薬理学的に操作されている幼虫に巻か修復および再生を監視するための可能性を提供する。
開示事項
著者らは、開示することは何もない。
謝辞
We thank the MDI Biological Laboratory animal core service facility for zebrafish maintenance. Research reported in this publication was supported by Institutional Development Awards (IDeA) from the National Institute of General Medical Sciences of the National Institutes of Health under grant numbers P20GM104318 (for COBRE) and P20GM103423 (INBRE) and Department of Defense – USAMRAA (W81XWH-BAA-1) grant.
資料
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Bullseye Agarose | MidSci | BE-GCA500 | |
| Low-melt agarose | Fisher BioReagents | BP1360-100 | |
| 1-phenyl-2-thiourea | Alfa Aesar | L06690 | |
| Instant Ocean Aquarium Salt | Pet store | ||
| Methylene Blue (0.1% solution) | Sigma | M9140 | |
| Tricaine (Ethyl 3-aminobenzoate methanesulfonate) | Sigma-Aldrich | E10505 | |
| 2-Phenoxyethanol | Sigma-Aldrich | 77699 | |
| Petri Dish 35 x 15 mm | BD Falcon | 351008 | |
| Petri Dish 60 x 15 mm | BD Falcon | 351007 | |
| Petri Dish 100 x 25 mm | BD Falcon | 351013 | |
| 5.75 inch boroschillate glass pipets | Fisher | ||
| 35 mm Glass Top Glass Bottom Dish (Glass: 0.085-0.115mm) | MatTek Corporation | D35-20-0-TOP | |
| Superfrost/Plus microscope slides | Fisherbrand | 12-550-15 | |
| Glass coverslips | Electron Microscopy Services | 72191-75 | |
| Glass coverslips | Warner Instruments | CS-18R15 | |
| Phifer Phiferglass Insect Screen Charcoal - 48" | Home Depot | ||
| High vacuum grease | Dow Corning | ||
| Microloader pipette tips 20 µl | Eppendorf | 930001007 | |
| Fine Scissors - Sharply Angled Up | Fine Science Tools | 14037-10 | |
| 3 ml Luer-Lok™ disposable syringe | BD | 309657 | |
| 60 ml Luer-Lok™ disposable syringe | BD | 309653 | |
| 23 G syringe needles | BD | 305145 | |
| Dumont #5 Forceps | Fine Science Tools | 11295-00 | |
| Equipment | |||
| LabDoctor Mini Dry Bath | MidSci | ||
| Discovery.V12 compound microscope | Zeiss | ||
| Plan Apo S 3.5X objective | Zeiss | ||
| AxioCam MRm | Zeiss | ||
| Axiovision software, Release 4.8.2SP1 (12-2011) | Zeiss | ||
参考文献
- San Miguel-Ruiz, J. E., García-Arrarás, J. E. Common cellular events occur during wound healing and organ regeneration in the sea cucumber Holothuria glaberrima. BMC Dev Biol. 7, 115 (2007).
- Poss, K. D., Keating, M. T., Nechiporuk, A. Tales of regeneration in zebrafish. Dev Dyn. 226, 202-210 (2003).
- Akimenko, M. A., Marí-Beffa, M., Becerra, J., Old Géraudie, J. Old questions, new tools, and some answers to the mystery of fin regeneration. Dev Dyn. 226, 190-201 (2003).
- Slack, J. M. Regeneration research today. Dev Dyn. 226, 162-166 (2003).
- Seifert, A. W., et al. Skin shedding and tissue regeneration in African spiny mice (Acomys). Nature. 489, 561-565 (2012).
- Goss, R. J., Grimes, L. N. Epidermal downgrowths in regenerating rabbit ear holes. J Morphol. 146, 533-542 (1975).
- Williams-Boyce, P. K., Daniel, J. C. Comparison of ear tissue regeneration in mammals. J Anat. 149, 55-63 (1986).
- Allan, C. H., et al. Tissue response and Msx1 expression after human fetal digit tip amputation in vitro. Wound Repair Regen. 14, 398-404 (2006).
- Borgens, R. B. Mice regrow the tips of their foretoes. Science. 217, 747-750 (1982).
- Han, M., Yang, X., Lee, J., Allan, C. H., Muneoka, K. Development and regeneration of the neonatal digit tip in mice. Dev Biol. 315, 125-135 (2008).
- Muneoka, K., Allan, C. H., Yang, X., Lee, J., Han, M. Mammalian regeneration and regenerative medicine. Birth Defects Res C Embryo Today. 84, 265-280 (2008).
- Takeo, M., et al. Wnt activation in nail epithelium couples nail growth to digit regeneration. Nature. 499, 228-232 (2013).
- Akimenko, M. A., Johnson, S. L., Westerfield, M., Ekker, M. Differential induction of four msx homeobox genes during fin development and regeneration in zebrafish. Development. 121, 347-357 (1995).
- Reginelli, A. D., Wang, Y. Q., Sassoon, D., Muneoka, K. Digit tip regeneration correlates with regions of Msx1 (Hox 7) expression in fetal and newborn mice. Development. 121, 1065-1076 (1995).
- Brien, G. S., et al. Coordinate development of skin cells and cutaneous sensory axons in zebrafish. Journal of Comparative Neurology. 520, 816-831 (2012).
- Kawakami, A., Fukazawa, T., Takeda, H. Early fin primordia of zebrafish larvae regenerate by a similar growth control mechanism with adult regeneration. Dev Dyn. 231, 693-699 (2004).
- Yoshinari, N., Ishida, T., Kudo, A., Kawakami, A. Gene expression and functional analysis of zebrafish larval fin fold regeneration. Dev Biol. 325, 71-81 (2009).
- Westerfield, M. . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). , (2000).
- Detrich, H. W., Westerfield, M., Zon, L. I. The Zebrafish: Cellular and Developmental Biology, part A. Preface. Methods Cell Biol. 100 (13), (2010).
- Dahm, N. -. V. a. . Zebrafish: A Practical Approach, Issue 975. , 303 (2002).
- Detrich, H., Westerfield, M., Zon, L. . The Zebrafish: 2nd Edition Genetics, Genomics and Informatics. , (2005).
- Concha, M. L., Adams, R. J. Oriented cell divisions and cellular morphogenesis in the zebrafish gastrula and neurula: a time-lapse analysis. Development. 125, 983-994 (1998).
- Distel, M., Köster, R. W. In vivo time-lapse imaging of zebrafish embryonic development. CSH Protoc. 2007, (2007).
- Kulesa, P. M., Kasemeier-Kulesa, J. C. Construction of a Heated Incubation Chamber around a Microscope Stage for Time-Lapse Imaging. CSH Protoc. 2007, (2007).
- . Bitplane. Imaris V 6.1.0 Reference Manual. , (2008).
- Abramoff, M. D., Magalhaes, P. J., Ram, S. J. . Image Processing with ImageJ. , 36-42 (2004).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9, 676-682 (2012).
- Mateus, R., et al. In vivo cell and tissue dynamics underlying zebrafish fin fold regeneration. PLoS One. 7, e51766 (2012).
- Jones, E. A., et al. et al.Dynamic in vivo imaging of postimplantation mammalian embryos using whole embryo culture. Genesis. 34, 228-235 (2002).
- Rieger, S., Senghaas, N., Walch, A., Köster, R. W. Cadherin-2 controls directional chain migration of cerebellar granule neurons. PLoS Biol. 7, e1000240 (2009).
- Langenberg, T., Brand, M., Cooper, M. S. Imaging brain development and organogenesis in zebrafish using immobilized embryonic explants. Dev Dyn. 228, 464-474 (2003).
- Kaufmann, A., Mickoleit, M., Weber, M., Huisken, J. Multilayer mounting enables long-term imaging of zebrafish development in a light sheet microscope. Development. 139, 3242-3247 (2012).
- Tadrous, P. J. A method of PSF generation for 3D brightfield deconvolution. J Microsc. 237, 192-199 (2010).
- Distel, M., Babaryka, A., Köster, R. W. Multicolor in vivo time-lapse imaging at cellular resolution by stereomicroscopy. Dev Dyn. 235, 1100-1106 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved