Method Article
Захват восстановления тканей в данио рерио Личинки с Интерв светлого стереомикроскопия
В этой статье
Резюме
We present a protocol for capturing the dynamics of zebrafish larval tail fin regeneration on a whole-tissue scale using brightfield-based stereomicroscopy. This technique enables capturing the regeneration dynamics with single cell resolution. This methodology can be adapted to any stereomicroscope equipped with a CCD camera and time-lapse software.
Аннотация
The zebrafish larval tail fin is ideal for studying tissue regeneration due to the simple architecture of the larval fin-fold, which comprises of two layers of skin that enclose undifferentiated mesenchyme, and because the larval tail fin regenerates rapidly within 2-3 days. Using this system, we demonstrate a method for capturing the repair dynamics of the amputated tail fin with time-lapse video brightfield stereomicroscopy. We demonstrate that fin amputation triggers a contraction of the amputation wound and extrusion of cells around the wound margin, leading to their subsequent clearance. Fin regeneration proceeds from proximal to distal direction after a short delay. In addition, developmental growth of the larva can be observed during all stages. The presented method provides an opportunity for observing and analyzing whole tissue-scale behaviors such as fin development and growth in a simple microscope setting, which is easily adaptable to any stereomicroscope with time-lapse capabilities.
Введение
The ability of an organism to orchestrate tissue repair processes after injury is crucial for its survival 1. While all animals have the capacity to heal their wounds, the extent to which tissues regenerate differs greatly among species. Vertebrate species such as zebrafish, salamanders and frog tadpoles have the remarkable ability to regenerate lost tissues, including their appendages, portions of their eyes, heart, and central nervous system 2-4. Mammalian species, such as the African spiny mouse and rabbits, are capable of regenerating holes in their pinnae 5-7, and humans and mice regenerate portions of their liver as well as their digit tips during fetal and juvenile stages 8-12. Although it is not well understood yet why and how certain species regenerate tissues more effectively than others, the presence of similar genetic pathways suggests that these mechanisms may lie dormant in species without great regeneration potential 13,14. Thus elucidating tissue repair and regeneration mechanisms in species with satisfactory regeneration outcomes will benefit regeneration in humans.
We have chosen the larval zebrafish tail fin as a paradigm to demonstrate its regeneration with time-lapse brightfield stereomicroscopy. The zebrafish larval tail fin is anatomically simple as compared to the more complex adult structures, consisting of a two-layered, infolded epithelium with somatosensory axons innervating the skin that surrounds medially located mesenchymal cells 15. Despite the anatomical differences, larval tail fin regeneration is somewhat comparable to adult fin regeneration in terms of the molecular signatures and the outgrowth responses 16,17. As compared to the adult fin, imaging larval tail fin regeneration has however several advantages: 1) larval fin regeneration is completed within just 2-3 days 16, 2) larvae can be mounted in low-melt agarose, and 3) larvae do not require feeding until ~ 5 days post fertilization (dpf) due to the presence of the yolk sac. This makes zebrafish larvae ideal for observing tissue repair dynamics in vivo.
The presented method enables the capture of detailed dynamics underlying the early processes of fin regeneration. Many studies have utilized fluorescence-based confocal microscopy to study cellular and subcellular biological processes in embryonic and larval zebrafish. Sophisticated confocal imaging setups are however often not accessible to everyone and highly expensive as compared to other imaging techniques. In contrast, the presented methodology utilizes a Discovery V12 stereomicroscope equipped with Axiovision software and a time-lapse module, thus providing a more affordable alternative to expensive imaging equipment to examine tissue behaviors. We demonstrate that this method can be utilized for imaging tissue regeneration with high temporal resolution at a minimal cost. The implications for this method could extend beyond basic biology to advance mammalian regeneration studies using organ cultures, for therapeutic development through pharmacological and genetic screens, and it can serve as a teaching tool in a classroom setting.
протокол
Данио рерио (штамм перламутр) были выведены и вырос в соответствии с установленными протоколами. Все усилия были сделаны, чтобы минимизировать страдания, используя 0,4 мМ Tricaine для анестезии и 1 мМ Tricaine для эвтаназии. Эмбрионы рыбок данио и личинки были обработаны в строгом соответствии с надлежащей практикой животных, утвержденных соответствующим комитетом (MDI биологическая лаборатория животное ядро IACUC номер 13-20). Это исследование было одобрено Национальным Геном человека Научно-исследовательский институт по уходу за животными и использованию комитета, MDIBL Институциональная Assurance #-3562-01 по по протоколу # 14-09.
Примечание: процедура визуализации, которая захватывает плавник регенерации мальков данио кратко изложена в следующих шагов:
1. Повышение данио рерио, чтобы личиночной стадии
- Сбор яиц и поместите около 50 яиц в 100 х 25 мм чашки Петри, содержащей 0,03% мгновенных Ocean соли в деионизированной воде с добавлением 0,00004% метиленового синего. Выдержите O / N в 28,5 ° C инкубатора.
- следующее утро удалить мертвые эмбрионы с стеклянной пипетки и промыть яйца в сито с 0,03% мгновенных океана соли в деионизированной воде (называется эмбрион среды).
Примечание: среде, такой как Рингера 18, 18 Хэнкса, E2, E3 19 20 и 21 мая Danieau быть предпочтительным. - SUP> Добавить свежие эмбриона среды в блюдо. При использовании пигментированных штаммов, необязательно добавляют 0,2 мМ 1-фенил-2-тиомочевины (ПТУ), а ПТУ предотвратит меланогенез и, таким образом пигментации личинок. Пусть эмбрионы дальнейшее развитие в инкубаторе до 2 дней после оплодотворения или любой другой нужной личиночной стадии.
2. Подготовка изображениями палаты
- Метод 1: Визуализация камеры, изготовленные из ПВХ или тефлоновые трубки (рис 1)
Примечание: Этот метод похож на Конча и Адамса (1998) 22.- Приобретать пластика класса питьевой воды или тефлоновую трубку из хозяйственного магазина с 25 мм внешним апда 20 мм внутренний диаметр. Сокращение трубки, чтобы кольца примерно 10 мм толщиной с ровной поверхности на каждой стороне. Используйте> 200 наждачной бумагой сгладить края.
- Очистите кольца с теплой водой и 70% этанола, и пусть они высохнуть на воздухе.
- С кончика пипетки нанесите силиконовую смазку на половину кольца и установите кольца 75 мм х 25 мм покровным стеклом. Кроме того, использовать шприц 3 мл, наполненный силиконовой смазкой, а не кончиком пипетки.
Примечание: Поскольку трудно вставить силиконовую смазку в шприц 3 мл, добавить силиконовую смазку с 30 мл шприц с первым и использовать это для заполнения шприц 3 мл.
- Способ 2: Получение чашке Петри в качестве изображения камеры.
- Приобретать 35 или 60 мм в диаметре чашки Петри с покровным стеклом, прикрепленной к крышке (рис 2а). Кроме того, как показано на рисунке 3 Distel и Кестер (2007) 23, просверлить отверстие достаточно малы, чтобы чстарый покровное в крышку небольшой чашке Петри и применять силиконовую смазку наружу с 3 мл шприца. Используя чистую пипетки, тщательно прикрепить круглую или квадратную покровное нужной толщины к внешним (рис 2б).
- Для того, чтобы агарозы используется для монтажа твердо лежит во время процедуры визуализации, приложите тонкую пластиковую сетку внутри кольца. Во-первых, сократить сетку, изготовленную из стекла экрана, полученного из хозяйственном магазине, в размера внутреннего диаметра кольца с помощью тонких ножниц с углом. Затем вырезать небольшой прямоугольник> в два раза больше личинки в середине сетки (фиг.1, 2).
- Применить четыре маленькие точки нетоксичного силиконовой смазкой на границе между покровным и камерного кольца (рис 1А).
- Использование щипцов для прикрепления сетки плотно к нижней части покровного стекла.
3. Монтаж и Визуализация предварительного Injряться Личинка (Этот шаг является необязательным)
Примечание: Этот шаг является подходящим для сравнений между ампутированной и регенерированного плавника длины, как ампутация самолет после плавника регенерации не распознается в данио личинок.
- Подготовьте 0,5-1,2% с низким уровнем расплава агарозном решение в зародыше среда для иммобилизации образца.
- Нагрейте агарозы в микроволновой печи и передавать жидкости агарозы в 1,5 мл пробирки, которые предварительно нагревают до 42 ° С в нагревательном блоке.
- Пусть горячей агарозы остыть до 42 ° С, которая может быть сохранена в течение нескольких недель при этой температуре. Старайтесь избегать пипетки личинок в агарозном выше 42 ° C, так как это будет вредно для животных.
- Обезболить несколько личинок с помощью 10 мл 0,4 мм Tricaine (рН 7) в зародыше среды в 60 мм Диаметр чашки Петри. Подготовка Tricaine в соответствии с данио рерио книги Рецепты 18.
- В качестве альтернативы, использовать 10 мл в разведении 1: 1000 в 99% 2-феноксиэтанол в 60 мм Диаметр чашки Петри. Совать личинок с ограничен наконечником microloader пипетки, чтобы оценить их чувствительности к силе нажатия, прежде чем продолжать. Используйте только не реагируют личинок.
- Трансфер в одну личинку в 42 ° C раствор агарозы с использованием стекла Пастера пипетки. Не передавать лишнюю жидкость в агарозе, в противном случае агарозы будет слишком разбавляют и не затвердевают.
- Отменить оставшуюся жидкость из пипетки, и передавать личинки с одной капли агарозы в небольшой чашке Петри (35 или 60 мм в диаметре). Установите личинку на бок изображений хвостового плавника.
- Разрешить агарозном закрепить. Оценка агарозы с пластиковым наконечником пипетки; подсказка погрузиться в агарозы, если он слишком жидкий. После агарозном укрепил, небольшое углубление будет виден при прикосновении с кончика пипетки. После затвердевания, добавить раствор Tricaine и перейти к стереомикроскопом, который будет использоваться в дальнейшем для покадровой обработки изображений. Примечание: Этот шаг может быть также выполнена путем размещения анестезированных личинку на чашке Петри с покрытием 1,5% агарозы в среде эмбрионов.
- Используйте стереомикроскопа с покадровой программного обеспечения. Выберите подходящий цели и увеличение, которое будет использоваться в дальнейшем для покадровой обработки изображений. Вот, используйте 3,5 х 16 мм Рабочее расстояние линзы объектива на стереомикроскопом. По желанию, использовать альтернативные микроскопы и объективы, но выбрать надлежащее увеличение учитывать потенциальную ху дрейфа и роста плавника в течение процедуры визуализации.
- Выберите режим обнаружения камеры на микроскоп.
- В программном обеспечении, выберите режим "живой", чтобы посмотреть личинку на экране.
- Откройте окно «Свойства» для автоматического определения яркости.
- Ручная регулировка контрастности у микроскопа транс-освещения базы.
- Перемещение личинку из поля зрения и выберите функцию Shading коррекции, чтобы минимизировать Не существует ни одногоISE.
- Установите личинку обратно в поле зрения и сделать снимок. Сохраните изображение.
- Удалить агарозы из личинки сначала выскабливание агарозы задевая голову. Таким образом, личинка может быть выскользнул из агарозы, осторожно потянув за голову от оставшейся агарозы с ограничен наконечником microloader пипетки или булавкой насекомых.
- С бокалом Пастера пипетки перенести личинку в свежий раствор Tricaine.
4. Ампутация Анализ
- Подготовьте 1,5% раствора агарозы с использованием эмбрионов среду и залить тонким слоем в чашку Петри. Пусть агарозном укрепить.
- Под стереомикроскопа, положите личинки вбок на затвердевшей агарозы и ампутировать хвостовой плавник с 23 г иглу шприца с небольшим давлением (рис 3А).
5. Монтаж Куклу для Интерв изображений
- Действуйте, как описано в шагах 3.1 - 3.5 (рис 3б).
- Передача каплю 0,5-1,2% жидкого агарозы при 42 ° С, содержащего личинки в томография кольцевой камеры (шаг 2,1), ориентироваться личинки, и пусть агарозном затвердевать. Заполните кольцо с раствором Tricaine. Кроме того, если блюдо камера Петри (шаг 2,2) используется, установите личинку на крышку покровного стекла и заполнить крышку раствором Tricaine.
- Для обеспечения надлежащей заживление ран или регенерации тканей произойти, тщательно соскоблить агарозы вокруг дистального хвостовой плавник с помощью колпачком кончик microloader пипетки или PIN-код насекомых. Старайтесь не повредить ребро неоднократно (рис 3C).
- Слейте раствор Tricaine, содержащий удалены агарозы и заполнить камеру кольцо с свежим раствором Tricaine.
- Применить силиконовую смазку на верхней части кольцевой камеры и приложите на 75 мм х 25 мм предметное стекло. Старайтесь избегать образования воздушных карманов в камере, так как они будут мешать визуализации светлого и пересушивает личинку в течение долгого времени.
- При использовании чашки Петри, какКамера изображения, применять силиконовую смазку на верхнем торце нижней камере и заполнить нижнюю камеру с раствором Tricaine. Тщательно слейте раствор Tricaine в крышке и повернуть крышку над погружать личинку в раствор Tricaine нижней камере под небольшим углом, чтобы избежать воздушных карманов. Камера будет запечатан за счет силиконовой смазкой.
6. Покадровый изображений
- Соберите с подогревом инкубационной камере, как описано в 23,24 (рис 4) .Поместить инкубационный камеру вокруг микроскопа и включите тепла. Отрегулируйте температуру до 28 ° С в течение примерно 10 - 20 мин или до стабилизации температуры.
- Открыть переднюю часть нагретого инкубационной камере и поместить в камеру формирования изображения на штатив для микроскопа с покровным вверх по направлению к цели.
- Установите личинок плавник таким образом, что 2/3 поля зрения остается незанятым. Это обеспечивает захватрост и регенерацию плавника над ходе процедуры формирования изображения без необходимости перемещать личинку.
- Отрегулируйте установленный личинку до 28 ° С в течение ~ 30 мин до начала покадровой записи, чтобы избежать изменений в интенсивности светлого или потенциальных сдвигов агарозы. Кроме того, использовать предварительно нагревают буфер запускать создание после короткого времени наладки.
- Чтобы настроить покадровой записи, откройте окно 6D Многомерная приобретение в программном обеспечении AxioVision и выберите опцию Z-стека и покадровой.
- Необязательно) На вкладке г-стека и нарезать режиме, выберите толщину среза, а затем выберите режим Start / Stop.
- Определить верхнюю и нижнюю позицию в стеке.
- На вкладке покадровой, выберите интервал и продолжительность фильма, а затем начать воспроизведение фильма нажатием на кнопку пуска. Мы обнаружили, что интервалы 30 мин достаточно, и этот интервал не генерирует избыточное данных; Однако shorteмогут быть использованы R интервалов.
- Проверьте положение и г-стека размеры в течение первого часа, если личинка не было предварительно отрегулировать. Если необходимо, переместите личинки затем после целого дня, а личинка может быть смещен.
- Сохраните файл на конце покадровой записи и продолжить пост-обработки и количественными с использованием доступного программного обеспечения для анализа изображений, таких как Imaris 25 или с открытым исходным кодом программных пакетов Image J 26 и Фиджи 27.
Анализ 7. Данные
- Определение плавник длину.
- Откройте покадровой фильм в ПО для обработки изображений и сохранять файлы в собственный формат файлов для повышения производительности программного обеспечения.
- Выберите ортогональной проекции, чтобы отобразить отдельные разделы, как прогнозируемых стеков. Для коррекции дрейфа, в меню Фиджи, выберите плагины, то регистрация, и "Правильное 3D дрейф». Это откроет окно Фиджи и выполнять корректировки дрейфа. Правильныйвращения дрейф в функции Imaris пятна. Кроме того, установить плагины StackReg и TurboReg в образе J и импортировать Фиджи. Выберите нужный алгоритм преобразования в плагине StackReg.
- Для измерения расстояния (например, раны диаметром или плавник длина), выберите опцию "добавить новые точки измерения" в верхнем левом панели инструментов.
- В разделе "Настройка списка видимых значений статистик 'в нижнем левом меню выберите значения Статистика будет отображаться.
- В режиме 'Line' на вкладке настроек выберите «Пары (AB, CD ...).
- В «Этикетки Свойства» выберите «Имя» и «расстояние», чтобы отобразить расстояние между точками А и В, рядом с измерительной линии.
- Переключитесь в режим "Изменить" и удерживайте кнопку переключения, чтобы выбрать первую точку в конце хорды. Затем используйте ту же конфигурацию, чтобы выбрать вторую точку на дальнем ребра края.
- На вкладке "Статистика", нажмите кнопку диска (Export All) в нижнем правом углу, чтобы отобразить и экспортировать расстояние на картинке.
- Повторите измерение в выбранных времена, перемещая ползунок под изображением справа. Вместо того чтобы создавать новые точки измерения, предыдущие можно перемещать, выбрав сначала пункт левой кнопкой мыши, а затем одновременно нажать сдвига и левую кнопку мыши в новой позиции.
- В качестве альтернативы вариант точек измерения, использовать зрителя ломтик измерения расстояния. В режиме просмотра среза, выделите нужное положение и нажмите на первом и втором положении с левой кнопкой мыши. Расстояние будет отображаться. Этот вариант, однако, не позволяют для экспорта данных.
- Определение плавник длина и площадь в ImageJ.
- Откройте покадровой фильм в ImageJ с помощью плагина, который признает .zvi формат файла. Кроме того, загрузить в КуickTime файл или последовательность TIFF.
Примечание: Если вы используете несжатый формат TIFF файла, размеры изображения не должны быть указаны. - Если открыть другой формат файла без информации о файле, выберите "Установить масштаба» в меню «Анализ», чтобы сначала определить расстояние до изображения и блок. В «SET MENU масштаба», типа в "Расстояние в пикселях", ниже типа в "известном расстоянии" для значения пикселя (это могут быть получены путем измерения количества пикселей на масштабной линейки, который был добавлен к изображению , а затем нажмите Измерить для получения результата), и "Единица длины" (обычно "мкм"). Затем нажмите кнопку ОК.
- Для измерения плавник область Выделите 'Freehand Selection "инструмент на панели инструментов и наметить плавник область, удерживая левую кнопку мыши во время рисования по контуру ребра. Для измерений ребер длины, выберите "квадратный" инструмент Линия и нарисуйте линию между желаемым точек будетизмерить.
- Выберите опцию "мера" под "Анализ", чтобы отобразить площадь и длину плавника. Повторите этот шаг часто, как необходимо для нескольких моментов времени фильма.
- Откройте покадровой фильм в ImageJ с помощью плагина, который признает .zvi формат файла. Кроме того, загрузить в КуickTime файл или последовательность TIFF.
- Используя статистические программное обеспечение данные могут быть графически отображены.
Результаты
Представленная методика подходит для выяснения динамики восстановления тканей в ответ на ампутации. Фильм демонстрирует, что ампутация плавника первоначально вызывает кошелек-строку эффект, характеризующийся сокращений с помощью актин-миозин кабелей, которые присутствуют в плавник раз 28 (рис 5 а, б). Одновременно клетки экструдируют из раны (см фильм). Сокращение таким образом, может быть средством, чтобы изгнать клетки, которые, вероятно, суждено пройти гибель клеток. Наши результаты также показывают, что рост развития личинки происходит независимо от регенерации (Видео), в то время как плавник регенерации не открывает приблизительно до 14 ч после ампутации как измеряется плавника длины и площади за время курса в 36 час следующем ампутации (5С , D). Общее регенеративного ребра рост после 1,5 дней составила около 60% от первоначальной длины ребер (фиг 5E). Взятые вместе, эти результаты показывают, что ампутация TR iggers ребра сжатия, экструзии клеток из раны, и по времени задержки восстановительной реакции. В то время как экструдированные клетки, вероятно, суждено подвергаются клеточной гибели, природа этих клеток нуждается в дальнейшем уточнении.

Рисунок 1. изображениями кольцевой камеры в сборе
(А) Показаны представляет собой пластиковую кольцо, которое крепится к покровным с силиконовой смазкой. Пластиковая сетка прикреплена к внутренней части камеры с четырьмя маленькими точками силиконовой смазки. (В) Камеру, содержащую установленную личинки заполнен раствором Tricaine и предметное стекло крепится к верхней части. (C) установлен 2-дневных личинок (стрелка) показана при большем увеличении, чтобы изобразить его размер по отношению к сетке."_blank"> Нажмите здесь, чтобы посмотреть большую версию этой цифры.

Рисунок 2. визуализации узла камеры изготовлены из чашки Петри. () Показана коммерческий стеклянной столешницей со стеклянным дном чашки Петри с пластиковой сеткой, прикрепленной к покровного стекла. (В) Показана возведенных Петри камеры с отверстием в крышке и покровным прикрепленной снаружи с силиконовой смазкой. Сетки и личинка устанавливаются внутри камеры, содержащей раствор Tricaine. Для герметизации камеры, силиконовая смазка наносится на верхней внешней кромки нижней палаты и верхней крышке прилагается. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
Рисунок 3. Схема ампутации и монтажа личинки для визуализации. () Для ампутации, поместите под наркозом личинку на агарозном покрытием чашки Петри и ампутировать хвостовой плавник с иглой шприца. (B) Для монтажа, передачи личинку с пипетки в 1,5 мл пробирку, заполненную 42 ° C жидкости агарозы и пипетки капли, содержащий личинки в камеру формирования изображения, ориентировать рыбу и покрыть затвердевает агарозы с эмбриона среды. (C) Соскребите агарозы из хвостовой плавник с помощью увенчанный пипетки microloader или аналогичный инструмент и заменить эмбриона среды свежей средой. (D) Изображение хвостовой плавник под стереомикроскопа. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.

Рисунок 4. Самостоятельная построены с подогревом инкубационной камере. (AC) Показана с подогревом Инкубационный камера из картона, пузырчатая пленка и липучки. Проводной купол нагреватель (первоначально разработан для куриного яйца инкубации) крепится к камере с помощью алюминиевой ленты. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
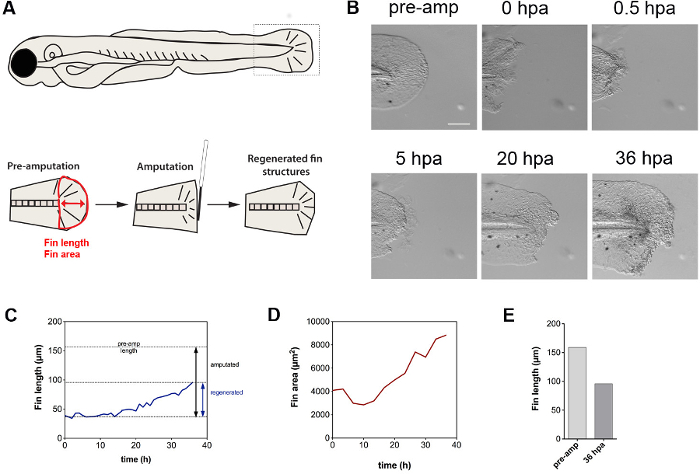
Рисунок 5. Динамика Fin регенерации. () Схема ребра ампутация анализа и количественного метода используется хвостовой определить плавник длину (красная стрелка) и площадь (красный контур из плавник). (B) Хвостовой плавник ампутация первоначально вызывает сокращение плавника, а затем REGEnerative ткани вырост. Плавник претерпевает рост развития, о чем свидетельствует боковой увеличения размера. (С) Показана ребра длины, как функцию времени, открывая линейный регенеративный запуска роста на ~ 14 гПа. (D) Количественное определение ребра области показывает, изначально уменьшаться в размере, который можно отнести к сжатию плавника. После ~ 14 час, ребристые увеличивается размер с линейной скоростью. (E) Сравнение ребра длиной до ампутации и после 36 часов показывает ~ 60% отрастания. Масштабная линейка: 100 мкм Сокращения: предварительный усилитель, предварительно ампутация; часов после ампутации, гПа; регенерация, регенерация; усилитель, ампутация Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
Кино . Fin регенерации по времени процессе 36ч. Показана хвостовой плавник из 2,5-дневного возраста личинки в ходе регенерации. Начиная с 30 мин после ампутации восстановительный рост изображается в 30-минутными интервалами на стереомикроскопом помощью 3.5x объектив.
Обсуждение
Представленный метод позволяет наблюдать заживление ран и регенерацию тканей живых данио личинок в естественных условиях покадровой съемки на светлое стереомикроскопом, используя сравнительно простую настройку. Эта процедура требует определенных важных аспектов, которые мы протестировали, которые будут оптимизировать результат: 1) Низкие агарозные концентрации (~ 0,5%) позволит свести к минимуму роста препятствий на постоянно растущий личинок рыбок данио, 2) Удаление агарозы вокруг плавника важно не чтобы скрыть процесс заживления, 3) Захват агарозы в пластиковой сетки сохраняет агарозы и животных, в стабильном положении на протяжении всей процедуры, и 4) правильное контролируемой температурой окружающей среды, что очень важно для личинок жизнеспособности. Мы адаптировали с подогревом инкубационной камере 23,24, который использует пузырчатую пленку, что выявляется на картон, и проводной купол нагреватель для контроля температуры и правильной циркуляции воздуха с минимальными колебаниями вопроцедура визуализации. Этот простой и экономичный камера может быть подготовлен, чтобы соответствовать любому микроскопа. Похоже подогревом инкубационной камере была также использована для мышей изображений и развитие цыплят 24,29.
Мы полагаем, что до ампутировали личинки монтируются на заранее ампутации изображения, демонтированных для ампутации, и перемонтирована для покадровой обработки изображений. Хотя это возможно, чтобы выполнить следующие действия в одну стадию в конечном камере формирования изображения, в нашем опыте мы обнаружили, что ампутации хвостовой плавник на покровным стеклом не является оптимальным, так как он разрывает ткань и не привести к чистый срез. Агарозном Метод, основанный на ампутации, используя иглу шприца первоначально был описан Каваками и его коллеги (2004) 16, а также, по нашему опыту, идеально подходит для выполнения ампутации. Таким образом, довольно сложный ряд шагов, которые мы представили вполне оправдано и обеспечивает оптимальный результат регенерации.
Мы показали, что larvаль данио в 2 денье могут быть отображены до 1,5 дней в агарозы и решения Tricaine. Мы использовали Tricaine (рН 7) рН раствора, оптимизированные подготовленный с помощью функции мгновенного океана соли, которая не мешает здоровья особи за представленный период формирования изображений. Мы ранее, однако, также показали, что с помощью Tricaine в Danieau среды позволяет покадровой визуализации 2,5 DPF личинок рыбок данио на конфокальной микроскопии, по крайней мере, 2 дней 30. Таким образом, оптимальные условия буфер может продлить личинок здоровье и продолжительность визуализации. С другой стороны, более низкие концентрации Tricaine могут быть использованы для анестезии или 2-феноксиэтанол, который мы обнаружили хорошо переносится во личинок и взрослых стадий при 28 ° С в течение по меньшей мере 60 ч.
Чтобы избежать дефектов в ребра регенерации, мы удалили агарозы из хвостового плавника до визуализации. Наши данные показывают, что в течение 1,5 дней плавник регенерируют до примерно 60%. Это скорость восстановления согласуется с предыдущим исследованием, определяющего 3 дней вš среднее время для регенерации хвостового плавника у рыбок данио личинок до 6 DPF 16. Альтернативные методы агарозы, однако, может быть использован для установки рыбы для визуализации. Например, тонкий плазменный сгустков 31 или фторированный этилен-пропилен (FEP) трубки, покрытые метилцеллюлозы и наполненные очень низких концентрациях агарозы (0,1%) были рекомендованы для легкой листовой микроскопии 32 и могут быть пригодны для нашего, представленном способе. Тем не менее, мы не рекомендуем метилцеллюлозы и 0,1% агарозы, как они требуют, чтобы образец установлены в нижней части камеры из-за отсутствия кристаллизации из этих сред. Очень высокие концентрации метилцеллюлозы будет того генерировать воздушные карманы, основанные на нашем опыте, и они могут влиять на процедуры визуализации. Если эти средства являются предпочтительными с использованием нижнюю камеру, важно, чтобы соответствующее рабочее расстояние между объективом и образцом присутствует. Следует отметить, что тэтилцеллюлоза в качестве монтажной среды рекомендуется только до 1 дня, так как это может помешать личинок здоровья 32.
Монтаж образца в крышке может привести к медленной гравитационной вниз дрейфа. Поэтому рекомендуется, чтобы изображения нескольких секций в каждый момент времени, который может быть либо прогнозируемых в одной плоскости или только изображений, которые находятся в фокальной плоскости могут быть извлечены для сборки окончательного фильма. Визуализация образец на дно камеры может быть альтернативной методологии, чтобы избежать возможных вниз дрейф. Плазменные сгустки может быть полезным, чтобы избежать дрейф, а плазма будет прилипать к внешней огибающей слоя (EVL, перидермы) 31 и, следовательно, может стабилизировать образца. Это, однако, должна быть проверена, а также, как долго личинок данио могут быть сохранены в плазменных сгустков, не мешая личинок здоровья или ребра регенерации.
Наша фильм был собран с использованием отдельных секций (26 мкм)записанного Z-стек, который охватывает всю толщину плавника (~ 10 мкм) и на долю которых приходится потенциального Z-дрейфа плавника во время процедуры визуализации. Для того, чтобы сохранить 3-D информации, это также можно Z-стеки в одиночных изображений проекта. Потому что это может привести к размытости изображения, светлое деконволюции может быть желательным. Программное обеспечение, такое как деконволюции или Autoquant X3 могут быть использованы для этой цели. Кроме того, математические алгоритмы (описанные в Tadrous 33) могут быть использованы для получения ФРТ функцию высоким соотношением сигнал-шум (SNR). Получение высокой SNR является одним из основных препятствий в светлое деконволюции. Хотя этот метод требует высокую контрастность и малую толщину образца, было бы целесообразно для визуализации хвостовой плавник из-за его уменьшенной ширины.
Явным преимуществом предложенного метода формирования изображения является то, что он быстро адаптируется к любому стереомикроскопа, снабженного ПЗС камерой ANd программного обеспечения покадровой и предлагает недорогую альтернативу для более дорогих систем конфокальной микроскопии. Хотя этот метод не использует флуоресценции для обнаружения клеток, он может быть продлен для таких приложений, путем использования автоматизированной системы управления жалюзи и пост-обработки изображений деконволюции программного обеспечения 34. Это позволит пользователям для дальнейшего наблюдения заживления раны и процессы регенерации с одной клетки или субклеточных разрешением в течение длительных периодов времени.
Оптическая прозрачность и легкость, с которой в зачаточном состоянии и личинок рыбок данио может быть обработан, и адаптивность этого метода к любому стереомикроскопом делает его пригодным для обучения основной позвоночных биологии в классной комнате. Этот метод может дать студентам лучше понять основные биологические процессы, лежащие в основе восстановления тканей и регенерации. Другие биологические процессы, которые были захвачены с аналогичным методом, данио эмбриональное развитие 23,34 и сердцафункция (не опубликовано). Этот метод также дает возможность для ремонта мониторинга раны и регенерации у личинок, которые были генетически и фармакологически манипулировать.
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
We thank the MDI Biological Laboratory animal core service facility for zebrafish maintenance. Research reported in this publication was supported by Institutional Development Awards (IDeA) from the National Institute of General Medical Sciences of the National Institutes of Health under grant numbers P20GM104318 (for COBRE) and P20GM103423 (INBRE) and Department of Defense – USAMRAA (W81XWH-BAA-1) grant.
Материалы
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Bullseye Agarose (MidSci, Cat. No. BE-GCA500) | |||
| Low-melt agarose (Fisher BioReagents, Cat No. BP1360-100) | |||
| 1-phenyl-2-thiourea [Alfa Aesar, Cat No. L06690] | |||
| Instant Ocean Aquarium Salt (Pet store) | |||
| Methylene Blue (0.1% solution) (Sigma, Cat. No. M9140) | |||
| Tricaine (Ethyl 3-aminobenzoate methanesulfonate, Sigma-Aldrich, Cat. No. E10505) | |||
| 2-Phenoxyethanol (Sigma-Aldrich, Cat. No. 77699) | |||
| Petri Dish 35 x 15 mm (BD Falcon, Cat. No 351008) | |||
| Petri Dish 60 x 15 mm (BD Falcon, Cat. No 351007) | |||
| Petri Dish 100 x 25 mm (BD Falcon, Cat. No 351013) | |||
| 5.75 inch boroschillate glass pipets (Fisher) | |||
| 35 mm Glass Top Glass Bottom Dish (MatTek Corporation, Cat No. D35-20-0-TOP) Glass: 0.085-0.115mm | |||
| Superfrost/Plus microscope slides (Fisherbrand, Cat No. 12-550-15) | |||
| Glass coverslips (Electron Microscopy Services, Cat No. 72191-75) | |||
| Glass coverslips (Warner Instruments, Cat. No. CS-18R15) | |||
| Phifer Phiferglass Insect Screen Charcoal - 48" (Home Depot) | |||
| DOW CORNING® HIGH VACUUM GREASE | |||
| Microloader pipette tips 20 µl (Eppendorf, Cat. No. 930001007) | |||
| Fine Scissors - Sharply Angled Up (Fine Science Tools, Cat. No. 14037-10) | |||
| 3 mL Luer-Lok™ disposable syringe (BD, Cat. No. 309657) | |||
| 60 mL Luer-Lok™ disposable syringe (BD, Cat. No. 309653) | |||
| 23-gauge syringe needles (BD, Cat. No. 305145) | |||
| Dumont #5 Forceps (Fine Science Tools, Cat. No. 11295-00) | |||
| Equipment | |||
| LabDoctor Mini Dry Bath (MidSci) | |||
| Zeiss Discovery.V12 compound microscope | |||
| Zeiss Plan Apo S 3.5X objective | |||
| Zeiss AxioCam MRm | |||
| Zeiss Axiovision software, Release 4.8.2SP1 (12-2011) |
Ссылки
- San Miguel-Ruiz, J. E., García-Arrarás, J. E. Common cellular events occur during wound healing and organ regeneration in the sea cucumber Holothuria glaberrima. BMC Dev Biol. 7, 115 (2007).
- Poss, K. D., Keating, M. T., Nechiporuk, A. Tales of regeneration in zebrafish. Dev Dyn. 226, 202-210 (2003).
- Akimenko, M. A., Marí-Beffa, M., Becerra, J., Old Géraudie, J. Old questions, new tools, and some answers to the mystery of fin regeneration. Dev Dyn. 226, 190-201 (2003).
- Slack, J. M. Regeneration research today. Dev Dyn. 226, 162-166 (2003).
- Seifert, A. W., et al. Skin shedding and tissue regeneration in African spiny mice (Acomys). Nature. 489, 561-565 (2012).
- Goss, R. J., Grimes, L. N. Epidermal downgrowths in regenerating rabbit ear holes. J Morphol. 146, 533-542 (1975).
- Williams-Boyce, P. K., Daniel, J. C. Comparison of ear tissue regeneration in mammals. J Anat. 149, 55-63 (1986).
- Allan, C. H., et al. Tissue response and Msx1 expression after human fetal digit tip amputation in vitro. Wound Repair Regen. 14, 398-404 (2006).
- Borgens, R. B. Mice regrow the tips of their foretoes. Science. 217, 747-750 (1982).
- Han, M., Yang, X., Lee, J., Allan, C. H., Muneoka, K. Development and regeneration of the neonatal digit tip in mice. Dev Biol. 315, 125-135 (2008).
- Muneoka, K., Allan, C. H., Yang, X., Lee, J., Han, M. Mammalian regeneration and regenerative medicine. Birth Defects Res C Embryo Today. 84, 265-280 (2008).
- Takeo, M., et al. Wnt activation in nail epithelium couples nail growth to digit regeneration. Nature. 499, 228-232 (2013).
- Akimenko, M. A., Johnson, S. L., Westerfield, M., Ekker, M. Differential induction of four msx homeobox genes during fin development and regeneration in zebrafish. Development. 121, 347-357 (1995).
- Reginelli, A. D., Wang, Y. Q., Sassoon, D., Muneoka, K. Digit tip regeneration correlates with regions of Msx1 (Hox 7) expression in fetal and newborn mice. Development. 121, 1065-1076 (1995).
- Brien, G. S., et al. Coordinate development of skin cells and cutaneous sensory axons in zebrafish. Journal of Comparative Neurology. 520, 816-831 (2012).
- Kawakami, A., Fukazawa, T., Takeda, H. Early fin primordia of zebrafish larvae regenerate by a similar growth control mechanism with adult regeneration. Dev Dyn. 231, 693-699 (2004).
- Yoshinari, N., Ishida, T., Kudo, A., Kawakami, A. Gene expression and functional analysis of zebrafish larval fin fold regeneration. Dev Biol. 325, 71-81 (2009).
- Westerfield, M. . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). , (2000).
- Detrich, H. W., Westerfield, M., Zon, L. I. The Zebrafish: Cellular and Developmental Biology, part A. Preface. Methods Cell Biol. 100 (13), (2010).
- Dahm, N. -. V. a. . Zebrafish: A Practical Approach, Issue 975. , 303 (2002).
- Detrich, H., Westerfield, M., Zon, L. . The Zebrafish: 2nd Edition Genetics, Genomics and Informatics. , (2005).
- Concha, M. L., Adams, R. J. Oriented cell divisions and cellular morphogenesis in the zebrafish gastrula and neurula: a time-lapse analysis. Development. 125, 983-994 (1998).
- Distel, M., Köster, R. W. In vivo time-lapse imaging of zebrafish embryonic development. CSH Protoc. 2007, (2007).
- Kulesa, P. M., Kasemeier-Kulesa, J. C. Construction of a Heated Incubation Chamber around a Microscope Stage for Time-Lapse Imaging. CSH Protoc. 2007, (2007).
- . Bitplane. Imaris V 6.1.0 Reference Manual. , (2008).
- Abramoff, M. D., Magalhaes, P. J., Ram, S. J. . Image Processing with ImageJ. , 36-42 (2004).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9, 676-682 (2012).
- Mateus, R., et al. In vivo cell and tissue dynamics underlying zebrafish fin fold regeneration. PLoS One. 7, e51766 (2012).
- Jones, E. A., et al. et al.Dynamic in vivo imaging of postimplantation mammalian embryos using whole embryo culture. Genesis. 34, 228-235 (2002).
- Rieger, S., Senghaas, N., Walch, A., Köster, R. W. Cadherin-2 controls directional chain migration of cerebellar granule neurons. PLoS Biol. 7, e1000240 (2009).
- Langenberg, T., Brand, M., Cooper, M. S. Imaging brain development and organogenesis in zebrafish using immobilized embryonic explants. Dev Dyn. 228, 464-474 (2003).
- Kaufmann, A., Mickoleit, M., Weber, M., Huisken, J. Multilayer mounting enables long-term imaging of zebrafish development in a light sheet microscope. Development. 139, 3242-3247 (2012).
- Tadrous, P. J. A method of PSF generation for 3D brightfield deconvolution. J Microsc. 237, 192-199 (2010).
- Distel, M., Babaryka, A., Köster, R. W. Multicolor in vivo time-lapse imaging at cellular resolution by stereomicroscopy. Dev Dyn. 235, 1100-1106 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены