Method Article
ハイブリッドμCT-FMT撮像と画像解析
* これらの著者は同等に貢献しました
要約
We describe a protocol for hybrid imaging, combining fluorescence-mediated tomography (FMT) with micro computed tomography (µCT). After fusion and reconstruction, we perform interactive organ segmentation to extract quantitative measurements of the fluorescence distribution.
要約
蛍光媒介トモグラフィー(FMT)は、インビボでの蛍光分布の縦及び定量決意を可能にし、新たなプローブの体内分布を評価するために、確立された分子プローブまたはレポーター遺伝子を用いて、疾患の進行を評価することができます。解剖学的モダリティ、 例えば 、マイクロコンピュータ断層撮影(μCT)との組み合わせは、画像解析のための蛍光再構成のために有益です。我々は、定量的な測定値を抽出するために必要な画像処理ステップを含むマルチモーダルμCT-FMTイメージングのためのプロトコルを説明します。マウスを調製し、画像化を行った後に、マルチモーダルデータセットが登録されています。続いて、改善された蛍光の再構成を考慮にマウスの形状をとる、行われます。定量分析のために、臓器セグメンテーションをインタラクティブセグメンテーションツールを使用して、解剖学的データに基づいて生成されます。最後に、生体内分布のCurvesは、バッチ処理機能を使用して生成されます。我々は、骨や関節に結合するよく知られているプローブの生体内分布を評価することによって方法の適用可能性を示しています。
概要
蛍光媒介トモグラフィーは、とも呼ばれる蛍光分子トモグラフィー(FMT)は、定量的にそのような麻酔したマウス、さらには人間の身体組織、 例えば 、乳房や指の関節などのびまん性組織における蛍光分布を評価するための有望な技術です。細胞下解像度1の表面的な標的のイメージングを可能にする非侵襲的な顕微鏡技術とは対照的に、FMTは、低解像度2であるが、数センチメートルの深さで蛍光源の三次元再構成を可能にします。 5 -多くのターゲットに蛍光プローブは、画像、血管新生、アポトーシス、炎症、その他2にご利用いただけます。いくつかのプローブは、 例えば 、活性化可能である。、蛍光色素のunquenchingにつながる特定の酵素切断によって。また、蛍光タンパク質を発現するレポーター遺伝子は、腫瘍細胞遊走6を追跡するため、 例えば 、画像化することができます。
FMTは強く解剖学的モダリティ、 例えば 、μCT2,7またはMRI 8と組み合わせから利益を得ます。スタンドアロンFMT装置9市販されているが、蛍光画像は、解剖学的な参照情報なしに解釈するのは困難です。最近では、融合された解剖学的画像データは、より堅牢な分析10を可能にすること、を示すことができました。解剖学的データはまた、正確な光造形および蛍光再構成11のために重要であるマウスの外形として予備知識を提供するために使用することができます。また、光散乱および吸収マップは、組織タイプのセグメント化を用いて推定し、クラス固有の係数12,13を割り当てることにより得ることができます。近赤外光は、ヘモグロビンはメラニンや毛皮14以外にも、マウスでは、吸収性本体です。相対血液量が桁違いに地域変化するので、吸収マップは、泉のために特に重要ですtitative蛍光再建13。
非侵襲性の撮像素子を使用することの一つの利点は、マウスを複数の時点で、すなわち 、縦方向に画像化することができるということです。これは、プローブの動的挙動、 即ち、それらの標的の蓄積、生体分布および排泄10,15を評価するため、または疾患の進行16を評価することが重要です。複数の時点で、いくつかのマウスを画像化する場合、画像データが大量に発生します。比較可能性を有効にするには、これらは明確に定義され、文書化プロトコルを使用して、 すなわち 、体系的な方法で取得する必要があります。スキャン多数の画像データから定量的な測定を抽出するために必要とされる画像解析のための課題を提起します。
私たちの研究の目的は、我々はいくつかの研究10,13,15,17,18全体で使用され、最適化μCT-FMT撮像プロトコルの詳細な説明を提供することにあります。我々は説明しデータセットが生成されるか、処理して可視化し、分析しました。これは、ヒドロキシアパタイト19に結合確立分子プローブ、OsteoSenseを用いて実証され、画像の骨疾患に使用され、2を改造することができます。動物に関わるすべての手順は、動物のケアに関する政府の審査委員会によって承認されました。
プロトコル
プロトコルは、以下の手順の詳細な説明が含まれています。最初は、ファントムまたはマウスおよびマルチモーダルマウスのベッドは、撮像のために用意されています。そして、全身スキャンをμCTで取得されます。その後、マウスのベッドは2つのスキャンが(アップと逆さま)を取得するFMTに転送されます。これは、複数の時点で複数のマウスについて繰り返すことができます。データ取得が完了した後、データがエクスポートされ、自動セグメンテーション(定義するもののソフトウェアライセンスを必要とする)、ならびに画像融合および(Imalytics前臨床ソフトウェアライセンスを必要とする)蛍光再構成を可能にするためにソートされる必要があります。最後に、臓器が対話的蛍光プローブの生体内分布を定量化するためにセグメント化された方法をマルチモーダルデータセットが可視化され、どのように示されています。
1.ファントムの準備
注:ファントムは、撮像システムをテストするのに有用であるが、事実上のキャリブレーションを決定します新しいプローブのR。
- 200ミリリットルの水、2%アガロース、1.8グラムのTiO 2粉末、50μlのトリパンブルーの溶液を調製します。煮沸した後、約8センチ長さ3センチ幅、1.5センチの高さの、長方形の形にソリューションをご記入ください。
- 蛍光およびμCT造影剤の混合物を含む、ピペットチップを使用して、仮想的に、いくつかの蛍光介在物を準備します。介在物を作成するには、ピペットチップを切断し、軽量化とそれらをシールします。
- 溶液が固化した後、ファントムに介在物を挿入します。不規則な形状を実現し、マルチモーダルマウスホルダーに収まるように、ファントムの一部を切り取ります。
- 新しいプローブの校正係数を決定するために、いくつかのファントムスキャンが必要とされています。このため、デフォルトFMTファントムは、プローブの既知の量と組み合わせて使用されます。精度向上のために、と含める内側同じ散乱係数を受信するための溶液に4%の脂質エマルジョンを追加ファントムの残りの部分。また、簡単に、画像解析のためμCT造影剤の少量(2%)を加えます。
2.マウスの準備
注:μCT-FMTイメージングは、麻酔や脱毛などの特別な準備が必要です。
- 7日撮影前に、クロロフィルのない食品の上にマウスを置きます。これは、バックグラウンド信号を減少させ、750 nm以下のFMTチャネルのために特に重要であるだろう。
- 全ての動物実験は、麻酔下で行われます。マウスが居眠りするまで麻酔を開始するには、空気中の2%イソフルラン(流量5 L /分)で満たされたチャンバー内にマウスを置きます。穏やかなつま先や皮膚つまんで、筋肉の緊張( 例えば 、顎の筋肉)の弛緩をチェックして、適切な麻酔を確認してください。麻酔を維持するために、(空気中の2%イソフルラン、速度1 L /分の流れ)は、マウスの鼻の上に配置されているチューブを使用してイソフルランアプリケーションを続けています。眼drynesを防止するためにSは、麻酔したマウスに獣医軟膏を使用しています。
- 造影剤を注入するために、テープを使用して、加熱パッド上で麻酔したマウスを修正。 (30gのマウスについて、すなわち 、150μL、5ミリリットル/ kg体重の最大注入量で、 例えば 、2ナノモル)を尾静脈にカテーテル(管に取り付けられた注射針)を配置し、蛍光造影剤を注入します。
- 有毛マウスを走査するため、走査領域は、事前に脱毛する必要があります。このため、シェーバーや脱毛クリームを使用しています。マウスのいくつかの株は、脱毛クリームの発疹を開発することができます。したがって、皮膚の変化のためのマウスを監視し、必要に応じてケアのための獣医学スタッフにお問い合わせください。新しいマウス系統を使用した場合も、少数の動物の耐性をテストします。
- (速度1 L /分の流れ、空気中2%イソフルラン)μCTとFMTイメージング中に麻酔マウスを保管してください。
3.マウスのベッドの準備
注:μCT-FMTスキャンの場合、マルチモーダルを使用μCTとFMTに両方にフィットするマウスのベッド、。
- 撮影前に、ウエットティッシュでマウス床を清掃してください。これはアクリルガラスを破損する可能性があるため、エタノールを使用しないでください。これは自動化されたマーカーの検出を損なう可能性があるため、マーカーは、水を含まないことを確認してください。
- マルチモーダルマウスのベッドのネジを開き、上部を取り外します。
- マウスのベッドの上で麻酔ガス管を取り付け、テープで固定します。
- マウスのベッドに麻酔をかけたマウスを置き、ガス管に鼻を置きます。マウスの頭部は、マウスのベッドの前面インジケータ( 図1)であることを確認します。
- マウスを最適FMTの視野を使用するには、マウスのベッドの真ん中にあることを確認します。
- マウスのベッドを閉じて、マウスがしっかりと固定されるまでネジを締めます。マウスが胸式呼吸の動きを視覚的に監視することにより着実に呼吸できることを確認してください。
4.μCTImaging
NOTE:全身スキャンがμCTを用いて行われます。生成された解剖学的データは、画像融合のために、改良された蛍光の再構成のための画像解析のために必要とされます。
- μCTにマウスでマウスのベッドを配置します。マウスは、それがμCTに「テール最初の "行くように配置されていることを確認します。これは、自動化された核融合のために重要です。
- μCT-蓋が閉じているときに、麻酔を維持するためには、μCTの場合にガスを流すようにチューブを再接続します。最初のマウスのベッドから長い管を切り離し、μCTの外側にあるコネクタに接続します。そしてμCT内部コネクタに残りの自由端を接続します。
- μCTにマウスのベッドを駆動します。ガス管が緩んでいないと回転ガントリーに引っ掛かることができないことを確認してください。必要に応じて、テープで固定します。マウスのベッドのホルダーのカットアウトにチューブを挿入します。
- μCTを閉じて、トポグラムを獲得。融合と再構築のために重要であるマウスとマウスのベッドのかなりの部分をカバーするために、少なくとも2つのsubscansを選択します。
- 副走査あたり90秒のスキャン時間を必要とする1全回転の間に1032 X 1012ピクセルと720の突起を取得HQD-6565-360-90命名μCTスキャンプロトコルを選択します。管は、電圧65キロボルトと電流1.0ミリアンペアで動作されます。また、走査プロトコルSQD-6565-360-29スキャン時間で516のx 506ピクセルの720の突起副走査当たり29秒を取得選択し、放射線量及び走査時間を短縮します。
- μCTスキャンを開始します。青いバーが進行状況を示しています。 subscansはその後、取得されます。低体温と流体損失があるため、わずか数分の短いスキャン時間の問題ではありません。これは自動的からユーザーを保護するためにスキャンが中断されますので、スキャン中にμCTの蓋を開けないでください放射。
- スキャンが完了すると、ふたを開け麻酔チューブを再接続し、FMTにそれを輸送するためにホルダーからマウスのベッドを切り離します。
5. FMTイメージング
注:直接μCTスキャンした後、マウスが改善された蛍光の再構築のために一緒に使用される2つの構成(アップと逆さま)にFMTに走査されます。
- FMTにマウスのベッドを配置する前に、FMTのための(速度1 L /分の流れ、空気中2%イソフルラン)麻酔ガス供給をオンにします。 FMT制御ソフトウェアを使用して、被験者の適切な数( すなわち 、マウス)を用いた研究グループを作成します。 (記載されていない新規のプローブに使用OsteoSense)イメージングのために使用されるプローブを選択します。
- FMTにマウスでマルチモーダルマウスのベッドを運びます。長い柔軟な麻酔ガス管は、ガス流を維持します。 FMTにマウスのベッドを挿入する前に、慎重にそれ以来、チューブを削除FMTの内側には必要ありません。マウスのベッドのネジを回すことは避けてください。
- 最初の赤のインジケータ(「ヘッド·ファースト」)とFMTにマウスのベッドを配置します。画像融合がμCTと矛盾しないようにするため、これは重要です。
- FMTを閉じます。
- 正しい研究グループと対象を選択します。 FMT(OsteoSense 750EXのために、750 nmのチャネルを使用する)のに必要なチャンネルを選択します。
- 説明、 例えばを追加します。「上」または「下」と「キャプチャー」を押して、概要スキャンを取得します。これは、視野全体の反射画像を捕捉します。それ以外の場合は、その後の3Dスキャンを取得することができないので、選択された「反射率だけイメージ」を持っていないことを確かめて下さい。
- 3Dスキャンの撮像パラメータを調整します。マウスのできるだけを含むように視野を拡大します。通常、頭と尾は完全しかし、視野に収まらないだろう。 「詳細設定]をクリックします221;およびイメージングの設定を確認してください。それぞれ5000と50000の法線と照明最小/最大に3ミリメートル、感度に設定されたサンプリング密度。
- 「復興キューに追加」をクリックした後、FMTのスキャンを開始するには、「スキャン」をクリックします。より長い露光時間が厚いオブジェクトに必要とされるので、これは、マウスの大きさ及び厚さに応じて、約5 15分かかります。デバイスは、低体温を避けるために、加熱された撮影室が含まれています。
- スキャン後、逆さまにマウスを含むマウスのベッドを反転し、別のスキャンを取得します。これは、蛍光の再構成のための追加データを提供します。
- μCTとFMT-スキャンが完了し、マウスは麻酔から目覚めているとき、それは十分な意識を取り戻したまで、歩くか、または胸骨の横臥位を維持するために、 例えば 、無人のままにしないでください。
6.画像の融合と再構築
注:後μCT-FMTスキャンが完了すると、 例えば 、試験の最後に、取得したデータは、自動化された画像融合および蛍光再構成を可能にするためにソートされる必要があります。
- さらなる処理のためのスキャンを並べ替えるには、研究のためのフォルダを作成します。各μCT-FMTスキャンの場合、名前がマウスのIDと時刻、 例えば 、M01_02hが含まれている1サブフォルダを作成します。
- 各μCT-FMTは、スキャンの.fmtファイルとしてFMTスキャン(上下)をエクスポートし、「_up.fmt」または「_down.fmt」のいずれかで終わるファイル名を使用してサブフォルダに保存してください。各の.fmtファイルには、カメラで撮影した取得した生データ、 すなわち 、励起および発光画像、メタデータ、例えば、露光時間として、およびFMTにより発生する蛍光の再構築が含まれています。
- μCTソフトウェアを使用して、等方性ボクセルサイズ35ミクロンとの再構成を作成します。円滑な復興カーネル(T10)を選択します。その視野を調整しますマーカーを含む全マウスの床が覆われていること。出力形式としてMIFX / RAWを選択し、再構築を開始します。再建が完了したら、μCT-FMTスキャンのサブフォルダにμCT再構成ファイルを移動します。
- すべてのスキャンにμCTとFMTデータをエクスポートします。各サブフォルダは、2つの.fmtファイル(上下)とMIFX / RAW形式のμCT再建が含まれていることを確認してください。完全に確認するには>メニュー - > CT-FMT-を選択Imalytics前臨床ソフトウェアを使用して完全性を確認してください。エラーのリストは、このようなの.fmtファイルやμCT再構成を欠落しているように、表示される場合があります。エラーを修正し、すべてのエラーが解決されるまで、完全性をチェックします。
- メニュー - > CT-FMT->設定を使用して、定義するものソフトウェアのサーバー名を確認し、必要に応じて調整します。デフォルトはhttp:// localhostを:8184、定義するもののソフトウェアが同じコンピュータにインストールされていると仮定します。ソフトウェア定義するものは、AUを実行するために次のステップで必要とされますマウスのベッドとマーカーのtomatedセグメンテーション。
- 全体研究のために自動化されたμCT-FMT融合を行うためにImalytics前臨床ソフトウェアでメニュー - > CT-FMT->ヒューズグループをクリックします。 μCT-FMTをスキャンし、検査フォルダに接尾辞「パッケージ」並列とフォルダ内の結果ごとにこの処理には数分かかります。これは、さらなる分析のために関連しているファイルのより小さなサブセット(μCTデータと融合したベンダー提供のFMTの再構築)が含まれています。
- マップ13吸収の生成を含むと散乱蛍光再構成を実行するためにImalytics前臨床ソフトウェアでメニュー- > CT-FMT->再構築グループ(FMT)をクリックします。処理はGPUアクセラレーション20であっても、それぞれの再構築は、マウスのサイズに応じて1〜4時間を必要とします。結果は、パッケージフォルダに格納されます。注:より高いスループットを有効にするには、我々は現在、56 GPUを搭載したGPUクラスタ上でこれらの再構成を行います。
7.画像解析
注:画像データから定量的な測定を抽出するために、病変および臓器のセグメント化が必要です。
- 一度すべてのデータセットが融合し、再構築され、各μCT-FMTのためのセグメンテーションを作成Imalytics前臨床ソフトウェアを使用してスキャンします。
- アンダーレイとしてμCTファイルやオーバーレイなどの蛍光ファイルをロードします。を押し、「3D」は、ボリュームレンダリングをオンにして、データ·セットを検査します。
- セグメントに肺、メニュー - >はクラス - >クラスを追加し、「TMP」という名前のクラスを作成します]をクリックします。これはまた、コンテキストメニューを介して行うことができます。新しいクラスを作成すると、自動的に後続のセグメンテーション操作用の出力クラスとして設定します。
- (メニュー - > Segmentation-> Thresholding->の下をクリックし、600と入力します)μCTデータセット内の低強度の全ての領域をセグメントに閾値化操作を実行します。今TMPクラスはMO外の空気が含まれていますだけでなく、肺組織を使用しています。
- 「肺」クラスを作成します。 「領域を埋める」の操作を実行し、外の空気から肺を分離するために、(> Region-を記入無制限領域を塗りつぶし>肺に右クリックしてメニュー - を選択します)。
- それはもはや必要ないため、TMPクラスを削除します。
- セグメント凸部、 例えば 、膀胱に、落書きモードを使用します。ファーストクラス "膀胱"を作成します。
- すべての落書きを削除するには、F1キーを押してください。
- コンピュータのマウスを使用して、膀胱の境界を線引きする落書きを描きます。
- F3キーを押して、赤のオーバーレイとして表示され、一時的なマスクで走り書きで囲まれた領域を埋めるために。反復(任意のスライス方向で)より走り書きを追加し、十分な精度が達成されるまでF3を押してください。典型的には、10スライスで落書きは十分です。
- F4キーを押し、「膀胱」として一時的なマスクを格納します。
- セグメントに次のように進んでください例えば、心臓や腎臓などの他の凸部。多くの領域は、 例えば 、胃や肝臓は、いくつかの凸状の領域によって近似することができます。
- セグメント脊椎に、最初の "骨"クラスを作成します。
- 「骨」として、すべての明るいボクセル( 例えば 、1,600以上)を分類するために閾値化操作を実行するためにContextMenu-> Thresholding->上を選択します。
- それは骨格の多くの他の部分、 例えば 、リブに接続されているので、領域充填操作は、セグメントに背骨を失敗します。反復落書きを描き、頭蓋骨、肋骨、および仙骨骨から背骨を分離するためにF2キーを押して、いくつかの切断操作を実行します。
- 最後に、「スパイン」のクラスを作成し、脊椎(背骨に右クリックしてContextMenu-を選択> Region-を記入>無制限の領域を埋める)を取得するために地域の充填作業を行います。
- 目の内部ファイルとしてセグメンテーションを保存μCT-FMTスキャンの電子サブフォルダ。バッチ処理を可能にするために、organs.seg、 例えば 、一貫性のある名前を使用します。
- メニュー - > Statistics->クラス統計(オーバーレイ)を選択し、各クラスの平均蛍光強度が含まれているスプレッドシート、ボリュームと合計金額(平均と体積の積)を生成します。
- 、すべてのμCT-FMTスキャンのすべての領域の値を含む単一のスプレッドシートを生成するメニュー - >バッチ - >設定バッチ設定をクリックし、メニュー - >バッチ - >バッチ統計をクリックします。これは、 すなわち 、それぞれのμCT-FMTスキャンのいずれかを、多くのスプレッドシートファイルを作成し、マージの手間を避けることができます。
8.プローブ校正
- プローブの校正係数を計算するために、プローブの異なる既知量を持つ複数のμCT-FMTファントムスキャンは、 例えば 、(ステップ1.4を参照)が必要です。、100ピコモル、50ピコモル、25ピコモルと0ピコモルで。
- に記載されているようにファントムをスキャンFMTのセクション4およびファントムスキャンにも5、上下スキャンが必要とされています。
- データをエクスポートし、第6章で説明したように融合し、再構成を行います。
- セグメント(1200以上)閾値処理することによって、各スキャンのμCTデータを用いて封入し、領域充填。
- 測定された蛍光量のスプレッドシートを生成し、既知量の関数として、それらをプロットします。線形回帰フィットの傾きを計算します。これは、プローブの校正係数です。
結果
私たちは、ヒドロキシアパタイトに結合する標的化プローブ、OsteoSenseの生体内分布を評価するために記載されたプロトコールを適用しました。 3匹のマウス(C57BL / 6アポ - / - AHSG - / - 二重ノックアウトマウス、10週齢)は撮像された前、15分、2時間、4時間、6時間、2ナノモルのOsteoSenseの静脈内注射の24時間後。当社のソフトウェアは自動的にFMT( 図2C、D)で行わ蛍光復興解剖学的μCTデータの融合を可能にしたマルチモーダルマウスのベッドに組み込まれたマーカー( 図1、図2A、B)を 、検出されました。 OsteoSenseは、低分子量を有するプローブであることから、膀胱における高速腎排泄ので、高信号が期待されます。 FMTの蛍光再建の融合は、膀胱( 図2C、D)の外に、このような見当違いの信号などの問題を明らかにしました。 FMTはマウスの真の形状を知っていて、ブロック状を呈していないため、これらの問題が発生します。オウRの再構築は、μCTデータから正確な形状を決定し、散乱と吸収が膀胱( 図2E、F)のために特に顕著である良好な信号の局在化、とのより正確な蛍光再構成を可能にするために、13にマッピングが生成されます。
適切な領域に再構成された蛍光を割り当てるには、我々は対話的に当社のソフトウェア( 図3)を使用して、いくつかの器官をセグメント化。 18のスキャンのそれぞれについて、7領域はμCTデータ、 すなわち 、心臓、肺、肝臓、腎臓、脊椎、腸および膀胱に基づいてセグメント化されました。次いで、ソフトウェア126の各領域の平均蛍光濃度を計算するために使用されました。幸いなことに、ソフトウェアは、すべての値を計算し、単一のスプレッドシートに保存しますバッチモードを提供します。
蛍光分布を可視化するために、3Dレンダリングは、各時点で生成されました、同等のウィンドウ設定( 図4A-F)を使用して。定量化された臓器の値を使用して、生体内分布は、3匹のマウス( 図4G)で臓器値を平均することにより算出しました。注射の前に取得事前スキャンは、無視できるバックグラウンドシグナルを示しました。 15分注射後、最も強い信号があるため、高速腎排泄のため、膀胱に登場しました。その後の時点で、残りのプローブは、骨および関節に蓄積していました。

図1.マルチモーダルマウスベッド。(A)マルチモーダルマウスベッドはしっかりとマウスを保持している2つのアクリルガラスプレートが含まれています。締め付けは、2本のネジを使用して調整されます。マウスのベッドは、画像融合のためのマーカー(空孔)が含まれています。麻酔ガスをtで固定されるフレキシブルチューブを使用して供給されます。猿。 (B)マウスの床は、金属ホルダに取り付けられた回転μCTガントリの中心に保持されます。そうしないと、マーカーが誤って間違ったの融合につながる割り当てることができるため、(C)は 、マウスのベッドと金属ホルダとの間のギャップを避けてください。麻酔ガス管はチューブコネクタに接続する必要があります。 (D)は、マウスのベッドは正しい自動融合を可能にするために、フロント最初にFMTに挿入する必要があります。 (E)マーカーは、自動化されたマーカーの検出および融合のために使用されるFMTカメラ、に表示されます。 この図の拡大版を表示するには、こちらをクリックしてください。
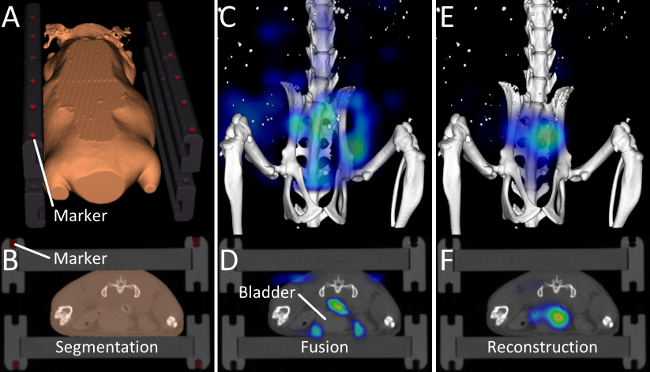
図2.画像の融合と再構成。(A、B)マーカーとMOUの外形SEは、自動セグメンテーションアルゴリズムによって決定されます。 (C、D)OsteoSenseの注射後15分、プローブのかなりの量は、すでに膀胱中に排泄されています。 μCTデータとベンダー提供の再建を融合した後、問題が見えてきます。信号の大部分は、膀胱の周りではなく、膀胱の内側に表示され、いくつかの信号があっても、空気に表示されます。 FMTは、ブロック状のマウスを想定しているために発生します。 (E、F)私たちの改善された蛍光の再構築、μCTデータから派生したマウスの形状を使用して、膀胱内の蛍光のより良いローカライズをもたらす。 この図の拡大版を表示するには、こちらをクリックしてください。
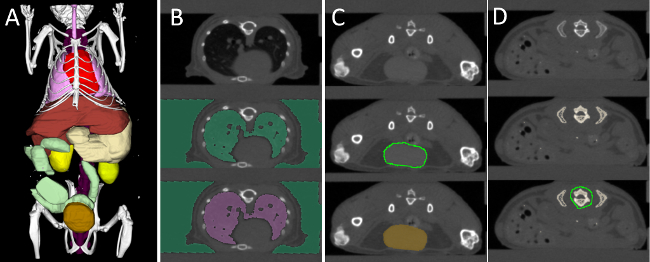
図3.インタラクティブオルガンSegmentat蛍光分布を定量化するために、イオン(A)、いくつかの器官がセグメント化されています。心(赤)、肺(ピンク)、肝臓(茶色)、胃(ベージュ)、脊椎(紫)、腎臓(黄色)、腸(緑) 、および膀胱(金)。 (B)に強く、周囲の組織と比較して対比される肺は、しきい値および領域の充填を使用してセグメント化されます。膀胱、腎臓、および心臓などの(C)ラウンド器官は、「落書き」を使用してセグメント化されます。 (D)より複雑な形状の器官は、 例えば 、肝臓と胃を走り書きを使用してインクリメンタルにセグメント化されます。セグメントに背骨、高しきい値は、すべての骨のセグメントに適用されます。そしていくつかの骨、 例えば脊椎が残るまで、リブは、切り取られている。 この図の拡大版を表示するには、こちらをクリックしてください。
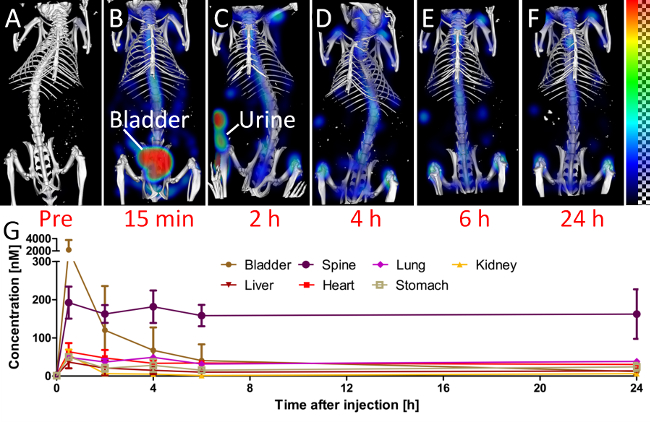
図4:生体内分布。生体内分布を評価するために、マウスを、いくつかの時点(AF)に走査されます。 (A)プリスキャンは、注射の前に、750 nmのチャンネルに少し背景信号を示しています。 (B)15分注入後、プローブのかなりの量は、膀胱内に既にあります。 (C)2時間の時点で、マウスは、マウスの外で蛍光をもたらす、排尿していました。後の時点(DF)において、信号は、脊椎や膝に、骨や関節、 すなわち 。で優先的に表示されます。 (G)蛍光定量化濃度は、選択された臓器のために示されています。
ディスカッション
我々は、説明し、マルチモーダルμCT-FMTイメージングのためのプロトコルを適用します。 17,21 -私たちは、市販されており、広く使用されているFMTとμCTデバイス3,11,15を使用します。プロトコルは、特定のFMTを必要とするがμCTは、同様の機能と同等の走査パラメータを持つ別のμCTに置き換えることができ、例えば、視野がマーカーを含むマウスのベッドをカバーするのに十分な大きさでなければなりません。
FMTは、μCTまたはMRI 21と組み合わせることなく、生体分布分析のために使用されてきたが、解剖学的データは、セグメンテーションをμCTデータ10に表示された臓器の境界に基づいて行うことができるため、再現性を高めるために有益です。統合μCT-FMT装置は2,7を開発されてきたが、これらはまだ市販されていません。さらに、2つの別々のデバイスを使用する配管は、可能にする、すなわち 、次のマウスCAを最初のマウスは、スループットを向上させるために、FMTである間のnμCTで画像化すること。
手動の作業負荷を低減するために、我々は、自動化されたマーカーの検出および融合を行います。さらに、マウスの形状を自動的にセグメント化され、この情報はかなりの蛍光再構成11,13,22を改善します。定量的蛍光再構成のために、吸収及び散乱マップは13,23を必要としています。我々は、自動化されたμCTデータのセグメント化といくつかの組織タイプ(肺、骨、皮膚、脂肪、および残りの軟組織)の既知の散乱係数を割り当てる24により散乱マップを導出します。その後、我々は、心臓や肝臓13,20だけでなく、灌流臓器のために特に重要である光生データからの吸収マップを再構築します。
複数の時点で、いくつかのマウスをスキャンするとすぐに分析されるデータセットの数が多いことになります。 biodis用tributionの研究は、いくつかの器官は、各μCT-FMTスキャンのためにセグメント化される必要があります。マウスが新たに繰り返しマウス床に位置しているので残念ながら、セグメンテーションは、再利用することはできません。私たちは私たちの研究所で開発された対話型のセグメント化のためのツールを使用するが、他のツールも25適切であるかもしれません。これらは、楕円やキューブ26のような単純な形状よりも複雑な器官へのより良い一致しているため私たちは、ボクセルワイズセグメンテーションを生成します。自動化された全動物のセグメンテーションは、さらに手動の作業負荷27を減少させるのに有用であろうが、インタラクティブセグメンテーションツールは依然としてセグメント化誤差を補正するために必要とされるであろう。また、自動化されたセグメント化ツールは、正確に病状などの特別な場合をほとんど予想することはできません。私たちはネイティブμCTスキャンを使用するため、脾臓などのいくつかの器官があっても、手動でセグメントに非常に困難です。造影剤は役立つだろうが、忍容性に問題があり、それはmaintaiすることが困難です縦イメージングを通じてNA安定した造影剤の分布。
我々ファントム研究は、蛍光再構成のために形状情報を使用した場合の信号定位が改善されることを示している。 インビボでは 、プローブの大量に既にある場合にも同様の改善が、早い時点(注射後15分)のために明らかです膀胱。ヒドロキシアパタイト結合プローブは、骨や関節に蓄積します。それはつまり 、この問題が発生したどのくらいの速顕著で、信号は注射後脊柱15分ですでにはっきりと見えます。これはおそらく、標的領域への高速血管外漏出と拡散を可能にプローブの低分子量によって引き起こされます。プローブがその標的ヒドロキシアパタイトに共有結合し、結合していないプローブが排泄されます。後の時点では、6時間および注射後24時間の間、脊椎における信号強度はおそらく、比較的安定したままで、ほとんどすべての光再ため、蛍光を漂白する深いマウスに痛みます。私たちの研究のために、我々は、注入前に取得したスキャンの明らかなように、低バックグラウンド蛍光を生じさせる750 nmのチャネルを使用します。低い波長では、より多くのバックグラウンド信号28を期待することができます。
要約すると、我々は、商業的に入手可能なFMTとμCTデバイスのためのマルチモーダルイメージングプロトコルを記述します。我々は、組み合わせは、蛍光再構成のための利点を提供することを示しています。我々は、生体内分布曲線をインタラクティブ臓器セグメンテーション及びバッチ処理によって大量の画像データから抽出される方法を示します。我々は、この標準化されたワークフローは、薬剤開発および蛍光標識したプローブを用いて、他のイメージング研究のために役立つことができると信じています。
開示事項
フェリックスGremseはGremse-IT、フィリップスとアーヘン工科大学の実験的分子イメージングのための部門との協力における医用画像解析のためのソフトウェアとサービスを提供しています新興企業の創設者であり、所有者です。
謝辞
私たちは、ファントム実験を行うためのマレクワイラーに感謝します。この作品は、欧州研究会議(ERC開始グラント309495:NeoNaNo)によってサポートされていました、ノルトラインヴェストファーレン、ドイツ連邦州(NRW; High-Tech.NRW/EU-Ziel 2 - のprogramm(EFRE); ForSaTum)、ドイツ語教育研究省(BMBF)(資金調達プログラム仮想肝臓(0315743)、LungSys(0315415C)、LungSys2(0316042F)、Photonik Forschungドイツ(13N13355))、アーヘン工科大学(I 3 TMのシード基金)、フィリップスリサーチ(アーヘン、ドイツ)。
資料
| Name | Company | Catalog Number | Comments |
| FMT (Fluorescence molecular tomography) FMT2500 LX | PerkinElmer | FMT2000 | Device for fluorescence molecular tomography |
| µCT (micro computed tomography) Tomoscope Duo | CT Imaging GmbH | Tomoscope Duo | Device for micro computed tomography |
| Multimodal Mouse Bed | CT Imaging GmbH | Experimental builder | Partially transparent animal holder |
| IsoFlo (isoflurane, USP) | Abbott | 05260-05 | Isoflurane Inhalation anesthesia |
| Small animal anesthesia system | Harvard apparatus | 726419 | Complete Isoflurane Table-Top System |
| Chlorophyll-free mouse food | Ssniff | E15051 | low chlorophyll / low fluorescence food |
| OsteoSense 750EX | PerkinElmer | NEV10053EX | Animal FMT contrast agent |
| Portex Fine Bore Polythene Tubing | Smith medical | 800/100/120 | Tube for injection catheter |
| Sterican 30g | BBraun | 4656300 | Hypodermic needle for catheter |
| Imeron | Altana pharma | INLA F.1/0203/3.5337.69 | CT contrast agent for the phantom inclusions |
| Agarose | Sigma | 90-12-36-6 | Agarose for phantom production |
| TiO2 | Applichem | A1900,1000 | Titanium oxyde as phantom scattering agent |
| Trypan blue | Fluka | 93595 | Trypan blue to adjust phantom light propagation |
| Cy7 | Lumiprobe | 15020 | Fluorochrome for the phantom inclusions |
| Lipovenoes 20% | Fresenius Kabi | 3094740 | Lipid emulsion, scattering agent for FMT contrast agents |
| Definiens Developer XD Server | Definiens AG | Server XD | Software platform for automated segmentation |
| Imalytics Preclinical | ExMI/Gremse-IT | Version 2.0.1 | Software for image fusion, reconstruction and analysis |
| NVIDIA Geforce Titan | Asus | GTXTITAN6GD5 | High end computer graphics card, 6GB Memory |
参考文献
- Hoffman, R. M., Yang, M. Subcellular imaging in the live mouse. Nature Protocols. 1 (2), 775-782 (2006).
- Ale, A., Ermolayev, V., Herzog, E., Cohrs, C., Angelis, M. H., Ntziachristos, V. FMT-XCT: in vivo animal studies with hybrid fluorescence molecular tomography-X-ray computed tomography. Nature Methods. 9 (9), 615-620 (2012).
- Eaton, V. L., Vasquez, K. O., Goings, G. E., Hunter, Z. N., Peterson, J. D., Miller, S. D. Optical tomographic imaging of near infrared imaging agents quantifies disease severity and immunomodulation of experimental autoimmune encephalomyelitis in vivo. Journal of Neuroinflammation. 10 (138), (2013).
- Lederle, W., Arns, S., et al. Failure of annexin-based apoptosis imaging in the assessment of antiangiogenic therapy effects. EJNMMI Research. 1 (26), (2011).
- Ntziachristos, V., Tung, C. -. H., Bremer, C., Weissleder, R. Fluorescence molecular tomography resolves protease activity in vivo. Nature Medicine. 8 (7), (2002).
- Hoffman, R. M. The multiple uses of fluorescent proteins to visualize cancer in vivo. Nature Reviews Cancer. 5 (10), 796-806 (2005).
- Schulz, R. B., Ale, A., et al. Hybrid system for simultaneous fluorescence and x-ray computed tomography. IEEE Transactions on Medical Imaging. 29 (2), 465-473 (2010).
- Stuker, F., Baltes, C., et al. Hybrid small animal imaging system combining magnetic resonance imaging with fluorescence tomography using single photon avalanche diode detectors. IEEE Transactions on Medical Imaging. 30 (6), 1265-1273 (2011).
- Leblond, F., Davis, S. C., Valdés, P. A., Pogue, B. W. Preclinical Whole-body Fluorescence Imaging: Review of Instruments, Methods and Applications. Journal of Photochemistry and Photobiology B: Biology. 98 (1), 77-94 (2010).
- Kunjachan, S., Gremse, F., et al. Noninvasive optical imaging of nanomedicine biodistribution. ACS Nano. 7 (1), 252-262 (2013).
- Radrich, K., Ale, A., Ermolayev, V., Ntziachristos, V. Improving limited-projection-angle fluorescence molecular tomography using a co-registered x-ray computed tomography scan. Journal of Biomedical Optics. 17 (12), 126011 (2012).
- Freyer, M., Ale, A., Schulz, R. B., Zientkowska, M., Ntziachristos, V., Englmeier, K. -. H. Fast automatic segmentation of anatomical structures in x-ray computed tomography images to improve fluorescence molecular tomography reconstruction. Journal of Biomedical Optics. 15 (3), 036006 (2010).
- Gremse, F., Theek, B., et al. Absorption Reconstruction Improves Biodistribution Assessment of Fluorescent Nanoprobes Using Hybrid Fluorescence-mediated Tomography. Theranostics. 4 (10), 960-971 (2014).
- Cheong, W. -. F., Prahl, S. A., Welch, A. J. A review of the optical properties of biological tissues. IEEE Journal of Quantum Electronics. 26 (12), 2166-2185 (1990).
- Doleschel, D., Mundigl, O., et al. Targeted near-infrared imaging of the erythropoietin receptor in human lung cancer xenografts. Journal of Nuclear Medicine: Official Publication, Society of Nuclear Medicine. 53 (2), 304-311 (2012).
- Al Rawashdeh, W., Arns, S., et al. Optical tomography of MMP-activity allows a sensitive non-invasive characterization of the invasiveness and angiogenesis of SCC-xenografts. Neoplasia. 16 (3), 235-246 (2014).
- Kunjachan, S., Pola, R., et al. Passive versus Active Tumor Targeting Using RGD- and NGR-Modified Polymeric Nanomedicines. Nano Letters. 14 (2), 972-981 (2014).
- Schober, A., Nazari-Jahantigh, M., et al. MicroRNA-126-5p promotes endothelial proliferation and limits atherosclerosis by suppressing Dlk1. Nature Medicine. 20 (4), 368-376 (2014).
- Aikawa, E., Nahrendorf, M., et al. Osteogenesis associates with inflammation in early-stage atherosclerosis evaluated by molecular imaging in vivo. Circulation. 116 (24), 2841-2850 (2007).
- Gremse, F., Höfter, A., Schwen, L., Kiessling, F., Naumann, U. GPU-Accelerated Sparse Matrix-Matrix Multiplication by Iterative Row Merging. SIAM Journal on Scientific Computing. , C54-C71 (2015).
- Vasquez, K. O., Casavant, C., Peterson, J. D. Quantitative Whole Body Biodistribution of Fluorescent-Labeled Agents by Non-Invasive Tomographic Imaging. PLoS ONE. 6 (6), e20594 (2011).
- Theek, B., Gremse, F., et al. Characterizing EPR-mediated passive drug targeting using contrast-enhanced functional ultrasound imaging. Journal of Controlled Release. 182 (1), 83-89 (2014).
- Hyde, D., Schulz, R., Brooks, D., Miller, E., Ntziachristos, V. Performance dependence of hybrid x-ray computed tomography/fluorescence molecular tomography on the optical forward problem. Journal of the Optical Society of America. A, Optics, Image Science, and Vision. 26 (4), 919-923 (2009).
- Jacques, S. L. Optical properties of biological tissues: a review. Physics in Medicine and Biology. 58 (11), R37 (2013).
- Loening, A. M., Gambhir, S. S. AMIDE: a free software tool for multimodality medical image analysis. Molecular Imaging. 2 (3), 131-137 (2003).
- Gremse, F., Schulz, V. Qualitative and Quantitative Data Analysis. Small Animal Imaging. , 363-378 (2011).
- Baiker, M., Milles, J., et al. Atlas-based whole-body segmentation of mice from low-contrast Micro-CT data. Medical Image Analysis. 14 (6), 723-737 (2010).
- Sevick-Muraca, E. M., Rasmussen, J. C. Molecular imaging with optics: primer and case for near-infrared fluorescence techniques in personalized medicine. Journal of Biomedical Optics. 13 (4), 041303 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved