このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
高速走査電子常磁性共鳴イメージング生理学的に重要なパラメータのための新しい道を開きます。
要約
新しい電子常磁性共鳴(EPR)法、高速走査EPR(RS-EPR)は、従来の連続波(CW)技術に優れており、in vivoイメージングのための新しい会場を開き、2Dスペクトル空間イメージングのために実証されています。結果は、250 MHzで実証されていますが、技術は、任意の周波数においても適用可能です。
要約
我々は、酸素濃度、pH、酸化還元のインビボ条件下で定量的な情報を提供することができ、迅速な走査電子常磁性共鳴(RS-EPR)を用いて250 MHzで安定なラジカルレポーター分子の二次元スペクトル空間イメージングの優れた方法を示しますステータスとシグナル伝達分子の濃度( すなわち、OH•、•NO)。 RS-EPR技術は、標準的な連続波(CW)手法と比較して、より高い感度、改善された空間分解能(1 mm)で、短い取得時間を有します。ファントムの種々の構成は、1〜6 mmまで変化する空間分解能、及び16μT(160 mg)を5 MT(50 G)の範囲のレポーター分子のスペクトル幅で、試験されました。高速走査効果はEPR信号を増加させ、より多くの電力が飽和する前に、スピン系に入力することを可能にする一方で、クロスループバイモーダル共振器は、ノイズを低減し、励起および検出を切り離します。この従来のCW EPR実験におけるよりも実質的に高い信号対雑音比をもたらします。
概要
他の医療イメージングモダリティに比べて、電子常磁性共鳴イメージング(EPRI)は定量的に画像の拡散のpHは1-3、PO 2 4-7、温度8、灌流および組織9の生存性、微小粘度と使いやすさなどの生理学的特性をに一意ことができ、小分子10と酸化ストレス11。組織および細胞12,13中のグルタチオン(GSH)によるジスルフィド切断の容易さの推定は、酸化還元状態に報告することができます。これらの周波数は、強誘電体損失の影響によって減少されない小動物用画像を生成する(数cmまで)組織浸透の十分な深さを提供するため、 インビボイメージングのために、250 MHzから1GHzの間の周波数範囲内のEPRが選択されます。このような9.5 GHzの14(Xバンド)および17 GHzの(K uは -band)15,16のような高い周波数では、肌や髪または単一細胞のイメージングのために使用することができます、それぞれ。すべての周波数でEPRIの成功は、その場所と運命を画像化することができるように、組織に特異的である常磁性スピンプローブによって異なります。
電子スピンプローブの環境が空間的に不均一である場合には、EPRスペクトルは、すべてのロケーションからの寄与の和です。スペクトル空間イメージングは、小さな空間のセグメントの配列内に試料の量を分割し、これらのセグメント17のそれぞれのためのEPRスペクトルを計算します。これは、EPRスペクトルの空間的変化を測定することにより、ローカル環境のマッピングを可能にします。磁場勾配は、突起と呼ばれるEPRスペクトルに空間情報を符号化するために使用されます。スペクトル空間画像は、これらの突起18,19から再構築されます。
RS-EPRに磁界がスピン緩和時間( 図2)20,21 を電子する短い相対時間で共振を通って走査されます。 D迅速なスキャン信号のeconvolutionは、従来の第1微分CWスペクトルの第1の積分に相当する、吸収スペクトルを与えます。スピン系の応答の両方の吸収および分散成分が測定されるように、迅速な走査信号が直角位相で検出されます。これは本質的に二度の単位時間当たりのデータ量を収集しています。高出力が飽和を気にすることなく使用することができるように、迅速なスキャン実験における信号の飽和は、CWよりも高いパワーで起こる。20,22多くの複数の平均値は、CWと比較して単位時間当たりに行うことができます。高電力、直接直交検波や単位時間当たりの平均値は、高品質の画像をもたらす、特に空間的な分離を規定する高勾配突起で、迅速なスキャンをより良い信号対雑音比(SNR)を得るために結合します。迅速なスキャン23用としてCWで約10倍の長に必要なファントムの画像についても同様のSNRについて達成するために。
テント">増加したSNRはまたでOHとの反応によって形成された低濃度のスピントラップ付加物と250 MHzでの実験を可能にする5-tert-ブトキシカルボニル5-メチル-1- pyrroline- Nのオキシド(BMPO-OH)となりますジスルフィドリンカーに接続されたCW方式24には見えない。Dinitroxidesは、グルタチオンによる切断に感受性であるので、細胞の酸化還元状態に報告することができます。平衡が存在し、ジ-およびモノラジカル形の間、グルタチオン存在の濃度に依存します。これらの変化を観察すると、全体の5 mTの広いスペクトルの取得を必要とし、CW実験に磁界をステッピングに比べて迅速なスキャンのEPRとはるかに高速を達成することができます。分光計、主磁場マグネット、高速走査コイルドライバ、および迅速なスキャンクロスループ共振器:完全な高速走査システムは、4つの部分から構成されます。分光器と主磁場マグネット機能CW実験と同様に、メインゼーマンフィールドを設定します共振器からのデータを収集。高速走査コイルドライバは、高速走査クロスループ共振器に特別に設計された高速走査コイルに入る正弦波スキャン電流を生成します。ラピッドスキャンクロスループ共振器の迅速な走査コイル3と15kHzの間の周波数で掃引され、大きな均一な磁場を発生させます。
プロトコル
250 MHzの高速走査コイルドライバの1.セットアップ
- ラピッドスキャン実験条件の計算
注:RS-EPRの中で最も重要なパラメータは、走査周波数と走査幅(式3)の積である走査速度、α、です。ナロースキャン幅については、より速いスキャン速度が使用され、より広い掃引幅のために、より遅い走査速度が使用されます。次の手順では、後者の場合をステップと7のMT掃引幅は6.8 kHzの走査周波数の実験コイルドライバパラメータに到達する方法を示しています。- 共振器の帯域幅(BW RES)を決定します 。
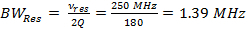 (1)
(1)
ここで、V RESは、共振器の動作周波数であり、Qは品質係数です。 Q = 90は、代表的な結果のデータを取得するために使用される高速走査共振器は一般的です。 - すべて、α、迅速なスキャンレートを決定します共振器の帯域幅によって負っ
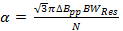 (2)
(2) 
Nはしばしば控えめに5-6であるように選択される定数である、ΔBppがミリテスラのピーク・ツー・ピーク誘導体の線幅であり、ローレンツ線幅のためのT / sの場合、スキャン速度です。
注意:代表的なセクションでのラジカルのための一般的な値であります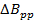 = 0.1ミリテスラ。以前の迅速なスキャンの文献と比較して、式2は、BW RESに等しい信号帯域幅(BWのSIG)を設定することにより導出されます。
= 0.1ミリテスラ。以前の迅速なスキャンの文献と比較して、式2は、BW RESに等しい信号帯域幅(BWのSIG)を設定することにより導出されます。 - 速度によって許容される最大の迅速な走査周波数を決定します。
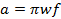 (3)
(3) 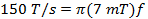
wは 、SCAの幅でありますN fは 、走査周波数です。 7 MTの掃引幅は、in vivoで使用電流プローブのためのスペクトルの100%をカバーします。走査周波数を決定するために、この値と(式2)で計算されたレートを使用してください。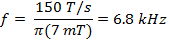
- 共振器の帯域幅(BW RES)を決定します 。
- 同調用コンデンサの選択と迅速なスキャンコイルドライバのチューニング
注:高速走査コイルドライバは、通常、正弦波を発生させる共振さモードで実行されています。レゾナンスは、総リアクタンスがゼロに近くなるように誘導性及び容量リアクタンスは、等しい大きさと符号が逆である走査周波数で発生します。- 高速走査コイルのインダクタンス、Lを使用して、1.1.3で決定された周波数、および(式4)のための適切な容量を決定します。

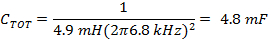
- コイルドライバコンデンサボックスの各側にコンデンサの値を取得するために半分に(式4)からC TOTを分割します。
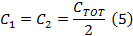
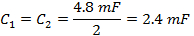
注:高速走査コイルドライバは、2つのアンプを持っています。コンデンサを選択すると、コンデンサボックスはボックスの両側に同じ容量のバランスする必要があります。双方は直列です。 - コンデンサボックスの上部カバーを外し、ステップ1.2.2で求めた値に等しい両側にコンデンサを挿入します。
- コンデンサボックスの上部を交換し、それが点灯したまま確実にするためにそれをねじ込みます。
- 正弦波形が最大振幅になるまで共振さコイルドライバの前面パネルを使用して、出力周波数を調整します。
- 高速走査コイルのインダクタンス、Lを使用して、1.1.3で決定された周波数、および(式4)のための適切な容量を決定します。
試薬およびファントムの作製
- ラジの調製CAL
- 冷凍庫から15 N-PDTを取り外し、容器は、室温(10〜15分)に来ることができます。
- 化学天秤を使用して、15 N-PDTの1.4ミリグラムを秤量。
- 15 15 N-PDTの1.4 mgの追加mlの脱イオン(DI)を0.5mMの最終濃度のためにH 2 O。
注:4-オキソ-2,2,6,6-テトラ(2 H 3)メチル-1-(3,3,5,5- 2 H 4、1〜15 N)piperdinyloxyl(15 N-PDT) 4- 1 H-3-カルバモイル- 2,2,5,5-テトラ(2 H 3)メチル-3- pyrrolinyloxyl(15 N-mHCTPO)および3-カルボキシ- 2,2,5,5-テトラ(2 H 3)メチル-1-(3,4,4- 2 H 3、1〜15 N)ピロリジニル(15 N-PROXYL)25( 図1E-G)の基は、水溶液中での長期安定性(2年)を有すると室温で。彼らの固体形態は、通常は年間安定これらの基を保つために冷凍庫や冷蔵庫に保存されます。ニトロキシドラジカルの安定性は、一般に、それらは非毒性で行い、溶媒が水である場合、それらの調製は、通常のベンチトップ上で行うことができます。有機溶剤を使用する場合は、適切な個人用保護具(PPE)を装備しながら、ヒュームフード内部の窒素酸化物溶液を調製。
- pH感受性トリチルラジカルの調製
- ラジカルトリアリールメチル0.7mgの(ATAM 4)26ラジカル(1400グラム/モル)を秤量し、無水エタノール200μlに溶解します。
- KH 2 PO 4(136.1グラム/モル)の0.00681グラム計量し、1mMの最終濃度のために50mLのDI水に溶解します。
- KOH(56グラム/モル)2.8gを秤量し、1 Mの最終濃度のために脱イオン水50mlに溶解
- KOHは、7.0のpHを調整するためにリン酸緩衝液(2.2.2)に滴下して加えます。
- 最終濃度1mMのリン酸緩衝液800μlの無水エタノール中ATAM 4の200μLを加えますエタノール:80:20バッファ0.5mmのentration。
- 手順を繰り返して、2.2.1-2.2.5てpH = 7.2にATAM 4サンプルを作成します。
- 独立した6ミリメートルの石英試料管にATAM 4、pH値= 7.0とATAM 4、pH値= 7.2を置きます。
- 間で厚さ2mmの発泡スチロールのスペーサーを、16ミリメートル石英EPR管に両方6ミリメートルの石英EPR管を配置します。
注:石英試料管の壁は厚さ0.5mmであり、2mmのスペーサに加えATAMサンプル間3mmの分離をもたらします。使用pH感受性トリチルラジカルは、オハイオ州立大学26で合成しました。イメージングのために使用された例はATAM 4と呼ばれています。 pH感受性を占める反応は、 図1Aに示されています。
- BMPO-OHの生成
- KH 2 PO 4の680ミリグラムを秤量し、50mMの最終濃度を100 mLの脱イオン水に溶解します。
- 1 M KOH滴下して追加します。でpH = 7.3にリン酸緩衝液へ。
- BMPO(199.25グラム/モル)50mgを秤量。
- BMPO 50mgの16ミリメートルの石英照射管内でリン酸緩衝液5mlで組み合わせます。
- 300 mMの過酸化水素の100μLを加えます。
- 5分間、中圧450 W UVランプ16石英mmの照射管中の混合物を照射します。
- ガラス転移ピペットを用いて、石英照射管から出て、3mmの分周器16ミリメートルの石英試料管の片側に照射BMPO-OH溶液2.5mlのを転送します。
- 3ミリメートル分周器と16ミリメートルの石英試料管の反対側に照射BMPO-OHの残りの2.5ミリリットルを転送します。
- dinitroxideラジカルの調製
- 47.5ミリモルの原液のために1ミリリットルのDMSO中に2 H、15 N-ジスルフィドdinitroxide( 図1C)の24.7 mgの秤量。
- 10mMのトリス緩衝液を準備し、pHを7.2に調整します。
- 40を取りますμlのdinitroxideストック溶液と1mMの最終濃度になるようにTris緩衝液で希釈します。
- 中央に10ミリメートル分割器を使って16ミリメートルの石英試料管にバッファ内dinitroxide液の250μlのを置きます。
- グルタチオンの154ミリグラムを秤量し、100 mMの最終濃度トリス緩衝液5mlに追加します。
- モノラジカルにジラジカルを変換するために10ミリメートルの分周器の一方の側に、1mMのdinitroxide溶液を250μlの100 mMのグルタチオン溶液5μlを追加します。
- ニトロニルニトロキシドの調製
- 冷凍庫からラジカルを外し、容器は、室温(10〜15分)に来ることができます。
- ニトロニル(390グラム/モル)の1.9 mgの秤量。
- KOHが0.56ミリグラムを秤量し、1mMの最終濃度を10mLのDI水に溶解します。
- 0.5ミリモルのニトロニルの最終濃度1 mMのKOH溶液の10ミリリットルにニトロニルの1.9ミリグラムを混ぜます。
注:necess場合進、ニトロニルの溶媒和を高速化するためにボルテクサーまたは超音波処理器を使用します。
250 MHzで迅速なスキャン機器の3.セットアップ
注:緩衝溶液として共振器Qとチューニングにも同様の効果を持つニトロキシドラジカルの水性サンプルと共振器のチューニングは、サンプルを撮影するために設定するための良い方法です
- チューンニトロキシドラジカルの水性サンプルと共振器。
- 16ミリメートル石英EPR管に水試料中の0.5mM 15 N-PDTの15ミリリットルを挿入します。
- クロスループRS-EPR共振器の検出側に石英管を挿入します。
- それはサンプルが含まれている検出側の周波数に一致するまで、機器の電源の周波数を変更します。手動でソフトウェアで希望の値を入力することにより、250 MHzのソースのキャリア周波数を変更します。
- frequenと一致するように、励起側の周波数を変更します共振器の実験源と検出側のCIES。製造業者のプロトコルに従って、共振器空洞内に可変コンデンサを回して、励起側の周波数を変更します。
- インストゥルメントコンソールとメインマグネットを設定
- 分光器の電源をオンにし、横軸に時間とともに一時データを記録する実験を選択します。
- ソフトウェアの中で、65,536点の数と10ナノ秒の時間ベースを設定します。
- 強いまたは狭い信号を10,000に平均値の数を設定し、幅広いまたは弱い信号のための45,000。
- コンソールにソフトウェアから実験パラメータを送信し、主磁場マグネットを励磁するためのソフトウェアで、「従事」ボタンを押してください。
- 9 MTに主磁場を設定します。
- 50デシベルのパワー減衰のノブを設定し、7 W高出力増幅器をオンにします。
4.実行ラピッドスキャン実験の
注:BMPO-OH 24を含むファントムの解析に関連する具体的な手順については、pH感受性TAMラジカル19,27と酸化還元敏感dinitroxides 28は、文献に提供されています。
- 標準ニトロキシドサンプルのパワー飽和
注:pHや酸化還元状態に敏感ラジカルを見るために使用される同じ実験条件で、標準的なニトロキシドラジカルサンプル上のパワー飽和曲線を行うことが有利です。- 第1節(6.8 kHzから7 MTの走査幅の走査周波数)からの値を使用して、迅速なスキャンコイルドライバをオンにします。
- 50デシベルから開始し、100kの平均値と高速スキャンスペクトルを収集します。 3デシベルによって減衰量を減少させ、測定を繰り返します。 、またはブリッジの読み出しに分離測定が<0である限りのための0デシベルの減衰器の設定まで続けます。
- 転送トン彼の生の迅速なスキャンデータ(MATLABで記述された例)デコンボリューションプログラムへと吸収スペクトルに生データを処理します。
- プログラムに走査周波数、掃引幅、ポイント数とタイムベースを入力し、吸収信号に生の迅速なスキャン信号を処理するためのプログラムを実行します。
- 共振器上の平方根電力(ワットで)事件の関数として吸収信号の振幅をプロットします。非飽和レジームでは、振幅は入射電力の平方根に直線的に依存しています。
- 0,0から始まるトレンドラインを取り付け、線形応答領域に入る全てのデータポイントを含みます。線形応答領域では、マイクロ波電力の平方根に比例した信号振幅が増加します。
- 高出力にこの傾向を推定し、EPR信号強度を比較します。信号振幅が外挿されたトレンドラインから3%以上を逸脱しないための最高の電力を使用してください。オードで正しく動作するための迅速なスキャン信号のデコンボリューションのためのrは、信号は依然として入射電力に対して線形応答領域である必要があります。
注意:生の迅速なスキャンデータの転送は、ネットワーク接続を介して、またはサムドライブを介して行うことができます。生データを処理するためのプログラム(Matlabのは)データ収集ソフトウェアがインストールされている同じコンピュータ上にないので、この場合は転送が必要です。生データを処理するデコンボリューションアルゴリズム29に記載されています。
結果
実験の製品は、信号振幅を表すために、偽カラースケールを持つ2次元(1スペクトル、一つの空間)の画像に再構成された投影のセットです。ディープブルーは、信号が存在しない場合に、緑は低振幅と赤が最高であるベースラインを意味します。 X軸(スペクトル次元)に沿ったスライスは、磁場軸にEPR信号(EPR遷移)を示します。 y軸(空間次元)に沿って、信号?...
ディスカッション
迅速なスキャン信号はCWよりも高い周波数成分を有する、より大きな線幅に応じて、共振器の帯域幅、緩和時間、及び急速スキャンの速度を必要とします。所定の実験に必要な帯域幅は、線幅と磁場(式2)の走査速度に基づいています。研究中のプローブ(T 2およびT 2 *)、および走査速度の緩和時間に応じて、振動は信号の立ち下がりエッジに表示されます。 250 MHzのT 2...
開示事項
We have nothing to disclose.
謝辞
NIHによって、この作品の部分的なサポートは、GRE、ハワードJ.ハルパーン、PIにNIBIBのEB002807とCA177744(GREおよびSSE)とP41のEB002034を付与し、デンバー大学が感謝して承諾されます。マークチェイトリンは、NIH R21 EB022775、NIH K25 EB016040、NIH / NIGMS U54GM104942によってサポートされていました。著者はmHCTPOの合成のためのpH感受性TAMラジカルの合成のためのオハイオ州立大学の今ウェストバージニア大学のヴァレリーKhramtsov、およびIllirian Dhimitrukaに感謝している、とメリーランド大学のジェラルド・ローゼンとヨセフ花王へ、PROXYL、BMPO及びニトロニル基です。
資料
| Name | Company | Catalog Number | Comments |
| 4-oxo-2,2,6,6-tetra(2H3)methyl-1-(3,3,5,5-2H4,1-15N)piperdinyloxyl (15N-PDT) | CDN Isotopes | M-2327 | 98% atom 15N, 98 % atom D, Quebec Canada |
| 4-1H-3-carbamoyl-2,2,5,5-tetra(2H3)methyl-3-pyrrolinyloxyl (15N-mHCTPO) | N/A | N/A | Synthesized at U. Maryland and described in Reference 29 |
| 3-carboxy-2,2,5,5-tetra(2H3)methyl-1-(3,4,4-2H3,1-15N)pyrrolidinyloxyl (15N-Proxyl) | N/A | N/A | Synthesized at U. Maryland and described in Reference 25 |
| 4 mm Quartz EPR Tubes | Wilmad Glass | 707-SQ-100M | |
| 4-oxo-2,2,6,6-tetra(2H3)methyl-1-(3,3,5,5-2H4)piperdinyloxyl (14N-PDT) | CDN Isotopes | D-2328 | 98% atom D, Quebec Canada |
| pH sensitive trityl radical (aTAM4) | Ohio State University | N/A | Synthesized at Ohio State University and described in Reference 26 |
| Potassum Phosphate, Monobasic | J.T. Baker Chemicals | 1-3246 | |
| 6 mm Quartz EPR Tubes | Wilmad Glass | Q-5M-6M-0-250/RB | |
| 8 mm Quartz EPR Tubes | Wilmad Glass | Q-7M-8M-0-250/RB | |
| 5-tert-butoxycarbonyl-5-methyl-1-pyrroline-N-oxide (BMPO) | N/A | N/A | Synthesized at U. Maryland and described in Reference 30 |
| Hydrogen Peroxide | Sigma Aldrich | H1009 SIGMA | 30% |
| 16 mm Quartz EPR tube | Wilmad Glass | 16-7PP-11QTZ | |
| Medium Pressure 450 W UV lamp | Hanovia | 679-A36 | Fairfield, NJ |
| L-Glutathione, reduced | Sigma Aldrich | G470-5 | |
| Nitronyl | NA | N/A | Synthesized at U. Maryland and described in Reference 31 |
| Sodium Hydroxide | J.T. Baker Chemicals | 1-3146 |
参考文献
- Bobko, A. A., et al. In vivo monitoring of pH, redox status, and glutathione using L-band EPR for assessment of therapeutic effectiveness in solid tumors. Magn. Reson. Med. 67 (6), 1827-1836 (2012).
- Utsumi, H., et al. Simultaneous molecular imaging of redox reactions monitored by overhauser-enhanced MRI with 14N-and 15N-labeled nitroxyl radicals. Proc. Nat. Acad. Sci. U.S.A. 103 (5), 1463-1468 (2006).
- Khramtsov, V. V., Grigor'ev, I. A., Foster, M. A., Lurie, D. J., Nicholson, I. Biological applications of spin pH probes. Cell. Mol. Bio. 46 (8), 1361-1374 (2000).
- Halpern, H. J., et al. Oxymetry Deep in Tissues with Low-Frequency Electron-Paramagnetic Resonance. Proc. Nat. Acad. Sci. U.S.A. 91 (26), 13047-13051 (1994).
- Matsumoto, S., et al. Low-field paramagnetic resonance imaging of tumor oxygenation and glycolytic activity in mice. J. Clin. Invest. 118 (5), 1965-1973 (2008).
- Velan, S. S., Spencer, R. G. S., Zweier, J. L., Kuppusamy, P. Electron paramagnetic resonance oxygen mapping (EPROM): Direct visualization of oxygen concentration in tissue. Magn. Reson. Med. 43 (6), 804-809 (2000).
- Elas, M., et al. Electron paramagnetic resonance oxygen image hypoxic fraction plus radiation dose strongly correlates with tumor cure in FSA fibrosarcomas. Int. J. Radiat. Oncol. 71 (2), 542-549 (2008).
- Dreher, M. R., et al. Nitroxide conjugate of a thermally responsive elastin-like polypeptide for noninvasive thermometry. Med. Phys. 31 (10), 2755-2762 (2004).
- Gallez, B., Mader, K., Swartz, H. M. Noninvasive measurement of the pH inside the gut by using pH-sensitive nitroxides. An in vivo EPR study. Magn. Reson. Med. 36 (5), 694-697 (1996).
- Halpern, H. J., et al. Diminished aqueous microviscosity of tumors in murine models measured with in vivo radiofrequency electron paramagnetic resonance. Cancer Res. 59 (22), 5836-5841 (1999).
- Elas, M., Ichikawa, K., Halpern, H. J. Oxidative Stress Imaging in Live Animals with Techniques Based on Electron Paramagnetic Resonance. Radiat. Res. 177 (4), 514-523 (2012).
- Kuppusamy, P., et al. Noninvasive imaging of tumor redox status and its modification by tissue glutathione levels. Cancer Res. 62 (1), 307-312 (2002).
- Khramtsov, V. V., Yelinova, V. I., Glazachev, Y. I., Reznikov, V. A., Zimmer, G. Quantitative determination and reversible modification of thiols using imidazolidine biradical disulfide label. J. Biochem. Biophys. Methods. 35 (2), 115-128 (1997).
- Plonka, P. M. Electron paramagnetic resonance as a unique tool or skin and hair research. Exp. Dermatol. 18, 472-484 (2009).
- Halevy, R., Shtirberg, L., Shklyar, M., Blank, A. Electron Spin Resonance Micro-Imaging of Live Species for Oxygen Mapping. J. Vis. Exp. (42), e122 (2010).
- Halevy, R., Tormyshev, V., Blank, A. Microimaging of oxygen concentration near live photosynthetic cells by electron spin resonance. Biophys J. 99 (3), 971-978 (2010).
- Eaton, G. R., Eaton, S. S. . Concepts Magn. Reson. 7, 49-67 (1995).
- Maltempo, M. M. Differentiaon of spectral and spatial components in EPR imaging using 2-D image reconstruction algorithms. J. Magn. Reson. 69, 156-161 (1986).
- Tseitlin, M., et al. New spectral-spatial imaging algorithm for full EPR spectra of multiline nitroxides and pH sensitive trityl radicals. J. Magn. Reson. 245, 150-155 (2014).
- Mitchell, D. G., Radu, N., Koch, S., et al. . Abstracts of Papers of the American Chemical Society. 242, (2011).
- Stoner, J. W., et al. Direct-detected rapid-scan EPR at 250 MHz. J. Magn. Reson. 170 (1), 127-135 (2004).
- Tseytlin, M., Biller, J. R., Mitchell, D. G., Yu, Z., Quine, R. W., Rinard, G. A., Eaton, S. S., Eaton, G. R. . EPR Newsletter. 23, 8-9 (2014).
- Biller, J. R., et al. Imaging of nitroxides at 250 MHz using rapid-scan electron paramagnetic resonance. J. Magn. Reson. 242, 162-168 (2014).
- Biller, J. R., et al. Improved Sensitivity for Imaging Spin Trapped Hydroxyl Radical at 250 MHz. Chem. Phys. Chem. 16 (3), 528-531 (2015).
- Burks, S. R., Bakhshai, M. A., Makowsky, M. A., Muralidharan, S., Tsai, P., Rosen, G. M., Kao, J. Y. 2H, 15N-Substituted nitroxides as sensitive probes for electron paramagnetic resonance imaging. J. Org. Chem. 75, 6463-6467 (2010).
- Dhimitruka, I., Bobko, A. A., Hadad, C. M., Zweier, J. L., Khramtsov, V. V. Synthesis and characterization of amino derivatives of persistent trityl radicals as dual function pH and oxygen paramagnetic probes. J. Am. Chem. Soc. 130 (32), 10780-10787 (2008).
- Elajaili, H. B., et al. Electron spin relaxation times and rapid scan EPR imaging of pH-sensitive amino-substituted trityl radicals. Magn. Reson. Chem. 53 (4), 280-284 (2015).
- Elajaili, H., Biller, J. R., Rosen, G. M., Kao, J. P. Y., Tseytlin, M., Buchanan, L. B., Rinard, G. A., Quine, R. W., McPeak, J., Shi, Y., Eaton, S. S., Eaton, G. R. Imaging Disulfides at 250 MHz to Monitor Redox. J. Magn. Reson. , (2015).
- Tseitlin, M., Rinard, G. A., Quine, R. W., Eaton, S. S., Eaton, G. R. Deconvolution of sinusoidal rapid EPR scans. J. Magn. Reson. 208 (2), 279-283 (2011).
- Halpern, H. J., Peric, M., Nguyen, T. D., Spencer, D. P., Teicher, B. A., Lin, Y. J., Bowman, M. K. Selective isotopic labeling of a nitroxide spin label to enhance sensitivity for T2 oxymetry. J. Magn. Reson. 90, 40-51 (1990).
- Tsai, P., et al. Esters of 5-carboxyl-5-methyl-1-pyrroline N-oxide: A family of spin traps for superoxide. J. Org. Chem. 68 (20), 7811-7817 (2003).
- Biller, J. R., et al. Frequency dependence of electron spin relaxation times in aqueous solution for a nitronyl nitroxide radical and perdeuterated-tempone between 250 MHz and 34 GHz. J. Magn. Reson. 225, 52-57 (2012).
- Rosen, G. M., et al. Dendrimeric-containing nitronyl nitroxides as spin traps for nitric oxide: Ssynthesis, kinetic, and stability studies. Macromolecules. 36 (4), 1021-1027 (2003).
- Bobko, A. A., et al. Redox-sensitive mechanism of no scavenging by nitronyl nitroxides. Free Radical Biol. Med. 36 (2), 248-258 (2004).
- Roshchupkina, G. I., et al. In vivo EPR measurement of glutathione in tumor-bearing mice using improved disulfide biradical. Free Radical Bio. Med. 45 (3), 312-320 (2008).
- Mitchell, D. G., et al. Use of Rapid-Scan EPR to Improve Detection Sensitivity for Spin-Trapped Radicals. Biophysical Journal. 105 (2), 338-342 (2013).
- Bobko, A. A., Dhimitruka, I., Zweier, J. L., Khramtsov, V. V. Trityl radicals as persistent dual function pH and oxygen probes for in vivo electron paramagnetic resonance spectroscopy and imaging: Concept and experiment. J. Am. Chem. Soc. 129 (23), (2007).
- Biller, J. R., et al. Electron spin-lattice relaxation mechanisms of rapidly-tumbling nitroxide radicals. J. Magn. Reson. 236, 47-56 (2013).
- Redler, G., Barth, E. D., Bauer, K. S., Kao, J. P. Y., Rosen, G. M., Halpern, H. J. In vivo electron paramagnetic resonance imaging of differential tumor targeting using cis-3,4-di(acetoxymethoxycarbonyl)-2,2,5,5-tetramethyl-1-pyrrolidinyloxyl. Magn. Reson. Med. 71 (4), 1650-1656 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved