Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Numérisation rapide résonance paramagnétique électronique ouvre de nouvelles voies pour l'imagerie physiologiquement Paramètres importants
Dans cet article
Résumé
Une méthode, rapide balayage EPR (RS-EPR) nouvelle résonance paramagnétique électronique (EPR), est mise en évidence pour la 2D imagerie spatiale spectrale qui est supérieure à la technique traditionnelle onde continue (CW) et ouvre de nouveaux espaces pour l' imagerie in vivo. Les résultats sont démontrés à 250 MHz, mais la technique est applicable à toute fréquence.
Résumé
Nous démontrons une méthode supérieure d'imagerie 2D spectral-spatial des molécules rapporteurs radicalaires stables à 250 MHz à l' aide d' électrons paramagnétique résonance rapide balayage (RS-EPR), qui peut fournir des informations quantitatives dans des conditions in vivo de la concentration en oxygène, le pH, le potentiel redox le statut et la concentration des molécules de signalisation (ie, OH •, NO •). La technique RS-EPR a une sensibilité plus élevée, une meilleure résolution spatiale (1 mm), et la réduction du temps d'acquisition par rapport à la technique standard onde continue (CW). Une variété de configurations de fantômes ont été testées, avec une résolution spatiale variant de 1 à 6 mm, et la largeur spectrale des molécules rapporteuses allant de 16 pT (160 mg) à 5 mT (50 G). Un croisement en boucle résonateur bimode découple excitation et de détection, réduisant ainsi le bruit, tandis que l'effet de balayage rapide permet une plus grande puissance d'être entrées dans le système de spin avant saturation, ce qui augmente le signal RPE. Ceconduit à un taux sensiblement plus élevé signal à bruit que dans les expériences CW EPR classiques.
Introduction
Par rapport à d' autres modalités d'imagerie médicale, l' imagerie par résonance paramagnétique électronique (EPRI) est uniquement en mesure de quantitativement l' image des propriétés physiologiques , y compris pH 1-3, pO 2 4-7 température 8, la perfusion et la viabilité des tissus 9, microviscosité et la facilité de diffusion de de petites molécules 10 et stress oxydatif 11. Estimation de la facilité de clivage du disulfure de glutathion (GSH) dans les tissus et les cellules 12,13 peut présenter sur l' état d'oxydo - réduction. Pour l' imagerie in vivo, l' EPR dans la gamme de fréquences comprise entre 250 MHz et 1 GHz est choisie car ces fréquences donnent une profondeur suffisante de pénétration des tissus (jusqu'à plusieurs cm) pour générer des images pour les petits animaux dans lesquels les intensités ne sont pas diminuées par des effets de perte diélectrique. Des fréquences plus élevées, telles que 9,5 GHz 14 (bande X) et 17 GHz (bande K u) 15,16 peuvent être utilisés pour l' imagerie de la peau et des cheveux ou des cellules individuelles, respectivement. Le succès de l'EPRI à toutes les fréquences dépend des sondes de spin paramagnétique qui sont spécifiques pour les tissus de sorte que leur emplacement et sort peut être imagé.
Si l'environnement d'une sonde de spin électronique est spatialement hétérogène, le spectre RPE est la somme des contributions de tous les endroits. L' imagerie spectrale spatiale divise le volume de l'échantillon dans une matrice de petits segments spatiaux et calcule le spectre RPE pour chacun de ces segments 17. Ceci permet la cartographie de l'environnement local, en mesurant la variation spatiale dans le spectre RPE. gradients de champ magnétique sont utilisés pour coder l'information spatiale en spectres EPR, qui sont appelées projections. L'image spectrale spatiale est reconstruite à partir de ces projections 18,19.
En RS-EPR le champ magnétique est balayée par la résonance dans un temps qui est court par rapport à des temps de relaxation de spin électronique (Figure 2) 20,21. ré econvolution du signal de balayage rapide donne le spectre d'absorption, ce qui est équivalent à la première intégrale du spectre CW premier dérivé classique. Le signal de balayage rapide est détecté en quadrature, de sorte que les deux éléments d'absorption et de dispersion de la réponse du système de spin sont mesurés. Ceci est essentiellement la collecte de deux fois la quantité de données par unité de temps. Saturation du signal dans une expérience de balayage rapide se produit à des puissances plus élevées que pour la CW, donc des puissances plus élevées peuvent être utilisées sans se soucier de la saturation. 20,22 Beaucoup plus moyennes peuvent être effectués par unité de temps par rapport à CW. Plus de puissance, la détection directe de quadrature et plus en moyenne par unité de temps se combinent pour donner scan rapide un meilleur rapport (SNR) signal-bruit, en particulier à des projections élevées de gradient qui définissent la séparation spatiale, conduisant à des images de qualité. Pour atteindre environ le même SNR pour une image d'un fantôme nécessaire environ 10 fois plus longtemps pour CW que pour le balayage rapide 23.
Tente "> L'augmentation de SNR permet également des expériences à 250 MHz avec des adduits de piégeage concentration de spin faible formés par la réaction de OH avec du 5-tert-butoxycarbonyl-5-méthyl-1-pyrroline- N - oxyde (BMPO-OH) qui serait Dinitroxides invisibles à la méthode CW 24. connectés à un groupe de liaison disulfure sont sensibles au clivage par le glutathion, et peuvent donc rendre compte de l' état redox cellulaire. l' équilibre existe, dépendant de la concentration de glutathion présente, entre les formes di- et un radical mono. l'observation de ces changements nécessite la capture de l'ensemble de 5 mT large spectre, et peut être réalisé beaucoup plus rapidement avec le balayage rapide EPR par rapport à intensifier le champ magnétique dans une expérience CW.Un système complet de balayage rapide se compose de quatre parties: le spectromètre, l'aimant de champ principal, le conducteur de la bobine de balayage rapide, et le balayage rapide contre-boucle résonateur. Le spectromètre et le fonctionnement de l'aimant de champ principal le même que dans une expérience CW, définissant le champ de Zeeman principalet la collecte des données à partir du résonateur. Le conducteur de la bobine de balayage rapide génère le courant de balayage sinusoïdal qui va dans les bobines de balayage rapides spécialement conçus sur le balayage rapide contre-boucle résonateur. Les bobines de balayage rapide du balayage transversal résonateur à boucle rapide génèrent un champ magnétique homogène, qui est balayée à des fréquences comprises entre 3 et 15 kHz.
Protocole
1. Configuration du pilote rapide scan Coil à 250 MHz
- Calcul des rapides de numérisation Conditions expérimentales
Remarque: Le paramètre le plus important dans le RS-EPR est la vitesse de balayage, α, qui est le produit de la fréquence de balayage et de la largeur de balayage (équation 3). Pour des largeurs de balayage étroites, des vitesses de balayage plus rapide sont utilisés, ainsi que pour des largeurs de balayage plus larges, plus lentes vitesses de balayage sont utilisés. Les instructions suivantes pas à travers ce dernier cas, et de montrer comment arriver à les paramètres du pilote de bobine expérimentales de 7 mT largeur de balayage et 6,8 kHz fréquence de balayage.- Déterminer la largeur de bande de résonateur (BW Res).
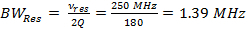 (1)
(1)
où v res est la fréquence de fonctionnement du résonateur et Q est le facteur de qualité. Q = 90, est commun pour le résonateur de balayage rapide utilisé pour obtenir les données en résultats représentatifs. - Déterminer la vitesse de balayage rapide, α, tous lesdue par la bande passante du résonateur
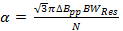 (2)
(2) 
où N est une constante souvent prudemment choisie pour être 5-6, pp Ab est le linewidth dérivé de crête à crête en mT, et est la vitesse de balayage si T / s pour une largeur de raie lorentzienne.
Remarque: Une valeur commune pour les radicaux dans la section représentative est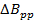 = 0,1 mT. En comparaison avec la littérature antérieure de balayage rapide; L' équation 2 est dérivée en définissant la bande passante du signal (BW sig) égale à BW Res.
= 0,1 mT. En comparaison avec la littérature antérieure de balayage rapide; L' équation 2 est dérivée en définissant la bande passante du signal (BW sig) égale à BW Res. - Déterminer la fréquence de balayage rapide maximum autorisé par le taux.
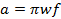 (3)
(3) 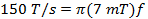
où w est la largeur de la scan et f est la fréquence de balayage. Une largeur de balayage de 7 mT couvrira 100% du spectre pour les sondes actuelles utilisées in vivo. Utilisez cette valeur et le taux calculé (Equation 2) pour déterminer la fréquence de balayage.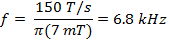
- Déterminer la largeur de bande de résonateur (BW Res).
- Sélection des condensateurs d'accord et le réglage du pilote de la bobine de balayage rapide
Remarque: Le pilote de la bobine de balayage rapide est généralement exécuté dans un mode en résonance générant une onde sinusoïdale. La résonance se produit à une fréquence de balayage, où les réactances inductives et capacitives sont de signes opposés et d'amplitude égale, de sorte que la réactance totale est proche de zéro.- Déterminer la capacité appropriée pour la fréquence déterminée 1.1.3 en utilisant l'inductance, L, des bobines de balayage rapide et (équation 4).

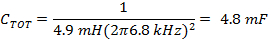
- Diviser C TOT de (équation 4) en deux pour obtenir les valeurs des condensateurs de chaque côté du boîtier de condensateur de commande de la bobine.
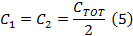
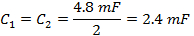
Remarque: Le pilote de la bobine de balayage rapide a deux amplificateurs. Lors de la sélection d'un condensateur, la boîte de condensateur doit être équilibré avec une capacité égale de chaque côté de la boîte. Les deux parties sont en série. - Dévissez le couvercle supérieur de la boîte de condensateur et insérer des condensateurs sur les deux côtés qui sont égaux à la valeur déterminée à l'étape 1.2.2.
- Replacer le couvercle de la boîte de condensateur et visser pour assurer qu'il reste sur.
- En utilisant le panneau avant du conducteur de bobine résonnante, régler la fréquence de sortie jusqu'à ce que la forme d'onde sinusoïdale a une amplitude maximale.
- Déterminer la capacité appropriée pour la fréquence déterminée 1.1.3 en utilisant l'inductance, L, des bobines de balayage rapide et (équation 4).
2. Préparation des réactifs et des Phantoms
- Préparation de radicals
- Retirer 15 N-PDT du congélateur et laisser le conteneur à venir à la température ambiante (10-15 min).
- Peser 1,4 mg de 15 N-PDT en utilisant une balance analytique.
- Ajouter 1,4 mg de 15 N-HAP à 15 ml déionisée (DI) H 2 O pour une concentration finale de 0,5 mM.
Note: 4-oxo-2,2,6,6-tétra (2 H 3) méthyl-1- (3,3,5,5- 2 H 4, 1- 15 N) piperdinyloxyl (15 N-HAP), 4- 1 H-3-carbamoyl-2,2,5,5-tétra (2 H 3) méthyl-3-pyrrolinyloxyl (15 N mHCTPO) et 3-carboxy-2,2,5,5-tétra (2 H 3) méthyl-1- (3,4,4- 2 H 3, 1- 15 N) pyrrolidinyloxy (PROXYL 15 N) 25 (figure 1E-G) les radicaux ont une stabilité à long terme (2 ans) en solution aqueuse et à température ambiante. Leurs formes solides sont généralement stockés dans un congélateur ou un réfrigérateur pour garder ces radicaux stables pendant des années.La stabilité des radicaux nitroxydes font généralement les non-toxiques, et leur préparation peut être effectuée sur une paillasse normale lorsque le solvant est l'eau. Lors de l'utilisation de solvants organiques, préparer des solutions nitroxyde dans une hotte tout équipé de l'équipement de protection individuelle (EPI).
- Préparation des radicaux trityle de pH sensible
- Peser 0,7 mg de triaryle radical méthyle (ATAM 4) 26 radical (1400 g / mole) et dissoudre dans 200 ul d'éthanol absolu.
- Peser 0,00681 g de KH 2 PO 4 (136,1 g / mol) et le dissoudre dans 50 ml d' eau déminéralisée pour obtenir une concentration finale de 1 mM.
- Peser 2,8 g de KOH (56 g / mol) et le dissoudre dans 50 ml d'eau déminéralisée pour obtenir une concentration finale de 1 M.
- Ajouter goutte à goutte de KOH dans le tampon phosphate (2.2.2) pour ajuster le pH de 7,0.
- Ajouter 800 ul de tampon phosphate 1 mM et 200 pl de 4 Atam dans l' éthanol absolu pour une concntration de 0,5 mM dans 80:20 tampon: éthanol.
- Répétez les étapes 2.2.1-2.2.5 pour créer le Atam 4 échantillon à pH = 7,2.
- Placez le Atam 4, pH = 7,0 et Atam 4, pH = 7,2 dans des tubes d'échantillons de quartz 6 mm séparés.
- Placer les deux tubes EPR de quartz de 6 mm dans un tube EPR de quartz de 16 mm, avec un 2 mm d'épaisseur de styromousse entretoise entre les deux.
Remarque: les parois du tube d'échantillonnage sont en quartz de 0,5 mm d'épaisseur, et en plus de l'entretoise 2 mm obtenir une séparation de 3 mm entre les échantillons Atam. Les radicaux trityle sensibles au pH utilisés ont été synthétisés à l'Université Ohio State 26. L'exemple qui a été utilisé pour l' imagerie est appelé Atam 4. La réaction qui représente la sensibilité au pH est représentée sur la figure 1A.
- Génération de BMPO-OH
- Peser 680 mg de KH 2 PO 4 et le dissoudre dans 100 ml d' eau déminéralisée pour obtenir une concentration finale de 50 mM.
- Ajouter 1 M KOH goutte à gouttele tampon phosphate à pH = 7,3.
- Peser 50 mg de BMPO (199.25 g / mol).
- Combiner les 50 mg de BMPO avec 5 ml de tampon phosphate dans un tube en quartz d'irradiation de 16 mm.
- Ajouter 100 pi de 300 mM de peroxyde d'hydrogène.
- Irradier le mélange dans le tube d'irradiation de quartz de 16 mm avec une pression de 450 W lampe UV moyenne pendant 5 min.
- En utilisant une pipette de transfert du verre, transférer 2,5 ml d'une solution irradiée BMPO-OH hors du tube d'irradiation à quartz et dans un côté d'un tube d'échantillon en quartz de 16 mm à 3 mm diviseur.
- Transférer les 2,5 ml restants d'irradiation BMPO-OH dans l'autre extrémité du tube d'échantillon en quartz de 16 mm à 3 mm diviseur.
- Préparation de dinitroxide radical
- Peser 24,7 mg de 2 H, dinitroxide 15 N-disulfure (figure 1C) dans 1 ml de DMSO pour une solution mère de 47,5 mM.
- Préparer tampon Tris 10 mM et ajuster à pH 7,2.
- Prendre 40ul dinitroxide solution mère et diluer avec du tampon Tris à une concentration finale de 1 mM.
- Placer 250 pi de solution de dinitroxide dans le tampon dans un tube d'échantillon en quartz de 16 mm avec un diviseur 10 mm au centre.
- Peser 154 mg de glutathion et ajouter 5 ml de tampon Tris à une concentration finale de 100 mM.
- Ajouter 5 ul de la solution de glutathione 100 mM à 250 pi de solution de dinitroxide 1 mM sur un côté de la cloison 10 mm pour convertir le diradical en monoradical.
- Préparation de nitroxyde nitronyl
- Retirer le reste du congélateur, et laisser le récipient revenir à la température ambiante (10-15 min).
- Peser 1,9 mg d'nitronyl (390 g / mol).
- Peser 0,56 mg de KOH dissous dans 10 ml d'eau déminéralisée pour obtenir une concentration finale de 1 mM.
- Mélanger le 1,9 mg de nitronyl dans 10 ml d'une solution 1 mM de KOH à une concentration finale de 0,5 mM nitronyl.
Remarque: Si nécessary, utiliser un vortex ou sonicateur à solvatation de vitesse du nitronyl.
3. Mise en place de l'instrument d'analyse rapide à 250 MHz
Remarque: L'accord du résonateur avec un échantillon aqueux de radical nitroxyde, qui a un effet similaire sur résonateur Q et tuning comme solution tampon, est un bon moyen de mettre en place pour l'échantillon à imager
- Tune le résonateur avec un échantillon aqueux de radical nitroxyde.
- Insérez les 15 ml de 0,5 mM 15 N-PDT dans l' échantillon d'eau dans un tube de quartz EPR de 16 mm.
- Insérez le tube de quartz dans le côté de détection de la croix en boucle RS-EPR résonateur.
- Modifier la fréquence de la source de l'instrument jusqu'à ce qu'il corresponde à la fréquence de la face de détection qui contient l'échantillon. Modifier manuellement la fréquence porteuse de la source 250 MHz en entrant la valeur désirée dans le logiciel.
- Changer la fréquence du côté d'excitation pour faire correspondre les frépoli- de la source d'essai et du côté de détection du résonateur. Changer la fréquence du côté d'excitation en activant un condensateur variable à l'intérieur de la cavité du résonateur selon le protocole du fabricant.
- Mettre en place Instrument Console et aimant principal
- Allumez le spectromètre et choisir une expérience qui enregistre les données transitoires avec le temps en abscisse.
- Dans le logiciel, définir le nombre de points à 65.536 et la base de temps de 10 nanosecondes.
- Réglez le nombre de moyennes à 10.000 pour un signal fort ou étroit, et à 45.000 pour un signal large ou faible.
- Appuyez sur le bouton "s'engager" dans le logiciel pour envoyer les paramètres expérimentaux à partir du logiciel de la console et de dynamiser l'aimant de champ principal.
- Définissez le champ magnétique principal à 9 mT.
- Réglez l'atténuation de puissance bouton à 50 dB, et allumez le 7 W amplificateur haute puissance.
4. exécutionde numérisation rapide Expérience
Note: Des instructions spécifiques liées à l' analyse des fantômes contenant BMPO-OH 24, sensibles au pH radicaux TAM 19,27 et redox dinitroxides sensibles 28 sont fournis dans la littérature.
- Saturation de puissance de l' échantillon nitroxyde norme
Remarque: Il est avantageux de faire une courbe de saturation de puissance sur un nitroxyde échantillon standard radical dans les mêmes conditions expérimentales qui seront utilisés pour regarder des radicaux sensibles au pH ou de l'état redox.- Allumez le pilote de la bobine de balayage rapide, avec les valeurs de la section 1 (fréquence de balayage de 6,8 kHz et la largeur de balayage de 7 mT).
- À partir de 50 dB, recueillir un spectre de balayage rapide avec 100k moyennes. Diminuer l'atténuation de 3 dB et répéter la mesure. Continuer jusqu'à ce qu'un réglage de l'atténuateur de 0 dB, ou aussi longtemps que la mesure d'isolement sur l'affichage du pont est <0.
- Transfert til analyse les données brutes rapide dans un programme de déconvolution (par exemple, écrites dans Matlab) et traiter les données brutes dans le spectre d'absorption.
- Entrez la fréquence de balayage, largeur de balayage, le nombre de points et la base de temps dans le programme, et exécuter le programme pour traiter le signal de balayage rapide brut en un signal d'absorption.
- Tracer l'amplitude du signal d'absorption en fonction de la puissance de racine carrée (en Watt) incident sur le résonateur. Dans le non saturant régime, l'amplitude est linéairement dépendante de la racine carrée de la puissance incidente.
- Mettre en place une ligne de tendance à partir de 0,0 et inclure tous les points de données qui tombent dans la région de réponse linéaire. Dans la région de réponse linéaire, l'amplitude du signal augmente proportionnellement à la racine carrée de puissance micro-ondes.
- Extrapoler cette tendance à des puissances plus élevées, et de comparer l'intensité du signal EPR. Utilisez la puissance la plus élevée pour laquelle l'amplitude du signal ne dévie pas plus de 3% par rapport à la ligne de tendance extrapolée. En order pour la déconvolution du signal de balayage rapide pour fonctionner correctement, le signal doit être encore dans la région de réponse linéaire par rapport à la puissance incidente.
Note: Transfert des données brutes de balayage rapide peut se faire via une connexion réseau ou via une clé USB. Dans ce cas, le transfert est nécessaire parce que le programme de traitement des données brutes (Matlab) ne sont pas sur le même ordinateur qui dispose d'un logiciel de collecte de données. L'algorithme de déconvolution qui traite des données brutes est décrite dans le 29.
Résultats
Le produit de l'expérience est un ensemble de projections qui sont reconstruites en images en deux dimensions (un spectral, d'un espace) avec une échelle de fausses couleurs pour représenter l'amplitude du signal. Deep blue dénote référence où aucun signal est présent, le vert est faible amplitude et rouge est le plus élevé. Tranches le long de l'axe des x (dimension spectrale) représentent le signal RPE EPR (de transition) sur un axe de champ magnétique. Le l...
Discussion
signaux Rapid-scan ont des composantes de fréquence que CW, et nécessitent une largeur de bande de résonateur plus grande en fonction des largeurs de ligne, les temps de relaxation, et la vitesse des rapides-scans. La bande passante requise pour une expérience donnée est basée sur la largeur de raie et la vitesse de balayage du champ magnétique (équation 2). En fonction des temps de relaxation de la sonde à l'étude (T 2 et T 2 *) et la vitesse de balayage, les oscillations peuvent app...
Déclarations de divulgation
We have nothing to disclose.
Remerciements
Prise en charge partielle de ce travail par le NIH accorde NIBIB EB002807 et CA177744 (GRE et SSE) et P41 EB002034 au GRE, Howard J. Halpern, PI, et par l'Université de Denver est appréciée. Mark Tseytlin a été soutenu par le NIH R21 EB022775, NIH K25 EB016040, NIH / NIGMS U54GM104942. Les auteurs remercient Valery Khramtsov, maintenant à l'Université de Virginie-Occidentale, et Illirian Dhimitruka à l'Ohio State University pour la synthèse des radicaux TAM sensibles au pH et à Gerald Rosen et Joseph Kao à l'Université du Maryland pour la synthèse de l'mHCTPO , PROXYL, BMPO et les radicaux nitronyl.
matériels
| Name | Company | Catalog Number | Comments |
| 4-oxo-2,2,6,6-tetra(2H3)methyl-1-(3,3,5,5-2H4,1-15N)piperdinyloxyl (15N-PDT) | CDN Isotopes | M-2327 | 98% atom 15N, 98 % atom D, Quebec Canada |
| 4-1H-3-carbamoyl-2,2,5,5-tetra(2H3)methyl-3-pyrrolinyloxyl (15N-mHCTPO) | N/A | N/A | Synthesized at U. Maryland and described in Reference 29 |
| 3-carboxy-2,2,5,5-tetra(2H3)methyl-1-(3,4,4-2H3,1-15N)pyrrolidinyloxyl (15N-Proxyl) | N/A | N/A | Synthesized at U. Maryland and described in Reference 25 |
| 4 mm Quartz EPR Tubes | Wilmad Glass | 707-SQ-100M | |
| 4-oxo-2,2,6,6-tetra(2H3)methyl-1-(3,3,5,5-2H4)piperdinyloxyl (14N-PDT) | CDN Isotopes | D-2328 | 98% atom D, Quebec Canada |
| pH sensitive trityl radical (aTAM4) | Ohio State University | N/A | Synthesized at Ohio State University and described in Reference 26 |
| Potassum Phosphate, Monobasic | J.T. Baker Chemicals | 1-3246 | |
| 6 mm Quartz EPR Tubes | Wilmad Glass | Q-5M-6M-0-250/RB | |
| 8 mm Quartz EPR Tubes | Wilmad Glass | Q-7M-8M-0-250/RB | |
| 5-tert-butoxycarbonyl-5-methyl-1-pyrroline-N-oxide (BMPO) | N/A | N/A | Synthesized at U. Maryland and described in Reference 30 |
| Hydrogen Peroxide | Sigma Aldrich | H1009 SIGMA | 30% |
| 16 mm Quartz EPR tube | Wilmad Glass | 16-7PP-11QTZ | |
| Medium Pressure 450 W UV lamp | Hanovia | 679-A36 | Fairfield, NJ |
| L-Glutathione, reduced | Sigma Aldrich | G470-5 | |
| Nitronyl | NA | N/A | Synthesized at U. Maryland and described in Reference 31 |
| Sodium Hydroxide | J.T. Baker Chemicals | 1-3146 |
Références
- Bobko, A. A., et al. In vivo monitoring of pH, redox status, and glutathione using L-band EPR for assessment of therapeutic effectiveness in solid tumors. Magn. Reson. Med. 67 (6), 1827-1836 (2012).
- Utsumi, H., et al. Simultaneous molecular imaging of redox reactions monitored by overhauser-enhanced MRI with 14N-and 15N-labeled nitroxyl radicals. Proc. Nat. Acad. Sci. U.S.A. 103 (5), 1463-1468 (2006).
- Khramtsov, V. V., Grigor'ev, I. A., Foster, M. A., Lurie, D. J., Nicholson, I. Biological applications of spin pH probes. Cell. Mol. Bio. 46 (8), 1361-1374 (2000).
- Halpern, H. J., et al. Oxymetry Deep in Tissues with Low-Frequency Electron-Paramagnetic Resonance. Proc. Nat. Acad. Sci. U.S.A. 91 (26), 13047-13051 (1994).
- Matsumoto, S., et al. Low-field paramagnetic resonance imaging of tumor oxygenation and glycolytic activity in mice. J. Clin. Invest. 118 (5), 1965-1973 (2008).
- Velan, S. S., Spencer, R. G. S., Zweier, J. L., Kuppusamy, P. Electron paramagnetic resonance oxygen mapping (EPROM): Direct visualization of oxygen concentration in tissue. Magn. Reson. Med. 43 (6), 804-809 (2000).
- Elas, M., et al. Electron paramagnetic resonance oxygen image hypoxic fraction plus radiation dose strongly correlates with tumor cure in FSA fibrosarcomas. Int. J. Radiat. Oncol. 71 (2), 542-549 (2008).
- Dreher, M. R., et al. Nitroxide conjugate of a thermally responsive elastin-like polypeptide for noninvasive thermometry. Med. Phys. 31 (10), 2755-2762 (2004).
- Gallez, B., Mader, K., Swartz, H. M. Noninvasive measurement of the pH inside the gut by using pH-sensitive nitroxides. An in vivo EPR study. Magn. Reson. Med. 36 (5), 694-697 (1996).
- Halpern, H. J., et al. Diminished aqueous microviscosity of tumors in murine models measured with in vivo radiofrequency electron paramagnetic resonance. Cancer Res. 59 (22), 5836-5841 (1999).
- Elas, M., Ichikawa, K., Halpern, H. J. Oxidative Stress Imaging in Live Animals with Techniques Based on Electron Paramagnetic Resonance. Radiat. Res. 177 (4), 514-523 (2012).
- Kuppusamy, P., et al. Noninvasive imaging of tumor redox status and its modification by tissue glutathione levels. Cancer Res. 62 (1), 307-312 (2002).
- Khramtsov, V. V., Yelinova, V. I., Glazachev, Y. I., Reznikov, V. A., Zimmer, G. Quantitative determination and reversible modification of thiols using imidazolidine biradical disulfide label. J. Biochem. Biophys. Methods. 35 (2), 115-128 (1997).
- Plonka, P. M. Electron paramagnetic resonance as a unique tool or skin and hair research. Exp. Dermatol. 18, 472-484 (2009).
- Halevy, R., Shtirberg, L., Shklyar, M., Blank, A. Electron Spin Resonance Micro-Imaging of Live Species for Oxygen Mapping. J. Vis. Exp. (42), e122 (2010).
- Halevy, R., Tormyshev, V., Blank, A. Microimaging of oxygen concentration near live photosynthetic cells by electron spin resonance. Biophys J. 99 (3), 971-978 (2010).
- Eaton, G. R., Eaton, S. S. . Concepts Magn. Reson. 7, 49-67 (1995).
- Maltempo, M. M. Differentiaon of spectral and spatial components in EPR imaging using 2-D image reconstruction algorithms. J. Magn. Reson. 69, 156-161 (1986).
- Tseitlin, M., et al. New spectral-spatial imaging algorithm for full EPR spectra of multiline nitroxides and pH sensitive trityl radicals. J. Magn. Reson. 245, 150-155 (2014).
- Mitchell, D. G., Radu, N., Koch, S., et al. . Abstracts of Papers of the American Chemical Society. 242, (2011).
- Stoner, J. W., et al. Direct-detected rapid-scan EPR at 250 MHz. J. Magn. Reson. 170 (1), 127-135 (2004).
- Tseytlin, M., Biller, J. R., Mitchell, D. G., Yu, Z., Quine, R. W., Rinard, G. A., Eaton, S. S., Eaton, G. R. . EPR Newsletter. 23, 8-9 (2014).
- Biller, J. R., et al. Imaging of nitroxides at 250 MHz using rapid-scan electron paramagnetic resonance. J. Magn. Reson. 242, 162-168 (2014).
- Biller, J. R., et al. Improved Sensitivity for Imaging Spin Trapped Hydroxyl Radical at 250 MHz. Chem. Phys. Chem. 16 (3), 528-531 (2015).
- Burks, S. R., Bakhshai, M. A., Makowsky, M. A., Muralidharan, S., Tsai, P., Rosen, G. M., Kao, J. Y. 2H, 15N-Substituted nitroxides as sensitive probes for electron paramagnetic resonance imaging. J. Org. Chem. 75, 6463-6467 (2010).
- Dhimitruka, I., Bobko, A. A., Hadad, C. M., Zweier, J. L., Khramtsov, V. V. Synthesis and characterization of amino derivatives of persistent trityl radicals as dual function pH and oxygen paramagnetic probes. J. Am. Chem. Soc. 130 (32), 10780-10787 (2008).
- Elajaili, H. B., et al. Electron spin relaxation times and rapid scan EPR imaging of pH-sensitive amino-substituted trityl radicals. Magn. Reson. Chem. 53 (4), 280-284 (2015).
- Elajaili, H., Biller, J. R., Rosen, G. M., Kao, J. P. Y., Tseytlin, M., Buchanan, L. B., Rinard, G. A., Quine, R. W., McPeak, J., Shi, Y., Eaton, S. S., Eaton, G. R. Imaging Disulfides at 250 MHz to Monitor Redox. J. Magn. Reson. , (2015).
- Tseitlin, M., Rinard, G. A., Quine, R. W., Eaton, S. S., Eaton, G. R. Deconvolution of sinusoidal rapid EPR scans. J. Magn. Reson. 208 (2), 279-283 (2011).
- Halpern, H. J., Peric, M., Nguyen, T. D., Spencer, D. P., Teicher, B. A., Lin, Y. J., Bowman, M. K. Selective isotopic labeling of a nitroxide spin label to enhance sensitivity for T2 oxymetry. J. Magn. Reson. 90, 40-51 (1990).
- Tsai, P., et al. Esters of 5-carboxyl-5-methyl-1-pyrroline N-oxide: A family of spin traps for superoxide. J. Org. Chem. 68 (20), 7811-7817 (2003).
- Biller, J. R., et al. Frequency dependence of electron spin relaxation times in aqueous solution for a nitronyl nitroxide radical and perdeuterated-tempone between 250 MHz and 34 GHz. J. Magn. Reson. 225, 52-57 (2012).
- Rosen, G. M., et al. Dendrimeric-containing nitronyl nitroxides as spin traps for nitric oxide: Ssynthesis, kinetic, and stability studies. Macromolecules. 36 (4), 1021-1027 (2003).
- Bobko, A. A., et al. Redox-sensitive mechanism of no scavenging by nitronyl nitroxides. Free Radical Biol. Med. 36 (2), 248-258 (2004).
- Roshchupkina, G. I., et al. In vivo EPR measurement of glutathione in tumor-bearing mice using improved disulfide biradical. Free Radical Bio. Med. 45 (3), 312-320 (2008).
- Mitchell, D. G., et al. Use of Rapid-Scan EPR to Improve Detection Sensitivity for Spin-Trapped Radicals. Biophysical Journal. 105 (2), 338-342 (2013).
- Bobko, A. A., Dhimitruka, I., Zweier, J. L., Khramtsov, V. V. Trityl radicals as persistent dual function pH and oxygen probes for in vivo electron paramagnetic resonance spectroscopy and imaging: Concept and experiment. J. Am. Chem. Soc. 129 (23), (2007).
- Biller, J. R., et al. Electron spin-lattice relaxation mechanisms of rapidly-tumbling nitroxide radicals. J. Magn. Reson. 236, 47-56 (2013).
- Redler, G., Barth, E. D., Bauer, K. S., Kao, J. P. Y., Rosen, G. M., Halpern, H. J. In vivo electron paramagnetic resonance imaging of differential tumor targeting using cis-3,4-di(acetoxymethoxycarbonyl)-2,2,5,5-tetramethyl-1-pyrrolidinyloxyl. Magn. Reson. Med. 71 (4), 1650-1656 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon