É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Rápida digitalização ressonância paramagnética eletrônica abre novos caminhos para criação de imagens fisiologicamente parâmetros importantes
Neste Artigo
Resumo
Um novo método de ressonância paramagnética eletrônica (EPR), rápidas digitalização EPR (RS-EPR), é demonstrado para 2D imagens espaciais espectral, que é superior à técnica tradicional de onda contínua (CW) e abre novos espaços para imagiologia in vivo. Os resultados são demonstrados a 250 MHz, mas a técnica é aplicável em qualquer frequência.
Resumo
Nós demonstramos um método superior de 2D imagem espectral-espacial de moléculas repórter radicais estáveis a 250 MHz usando elétron-paramagnética de ressonância rápida-scan (RS-EPR), que pode fornecer informações quantitativas em condições in vivo na concentração de oxigênio, pH, redox estado e a concentração de moléculas de sinalização (ou seja, OH •, NÃO •). A técnica RS-EPR tem uma maior sensibilidade, uma melhor resolução espacial (1 mM), e tempo de aquisição mais curto, em comparação com a técnica padrão de onda contínua (CW). Uma variedade de configurações de fantasmas foram testados, com resolução espacial variando de 1 até 6 mm, e a largura espectral das moléculas repórter que variam de 16 mT (160 mg) a 5 mT (50 L). Um ressonador bimodal cross-circuito desacopla de excitação e detecção, reduzindo o ruído, enquanto o efeito de verificação rápida permite mais poder para servir de entrada para o sistema de rotação antes da saturação, aumentando o sinal EPR. esteleva a uma proporção substancialmente mais elevada de sinal-para-ruído do que em experiências CW EPR convencionais.
Introdução
Em relação a outras modalidades de imagem médica, imagiologia de ressonância paramagnética eletrônica (EPRI) é o único capaz de imagem quantitativamente propriedades fisiológicas, incluindo pH 1-3, pO 2 4-7, temperatura 8, perfusão e viabilidade dos tecidos 9, microviscosidade e facilidade de difusão de pequenas moléculas 10 e estresse oxidativo 11. Estimativa da facilidade de clivagem dissulfeto de glutationa (GSH) no tecido e células 12,13 pode informar sobre o estado redox. Para imagiologia in vivo, EPR na gama de frequências entre 250 MHz e 1 GHz é escolhido porque estas frequências proporcionar suficiente profundidade de penetração do tecido (até vários centímetros) para gerar imagens para pequenos animais, em que as intensidades não são diminuídas por efeitos de perdas dieléctricas. As frequências mais altas, tais como 9,5 GHz 14 (X-band) e 17 GHz (K u -band) 15,16 pode ser utilizado para imagiologia de pele e cabelo ou células individuais, Respectivamente. O sucesso do EPRI em todas as frequências depende de sondas de spin paramagnéticos que são específicos para os tecidos de modo a que a sua localização e destino pode ser trabalhada.
Se o ambiente de uma sonda de spin do elétron é espacialmente heterogêneo, o espectro EPR é a soma das contribuições de todos os locais. Imagem espectral-espacial divide o volume da amostra em uma matriz de pequenos segmentos espaciais e calcula o espectro de EPR de cada um desses segmentos 17. Isto permite o mapeamento do ambiente local através da medição da variação espacial no espectro de EPR. gradientes de campo magnético são usados para codificar informação espacial em espectros de EPR, que são chamados projecções. A imagem espectral-espacial é reconstruída a partir dessas projeções 18,19.
Na RS-EPR o campo magnético é digitalizado através da ressonância em um tempo que é curto em relação aos tempos de spin do elétron de relaxamento (Figura 2) 20,21. D econvolution do sinal rápida de varrimento dá o espectro de absorção, que é equivalente à primeira integral do espectro CW primeira derivado convencional. O sinal rápida de varrimento é detectada em quadratura, de modo que ambos os componentes de absorção e de dispersão da resposta do sistema de spin são medidos. Isto é, essencialmente, recolhendo o dobro da quantidade de dados por unidade de tempo. A saturação do sinal através de uma experiência de verificação rápida acontece em potências mais elevadas do que para CW, de modo potências mais elevadas podem ser utilizadas sem a preocupação de saturação. 20,22 Muito mais médias pode ser feito por unidade de tempo em comparação com CW. Maior potência, a detecção directa e em quadratura mais médias por unidade de tempo se combinam para dar varredura rápida uma melhor relação sinal-ruído (SNR), especialmente em altas projecções que definem gradientes separação espacial, conduzindo a imagens de maior qualidade. Para atingir aproximadamente o mesmo SNR para uma imagem de um fantasma necessários cerca de 10 vezes mais tempo para CW como para a verificação rápida 23.
tenda "> O aumento da SNR também permite experiências a 250 MHz com aductos de armadilha de spin concentração baixa formados pela reacção de OH com 5-terc-butoxicarbonil-5-metil-1-N-óxido pyrroline- (BMPO-OH), que seria invisíveis para o método CW 24. Dinitroxides ligadas com um ligante dissulfureto são sensíveis à clivagem por glutationa, e assim pode reportar sobre o estado redox celular. existe Equilíbrio, dependente da concentração de glutationa presentes, entre as formas di- e mono-radical. observando estas alterações requer a captura de toda a largura do espectro 5 mT, e pode ser alcançado muito mais rapidamente com EPR varredura rápida em comparação com o reforço do campo magnético através de uma experiência CW.Um sistema de varredura rápida completa é composta de quatro partes: o espectrômetro, o ímã de campo principal, o motorista bobina varredura rápida, e a varredura rápida cross-circuito ressonador. O espectrómetro e a principal função íman campo o mesmo como numa experiência de CW, definindo o principal campo de Zeemane recolha dos dados do ressonador. O condutor da bobina varredura rápida gera a corrente sinusoidal de digitalização que entra em especialmente concebidos bobinas de verificação rápida sobre a varredura rápida cross-circuito ressonador. As bobinas de verificação rápida sobre a rápida verificação ressonador transversal de circuito gerar um grande campo magnético homogéneo, que é varrida a frequências entre 3 e 15 kHz.
Protocolo
1. Configuração do driver rápida verificação da bobina a 250 MHz
- Cálculo da rápida digitalização condições experimentais
Nota: O parâmetro mais importante na RS-EPR é a taxa de varredura, α, que é o produto da freqüência de varredura e largura de varredura (Equação 3). Para larguras de digitalização estreitas, as taxas de digitalização mais rápida são usados, e para larguras de varrimento mais amplos, as taxas de digitalização mais lentas são usadas. As instruções a seguir percorrer o último caso e mostrar como chegar aos parâmetros do driver de bobina experimentais de largura de varredura 7 mT ea frequência de scaneamento 6,8 kHz.- Determinar a largura de banda ressonador (BW Res).
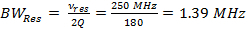 (1)
(1)
em que v é a frequência res de funcionamento do dispositivo de ressonância e Q é o factor de qualidade. Q = 90, é comum que o ressonador varredura rápida usado para obter os dados de resultados representativos. - Determinar a taxa de varredura rápida, α, todosdevidos pela largura de banda ressonador
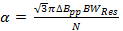 (2)
(2) 
em que N é uma frequência constante conservadora seleccionada para ser 5-6, pp ΔB é a largura de linha derivado de pico-a-pico em MT, e a é a taxa de varrimento se T / s para uma largura de linha de Lorentz.
Nota: Um valor comum para os radicais na seção representativa é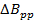 = 0,1 mt. Em comparação com a literatura anterior varredura rápida; Equação 2 é derivado, definindo a largura de banda do sinal (BW sig) igual a BW Res.
= 0,1 mt. Em comparação com a literatura anterior varredura rápida; Equação 2 é derivado, definindo a largura de banda do sinal (BW sig) igual a BW Res. - Determine a frequência de varredura rápida máximo permitido pela taxa.
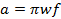 (3)
(3) 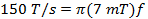
em que w representa a largura do SCAn ef é a frequência de varredura. A largura de varredura de 7 mT cobrirá 100% do espectro para sondas de corrente usados in vivo. Utilize este valor e a taxa calculada em (Equação 2) para determinar a frequência de varredura.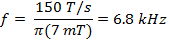
- Determinar a largura de banda ressonador (BW Res).
- Seleção de capacitores de sintonia e afinação de rápida motorista bobina de varredura
Nota: O driver de bobina varredura rápida é tipicamente executado em um modo ressonada gerando uma onda sinusoidal. Ressonância ocorre com uma frequência de varredura, onde as reatâncias indutivas e capacitivas são de magnitude e opostas sinais iguais, de modo que reatância total é próximo de zero.- Determinar a capacidade adequada para a frequência determinada em 1.1.3 utilizando a indutância, L, uma das bobinas de verificação rápida e (Equação 4).

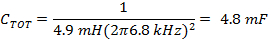
- Divida C TOT a partir de (Equação 4) ao meio para obter os valores de capacitores para cada lado da caixa capacitor o motorista bobina.
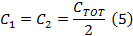
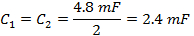
Nota: O driver de bobina varredura rápida tem dois amplificadores. Ao seleccionar um condensador, a caixa de condensador tem de ser equilibrada com uma capacitância iguais em cada lado da caixa. Os dois lados estão em série. - Desapertar a tampa superior da caixa do condensador e inserir capacitores em ambos os lados que são iguais ao valor determinado na etapa 1.2.2.
- Substitua o topo da caixa de capacitor e aperte-o para baixo para garantir que ele permanece ligado.
- Com o painel frontal do condutor da bobina ressonada, ajustar a frequência de saída até que a forma de onda sinusoidal tem a amplitude máxima.
- Determinar a capacidade adequada para a frequência determinada em 1.1.3 utilizando a indutância, L, uma das bobinas de verificação rápida e (Equação 4).
2. Preparação de Reagentes e Phantoms
- Preparação de radicals
- Retirar 15 N-TFD do congelador e para permitir que o recipiente atingir a temperatura ambiente (10-15 min).
- Pesar 1,4 mg de 15 N-PDT usando uma balança analítica.
- Adicionar 1,4 mg de 15-N PDT para 15 ml desionizada (DI) H2O para uma concentração final de 0,5 mM.
Nota: 4-oxo-2,2,6,6-tetra (2 H 3) (1- 15 N 3,3,5,5- 2 H 4,) piperdinyloxyl metil-1- (N-15 PDT), 4- 1 H-3-carbamoil-2,2,5,5-tetra (2 H 3) metil-3-pyrrolinyloxyl (15 N-mHCTPO) e 3-carboxi-2,2,5,5-tetra (2 H 3) metil-1- (3,4,4- 2 H 3, 1- 15 N) pirrolidiniloxi (PROXYL-15 N) 25 (Figura 1E-G) radicais têm estabilidade a longo prazo (2 anos) em solução aquosa e à temperatura ambiente. Suas formas sólidas são normalmente armazenados em um freezer ou geladeira para manter esses radicais estável há anos.A estabilidade dos radicais de nitróxido geralmente torná-los não-tóxicos, e a sua preparação pode ser feito em uma bancada normal quando o solvente é a água. Ao utilizar solventes orgânicos, preparar soluções nitróxido dentro de um exaustor quando equipado com o equipamento de protecção individual (EPI).
- Preparação de radicais tritilo sensíveis ao pH
- Pesar 0,7 mg de triaril radical metilo (Atam 4) 26 radical (1400 g / mol) e dissolvem-se em 200 ul de etanol absoluto.
- Pesar 0,00681 g de KH 2 PO 4 (136,1 g / mol) e dissolvem-se em 50 ml de água desionizada para uma concentração final de 1 mM.
- Pesar 2,8 g de KOH (56 g / mol) e dissolvem-se em 50 ml de água desionizada para uma concentração final de 1 M.
- Adicionar gota a gota de KOH para o tampão de fosfato (2.2.2) para ajustar o pH de 7,0.
- Adicionar 800 ul de tampão de fosfato 1 mM e 200 ul de Atam 4 em etanol absoluto para uma concentração finalentration de 0,5 mM em tampão de 80:20: etanol.
- Repita os passos 2.2.1-2.2.5 para criar a amostra 4 Atam em pH = 7,2.
- Coloque a Atam 4, pH = 7,0 e Atam 4, pH = 7,2 em tubos separados da amostra de quartzo 6 mm.
- Coloque as duas 6 mm tubos de quartzo EPR em um tubo de quartzo EPR 16 mm, com a 2 mm de espessura espaçador isopor no meio.
Nota: As paredes do tubo de ensaio de quartzo são de 0,5 mm de espessura, e para além dos 2 mm espaçador originar uma separação de 3 mm entre as amostras Atam. Os radicais tritilo sensíveis ao pH utilizados foram sintetizados na Universidade do Estado de Ohio 26. O exemplo que foi utilizada para geração de imagens é chamado Atam 4. A reacção que representa a sensibilidade ao pH é mostrado na Figura 1A.
- Geração de BMPO-OH
- Pesar 680 mg de KH 2 PO 4 e dissolve-se em 100 ml de água DI para uma concentração final de 50 mM.
- Adicione 1 M KOH gota a gotapara o tampão de fosfato a pH = 7,3.
- Pesar 50 mg de BMPO (199,25 g / mol).
- Combinar a 50 mg de BMPO com 5 ml de tampão fosfato em um tubo de irradiação de quartzo de 16 mm.
- Adicionar 100 ul de peróxido de hidrogénio 300 mM.
- Irradiar a mistura no tubo de irradiação de quartzo 16 mm, com uma lâmpada de 450 W de pressão média UV durante 5 min.
- Usando uma pipeta de transferência de vidro, transferir 2,5 mL da solução BMPO-OH irradiada para fora do tubo de irradiação de quartzo e para um lado de um tubo de amostra de quartzo com 16 milímetros divisor 3 milímetros.
- Transferir os restantes 2,5 mL de irradiado BMPO-OH para o outro lado do tubo de ensaio de quartzo com 16 milímetros divisor 3 milímetros.
- Preparação de dinitroxide radical
- Pesar 24,7 mg de 2 H, dinitroxide 15 N-dissulfureto (Figura 1C) em 1 ml de DMSO de uma solução de estoque de 47,5 mM.
- Preparar tampão Tris 10 mM e ajustar para pH 7,2.
- tome 40ul dinitroxide solução estoque e dilui-se com tampão Tris a uma concentração final de 1 mM.
- Coloque 250 ml de solução em tampão de dinitroxide num tubo de ensaio de quartzo 16 milímetros com um divisor de 10 milímetros no centro.
- Pesar 154 mg de glutationa e adicionar a 5 ml de tampão Tris para uma concentração final de 100 mM.
- Adicionam-se 5 ul da solução de 100 mM de glutationa para 250 ul de solução dinitroxide 1 mM num dos lados do divisor de 10 mm a converter o di-radical em mono.
- Preparação de nitróxido nitronil
- Remover o radical do congelador e para permitir que o recipiente atingir a temperatura ambiente (10-15 min).
- Pesar 1,9 mg de nitronil (390 g / mol).
- Pesar 0,56 mg de KOH e dissolver em 10 ml de água desionizada para uma concentração final de 1 mM.
- Misture a 1,9 mg de nitronil em 10 ml de uma solução de KOH mM para uma concentração final de 0,5 mM nitronil.
Nota: Se necessary, usar um agitador ou sonicator a solvatação velocidade do nitronil.
3. Configuração do Instrumento Rápido de digitalização a 250 MHz
Nota: Ajustamento do ressonador com uma amostra aquosa de nitróxido radical, que tem um efeito semelhante sobre ressonador Q e ajuste como solução tampão, é uma boa maneira de configurar para a amostra a ser trabalhada
- Sintonize o ressonador com uma amostra aquosa de radical nitróxido.
- Inserir os 15 ml de 0,5 mM 15 N-PDT em amostra de água em um tubo de quartzo EPR 16 mm.
- Inserir o tubo de quartzo para o lado de detecção do cruzamento de ciclo-RS EPR ressonador.
- Alterar a frequência da fonte de instrumento até que ele corresponda a frequência de lado a detecção que contém a amostra. alterar manualmente a frequência portadora da fonte 250 MHz, inserindo o valor desejado no software.
- Alterar a frequência do lado de excitação para coincidir com as frequencies da origem de experiência e o lado de detecção do dispositivo de ressonância. Alterar a frequência de lado a excitação girando um capacitor variável dentro da cavidade do ressonador de acordo com o protocolo do fabricante.
- Configurar Console Instrumento e Magnet Principal
- Ligue o espectrômetro e escolha um experimento que grava os dados transitórios com o tempo na abcissa.
- Dentro do software, defina o número de pontos a 65.536 e a base de tempo para 10 nanossegundos.
- Defina o número de médias de 10.000 para um sinal forte ou estreito, e 45.000 para um sinal largo ou fraco.
- Pressione o botão "envolver" no software para enviar os parâmetros experimentais do software para o console e energizar o ímã de campo principal.
- Defina o campo magnético principal para 9 mt.
- Coloque o botão de atenuação de energia para 50 dB, e ligue a 7 W amplificador de alta potência.
4. Execuçãoda Experiência rápida digitalização
Nota: As instruções específicas relacionadas com a análise dos fantasmas contendo BMPO-OH 24, radicais TAM sensíveis ao pH 19,27 e redox dinitroxides sensíveis 28 são fornecidos na literatura.
- Saturação de poder da amostra nitróxido padrão
Nota: É vantajoso para fazer uma curva de saturação de energia com base numa amostra radical nitróxido padrão, nas mesmas condições experimentais que serão utilizados para analisar os radicais sensíveis ao pH ou estado redox.- Ligue o rápido motorista de bobina de digitalização, com os valores da secção 1 (frequência de varredura de 6,8 kHz e largura de digitalização de 7 mT).
- A partir de 50 dB, coletar um espectro de varredura rápida com 100k médias. Diminuir a atenuação de 3 dB e repetir a medição. Continuar até que um ajuste do atenuador de 0 dB, ou por tanto tempo quanto a medição de isolamento sobre a leitura ponte é <0.
- transferência tele matérias dados de verificação rápida numa programa de desconvolução (por exemplo escrito em Matlab) e processar os dados em bruto para o espectro de absorção.
- Introduza a frequência de varredura, largura de varredura, o número de pontos e base de tempo no programa, e executar o programa para processar o sinal de varredura rápida bruto em um sinal de absorção.
- Traça-se a amplitude do sinal de absorção como uma função da raiz quadrada de energia (em Watt) incidente sobre o ressonador. No regime não saturante, a amplitude é linearmente dependente da raiz quadrada da potência incidente.
- Encaixe uma linha de tendência a partir de 0,0 e incluir todos os pontos de dados que se inserem na região de resposta linear. Na região de resposta linear, amplitude do sinal aumentos proporcionais à raiz quadrada da potência de microondas.
- Extrapolar essa tendência de poderes superiores, e comparar a intensidade do sinal EPR. Use o mais alto poder para o qual a amplitude do sinal não se desvie mais de 3% a partir da linha de tendência extrapolada. em order para a deconvolução do sinal de verificação rápida para funcionar corretamente, o sinal deve ainda estar na região linear de resposta em relação à potência incidente.
Nota: Transferência dos dados de digitalização rápidas matérias pode ser feito através de uma conexão de rede ou via pen drive. Neste caso, a transferência é necessário porque o programa para processar os dados em bruto (Matlab) não está no mesmo computador que tem software de recolha de dados. O algoritmo de desconvolução que processa dados em bruto é descrito em 29.
Resultados
O produto da experiência é um conjunto de projeções que são reconstruídas em imagens bidimensionais (um espectro, um espacial) com uma escala de cores falsas para representar a amplitude do sinal. azul profundo denota linha de base, onde nenhum sinal estiver presente, o verde é baixa amplitude e vermelho é mais alto. Fatias ao longo do eixo x (dimensão espectral) representam o sinal EPR (transição EPR) sobre um eixo do campo magnético. Ao longo do eixo y (dimensão espacial),...
Discussão
sinais de varredura rápida tem componentes de frequência mais elevadas do que CW, e requerem uma largura de banda ressonador maior dependendo linewidths, tempos de relaxação, ea velocidade das rápidas-scans. A largura de banda necessária para uma dada experiência baseia-se na largura de linha e da velocidade de varrimento do campo magnético (Equação 2). Dependendo dos tempos de relaxação da sonda sob estudo (T 2 e T 2 *), e a velocidade de varrimento, oscilações podem aparecer no bord...
Divulgações
We have nothing to disclose.
Agradecimentos
apoio parcial deste trabalho pelo NIH concede NIBIB EB002807 e CA177744 (GRE e SSE) e EB002034 P41 para GRE, Howard J. Halpern, PI, e pela Universidade de Denver é reconhecido agradecimento. Mark Tseytlin foi financiado pelo NIH R21 EB022775, NIH K25 EB016040, NIH / NIGMS U54GM104942. Os autores são gratos ao Valery Khramtsov, agora na Universidade de West Virginia, e Illirian Dhimitruka da Universidade Estadual de Ohio para a síntese dos radicais TAM sensíveis ao pH, e Gerald Rosen e Joseph Kao na Universidade de Maryland para a síntese do mHCTPO , PROXYL, BMPO e radicais nitronil.
Materiais
| Name | Company | Catalog Number | Comments |
| 4-oxo-2,2,6,6-tetra(2H3)methyl-1-(3,3,5,5-2H4,1-15N)piperdinyloxyl (15N-PDT) | CDN Isotopes | M-2327 | 98% atom 15N, 98 % atom D, Quebec Canada |
| 4-1H-3-carbamoyl-2,2,5,5-tetra(2H3)methyl-3-pyrrolinyloxyl (15N-mHCTPO) | N/A | N/A | Synthesized at U. Maryland and described in Reference 29 |
| 3-carboxy-2,2,5,5-tetra(2H3)methyl-1-(3,4,4-2H3,1-15N)pyrrolidinyloxyl (15N-Proxyl) | N/A | N/A | Synthesized at U. Maryland and described in Reference 25 |
| 4 mm Quartz EPR Tubes | Wilmad Glass | 707-SQ-100M | |
| 4-oxo-2,2,6,6-tetra(2H3)methyl-1-(3,3,5,5-2H4)piperdinyloxyl (14N-PDT) | CDN Isotopes | D-2328 | 98% atom D, Quebec Canada |
| pH sensitive trityl radical (aTAM4) | Ohio State University | N/A | Synthesized at Ohio State University and described in Reference 26 |
| Potassum Phosphate, Monobasic | J.T. Baker Chemicals | 1-3246 | |
| 6 mm Quartz EPR Tubes | Wilmad Glass | Q-5M-6M-0-250/RB | |
| 8 mm Quartz EPR Tubes | Wilmad Glass | Q-7M-8M-0-250/RB | |
| 5-tert-butoxycarbonyl-5-methyl-1-pyrroline-N-oxide (BMPO) | N/A | N/A | Synthesized at U. Maryland and described in Reference 30 |
| Hydrogen Peroxide | Sigma Aldrich | H1009 SIGMA | 30% |
| 16 mm Quartz EPR tube | Wilmad Glass | 16-7PP-11QTZ | |
| Medium Pressure 450 W UV lamp | Hanovia | 679-A36 | Fairfield, NJ |
| L-Glutathione, reduced | Sigma Aldrich | G470-5 | |
| Nitronyl | NA | N/A | Synthesized at U. Maryland and described in Reference 31 |
| Sodium Hydroxide | J.T. Baker Chemicals | 1-3146 |
Referências
- Bobko, A. A., et al. In vivo monitoring of pH, redox status, and glutathione using L-band EPR for assessment of therapeutic effectiveness in solid tumors. Magn. Reson. Med. 67 (6), 1827-1836 (2012).
- Utsumi, H., et al. Simultaneous molecular imaging of redox reactions monitored by overhauser-enhanced MRI with 14N-and 15N-labeled nitroxyl radicals. Proc. Nat. Acad. Sci. U.S.A. 103 (5), 1463-1468 (2006).
- Khramtsov, V. V., Grigor'ev, I. A., Foster, M. A., Lurie, D. J., Nicholson, I. Biological applications of spin pH probes. Cell. Mol. Bio. 46 (8), 1361-1374 (2000).
- Halpern, H. J., et al. Oxymetry Deep in Tissues with Low-Frequency Electron-Paramagnetic Resonance. Proc. Nat. Acad. Sci. U.S.A. 91 (26), 13047-13051 (1994).
- Matsumoto, S., et al. Low-field paramagnetic resonance imaging of tumor oxygenation and glycolytic activity in mice. J. Clin. Invest. 118 (5), 1965-1973 (2008).
- Velan, S. S., Spencer, R. G. S., Zweier, J. L., Kuppusamy, P. Electron paramagnetic resonance oxygen mapping (EPROM): Direct visualization of oxygen concentration in tissue. Magn. Reson. Med. 43 (6), 804-809 (2000).
- Elas, M., et al. Electron paramagnetic resonance oxygen image hypoxic fraction plus radiation dose strongly correlates with tumor cure in FSA fibrosarcomas. Int. J. Radiat. Oncol. 71 (2), 542-549 (2008).
- Dreher, M. R., et al. Nitroxide conjugate of a thermally responsive elastin-like polypeptide for noninvasive thermometry. Med. Phys. 31 (10), 2755-2762 (2004).
- Gallez, B., Mader, K., Swartz, H. M. Noninvasive measurement of the pH inside the gut by using pH-sensitive nitroxides. An in vivo EPR study. Magn. Reson. Med. 36 (5), 694-697 (1996).
- Halpern, H. J., et al. Diminished aqueous microviscosity of tumors in murine models measured with in vivo radiofrequency electron paramagnetic resonance. Cancer Res. 59 (22), 5836-5841 (1999).
- Elas, M., Ichikawa, K., Halpern, H. J. Oxidative Stress Imaging in Live Animals with Techniques Based on Electron Paramagnetic Resonance. Radiat. Res. 177 (4), 514-523 (2012).
- Kuppusamy, P., et al. Noninvasive imaging of tumor redox status and its modification by tissue glutathione levels. Cancer Res. 62 (1), 307-312 (2002).
- Khramtsov, V. V., Yelinova, V. I., Glazachev, Y. I., Reznikov, V. A., Zimmer, G. Quantitative determination and reversible modification of thiols using imidazolidine biradical disulfide label. J. Biochem. Biophys. Methods. 35 (2), 115-128 (1997).
- Plonka, P. M. Electron paramagnetic resonance as a unique tool or skin and hair research. Exp. Dermatol. 18, 472-484 (2009).
- Halevy, R., Shtirberg, L., Shklyar, M., Blank, A. Electron Spin Resonance Micro-Imaging of Live Species for Oxygen Mapping. J. Vis. Exp. (42), e122 (2010).
- Halevy, R., Tormyshev, V., Blank, A. Microimaging of oxygen concentration near live photosynthetic cells by electron spin resonance. Biophys J. 99 (3), 971-978 (2010).
- Eaton, G. R., Eaton, S. S. . Concepts Magn. Reson. 7, 49-67 (1995).
- Maltempo, M. M. Differentiaon of spectral and spatial components in EPR imaging using 2-D image reconstruction algorithms. J. Magn. Reson. 69, 156-161 (1986).
- Tseitlin, M., et al. New spectral-spatial imaging algorithm for full EPR spectra of multiline nitroxides and pH sensitive trityl radicals. J. Magn. Reson. 245, 150-155 (2014).
- Mitchell, D. G., Radu, N., Koch, S., et al. . Abstracts of Papers of the American Chemical Society. 242, (2011).
- Stoner, J. W., et al. Direct-detected rapid-scan EPR at 250 MHz. J. Magn. Reson. 170 (1), 127-135 (2004).
- Tseytlin, M., Biller, J. R., Mitchell, D. G., Yu, Z., Quine, R. W., Rinard, G. A., Eaton, S. S., Eaton, G. R. . EPR Newsletter. 23, 8-9 (2014).
- Biller, J. R., et al. Imaging of nitroxides at 250 MHz using rapid-scan electron paramagnetic resonance. J. Magn. Reson. 242, 162-168 (2014).
- Biller, J. R., et al. Improved Sensitivity for Imaging Spin Trapped Hydroxyl Radical at 250 MHz. Chem. Phys. Chem. 16 (3), 528-531 (2015).
- Burks, S. R., Bakhshai, M. A., Makowsky, M. A., Muralidharan, S., Tsai, P., Rosen, G. M., Kao, J. Y. 2H, 15N-Substituted nitroxides as sensitive probes for electron paramagnetic resonance imaging. J. Org. Chem. 75, 6463-6467 (2010).
- Dhimitruka, I., Bobko, A. A., Hadad, C. M., Zweier, J. L., Khramtsov, V. V. Synthesis and characterization of amino derivatives of persistent trityl radicals as dual function pH and oxygen paramagnetic probes. J. Am. Chem. Soc. 130 (32), 10780-10787 (2008).
- Elajaili, H. B., et al. Electron spin relaxation times and rapid scan EPR imaging of pH-sensitive amino-substituted trityl radicals. Magn. Reson. Chem. 53 (4), 280-284 (2015).
- Elajaili, H., Biller, J. R., Rosen, G. M., Kao, J. P. Y., Tseytlin, M., Buchanan, L. B., Rinard, G. A., Quine, R. W., McPeak, J., Shi, Y., Eaton, S. S., Eaton, G. R. Imaging Disulfides at 250 MHz to Monitor Redox. J. Magn. Reson. , (2015).
- Tseitlin, M., Rinard, G. A., Quine, R. W., Eaton, S. S., Eaton, G. R. Deconvolution of sinusoidal rapid EPR scans. J. Magn. Reson. 208 (2), 279-283 (2011).
- Halpern, H. J., Peric, M., Nguyen, T. D., Spencer, D. P., Teicher, B. A., Lin, Y. J., Bowman, M. K. Selective isotopic labeling of a nitroxide spin label to enhance sensitivity for T2 oxymetry. J. Magn. Reson. 90, 40-51 (1990).
- Tsai, P., et al. Esters of 5-carboxyl-5-methyl-1-pyrroline N-oxide: A family of spin traps for superoxide. J. Org. Chem. 68 (20), 7811-7817 (2003).
- Biller, J. R., et al. Frequency dependence of electron spin relaxation times in aqueous solution for a nitronyl nitroxide radical and perdeuterated-tempone between 250 MHz and 34 GHz. J. Magn. Reson. 225, 52-57 (2012).
- Rosen, G. M., et al. Dendrimeric-containing nitronyl nitroxides as spin traps for nitric oxide: Ssynthesis, kinetic, and stability studies. Macromolecules. 36 (4), 1021-1027 (2003).
- Bobko, A. A., et al. Redox-sensitive mechanism of no scavenging by nitronyl nitroxides. Free Radical Biol. Med. 36 (2), 248-258 (2004).
- Roshchupkina, G. I., et al. In vivo EPR measurement of glutathione in tumor-bearing mice using improved disulfide biradical. Free Radical Bio. Med. 45 (3), 312-320 (2008).
- Mitchell, D. G., et al. Use of Rapid-Scan EPR to Improve Detection Sensitivity for Spin-Trapped Radicals. Biophysical Journal. 105 (2), 338-342 (2013).
- Bobko, A. A., Dhimitruka, I., Zweier, J. L., Khramtsov, V. V. Trityl radicals as persistent dual function pH and oxygen probes for in vivo electron paramagnetic resonance spectroscopy and imaging: Concept and experiment. J. Am. Chem. Soc. 129 (23), (2007).
- Biller, J. R., et al. Electron spin-lattice relaxation mechanisms of rapidly-tumbling nitroxide radicals. J. Magn. Reson. 236, 47-56 (2013).
- Redler, G., Barth, E. D., Bauer, K. S., Kao, J. P. Y., Rosen, G. M., Halpern, H. J. In vivo electron paramagnetic resonance imaging of differential tumor targeting using cis-3,4-di(acetoxymethoxycarbonyl)-2,2,5,5-tetramethyl-1-pyrrolidinyloxyl. Magn. Reson. Med. 71 (4), 1650-1656 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados