Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
El rápido escaneo de electrones resonancia paramagnética abre nuevas vías para Imaging fisiológicamente parámetros importantes
En este artículo
Resumen
Un método nuevo de resonancia paramagnética electrónica (EPR), rápidos de escaneo de EPR (RS-EPR), se demuestra para la imagen espacial espectral 2D que es superior a la técnica tradicional de onda continua (CW) y abre nuevos lugares para formación de imágenes in vivo. Los resultados se demostraron a 250 MHz, pero la técnica es aplicable a cualquier frecuencia.
Resumen
Se demuestra un método superior de 2D imágenes espectrales-espacial de moléculas informadoras radicales estables a 250 MHz usando un rápido-scan de electrones paramagnético-resonancia (RS-EPR), que puede proporcionar información cuantitativa en condiciones in vivo de la concentración de oxígeno, pH, redox el estado y la concentración de moléculas de señalización (es decir, OH •, • NO). La técnica de RS-EPR tiene una sensibilidad más alta, una mejor resolución espacial (1 mm), y tiempo de adquisición más corto en comparación con la técnica estándar de onda continua (CW). Una variedad de configuraciones de trazos se han probado, con una resolución espacial que varía de 1 a 6 mm, y la anchura espectral de las moléculas informadoras que van de 16 mT (160 mg) a 5 mT (50 G). Un resonador bimodal-loop cruz desacopla de excitación y de detección, reduciendo el ruido, mientras que el efecto de exploración rápida permite un mayor poder de ser de entrada al sistema de giro antes de la saturación, el aumento de la señal de EPR. Estaconduce a una proporción sustancialmente más alta de señal a ruido que en los experimentos de CW EPR convencionales.
Introducción
En relación con otras modalidades de imagen médica, resonancia paramagnética electrónica (EPRI) es el único capaz de imagen cuantitativamente las propiedades fisiológicas incluyendo el pH 1-3, PO 2 4-7 de 8 de temperatura, la perfusión y la viabilidad de los tejidos 9, microviscosidad y la facilidad de difusión de pequeñas moléculas 10 y estrés oxidativo 11. Estimación de la facilidad de la escisión de disulfuro de glutatión (GSH) en el tejido y las células 12,13 puede informar sobre el estado redox. Para formación de imágenes in vivo, EPR en la gama de frecuencias entre 250 MHz y 1 GHz se elige debido a que estas frecuencias proporcionan suficiente profundidad de penetración en el tejido (de hasta varios cm) para generar imágenes para pequeños animales en los que las intensidades no están disminuidos por los efectos de pérdida dieléctrica. Las frecuencias más altas, tales como 9,5 GHz 14 (X-banda) y 17 GHz (K u -band) 15,16 se pueden usar para formación de imágenes de la piel y del cabello o células individuales, Respectivamente. El éxito de EPRI en todas las frecuencias depende de sondas de espín paramagnéticas que son específicos para los tejidos de modo que su ubicación y el destino pueden obtenerse imágenes.
Si el ambiente de una sonda de espín del electrón es espacialmente heterogénea, el espectro de EPR es la suma de las contribuciones de todos los lugares. Imágenes espectrales-espacial divide el volumen de la muestra en una matriz de pequeños segmentos espaciales y calcula el espectro de EPR para cada uno de estos segmentos 17. Esto permite el mapeo del entorno local mediante la medición de la variación espacial en el espectro de EPR. gradientes de campo magnético se usan para codificar la información espacial en los espectros de EPR, que se llaman proyecciones. La imagen espectral-espacial se reconstruye a partir de estas proyecciones 18,19.
En RS-EPR el campo magnético es escaneado a través de resonancia en un tiempo que es corto en relación a los tiempos de relajación espín electrónico (Figura 2) 20,21. re econvolution de la señal de rápido-scan da el espectro de absorción, que es equivalente a la primera integral del espectro de CW primero derivado convencional. La señal de rápido-scan se detecta en cuadratura, de manera que se miden ambos componentes de absorción y dispersión de la respuesta del sistema de centrifugado. Esto es esencialmente recogiendo el doble de la cantidad de datos por unidad de tiempo. La saturación de la señal en un experimento de exploración rápida que ocurre a potencias más altas que para CW, por lo potencias superiores se pueden usar sin la preocupación por la saturación. 20,22 Muchos más promedios se pueden hacer por unidad de tiempo en comparación con CW. Mayor potencia, detección de cuadratura directa y más medias por unidad de tiempo se combinan para dar una rápida exploración de una mejor relación (SNR) de señal a ruido, especialmente en una proyección de alto gradiente que definen la separación espacial, dando lugar a imágenes de mayor calidad. Para lograr aproximadamente la misma SNR para una imagen de un fantasma necesaria sobre 10 veces más largo para CW como para la rápida exploración 23.
tienda "> El aumento de la SNR también permite experimentos a 250 MHz con aductos de trampa concentración de giro bajas formadas por la reacción de OH con 5-terc-butoxicarbonil-5-metil-1-pyrroline- N-óxido (BMPO-OH), que sería invisibles para el método CW 24. Dinitroxides conectados con un enlazador disulfuro son sensibles a la escisión por el glutatión, y así pueden informar sobre el estado redox celular. existe equilibrio, depende de la concentración de glutatión presente, entre las formas di- y mono-radical. la observación de estos cambios requiere la captura de todo el amplio espectro 5 mT, y se puede lograr mucho más rápido con EPR rápida exploración en comparación con la intensificación del campo magnético en un experimento de CW.Un sistema completo de exploración rápida consiste en cuatro partes: el espectrómetro, el imán principal de campo, el conductor de la bobina de exploración rápida, y la rápida exploración de resonador de lazo cruz. El espectrómetro y la función de imán de campo principal de la misma como en un experimento de CW, estableciendo el campo Zeeman principaly la recogida de los datos de la resonador. El conductor de la bobina de exploración rápida genera la corriente senoidal de exploración que va en bobinas de escaneo rápidas especialmente diseñadas sobre la rápida exploración de circuito resonador cruz. Las bobinas de exploración rápidos en la rápida resonador de bucle transversal exploración generan un gran campo magnético homogéneo, que se barrió a frecuencias entre 3 y 15 kHz.
Protocolo
1. Configuración del controlador de escaneo rápido de la bobina a 250 MHz
- Cálculo de exploración rápida Condiciones experimentales
Nota: El parámetro más importante en RS-EPR es velocidad de barrido, α, que es el producto de la frecuencia de exploración y la anchura de escaneado (Ecuación 3). Para anchos de escaneo estrechas, se utilizan las tasas más rápido de exploración, y para anchos de barrido más amplio, se utilizan velocidades de barrido más lentas. Las siguientes instrucciones paso a través del último caso y muestran cómo llegar a los parámetros del controlador de la bobina experimentales de 7 Tm anchura de barrido y 6,8 kHz frecuencia de exploración.- Determinar el ancho de banda del resonador (BW Res).
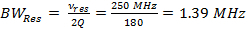 (1)
(1)
donde v res es la frecuencia de funcionamiento del resonador y Q es el factor de calidad. Q = 90, es común para el resonador de exploración rápida utilizado para obtener los datos de resultados representativos. - Determinar la velocidad de exploración rápida, α, todoadeudado por el ancho de banda del resonador
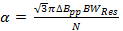 (2)
(2) 
donde N es una constante seleccionada a menudo de forma conservadora a ser 5-6, pp? B es la anchura de línea derivado de pico a pico en mT, y a es la velocidad de barrido si T / s para una anchura de línea de Lorentz.
Nota: Un valor común para los radicales en la sección representativa es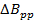 = 0,1 mT. En comparación con la literatura de exploración rápida anterior; La ecuación 2 se deriva mediante el establecimiento de la anchura de banda de la señal (BW sig) igual a BW Res.
= 0,1 mT. En comparación con la literatura de exploración rápida anterior; La ecuación 2 se deriva mediante el establecimiento de la anchura de banda de la señal (BW sig) igual a BW Res. - Determinar la máxima frecuencia de exploración rápida permitida por la velocidad.
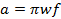 (3)
(3) 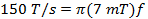
donde w es la anchura de la scan y f es la frecuencia de barrido. Una anchura de barrido de 7 mT cubrirá 100% del espectro para las sondas actuales utilizados in vivo. Utilice este valor y el tipo de cambio calculado (Ecuación 2) para determinar la frecuencia de barrido.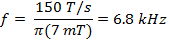
- Determinar el ancho de banda del resonador (BW Res).
- La selección de los condensadores de ajuste y puesta a punto del conductor de la bobina de exploración rápida
Nota: El controlador de la bobina de exploración rápida normalmente se ejecuta en un modo con resonancia generar una onda sinusoidal. La resonancia ocurre a una frecuencia de exploración donde las reactancias inductivas y capacitivas son de magnitud y opuestas signos iguales, de modo que la reactancia total es cercano a cero.- Determinar la capacidad adecuada para la frecuencia determinada en 1.1.3 usando la inductancia, L, de las bobinas de exploración rápidas y (Ecuación 4).

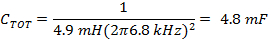
- Divida C TOT a partir de (Ecuación 4) por la mitad para obtener los valores de condensadores para cada lado de la caja del condensador conductor de la bobina.
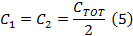
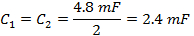
Nota: El conductor de la bobina de exploración rápida tiene dos amplificadores. Al seleccionar un condensador, la caja del condensador tiene que ser equilibrada con una capacitancia igual a cada lado de la caja. Las dos partes están en serie. - Desenroscar la tapa superior de la caja del condensador condensadores e insertar en ambos lados que son iguales al valor determinado en el paso 1.2.2.
- Vuelva a colocar la tapa de la caja del condensador y el tornillo hacia abajo para asegurarse de que permanece encendida.
- Utilizando el panel frontal del controlador de la bobina con resonancia, ajustar la frecuencia de salida hasta que la forma de onda sinusoidal tiene la amplitud máxima.
- Determinar la capacidad adecuada para la frecuencia determinada en 1.1.3 usando la inductancia, L, de las bobinas de exploración rápidas y (Ecuación 4).
2. Preparación de los reactivos y Phantoms
- Preparación de radiCAL
- Retire 15 N-PDT del congelador y deje el recipiente a la temperatura ambiente (10-15 min).
- Pesar 1,4 mg de 15 N-PDT utilizando una balanza analítica.
- Añadir 1,4 mg de 15 N-PDT a 15 (DI) H 2 O ml desionizada, para una concentración final de 0,5 mM.
Nota: 4-oxo-2,2,6,6-tetra (2 H 3) (1- 15 N 3,3,5,5- 2 H 4,) piperdinyloxyl metil-1- (N-15 PDT), 4- 1 H-3-carbamoil-2,2,5,5-tetra (2 H 3) metil-3-pyrrolinyloxyl (15 N-mHCTPO) y 3-carboxi-2,2,5,5-tetra (2 H 3) metil-1- (3,4,4- 2 H 3, 1- 15 N) pirrolidiniloxi (15 N-PROXYL) 25 () radicales Figura 1E-G tienen estabilidad a largo plazo (2 años) en solución acuosa y a temperatura ambiente. Sus formas sólidas se suelen almacenar en un congelador o refrigerador para mantener estos radicales estables durante años.La estabilidad de los radicales nitróxido en general los hacen no tóxico, y su preparación se puede hacer en una mesa de trabajo normal cuando el disolvente es agua. Cuando se utilizan disolventes orgánicos, preparar soluciones nitróxido dentro de una campana de humos, mientras que cuenta con el equipo adecuado de protección personal (EPP).
- Preparación de pH sensible radicales tritilo
- Pesar 0,7 mg de radical metilo triarilo (ATAM 4) 26 radicales (1.400 g / mol) y se disuelven en 200 l de etanol absoluto.
- Pesar 0,00681 g de KH 2 PO 4 (136,1 g / mol) y se disuelven en 50 ml de agua DI para una concentración final de 1 mM.
- Pesar 2,8 g de KOH (56 g / mol) y se disuelven en 50 ml de agua DI para una concentración final de 1 M.
- Añadir KOH gota a gota a la solución tampón de fosfato (2.2.2) para ajustar el pH de 7,0.
- Añadir 800 l de tampón de fosfato 1 mM y los 200 l de ATAM 4 en etanol absoluto para una concentración finalentration de 0,5 mM en tampón de 80:20: etanol.
- Repita los pasos 2.2.1-2.2.5 para crear la muestra 4 ATAM a pH = 7,2.
- Coloque la ATAM 4, pH = 7,0 y 4 ATAM, pH = 7,2 en tubos de muestra de cuarzo separadas 6 mm.
- Coloque los dos tubos de cuarzo EPR 6 mm en un tubo de cuarzo EPR 16 mm, con un espesor de espuma de poliestireno spacer 2 mm en el medio.
Nota: Las paredes del tubo de muestras de cuarzo son de 0,5 mm de grosor, y además de la 2 mm spacer producir una separación de 3 mm entre las muestras ATAM. Los radicales tritilo sensibles al pH utilizados se sintetizaron en la Universidad del Estado de Ohio 26. El ejemplo que se utilizó para la imagen se llama ATAM 4. La reacción que da cuenta de la sensibilidad al pH se muestra en la Figura 1A.
- Generación de BMPO-OH
- Pesar 680 mg de KH 2 PO 4 y disolver en 100 ml de agua DI para una concentración final de 50 mM.
- Añadir 1 M de KOH gota a gotaa la solución tampón de fosfato a pH = 7,3.
- Pesar 50 mg de BMPO (199,25 g / mol).
- Combinar el 50 mg de BMPO con 5 ml de tampón de fosfato en un tubo de cuarzo de irradiación 16 mm.
- Añadir 100 l de peróxido de hidrógeno 300 mM.
- Irradiar la mezcla en el tubo de la irradiación de cuarzo 16 mm con una lámpara de presión media 450 W UV durante 5 min.
- Usando una pipeta de transferencia de vidrio, transferir 2,5 ml de la solución irradiada BMPO-OH fuera del tubo de cuarzo y la irradiación en un lado de un tubo de muestra de cuarzo 16 mm con 3 mm divisor.
- Transferir el restante 2,5 ml de irradiado BMPO-OH en el otro lado del tubo de muestra de cuarzo 16 mm con 3 mm divisor.
- Preparación de dinitroxide radical
- Pesar 24,7 mg de 2 H, dinitroxide 15 N-disulfuro (Figura 1C) en 1 ml de DMSO para una solución madre de 47,5 mM.
- Preparar tampón Tris 10 mM y ajustar el pH a 7,2.
- tomar 40l dinitroxide solución madre y se diluye con tampón Tris a una concentración final de 1 mM.
- Coloque 250 l de solución de dinitroxide en tampón en un tubo de muestra de cuarzo 16 mm con un 10 mm divisor en el centro.
- Pesar 154 mg de glutatión y añadir a 5 ml de tampón Tris para una concentración final de 100 mM.
- Añadir 5 l de la solución de glutatión 100 mM a 250 l de solución de dinitroxide 1 mM en un lado de la 10 mm divisor para convertir el dirradical en monorradical.
- Preparación de nitróxido nitronil
- Retire el radical del congelador y deje el recipiente a la temperatura ambiente (10-15 min).
- Pesar 1,9 mg de nitronil (390 g / mol).
- Pesar 0,56 mg de KOH y se disuelve en 10 ml de agua DI para una concentración final de 1 mM.
- Mezclar el 1,9 mg de nitronil en 10 ml de solución de KOH 1 mM para una concentración final de 0,5 mM nitronil.
Nota: Si necessary, utilice un vórtice o aparato de ultrasonidos para la solvatación velocidad del nitronil.
3. Configuración del Instrumento rápido de escaneado a 250 MHz
Nota: sintonización del resonador con una muestra acuosa de radical nitróxido, que tiene un efecto similar sobre resonador Q y puesta a punto como solución tampón, es una buena manera de configurar para la muestra a ser fotografiado
- Sintonizar el resonador con una muestra acuosa de radicales nitróxido.
- Inserte los 15 ml de 0,5 mM 15 N-PDT en la muestra de agua en un tubo de cuarzo de 16 mm EPR.
- Insertar el tubo de cuarzo en el lado de detección del bucle transversal del resonador RS-EPR.
- Cambiar la frecuencia de la fuente de instrumento hasta que coincida con la frecuencia de la banda de detección que contiene la muestra. cambiar manualmente la frecuencia portadora de la fuente 250 MHz introduciendo el valor deseado en el software.
- Cambiar la frecuencia de la banda de excitación para que coincida con los frequencias de la fuente experimento y el lado de detección del resonador. Cambiar la frecuencia de la banda de excitación girando un condensador variable dentro de la cavidad del resonador de acuerdo con el protocolo del fabricante.
- Configurar Instrumento de consola y imán principal
- Encienda el espectrómetro y elegir un experimento que registra los datos transitorios con el tiempo en las abscisas.
- Dentro del software, establecer el número de puntos a 65.536, y la base de tiempo de 10 ns.
- Establecer el número de promedios de 10.000 para una señal fuerte o estrecho, y 45,000 para una señal ancha o débil.
- Presione el botón "participar" en el software para enviar los parámetros experimentales desde el software de la consola y energizar el principal imán de campo.
- Establecer el campo magnético principal de 9 mt.
- Ajuste la perilla de atenuación de potencia de 50 dB, y encender el amplificador de alta potencia 7 W.
4. EjecuciónExperimento de Rapid Scan
Nota: Las instrucciones específicas relacionadas con el análisis de los fantasmas que contienen BMPO-OH 24, pH radicales TAM sensibles 19,27 y dinitroxides sensibles redox 28 se proporcionan en la literatura.
- Saturación de poder de la muestra estándar nitróxido
Nota: Es conveniente hacer una curva de saturación de la energía en una muestra radical nitróxido estándar en las mismas condiciones experimentales que se utilizarán para mirar a los radicales sensibles al pH o el estado redox.- Encienda el conductor de la bobina de exploración rápida, con los valores de la Sección 1 (frecuencia de exploración de 6,8 kHz y el ancho de barrido de 7 millones de toneladas).
- A partir de 50 dB, recoger un espectro de exploración rápida con 100k promedios. Disminuir la atenuación de 3 dB y repetir la medición. Continuar hasta que un ajuste del atenuador de 0 dB, o durante el tiempo que la medición de aislamiento en la lectura del puente es <0.
- transferencia tque los datos de exploración rápidos en bruto en un programa de deconvolución (por ejemplo escrito en Matlab) y procesar los datos en bruto en el espectro de absorción.
- Introduzca la frecuencia de exploración, anchura de barrido, el número de puntos y base de tiempo en el programa, y ejecutar el programa para procesar la señal de exploración rápida en bruto en una señal de absorción.
- Trazar la amplitud de la señal de absorción como una función de la potencia de raíz cuadrada (en vatios) incidente sobre el resonador. En el régimen no saturante, la amplitud es linealmente dependiente de la raíz cuadrada de la potencia incidente.
- Montar una línea de tendencia a partir de 0,0 e incluir todos los puntos de datos que caen en la región de respuesta lineal. En la región de respuesta lineal, amplitud de la señal incrementos proporcionales a la raíz cuadrada de la potencia de microondas.
- Extrapolar esta tendencia a poderes superiores, y comparar la intensidad de la señal de EPR. Usa el poder más elevado para el cual la amplitud de la señal no se desvía más de un 3% desde la línea de tendencia extrapolada. en order para la deconvolución de la señal de exploración rápida para que funcione correctamente, la señal debe estar todavía en la región de respuesta lineal con respecto a la potencia incidente.
Nota: La transferencia de los datos escaneados rápidos primas puede realizarse a través de una conexión de red oa través de la impulsión del pulgar. En este caso la transmisión es necesaria porque el programa para procesar los datos en bruto (Matlab) no es en el mismo equipo que tiene software de recogida de datos. El algoritmo de deconvolución que procesa los datos en bruto se describe en 29.
Resultados
El producto del experimento es un conjunto de proyecciones que se reconstruyen en imágenes de dos dimensiones (una espectral, uno espacial) con una escala de colores falsa para representar amplitud de la señal. azul profundo indica la línea de base, donde está presente ninguna señal, el verde es baja amplitud y rojo es más alta. Rebanadas lo largo del eje x (dimensión espectral) representan la señal de EPR (transición EPR) en un eje de campo magnético. A lo largo del eje y (dim...
Discusión
señales de rápido-scan tienen componentes de frecuencia más altas que CW, y requieren un ancho de banda de resonador más grande dependiendo de anchuras de línea, tiempos de relajación, y la velocidad de los rápidos-scan. El ancho de banda necesario para un experimento dado se basa en la anchura de línea y la velocidad de barrido del campo magnético (Ecuación 2). En función de los tiempos de relajación de la sonda en estudio (T 2 y T 2 *), y la velocidad de barrido, las oscilaciones pued...
Divulgaciones
We have nothing to disclose.
Agradecimientos
Apoyo parcial de esta obra por el NIH subvenciones NIBIB EB002807 y CA177744 (GRE y SSE) y EB002034 P41 a GRE, Howard J. Halpern, PI, y por la Universidad de Denver se agradece. Marcos Tseytlin fue apoyado por el NIH R21 EB022775, NIH K25 EB016040, NIH / NIGMS U54GM104942. Los autores agradecen a Valery Khramtsov, ahora en la Universidad de Virginia Occidental, y Illirian Dhimitruka en la Universidad Estatal de Ohio para la síntesis de los pH radicales TAM sensibles, y para Gerald Rosen y Joseph Kao en la Universidad de Maryland para la síntesis de la mHCTPO , PROXYL, BMPO y radicales nitronil.
Materiales
| Name | Company | Catalog Number | Comments |
| 4-oxo-2,2,6,6-tetra(2H3)methyl-1-(3,3,5,5-2H4,1-15N)piperdinyloxyl (15N-PDT) | CDN Isotopes | M-2327 | 98% atom 15N, 98 % atom D, Quebec Canada |
| 4-1H-3-carbamoyl-2,2,5,5-tetra(2H3)methyl-3-pyrrolinyloxyl (15N-mHCTPO) | N/A | N/A | Synthesized at U. Maryland and described in Reference 29 |
| 3-carboxy-2,2,5,5-tetra(2H3)methyl-1-(3,4,4-2H3,1-15N)pyrrolidinyloxyl (15N-Proxyl) | N/A | N/A | Synthesized at U. Maryland and described in Reference 25 |
| 4 mm Quartz EPR Tubes | Wilmad Glass | 707-SQ-100M | |
| 4-oxo-2,2,6,6-tetra(2H3)methyl-1-(3,3,5,5-2H4)piperdinyloxyl (14N-PDT) | CDN Isotopes | D-2328 | 98% atom D, Quebec Canada |
| pH sensitive trityl radical (aTAM4) | Ohio State University | N/A | Synthesized at Ohio State University and described in Reference 26 |
| Potassum Phosphate, Monobasic | J.T. Baker Chemicals | 1-3246 | |
| 6 mm Quartz EPR Tubes | Wilmad Glass | Q-5M-6M-0-250/RB | |
| 8 mm Quartz EPR Tubes | Wilmad Glass | Q-7M-8M-0-250/RB | |
| 5-tert-butoxycarbonyl-5-methyl-1-pyrroline-N-oxide (BMPO) | N/A | N/A | Synthesized at U. Maryland and described in Reference 30 |
| Hydrogen Peroxide | Sigma Aldrich | H1009 SIGMA | 30% |
| 16 mm Quartz EPR tube | Wilmad Glass | 16-7PP-11QTZ | |
| Medium Pressure 450 W UV lamp | Hanovia | 679-A36 | Fairfield, NJ |
| L-Glutathione, reduced | Sigma Aldrich | G470-5 | |
| Nitronyl | NA | N/A | Synthesized at U. Maryland and described in Reference 31 |
| Sodium Hydroxide | J.T. Baker Chemicals | 1-3146 |
Referencias
- Bobko, A. A., et al. In vivo monitoring of pH, redox status, and glutathione using L-band EPR for assessment of therapeutic effectiveness in solid tumors. Magn. Reson. Med. 67 (6), 1827-1836 (2012).
- Utsumi, H., et al. Simultaneous molecular imaging of redox reactions monitored by overhauser-enhanced MRI with 14N-and 15N-labeled nitroxyl radicals. Proc. Nat. Acad. Sci. U.S.A. 103 (5), 1463-1468 (2006).
- Khramtsov, V. V., Grigor'ev, I. A., Foster, M. A., Lurie, D. J., Nicholson, I. Biological applications of spin pH probes. Cell. Mol. Bio. 46 (8), 1361-1374 (2000).
- Halpern, H. J., et al. Oxymetry Deep in Tissues with Low-Frequency Electron-Paramagnetic Resonance. Proc. Nat. Acad. Sci. U.S.A. 91 (26), 13047-13051 (1994).
- Matsumoto, S., et al. Low-field paramagnetic resonance imaging of tumor oxygenation and glycolytic activity in mice. J. Clin. Invest. 118 (5), 1965-1973 (2008).
- Velan, S. S., Spencer, R. G. S., Zweier, J. L., Kuppusamy, P. Electron paramagnetic resonance oxygen mapping (EPROM): Direct visualization of oxygen concentration in tissue. Magn. Reson. Med. 43 (6), 804-809 (2000).
- Elas, M., et al. Electron paramagnetic resonance oxygen image hypoxic fraction plus radiation dose strongly correlates with tumor cure in FSA fibrosarcomas. Int. J. Radiat. Oncol. 71 (2), 542-549 (2008).
- Dreher, M. R., et al. Nitroxide conjugate of a thermally responsive elastin-like polypeptide for noninvasive thermometry. Med. Phys. 31 (10), 2755-2762 (2004).
- Gallez, B., Mader, K., Swartz, H. M. Noninvasive measurement of the pH inside the gut by using pH-sensitive nitroxides. An in vivo EPR study. Magn. Reson. Med. 36 (5), 694-697 (1996).
- Halpern, H. J., et al. Diminished aqueous microviscosity of tumors in murine models measured with in vivo radiofrequency electron paramagnetic resonance. Cancer Res. 59 (22), 5836-5841 (1999).
- Elas, M., Ichikawa, K., Halpern, H. J. Oxidative Stress Imaging in Live Animals with Techniques Based on Electron Paramagnetic Resonance. Radiat. Res. 177 (4), 514-523 (2012).
- Kuppusamy, P., et al. Noninvasive imaging of tumor redox status and its modification by tissue glutathione levels. Cancer Res. 62 (1), 307-312 (2002).
- Khramtsov, V. V., Yelinova, V. I., Glazachev, Y. I., Reznikov, V. A., Zimmer, G. Quantitative determination and reversible modification of thiols using imidazolidine biradical disulfide label. J. Biochem. Biophys. Methods. 35 (2), 115-128 (1997).
- Plonka, P. M. Electron paramagnetic resonance as a unique tool or skin and hair research. Exp. Dermatol. 18, 472-484 (2009).
- Halevy, R., Shtirberg, L., Shklyar, M., Blank, A. Electron Spin Resonance Micro-Imaging of Live Species for Oxygen Mapping. J. Vis. Exp. (42), e122 (2010).
- Halevy, R., Tormyshev, V., Blank, A. Microimaging of oxygen concentration near live photosynthetic cells by electron spin resonance. Biophys J. 99 (3), 971-978 (2010).
- Eaton, G. R., Eaton, S. S. . Concepts Magn. Reson. 7, 49-67 (1995).
- Maltempo, M. M. Differentiaon of spectral and spatial components in EPR imaging using 2-D image reconstruction algorithms. J. Magn. Reson. 69, 156-161 (1986).
- Tseitlin, M., et al. New spectral-spatial imaging algorithm for full EPR spectra of multiline nitroxides and pH sensitive trityl radicals. J. Magn. Reson. 245, 150-155 (2014).
- Mitchell, D. G., Radu, N., Koch, S., et al. . Abstracts of Papers of the American Chemical Society. 242, (2011).
- Stoner, J. W., et al. Direct-detected rapid-scan EPR at 250 MHz. J. Magn. Reson. 170 (1), 127-135 (2004).
- Tseytlin, M., Biller, J. R., Mitchell, D. G., Yu, Z., Quine, R. W., Rinard, G. A., Eaton, S. S., Eaton, G. R. . EPR Newsletter. 23, 8-9 (2014).
- Biller, J. R., et al. Imaging of nitroxides at 250 MHz using rapid-scan electron paramagnetic resonance. J. Magn. Reson. 242, 162-168 (2014).
- Biller, J. R., et al. Improved Sensitivity for Imaging Spin Trapped Hydroxyl Radical at 250 MHz. Chem. Phys. Chem. 16 (3), 528-531 (2015).
- Burks, S. R., Bakhshai, M. A., Makowsky, M. A., Muralidharan, S., Tsai, P., Rosen, G. M., Kao, J. Y. 2H, 15N-Substituted nitroxides as sensitive probes for electron paramagnetic resonance imaging. J. Org. Chem. 75, 6463-6467 (2010).
- Dhimitruka, I., Bobko, A. A., Hadad, C. M., Zweier, J. L., Khramtsov, V. V. Synthesis and characterization of amino derivatives of persistent trityl radicals as dual function pH and oxygen paramagnetic probes. J. Am. Chem. Soc. 130 (32), 10780-10787 (2008).
- Elajaili, H. B., et al. Electron spin relaxation times and rapid scan EPR imaging of pH-sensitive amino-substituted trityl radicals. Magn. Reson. Chem. 53 (4), 280-284 (2015).
- Elajaili, H., Biller, J. R., Rosen, G. M., Kao, J. P. Y., Tseytlin, M., Buchanan, L. B., Rinard, G. A., Quine, R. W., McPeak, J., Shi, Y., Eaton, S. S., Eaton, G. R. Imaging Disulfides at 250 MHz to Monitor Redox. J. Magn. Reson. , (2015).
- Tseitlin, M., Rinard, G. A., Quine, R. W., Eaton, S. S., Eaton, G. R. Deconvolution of sinusoidal rapid EPR scans. J. Magn. Reson. 208 (2), 279-283 (2011).
- Halpern, H. J., Peric, M., Nguyen, T. D., Spencer, D. P., Teicher, B. A., Lin, Y. J., Bowman, M. K. Selective isotopic labeling of a nitroxide spin label to enhance sensitivity for T2 oxymetry. J. Magn. Reson. 90, 40-51 (1990).
- Tsai, P., et al. Esters of 5-carboxyl-5-methyl-1-pyrroline N-oxide: A family of spin traps for superoxide. J. Org. Chem. 68 (20), 7811-7817 (2003).
- Biller, J. R., et al. Frequency dependence of electron spin relaxation times in aqueous solution for a nitronyl nitroxide radical and perdeuterated-tempone between 250 MHz and 34 GHz. J. Magn. Reson. 225, 52-57 (2012).
- Rosen, G. M., et al. Dendrimeric-containing nitronyl nitroxides as spin traps for nitric oxide: Ssynthesis, kinetic, and stability studies. Macromolecules. 36 (4), 1021-1027 (2003).
- Bobko, A. A., et al. Redox-sensitive mechanism of no scavenging by nitronyl nitroxides. Free Radical Biol. Med. 36 (2), 248-258 (2004).
- Roshchupkina, G. I., et al. In vivo EPR measurement of glutathione in tumor-bearing mice using improved disulfide biradical. Free Radical Bio. Med. 45 (3), 312-320 (2008).
- Mitchell, D. G., et al. Use of Rapid-Scan EPR to Improve Detection Sensitivity for Spin-Trapped Radicals. Biophysical Journal. 105 (2), 338-342 (2013).
- Bobko, A. A., Dhimitruka, I., Zweier, J. L., Khramtsov, V. V. Trityl radicals as persistent dual function pH and oxygen probes for in vivo electron paramagnetic resonance spectroscopy and imaging: Concept and experiment. J. Am. Chem. Soc. 129 (23), (2007).
- Biller, J. R., et al. Electron spin-lattice relaxation mechanisms of rapidly-tumbling nitroxide radicals. J. Magn. Reson. 236, 47-56 (2013).
- Redler, G., Barth, E. D., Bauer, K. S., Kao, J. P. Y., Rosen, G. M., Halpern, H. J. In vivo electron paramagnetic resonance imaging of differential tumor targeting using cis-3,4-di(acetoxymethoxycarbonyl)-2,2,5,5-tetramethyl-1-pyrrolidinyloxyl. Magn. Reson. Med. 71 (4), 1650-1656 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados