Method Article
脳血管内皮細胞での生体エネルギー機能の評価
要約
内皮細胞のミトコンドリアは、血液脳関門の完全性を維持するために重要です。私たちは、脳血管内皮細胞に生体エネルギー機能を測定するためのプロトコルを紹介します。
要約
血液脳関門(BBB)の完全性は、脳損傷を防ぐために重要です。脳血管内皮(CVE)細胞がBBBを構成する細胞の種類の一つです。これらの細胞は、最適なミトコンドリア機能を必要とする非常に高いエネルギー需要を有します。疾患または損傷の場合には、これらの細胞におけるミトコンドリア機能は、疾患またはBBBの開口部に生じる、変更することができます。本稿では、我々は全体の、無傷の細胞およびバイオアナライザーを使用して、CVE細胞内のミトコンドリア機能を測定する方法をご紹介します。ミトストレスアッセイは、物理的または化学的に、摂動された細胞をチャレンジし、それらの生体エネルギー機能を評価するために使用されます。さらに、この方法はまた、ミトコンドリア機能に直接影響を持っている新しい治療薬をスクリーニングする便利な方法を提供します。我々は、ミトコンドリアパラ様々な計算を可能にする酸素消費速度を得るために必要な細胞密度を最適化しましたATP産生、最大呼吸、および余力を含めメートル、。また、マイクロRNA、のmiR-34aの導入は、ミトコンドリア活性の顕著なおよび検出可能な減少をもたらすことを実証することによって、アッセイの感度を示しています。本論文で示したデータはのbEnd。3細胞株のために最適化されているが、我々はまた、前臨床および臨床モデルでの有用性を示唆し、一次CVE細胞のためのプロトコルを最適化しました。
概要
広く、脳血管内皮(CVE)細胞によって形成され、血液脳関門(BBB)は、血管生物学の最も重要非常に異なるユニークな機能を有することが認識されます。これらの内皮細胞は、化学エネルギー源としてアデノシン三リン酸(ATP)の細胞供給の大部分を生成するために、ミトコンドリアを使用しています。 CVE細胞についてATPを提供することに加えて、ミトコンドリア1-4シグナリングセルラなどの血管内皮細胞における種々の細胞プロセス、アポトーシス5、および細胞周期の制御、細胞増殖6。CVE細胞におけるミトコンドリアの生体エネルギー機能の調節不全を調節します損なわれた血管内皮の活動につながる、ミトコンドリア生合成に影響を与え、脳血管疾患および神経変性疾患、 例えば 、脳卒中7,8およびアルツハイマー病(AD)9を悪化させる可能性があります 。私たちは、CVE細胞への傷害がlipopolysacへの暴露を、以下のことが実証されています糖類(LPS)は、ストロークが7成果CVE細胞中のミトコンドリア機能を損なうと悪化します。 t-ブチルヒドロキノン(TBHQ)はCVEセル10における酸化的リン酸化を妨害することによって、脳卒中死亡率を増加させます。したがって、CVE細胞だけでなく、パイロットの中枢神経系のメカニズムに関連した一連の研究(CNS)疾患における生体エネルギー機能の定量的なモデルは、だけでなく、血管生物学にミトコンドリアの機能を標的と治療薬の薬剤スクリーニングにおける画期的な製品を提供します。
単離されたミトコンドリアは、生体エネルギー関数を測定するために使用されてきました。私たちは7、その他11は、細胞外フラックスバイオアナライザーを使用して、無傷のCVE細胞における細胞生体エネルギーの評価を報告しています。アナライザは、内因性細胞生体エネルギー評価の利点を提供します。この感受性と一致するアッセイは、CVE細胞のミトコンドリア代謝を測定し、STIによって生体エネルギー障害を評価するために使用することができますMULIは、CVE細胞内のミトコンドリアの機能に影響を与えるミトコンドリアのシグナル伝達経路のメカニズム、および画面の薬や治療法を調査します。このプロトコルでは、ロテノン、及びアンチマイシンAのオリゴマイシン、カルボニルシアニド-4-(トリフルオロメトキシ)フェニルヒドラゾン(FCCP):酸素消費速度(OCRは)は、4つのミトコンドリア攪乱の使用を組み合わせることにより、薬理学的プロファイリングのアプローチを用いてバイオアナライザーによって記録されます我々は、詳細単一のアッセイで、測定および基底ミトコンドリア呼吸、ATP産生、プロトンリーク、最大呼吸、および予備呼吸容量を含むCVE細胞におけるミトコンドリア機能パラメータの計算を可能に最適化されたアプローチを。
プロトコル
注:プロトコルのスキームは、手続きのタイムラインを含め、 図1に示されています。
CVE細胞の1文化とパッセージ
- 完全増殖培地中で培養CVE細胞(のbEnd。3細胞)(高グルコースのダルベッコ改変イーグル培地、DMEM)は、T75のcm 2の組織培養フラスコ中、10%ウシ胎児血清(FBS)および1%ペニシリン/ストレプトマイシンを補充しました。 5%CO 2インキュベーター内で37℃で成長します。
- 取り外して、細胞培養培地を廃棄します。 0.25%トリプシン、0.03%EDTA溶液で細胞層を洗浄し、次いで1加算 - フラスコにトリプシンEDTA溶液2mLを3 37℃でフラスコを保つ - 5分。細胞層が分離されるまで、倒立顕微鏡下で細胞を観察します。完全増殖培地の10 mLを加え、穏やかにピペッティングすることにより細胞を吸引します。
- 細胞破片を除去するために、5分間、700×gで15 mLの遠心管とスピンに流体および細胞をデカントします。
- 遠心管からの上清を捨てます。完全増殖培地の10 mLを加え、細胞ペレットを再懸濁します。 5分間、700×gで細胞をスピン。
- 遠心管からの上清を捨てます。再懸濁(血球計を用いて計数することによって決定さ、トリパンブルー染色によって死細胞を除外)2.0×10 5細胞/ mlの濃度で完全増殖培地中で細胞ペレットを。
注:たて解凍した細胞は、実験のために少なくとも3継代のためのサブ培養されます。
細胞培養プレート上の細胞を2シードとトリート
- 96ウェルの細胞外フラックス細胞培養プレート上の種子細胞:80μL/ウェル。 5%CO 2インキュベーター中37℃で細胞培養プレートを置きます。注:ウェル当たり16×10 3細胞が60に到達します- 24時間以内に80%の密集度に。
- 細胞が化学物質にさらされている場合は、細胞がプレートの底に付着された後、治療を追加(8から24時間後の参照します鼎)。
注:トランスフェクション実験のために、完全増殖培地に抗生物質を追加しないでください。
バイオアナライザを使用したミトコンドリア機能の3.評価
- アッセイの開始に先立ち、プレートに細胞外フラックス較正溶液150μLを添加し、CO 2なしで37℃でO / Nをインキュベートすることによって較正を有する細胞外フラックスセンサカートリッジを水和。
- プレート洗浄ステーションを使用して、pH7.0の細胞外フラックスアッセイ培地中に、細胞培養培地を変えます。 60分- 30のためのCO 2なしで37℃で細胞をインキュベートします。
- 8μMのオリゴマイシン、4.5μMFCCP、10μMのロテノン、およびDMEM中で10μMのアンチマイシンAの作業溶液を調製します。カートリッジの注入口に原液の負荷25μL:ポートA、オリゴマイシン;ポートB、FCCP。ポートC、細胞外フラックスアッセイ培地とロテノンとアンチマイシンA。 表1に記載したように、アッセイプロトコルを実装。
- バイオアナライザに水和カートリッジをロードし、「スタート」ボタンをクリックしてキャリブレーションを行います。キャリブレーションが完了した後、カートリッジ底板を取り外し、「アンロードカートリッジ」プロンプトをクリックして、セルプレートをロードします。すべての測定が終了するまで試験を続けます。
- データファイルを開いて、バイオアナライザーからのレート値を取得します。スプレッドシートファイルにデータをエクスポートします。
4.データ解析
注:データ解析のための計算は、以下の処方されます。 OCRは、 図2に示すような値は、バイオアナライザー機器から得られます。
- 基底値から(測定3) - 基礎呼吸を計算するために、非ミトコンドリア呼吸(12測定10)を引きます。
注:基礎呼吸=基礎 - 非ミトコンドリア呼吸=レート③ - レート⑩〜⑫。 - ATP productiを計算するには基底値から(測定3) -で、ATP-リンク呼吸(6測定4)を引きます。
注:ATP産生=基礎 - ATP結合型呼吸=レート③ - レート④〜⑥。 - 最大呼吸から(測定7から9) - 最大呼吸を計算するために、非ミトコンドリア呼吸(12測定10)を引きます。
注:最大呼吸=最大呼吸 - 非ミトコンドリア呼吸=レート⑦〜⑨ - レート⑩〜⑫。 - スペア容量を計算するには 、最大呼吸から基底値(測定3)( - 9測定7)を引きます。
注:予備能力=最大呼吸 - 基礎=レート⑦〜⑨ - レート③。 - ATP-リンク呼吸(測定4)から- プロトンリークを計算するために、非ミトコンドリア呼吸(12計測10)を引きます。
注:プロトンリーク= ATP結合型呼吸 - 非ミトコンドリアリットルの呼吸=レート④ - レート⑩〜⑫。
結果
酸化ストレスに応答して、CVE細胞の生体エネルギー機能を評価するために、我々は、原発性脳腫瘍の微小血管内皮細胞12と同じ比較バリア特性が表示され、マウスの脳微小血管内皮細胞株のbEnd。3を選択しました。応答の動態および相対強度は、種々の細胞型の間で変化させることは、最初の一連の実験を示す、代謝プロファイリングするためのアッセイで使用するのbEnd。3細胞の最適な数を特定することによって測定OCRレベルを得るように設計された、指定されました評価に続いて、図2は 、データを図3に定量化し、提示されている。基礎呼吸、最大呼吸、および予備の呼吸容量は細胞密度と比例応答を示しました。しかし、ATP産生が過剰コンフルエント細胞培養があることを示唆し、ウェル当たり64×10 3細胞を選択したときに減少しましたこの実験には適していません。ミトコンドリア攪乱に対する応答に基づいて、ウェル当たり32×10 3細胞、 -最適な細胞密度は8の間に発生します。
その後の実験のために、ウェル当たり16×10 3細胞の播種密度は、OCRの変化の最適な検出を可能にするために使用されました。ウェル当たり16×10 3細胞を使用して、我々は、OCRで予想される応答を観察し、マイクロRNAのmiR-34aはCVE細胞( 図4)にミトコンドリアの機能を低下させることを実証しました。我々は以前のmiR-34aが、これらのセル13において酸化的リン酸化を減少させたことを報告しています。繰り返し実験はまた、最大の呼吸や予備容量を大幅に有意な変化を持っていなくても、基礎呼吸、ATP産生、およびプロトンリークかかわらず、トランスフェクションの24時間後でのCVEにおけるmiR-34aの過剰発現により減少したことを示した( 図4) 。これらのデータCVEにおけるミトコンドリア機能の変化を検出するバイオアナライザーの感度を示します。
実験図1.戦略計画。セル、プレート、およびカートリッジの準備のためのタイムラインは示されている。 この図の拡大版をご覧になるにはこちらをクリックしてください。
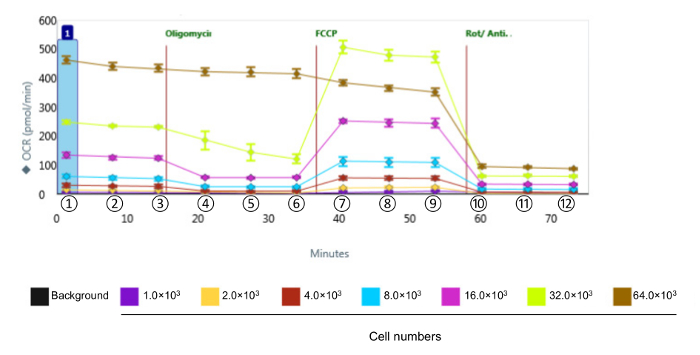
種々の細胞密度でCVE細胞における図形生体エネルギー関数の2代表的な生データを酸素消費速度は、異なる細胞密度でCVE細胞で測定しました。データは、平均±SDを表す(N = 5)。 OCR:酸素消費速度; FCCP:シアン化カルボニル-4-(トリフルオロメトキシ)フェニルヒドラゾン;腐/アンチA:ロテノンとアンチマイシンAに①、②、③と基礎呼吸を示しています。 ④、⑤、⑥とATPが呼吸をリンクされている示しています。 ⑦、⑧、および⑨最大呼吸を示しています。 ⑩、⑪、および⑫非ミトコンドリア呼吸を示している。 この図の拡大版をご覧になるにはこちらをクリックしてください。
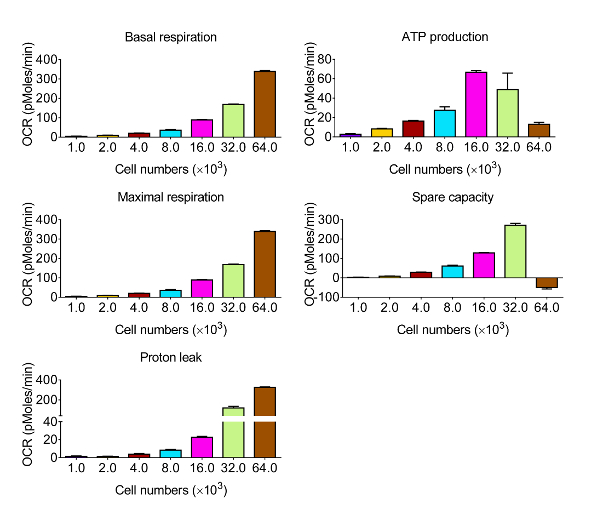
様々な細胞密度を持つCVE細胞における生体エネルギー機能図3.代表的な結果。基礎呼吸、ATP産生、最大の呼吸、及び予備容量が第4節に示されている式を用いて、図2に生体エネルギー機能アッセイによって生成された生データから計算されています。データは平均±SD(n = 5)を表します。 OCR:酸素消費速度。 F = "http://ecsource.jove.com/files/ftp_upload/54847/54847fig3large.jpg"ターゲット= "_空白">この図の拡大版をご覧になるにはこちらをクリックしてください。
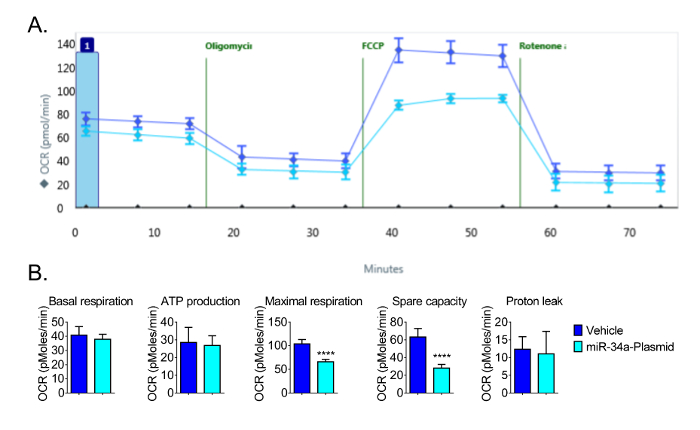
図4:のmiR-34aの減少生体エネルギー機能の代表的な結果 (A)の24時間後、トランスフェクションでのmiR-34aの過剰発現は、以下のミトコンドリア機能の生データ。 (B)基礎呼吸、ATP生産、最大呼吸、及び空き容量を図4Aの生体エネルギー機能アッセイによって生成された生データから計算されます。パラメータは、のmiR-34aの第4節過剰発現に示した式で計算される24時間トランスフェクション後にCVE細胞でミトコンドリアの機能を低下させます。データは、平均±SDを表す(N = 5)。 OCR:酸素消費速度。 ****、P <0.0001。ファイル/ ftp_upload / 54847 / 54847fig4large.jpg "ターゲット=" _空白 ">この図の拡大版をご覧になるにはこちらをクリックしてください。

表1.インストゥルメントを実行しますプロトコル。
ディスカッション
このプロトコルは、脳血管内皮細胞に生体エネルギーの表現型を評価するための方法を表しています。これは、内皮細胞ミトコンドリアの評価のための基本的なアッセイとして働き、それはCVE細胞におけるミトコンドリアシグナル伝達経路に影響を与えることができる刺激のメカニズムを研究するために設計された実験のために最適です。それはまた、BBB-破壊関連疾患のための潜在的治療薬を試験するための方法を提供します。
プロトコル内の重要なステップ
細胞外フラックスbioanalyzersはリアルタイムにOCRを測定する能力を持っています。このアッセイでは、適切な細胞密度を特定することが重要です。細胞密度はウェル当たり8×10 3細胞未満であると、基底OCR( 図2及び図3)分析されるには低すぎます。細胞密度はウェル当たり32×10 3個の細胞を超えている場合、細胞は、オリゴマイシンに応答又はFCCPの下水処理しませんNTS( 図2及び図3)。我々の実験モデルでは、この細胞株に対する最適な細胞密度は7と治療法10,14を刺激するために複製可能な結果と感度を示しているだけでなく、あたり16×10 3細胞です。 24ウェルバイオアナライザーを使用する場合は、細胞密度の新しい滴定アッセイのために必要とされるであろう。
CVEは、他の内皮細胞または組織型15,16に比べて、ミトコンドリアの大容量を有することには大きなエネルギー生産と生体エネルギー代謝を測定するための少数の細胞の必要性を示唆し、文書化されています。当社は、プライマリとして脳内皮細胞のいくつかのタイプを、テストし、7マウス脳血管内皮細胞を不死化し、人間の脳血管内皮細胞(未発表データ)を不死化しています。 160ピコモル/分 - これらの細胞は、40内の許容可能なOCR(基礎呼吸OCRに到達するために同様の細胞密度を必要と96ウェルプレート、50 - 24ウェルプレート、400ピコモル/分)生体エネルギー分析を行いました。 Kaczara らは、より高い細胞密度17を使用したヒト臍帯静脈内皮細胞(HUVEC)において、生体エネルギー代謝を測定することを報告しました。
当社グループは、他の組織または器官からの血管細胞を評価しませんでした。理論的には、バイオアナライザーは、潜在的に任意の細胞型に使用することができるが、それは(いくつかの特定の細胞がよく成長するコーティングされたプレートを必要とするかもしれない)、細胞密度、細胞培養培地、および培養条件についてのアッセイの最適化が必要です。なお、実験は、OCRの速度が許容範囲内であることを確認するために完了していることが要求されます。他の臓器の内皮細胞におけるOCRは、細胞密度を増加させる、脳からのCVEよりも低い場合に許容可能なOCRの範囲内で取得することができます。細胞はエネルギーの彼らの主な情報源として酸化的リン酸化を使用していない場合あるいは、バイオアナライザーは最適解ではないでしょうLアッセイ。
バイオアナライザーは、試薬が適用される順序に基づいて、電子伝達鎖の連続的破壊を可能にします。まず、オリゴマイシンは、ミトコンドリア複合体V(ATP合成酵素)を阻害する、適用されます。第二に、FCCP、電子脱共役剤は、プロトン勾配の破壊につながる、適用されます。最後に、ミトコンドリア複合体IおよびIIIを阻害ロテノン及びアンチマイシンAは、それぞれ、電子流の合計阻害をもたらすために適用されます。薬物が特定の電子伝達連鎖反応を遮断、逐次変化はミトコンドリアの機能を反映するように測定することができるので、薬物曝露の順序は必須です。
修正およびトラブルシューティング
CVE細胞における刺激に対するミトコンドリアの応答を評価するために、細胞を細胞培養プレートの底に付着させた後の刺激を細胞に適用されることをお勧めします(タイムラインを参照してください。図1に示されています。それは、通常、少なくとも6時間)を要します。処理により複製可能な結果を得るためには、一貫性のある細胞密度を維持するために極めて重要です。前処理は、細胞播種の前に設計されている場合、それぞれの前処理のための細胞密度は、慎重に播種するための死細胞を除外し、測定されるべきです。トランスフェクションは、実験計画に含まれている場合は、製造元のトランスフェクションプロトコールを参照してください。 図4に示されるデータで実証、のmiR-34Aは、miR-34aの過剰発現と代謝機能の変化を評価するために、抗生物質を含まない細胞培養培地およびミトストレステストを必要とリポフェクタミンのトランスフェクションキットを使用して、CVE細胞にトランスフェクトしました。プラスミドの用量はまた、以前に公表13のように、最適化することができます。プロトコルに対して行うことができるもう一つの変化は、試薬の濃度を変えています。オリゴマイシン、FCCP、および/またはロテノンとアンチマイシンAの滴定曲線はcompleすることができますテッド。
このアッセイは、ハイスループットの様々な薬剤の分析のために使用されている場合に加えて、我々の以前の刊行物7,13に記載された細胞生存率および細胞増殖を測定するための平行分析を含むことが示唆されています。 OCR値は有意に細胞数( 図2及び3)の影響を受け、そして細胞増殖および生存率アッセイは、データの標準化の利益しています。しかし、これらのアッセイの完了は、個々の研究室の裁量です。
テクニックの制限事項
このプロトコルの主な制限は、我々は唯一の研究ではin vitro細胞培養モデルを使用したことです。現在、内皮細胞のミトコンドリア機能に対処することができる利用可能なエクスビボモデルまたは動物モデルは存在しません。新しいモデルは、インビボで生体エネルギー機能の評価のために開発されることが期待されていると ex vivoでの今後の研究インチ
別の制限は、生体エネルギー対策以下のバリア性評価を拡張したものです。まず、生体エネルギーの測定が完了した後、細胞生存率は、電子伝達鎖の完全な破壊後減少する、ための実験を行うことができません。第二に、特定の細胞培養プレートおよびインサートは生体エネルギー値を検出するために必要なバリア性評価のための挿入に適合しません。したがって、生体エネルギーのアッセイ後に完了することができ、多くの機能アッセイは存在しません。しかしながら、特殊な装置が生体エネルギーアッセイの前に、機能的アッセイを行うために開発されることが期待されます。
既存の/代替方法に関して技術の意義
ミトコンドリアの機能を評価するための従来の技術は、セル18からミトコンドリアの単離を必要としました。このNEバイオアナライザーを使用してワット技術は、単離されたミトコンドリアを評価するよりも細胞環境のより多くを保持する無傷の細胞におけるミトコンドリア活性の測定を可能にします。
このテクニックをマスターした後、将来のアプリケーションや行き方
このプロトコルは、設計とのbEnd。3セルライン用に開発されたが、それはまた、主要な脳血管内皮(pCVE)セル7または他の内皮と互換性があり、我々はpCVEセル7を使用して、我々の以前の出版物でこれを実証しているされています。内皮細胞の他のタイプが使用される場合、培養プレートのコーティングおよび成長因子の使用が必要とされ得ます。ただし、滴定アッセイは、同様に他の細胞型のために推奨されます。このプロトコルは、CVE細胞の生体エネルギーの評価に採用される一般的な方法を提供し、それはさらに、このようにメカニズムの研究や治療応答に適用することができます。
開示事項
The authors declare no potential conflicts of interest with respect to the research, authorship, and/or publication of this article. Open Access fees for this article were provided by Agilent Technologies.
謝辞
This work was supported by the following grants: AHA 16SDG31170008 to X.R. and NIH P20 GM109098, P01 AG027956, and U54 GM104942 to J.W.S.
資料
| Name | Company | Catalog Number | Comments |
| bEnd.3 cell line | ATCC | CRL-2299 | 25 - 30 passages |
| Dulbecco's Modified Eagle's Medium (DMEM) | ATCC | 30-2002 | |
| Fetal Bovine Serum | Atlanta Biologicals | S12450 | 10% final concentration |
| Penicillin/Steptomycin | Hyclone | SV30010 | 1×100 stocking |
| 0.25% trypsin, 0.03% EDTA solution | Corning | 25-053-CI | |
| Sodium pyruvate | Corning | 25-000-CI | 1.0 µM final concentration |
| Glucose | Sigma | CAS 50-99-7 | 25 mM final concentration |
| Oligomycin | Sigma | O4876 | 1.0 µM final concentration |
| Carbonilcyanide 4-(trifluoromethoxy) phenylhydrazone (FCCP) | Sigma | C2920 | 0.5 µM final concentration |
| Rotenone | Sigma | R8875 | 1.0 µM final concentration |
| Antimycin A | Sigma | CAS 1397-94-0 | 1.0 µM final concentration |
| Plate wash station | Seahorse Bioscience | ||
| Extracellular flux bioanayzer | Seahorse Bioscience | XFe96 | |
| Extracellular flux cell culture plate | Seahorse Bioscience | 102416-100 | |
| Extracellular flux sensor cartridge | Seahorse Bioscience | 102416-100 | |
| Extracellular flux calibrant solution | Seahorse Bioscience | 100840-000 | |
| Extracellular flux assay medium | Seahorse Bioscience | 102365-100 | PH buffered prior to assay |
参考文献
- Quintero, M., Colombo, S. L., Godfrey, A., Moncada, S. Mitochondria as signaling organelles in the vascular endothelium. Proc Natl Acad Sci U S A. 103, 5379-5384 (2006).
- Liu, Y., Li, H., Bubolz, A. H., Zhang, D. X., Gutterman, D. D. Endothelial cytoskeletal elements are critical for flow-mediated dilation in human coronary arterioles. Med Biol Eng Comput. 46, 469-478 (2008).
- Al-Mehdi, A. B., et al. Perinuclear mitochondrial clustering creates an oxidant-rich nuclear domain required for hypoxia-induced transcription. Sci Signal. 5, ra47 (2012).
- Mironov, S. L., Ivannikov, M. V., Johansson, M. [Ca2+]i signaling between mitochondria and endoplasmic reticulum in neurons is regulated by microtubules. From mitochondrial permeability transition pore to Ca2+-induced Ca2+ release. J Biol Chem. 280, 715-721 (2005).
- Sutendra, G., et al. The role of Nogo and the mitochondria-endoplasmic reticulum unit in pulmonary hypertension. Sci Transl Med. 3, 88ra55 (2011).
- Mitra, K., Wunder, C., Roysam, B., Lin, G., Lippincott-Schwartz, J. A hyperfused mitochondrial state achieved at G1-S regulates cyclin E buildup and entry into S phase. Proc Natl Acad Sci U S A. 106, 11960-11965 (2009).
- Doll, D. N., et al. Mitochondrial crisis in cerebrovascular endothelial cells opens the blood-brain barrier. Stroke. 46, 1681-1689 (2015).
- Ren, X., Simpkins, J. W. Deciphering the Blood-Brain Barrier Damage in Stroke: Mitochondrial Mechanism. J Neuroinfect Dis. S2, e002 (2015).
- Pun, P. B., Lu, J., Moochhala, S. Involvement of ROS in BBB dysfunction. Free Radic Res. 43, 348-364 (2009).
- Sun, J., Hu, H., Ren, X., Simpkins, J. W. Tert-butylhydroquinone compromises survival in murine experimental stroke. Neurotoxicol Teratol. 54, 15-21 (2016).
- Modis, K., et al. Cellular bioenergetics is regulated by PARP1 under resting conditions and during oxidative stress. Biochem Pharmacol. 83, 633-643 (2012).
- Brown, R. C., Morris, A. P., O'Neil, R. G. Tight junction protein expression and barrier properties of immortalized mouse brain microvessel endothelial cells. Brain Res. 1130, 17-30 (2007).
- Bukeirat, M., et al. MiR-34a regulates blood-brain barrier permeability and mitochondrial function by targeting cytochrome c. J Cereb Blood Flow Metab. 36, 387-392 (2016).
- Hu, H., et al. Mitochondrial Impairment in Cerebrovascular Endothelial Cells is Involved in the Correlation between Body Temperature and Stroke Severity. Aging Dis. 7, 14-27 (2016).
- Oldendorf, W. H., Cornford, M. E., Brown, W. J. The large apparent work capability of the blood-brain barrier: a study of the mitochondrial content of capillary endothelial cells in brain and other tissues of the rat. Ann Neurol. 1, 409-417 (1977).
- Oldendorf, W. H., Brown, W. J. Greater number of capillary endothelial cell mitochondria in brain than in muscle. Proc Soc Exp Biol Med. 149, 736-738 (1975).
- Kaczara, P., et al. Carbon monoxide released by CORM-401 uncouples mitochondrial respiration and inhibits glycolysis in endothelial cells: A role for mitoBKCa channels. Biochim Biophys Acta. 1847, 1297-1309 (2015).
- Bharadwaj, M. S., et al. Preparation and respirometric assessment of mitochondria isolated from skeletal muscle tissue obtained by percutaneous needle biopsy. J Vis Exp. (96), e52350 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved