Method Article
Avaliação da função bioenergética em células endoteliais Vascular Cerebral
Neste Artigo
Resumo
mitocôndrias de células endoteliais são fundamentais para manter a integridade do cérebro-barreira sangue. Nós introduzimos um protocolo para medir a função bioenergética em células endoteliais vasculares cerebrais.
Resumo
A integridade do sangue-cérebro-barreira (BBB) é crítico para evitar a lesão cerebral. endotelial vascular cerebral células (CVE) são um dos tipos de células que compõem o BBB; estas células têm uma procura muito alta energia, o que requer a função mitocondrial óptima. No caso de doença ou lesão, a função mitocondrial nestas células pode ser alterada, resultando em doença ou a abertura da BBB. Neste artigo, apresentamos um método para medir a função mitocondrial em células CVE usando células intactas, inteiras e um Bioanalyzer. Um ensaio de mito-stress é usada para desafiar as células que foram perturbadas, física ou quimicamente, e avaliar a sua função bioenergética. Além disso, este método também fornece uma maneira útil para rastrear novas terapêuticas que têm efeitos diretos sobre a função mitocondrial. Temos optimizada a densidade celular necessária para se obter as taxas de consumo de oxigénio que permitem o cálculo de uma variedade de para mitocondrialmetros, incluindo a produção de ATP, a respiração máxima e capacidade de reposição. Também mostram a sensibilidade do ensaio, demonstrando que a introdução da microRNA, miR-34a, conduz a uma diminuição pronunciada e detectável da actividade mitocondrial. Embora os dados apresentados neste documento é optimizado para a linha celular bEnd.3, temos também optimizada do protocolo para as células ECV primárias, sugerindo ainda mais a utilidade em modelos pré-clínicos e clínicos.
Introdução
É amplamente reconhecido que o sangue-cérebro-barreira (BBB), formada por células endoteliais vasculares cerebrais (AVC) tem funções muito distintas e únicas primordiais para a biologia vascular. Estas células endoteliais usar mitocôndrias para gerar a maior parte do fornecimento celular de trifosfato de adenosina (ATP) como fonte de energia química. Além de fornecer ATP para as células ECV, mitocôndrias regulação de diversos processos celulares em células endoteliais vasculares, tais como sinalização celular, apoptose 1-4 5, e o controlo do ciclo celular e crescimento celular 6. A desregulação da função bioenergética mitocondrial em células ECV podem afectar a biogénese mitocondrial, levando a actividade de endotélio vascular danificado, e exacerbar doenças cerebrovasculares e desordens neurodegenerativas, por exemplo, acidente vascular cerebral 7,8 e doença de Alzheimer (AD) 9. Nós demonstramos que as células ECV insultos a seguir a exposição a lipopolysaccharide (LPS) prejudicar a função mitocondrial em células CVE e piorar acidente vascular cerebral resultados 7. Terc-butil-hidroquinona (tBHQ) aumenta mortalidade por AVC, interferindo com a fosforilação oxidativa em células CVE 10. Portanto, o modelo quantitativo da função bioenergética em células CVE não só pilotos uma série de estudos relacionados com o mecanismo de sistema nervoso central (SNC) doenças, mas também fornece um avanço na triagem de drogas de terapias dirigidas a função mitocondrial em biologia vascular.
Mitocôndrias isoladas têm sido usados para medir a função bioenergética. Nós 7 e outros 11 têm relatado avaliações da bioenergética celular em células intactas CVE usando um Bioanalyzer fluxo extracelular. O analisador proporciona a vantagem da avaliação do bioenergética celular endógeno. Este ensaio sensível e consistente mede o metabolismo mitocondrial de células ECV e pode ser utilizado para avaliar deficiência bioenergética por STImuli, investigar os mecanismos de vias de sinalização mitocondrial, e drogas de tela ou tratamentos que afetam a função mitocondrial em células CVE. A Taxa de Consumo de Oxigênio (OCR) é registrado pela Bioanalyzer usando uma abordagem de perfil farmacológico, combinando o uso de quatro disruptores mitocondriais: oligomicina, carbonil cianeto-4 (trifluorometoxi) fenil-hidrazona (FCCP), rotenona, e antimicina A. Neste protocolo, detalhamos uma abordagem otimizada que permite a medição e cálculo dos parâmetros funcionais mitocondriais em células CVE, incluindo respiração basal mitocondrial, a produção de ATP, vazamento de prótons, a respiração máxima e capacidade respiratória livre, em um único ensaio.
Protocolo
NOTA: O esquema do protocolo é demonstrado na Figura 1, incluindo uma linha de tempo dos procedimentos.
1. Cultura e passagem de células CVE
- Culturas de células (células ECV bEnd.3) em meio de crescimento completo (Modificado de Eagle Médium alto teor de glucose de Dulbecco, DMEM) suplementado com 10% de soro fetal de bovino (FBS) e 1% de penicilina / estreptomicina, em um balão de cultura T75 cm 2 de tecido. Crescer a 37 ° C numa incubadora de CO2 a 5%.
- Remova e descarte o meio de cultura celular. Lavar a camada celular com uma solução de EDTA 0,25% Tripsina-0,03%, e em seguida adicionar 1 - 2 ml de solução de tripsina-EDTA para o balão e manter o balão a 37 ° C durante 3-5 min. Observe as células sob um microscópio invertido até a camada de células é separada. Adicionam-se 10 ml de meio de crescimento completo e aspirar as células por pipetagem suave.
- Decanta-se o fluido e as células para um tubo de centrífuga de 15 mL e centrifugação a 700 xg durante 5 min para remover os detritos celulares.
- Descartar o sobrenadante do tubo de centrifugação. Adicionam-se 10 ml de meio de crescimento completo e re-suspensão da pelota celular. Rodar as células a 700 xg durante 5 min.
- Descartar o sobrenadante do tubo de centrifugação. Re-suspender o sedimento de células em meio de crescimento completo a uma concentração de 2,0 x 10 5 células / ml (determinado por contagem utilizando um hemocitómetro; excluir as células mortas por coloração com Trypan-azul).
NOTA: As células recém-descongeladas são sub-cultivadas durante pelo menos 3 passagens para as experiências.
2. Seed e tratar células em placas de cultura celular
- Semear as células em uma placa de cultura de células de fluxo extracelular de 96 poços: 80 uL / poço. Colocar a placa de cultura de células a 37 ° C numa incubadora de CO2 a 5%. Nota: 16 x 10 3 culas por po vai atingir 60-80% de confluência em 24 horas.
- Se as células são expostas a um produto químico, adicionar os tratamentos uma vez que as células são ligadas à parte inferior da placa (8 - 24 h após verding).
NOTA: Para as experiências de transfecção, não adicionar antibióticos no meio de crescimento completo.
3. Avaliação da função mitocondrial Usando o Bioanalyzer
- Antes do início do ensaio, hidrato de um cartucho do sensor de fluxo com extracelular de calibração por adição de 150 uL de fluxo extracelular solução de calibração para a placa e a incubação O / N a 37 ° C, sem CO2.
- Usando a estação de lavagem de placas, mudar o meio de cultura celular em pH 7,0 extracelular fluxo de meio de ensaio. Incubar as células a 37 ° C, sem CO2, durante 30 - 60 min.
- Preparar soluções de trabalho de 8 oligomicina uM, 4,5 uM FCCP, rotenona 10 uM, 10 uM e antimicina A em DMEM. Carga de 25 mL das soluções estoque em portos de injeção do cartucho: Port A, oligomicina; Porto B, FCCP; Porta C, rotenona e antimicina A com meio de ensaio de fluxo extracelular. Aplicar o protocolo de ensaio como descrito na Tabela 1.
- Coloque o cartucho hidratado no Bioanalyzer e realizar a calibração, clicando no botão "Iniciar". Após a calibração estiver concluída, remova a placa inferior do cartucho e carregar a placa de célula clicando o prompt "Descarregar cartucho". Continue o ensaio até que o fim de todas as medições.
- Abra o arquivo de dados e obter os valores da taxa do Bioanalyzer. Exportar os dados para um arquivo de planilha.
4. Análise de Dados
NOTA: Os cálculos para análises de dados são formulados abaixo. Os valores são obtidos a partir do instrumento Bioanalyzer como o OCR apresentado na Figura 2.
- Para calcular respiração basal, subtrair a respiração não-mitocondrial (medidas 10 - 12) a partir do valor basal (medida 3).
NOTA: respiração basal = Basal - respiração não-mitocondrial = Taxa ③ - Taxa ⑩ ~ ⑫. - Para calcular producti ATPem, subtrair a respiração ATP-ligada (medições de 4 - 6) a partir do valor de base (medição 3).
NOTA: a produção de ATP = Basal - respiração ATP ligada = Taxa ③ - Taxa ④ ~ ⑥. - Para calcular a respiração máxima, subtrair a respiração não-mitocondrial (medidas 10 - 12) a partir da respiração máxima (medidas 7 - 9).
NOTA: respiração máxima = respiração máxima - não mitocondrial respiração = Taxa ⑦ ~ ⑨ - Taxa ⑩ ~ ⑫. - Para calcular a capacidade de reposição, subtrair o valor basal (medida 3) a partir da respiração máxima (medidas 7 - 9).
NOTA: A capacidade de reposição = respiração máxima - Basal = Taxa ⑦ ~ ⑨ - Taxa ③. - Para calcular o vazamento do protão, subtrair a respiração não-mitocondrial (medida 10 - 12) a partir da respiração de ATP-ligada (de medição 4).
NOTA: vazamento Proton = respiração ATP ligada - não-mitocôndriasl respiração = Taxa ④ - Taxa ⑩ ~ ⑫.
Resultados
Para avaliar a função bioenergético das células CVE em resposta ao estresse oxidativo, nós escolhemos a linha de células de endotélio murino microvascular cerebral bEnd.3, que exibe as mesmas características de barreira comparativos como microvasculares cerebral primário células endoteliais 12. Dado que a cinética e a intensidade relativa de resposta são variadas entre os vários tipos de células, a primeira série de experiências foram concebidas para se obter níveis mensuráveis de OCR, identificando o número óptimo de células bEnd.3 para usar no ensaio de perfis metabólicos, mostrado na Figura 2. Após a avaliação, os dados são quantificados e apresentados na Figura 3. respiração basal, respiração máxima, e a capacidade respiratória de reposição mostrou uma resposta proporcional com a densidade celular. No entanto, a produção de ATP diminuída quando foram seleccionados 64 x 10 3 culas por po, o que sugere que a sobre-cultura de células confluentes énão é adequado para esta experiência. As densidades celulares óptimas ocorrer entre 8-32 x 10 3 culas por po, com base na resposta a disruptores mitocondriais.
Para as experiências subsequentes, uma densidade de sementeira de 16 x 10 3 culas por po foi utilizada para permitir a detecção de alterações óptima em OCR. Usando 16 × 10 3 células por poço, observamos as respostas esperadas em OCR e demonstrou que o microRNA miR-34a reduz a função mitocondrial em células CVE (Figura 4). Descrevemos previamente que o miR-34a reduzida fosforilação oxidativa nestas células 13. As experiências repetidas mostraram também que a respiração máxima e à capacidade foram significativamente diminuída pela sobre-expressão de miR-34a em CVEs às 24 h pós-transfecção, embora a respiração basal, a produção de ATP, e vazamento de protões não tiveram alterações significativas (Figura 4) . estes dadosdemonstram a sensibilidade da Bioanalyzer para detectar alterações na função mitocondrial em CVEs.
Figura 1. Planejamento Estratégico para o experimento. O cronograma para a célula, prato, e preparação do cartucho é indicado. Por favor clique aqui para ver uma versão maior desta figura.
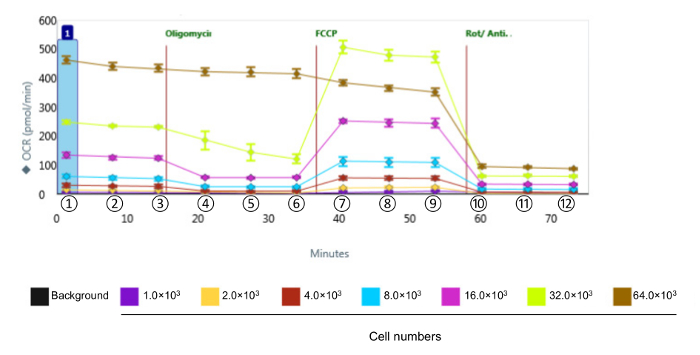
As taxas de consumo de oxigênio Figura 2. Representante dados brutos da função bioenergética em Células CVE com várias densidades celulares. Foram medidos em células CVE com diferentes densidades celulares. Os dados representam média ± SD (n = 5); OCR: Consumo de Oxigênio Taxa; FCCP: cianeto carbonil-4- (trifluorometoxi) fenil-hidrazona; Rot / Anti-A: rotenona e antimicina A. ①, ② e ③ indicam respiração basal; ④, ⑤ e ⑥ indicam ATP ligada a respiração; ⑦, ⑧ e ⑨ indicam máxima respiração; ⑩, ⑪ e ⑫ indicam a respiração não-mitocondrial. Por favor clique aqui para ver uma versão maior desta figura.
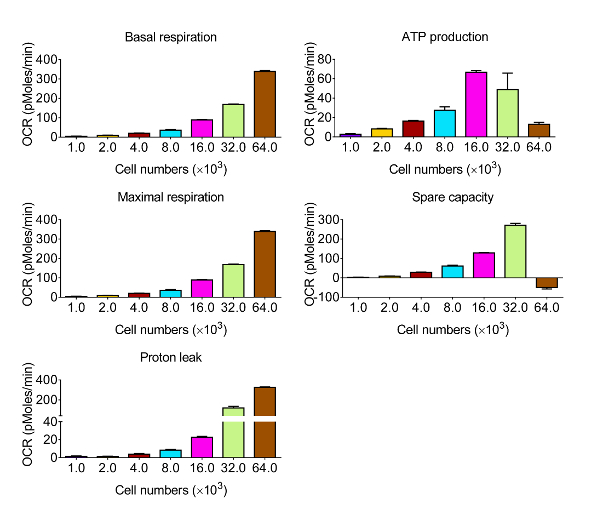
Figura 3. Os resultados representativos da função bioenergética em Células CVE com várias densidades celulares. Respiração basal, a produção de ATP, respiração máxima e capacidade de reposição são calculados a partir dos dados brutos gerados pelos bioenergética ensaio funcional na Figura 2 usando as fórmulas indicadas no ponto 4 . Os dados representam média ± SD (n = 5); OCR: Consumo de Oxigênio Rate. f = "http://ecsource.jove.com/files/ftp_upload/54847/54847fig3large.jpg" target = "_ blank"> Clique aqui para ver uma versão maior desta figura.
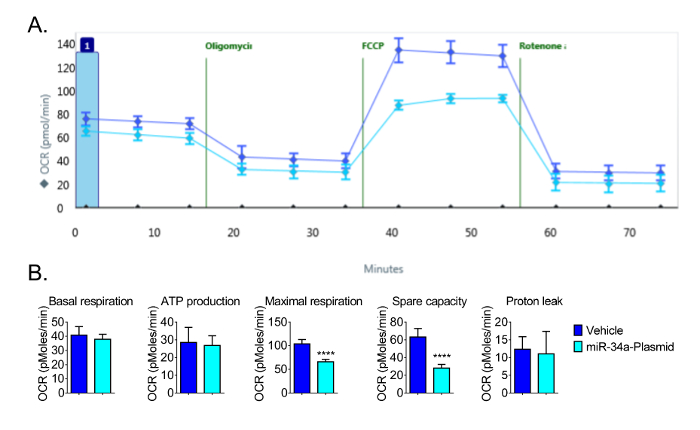
Figura 4: Os resultados representativos da função bioenergética diminuiu miR-34a (A) Os dados brutos da função mitocondrial seguinte superexpressão de miR-34a às 24 h pós-transfecção.. (B) respiração basal, a produção de ATP, a respiração máxima, e a capacidade não utilizada são calculados a partir dos dados brutos gerados pelos bioenergética ensaio funcional na Figura 4A; os parâmetros são calculados segundo as fórmulas indicadas na Secção 4. A sobre-expressão de miR-34a reduz a função mitocondrial em células ECV às 24 h pós-transfecção. Os dados representam média ± SD (n = 5); OCR: Consumo de Oxigênio Rate. ****, P <0,0001.files / ftp_upload / 54847 / 54847fig4large.jpg "target =" _ blank "> Clique aqui para ver uma versão maior desta figura.

Tabela 1. O instrumento Executar protocolo.
Discussão
Este protocolo representa um método para a avaliação do fenótipo bioenergética em células endoteliais vasculares cerebrais. Ele serve como um ensaio de base para a avaliação mitocondrial de células endoteliais, e é óptima para experiências concebidas para investigar os mecanismos de estímulos que podem afectar a via de sinalização mitocondrial em células ECV. Ele também fornece um método para testar agentes terapêuticos potenciais para doenças BBB-perturbações associadas.
Passos críticos dentro do Protocolo
bioanalyzers fluxo extracelular tem a capacidade de medir OCR em tempo real. Neste ensaio, identificando a densidade celular apropriada é crítica. Se a densidade de células é inferior a 8 x 10 3 culas por po, o OCR basal é muito baixa para ser analisado (Figura 2 e Figura 3); Se a densidade de células é superior a 32 x 10 3 culas por po, as células não respondem a oligomicina ou FCCP treatmeNTS (Figura 2 e Figura 3). A densidade celular óptima para esta linha de células no nosso modelo experimental é de 16 × 10 3 células por poço, o que demonstra resultados replicáveis e sensibilidade a estímulos 7 e tratamentos 10,14. Se um Bioanalyzer de 24 poços é usado, novas titulações da densidade celular seria necessário para o ensaio.
Ele está documentado que CVEs têm um grande volume de mitocôndrias em comparação com outras células endoteliais ou tipos de tecido 15,16, sugerindo a necessidade de uma maior produção de energia e menos células para medir o metabolismo bioenergética. Nós testamos vários tipos de células endoteliais do cérebro, tais como primário e imortalizado células endoteliais vasculares cerebrais murino 7 e imortalizado células endoteliais vasculares cerebrais humanos (dados não publicados). Estas células necessária densidades celulares semelhantes para atingir o OCR (respiração basal OCR aceitável dentro de 40-160 pmol / min duranteplacas de 96 poços e 50-400 pmol / min para placas de 24 poços), quando o ensaio foi realizado bioenergética. Kaczara et al. Relataram que mede o metabolismo bioenergético em células humanas umbilical veia endoteliais (HUVEC), que usou uma densidade celular mais elevada 17.
O nosso grupo não avaliou células dos vasos de outros tecidos ou órgãos. Teoricamente, o Bioanalyzer poderia potencialmente ser usado em qualquer tipo de célula, mas requer optimizar o ensaio para a densidade celular, meio de cultura de células, e as condições de cultura (algumas células específicas podem exigir placas revestidas a crescer bem). É necessário que as experiências são concluídas para assegurar a taxa de OCR está dentro da gama aceitável. Se o OCR em células endoteliais de outros órgãos é inferior a partir de cérebros de AVCs, aumentando a densidade celular pode ajudar a obter dentro de um intervalo aceitável de OCR. Alternativamente, se as células não estão usando fosforilação oxidativa como a sua principal fonte de energia, o Bioanalyzer não seria uma optimal ensaio.
O Bioanalyzer permite a interrupção sequencial da cadeia de transporte de elétrons, com base na ordem em que são aplicados os reagentes. Em primeiro lugar, é aplicada oligomicina, que inibe complexo V mitocondrial (ATP sintase). Em segundo lugar, FCCP, um desacoplador de electrões, é aplicada, o que conduz ao rompimento do gradiente de protões. Finalmente, rotenona e antimicina A, que inibem mitocondrial Complexos I e III, respectivamente, são aplicados a levar a uma inibição total do fluxo de electrões. A ordem de exposição à droga é essencial porque as drogas que bloqueiam a reação específica da cadeia de transporte de elétrons, e as mudanças sequenciais podem ser mensurados para refletir a função mitocondrial.
Modificações e resolução de problemas
Para avaliar a resposta a estímulos mitocondrial em células ECV, recomenda-se que os estímulos são aplicados às células após as células aderidas ao fundo da placa de cultura celular (ver a linha de tempomostrado na Figura 1; geralmente leva pelo menos 6 h). Para obter resultados reproduzíveis pelos tratamentos, é extremamente importante para manter a densidade celular consistente. Se pré-tratamentos são concebidos antes da semeadura de células, densidade celular para cada pré-tratamento devem ser cuidadosamente medido, excluindo as células mortas para semeadura. Se transfecção está incluído na concepção experimental, referem-se a transfecção protocolo do fabricante. Demonstrado nos dados apresentados na Figura 4, o miR-34a foi transfectado para as células ECV utilizando um kit de lipofectamina a transfecção, o que requer meio de cultura celular antibióticos livres e um teste de MITO-tensão para avaliar as alterações na função metabólica com a sobre-expressão de miR-34a . As doses de plasmídeo também pode ser optimizada, como anteriormente publicado a 13. Outra modificação que pode ser feita com o protocolo é a alteração das concentrações dos reagentes. Uma curva de titulação de oligomicina, FCCP, e / ou rotenona e antimicina A pode ser completed.
Além disso, se este ensaio é utilizado para análises de elevado rendimento de várias drogas, sugere-se a incluir um ensaio paralelo para medir a viabilidade celular e a proliferação celular, o que foi descrito nas nossas publicações anteriores 7,13. Os valores de OCR é significativamente afectada pelo número de células (Figuras 2 e 3), e os ensaios de proliferação e viabilidade celular beneficiar a normalização dos dados. No entanto, a conclusão destes ensaios são a critério de cada laboratório individual.
Limitações da técnica
A principal limitação deste protocolo é que nós só usamos um modelo in vitro cultura de células in no estudo. Actualmente, não existem disponíveis modelos ex vivo ou modelos animais que podem dirigir a função mitocondrial de células endoteliais. Os novos modelos são esperados para ser desenvolvida para a avaliação da função in vivo e bioenergética ex vivo em estudos futuros.
Outra limitação é a extensão das avaliações de barreira seguintes medidas bioenergética. As experiências não pode ser executada porque, em primeiro lugar, após a realização das medições bioenergéticos, a viabilidade celular diminui a seguir a interrupção completa da cadeia de transporte de electrões; segundo, placas e inserções de cultura de células específicas são necessárias para detectar valores bioenergética e não se encaixam inserções para as avaliações de barreira. Portanto, não há muitos ensaios funcionais que podem ser concluídas após o ensaio de bioenergética. No entanto, espera-se que os dispositivos especiais podem ser desenvolvidos para executar ensaios funcionais antes do ensaio bioenergética.
Importância da Técnica em Matéria de Existentes / Métodos Alternativos
As técnicas anteriores para avaliar a função mitocondrial exigiu o isolamento das mitocôndrias das células 18. este neW técnica usando o Bioanalyzer permite a medição da actividade mitocondrial em células intactas, o que preserva mais do ambiente celular do que avaliar mitocôndrias isoladas.
Aplicações futuras ou chegar depois de dominar esta técnica
Este protocolo foi concebido e desenvolvido para a linha celular bEnd.3, mas também é compatível com endotelial vascular cerebral primário (pCVE) 7 ou outras células do endotélio, e demonstramos isto na nossa publicação anterior utilizando células pCVE 7. Quando são utilizados outros tipos de endotélio, o revestimento da placa de cultura e a utilização de factores de crescimento pode ser necessária. No entanto, o ensaio de titulação é recomendado para outros tipos de células, bem. Este protocolo oferece um método geral a ser adoptada na avaliação dos bioenergética de células ECV, e pode ser adicionalmente aplicado para estudos de mecanismos ou respostas terapêuticos desta maneira.
Divulgações
The authors declare no potential conflicts of interest with respect to the research, authorship, and/or publication of this article. Open Access fees for this article were provided by Agilent Technologies.
Agradecimentos
This work was supported by the following grants: AHA 16SDG31170008 to X.R. and NIH P20 GM109098, P01 AG027956, and U54 GM104942 to J.W.S.
Materiais
| Name | Company | Catalog Number | Comments |
| bEnd.3 cell line | ATCC | CRL-2299 | 25 - 30 passages |
| Dulbecco's Modified Eagle's Medium (DMEM) | ATCC | 30-2002 | |
| Fetal Bovine Serum | Atlanta Biologicals | S12450 | 10% final concentration |
| Penicillin/Steptomycin | Hyclone | SV30010 | 1×100 stocking |
| 0.25% trypsin, 0.03% EDTA solution | Corning | 25-053-CI | |
| Sodium pyruvate | Corning | 25-000-CI | 1.0 µM final concentration |
| Glucose | Sigma | CAS 50-99-7 | 25 mM final concentration |
| Oligomycin | Sigma | O4876 | 1.0 µM final concentration |
| Carbonilcyanide 4-(trifluoromethoxy) phenylhydrazone (FCCP) | Sigma | C2920 | 0.5 µM final concentration |
| Rotenone | Sigma | R8875 | 1.0 µM final concentration |
| Antimycin A | Sigma | CAS 1397-94-0 | 1.0 µM final concentration |
| Plate wash station | Seahorse Bioscience | ||
| Extracellular flux bioanayzer | Seahorse Bioscience | XFe96 | |
| Extracellular flux cell culture plate | Seahorse Bioscience | 102416-100 | |
| Extracellular flux sensor cartridge | Seahorse Bioscience | 102416-100 | |
| Extracellular flux calibrant solution | Seahorse Bioscience | 100840-000 | |
| Extracellular flux assay medium | Seahorse Bioscience | 102365-100 | PH buffered prior to assay |
Referências
- Quintero, M., Colombo, S. L., Godfrey, A., Moncada, S. Mitochondria as signaling organelles in the vascular endothelium. Proc Natl Acad Sci U S A. 103, 5379-5384 (2006).
- Liu, Y., Li, H., Bubolz, A. H., Zhang, D. X., Gutterman, D. D. Endothelial cytoskeletal elements are critical for flow-mediated dilation in human coronary arterioles. Med Biol Eng Comput. 46, 469-478 (2008).
- Al-Mehdi, A. B., et al. Perinuclear mitochondrial clustering creates an oxidant-rich nuclear domain required for hypoxia-induced transcription. Sci Signal. 5, ra47 (2012).
- Mironov, S. L., Ivannikov, M. V., Johansson, M. [Ca2+]i signaling between mitochondria and endoplasmic reticulum in neurons is regulated by microtubules. From mitochondrial permeability transition pore to Ca2+-induced Ca2+ release. J Biol Chem. 280, 715-721 (2005).
- Sutendra, G., et al. The role of Nogo and the mitochondria-endoplasmic reticulum unit in pulmonary hypertension. Sci Transl Med. 3, 88ra55 (2011).
- Mitra, K., Wunder, C., Roysam, B., Lin, G., Lippincott-Schwartz, J. A hyperfused mitochondrial state achieved at G1-S regulates cyclin E buildup and entry into S phase. Proc Natl Acad Sci U S A. 106, 11960-11965 (2009).
- Doll, D. N., et al. Mitochondrial crisis in cerebrovascular endothelial cells opens the blood-brain barrier. Stroke. 46, 1681-1689 (2015).
- Ren, X., Simpkins, J. W. Deciphering the Blood-Brain Barrier Damage in Stroke: Mitochondrial Mechanism. J Neuroinfect Dis. S2, e002 (2015).
- Pun, P. B., Lu, J., Moochhala, S. Involvement of ROS in BBB dysfunction. Free Radic Res. 43, 348-364 (2009).
- Sun, J., Hu, H., Ren, X., Simpkins, J. W. Tert-butylhydroquinone compromises survival in murine experimental stroke. Neurotoxicol Teratol. 54, 15-21 (2016).
- Modis, K., et al. Cellular bioenergetics is regulated by PARP1 under resting conditions and during oxidative stress. Biochem Pharmacol. 83, 633-643 (2012).
- Brown, R. C., Morris, A. P., O'Neil, R. G. Tight junction protein expression and barrier properties of immortalized mouse brain microvessel endothelial cells. Brain Res. 1130, 17-30 (2007).
- Bukeirat, M., et al. MiR-34a regulates blood-brain barrier permeability and mitochondrial function by targeting cytochrome c. J Cereb Blood Flow Metab. 36, 387-392 (2016).
- Hu, H., et al. Mitochondrial Impairment in Cerebrovascular Endothelial Cells is Involved in the Correlation between Body Temperature and Stroke Severity. Aging Dis. 7, 14-27 (2016).
- Oldendorf, W. H., Cornford, M. E., Brown, W. J. The large apparent work capability of the blood-brain barrier: a study of the mitochondrial content of capillary endothelial cells in brain and other tissues of the rat. Ann Neurol. 1, 409-417 (1977).
- Oldendorf, W. H., Brown, W. J. Greater number of capillary endothelial cell mitochondria in brain than in muscle. Proc Soc Exp Biol Med. 149, 736-738 (1975).
- Kaczara, P., et al. Carbon monoxide released by CORM-401 uncouples mitochondrial respiration and inhibits glycolysis in endothelial cells: A role for mitoBKCa channels. Biochim Biophys Acta. 1847, 1297-1309 (2015).
- Bharadwaj, M. S., et al. Preparation and respirometric assessment of mitochondria isolated from skeletal muscle tissue obtained by percutaneous needle biopsy. J Vis Exp. (96), e52350 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados