このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
心筋細胞ベースのアクチュエータと自己安定化ビオロボ - 第2部
要約
この研究では、機能化されたエラストマーカンチレバーアームを有する生物学的アクチュエータおよび自己安定性水泳用ビオロボットに、心筋細胞を播種し、培養し、それらの生化学的および生体力学的特性を経時的に特徴付けた。
要約
近年、合成機械骨格と一体化された生細胞または組織成分からなるハイブリッドデバイスが開発されている。バイオロボットと呼ばれるこれらの装置は、生体構成要素の収縮活動から発生する力のみによって駆動され、多くの固有の利点のために、従来の完全人工ロボットの代替物となり得る。ここでは、この2部構成の記事の最初の部分で設計、製作、機能化された生物学的アクチュエータとバイオロボットをシードして特性付けする方法について説明します。ポリジメチルシロキサン(PDMS)ベースおよび薄膜カンチレバーからなる製作された生物学的アクチュエータおよびバイオロボットデバイスを、フィブロネクチンとの細胞接着のために官能化した。機能化後、新生児ラット心筋細胞をPDMSカンチレバーアーム上に高密度で播種し、コンフルエントな細胞シートを得た。デバイスは毎日撮影され、キャッチャーの動きレバーアームを分析した。播種後2日目に、自発収縮時に細胞が及ぼす力によるカンチレバーアームの屈曲を観察した。カンチレバー曲げの定量分析の際に、細胞が時間とともに成熟する際に表面の応力が徐々に増加することが観察された。同様に、我々は、フィンとして機能するPDMSカンチレバーアームの作動によるビオロボットの動きを観察した。装置の泳動プロファイルを定量化すると、フィンの静止角度の影響を受ける様々な推進モードが観察された。運動方向と鼓動周波数もまた、フィンの静止角度によって決定され、142μm/ sの最大泳速が観察された。この原稿では、作製されたデバイスに心筋細胞を移植するための手順、ならびに生物学的アクチュエータおよびビオロボの活性の評価について説明する。
概要
ビオロボットは、PDMSまたはヒドロゲル1のような軟質の弾性材料で通常構成される機械的骨格内に組み込まれた生きた細胞に基づくデバイスである。細胞は、自発的にまたは刺激に応答して、律動収縮を受け、したがって、アクチュエータとして機能する。細胞収縮から生成された電力は、様々なビオロボを駆動する。哺乳動物の心臓細胞(心筋細胞)および骨格筋細胞は、収縮特性のために、ビオロボの作動にしばしば用いられる。心筋細胞および骨格筋細胞のほかに、昆虫筋肉組織2および外植された筋肉組織3などの他の細胞型も使用されている。昆虫の筋組織は、室温で生物学的アクチュエータの操作を可能にする。
ビオロボットの機能および性能は、主に生物学的アクチュエータの強度および一貫性によって決定される( すなわち、。筋肉細胞)、機械的骨格構造は主として、運動、安定性、および力のメカニズムを決定する。これらのデバイスは細胞によって生成される力によって単独で駆動されるので、化学的汚染物質または作動音は存在しない。したがって、他の従来のロボットに代わるエネルギー効率の高い代替手段を構成します。様々な文献情報が生存細胞と組織をビオロボットに組み込む様々な方法について議論してきた1,4,5。微細加工技術と組織工学技術の進歩により、歩く、握る、泳ぐ、またはポンプすることができるバイオロボットの開発が可能になった5,6。一般に、細胞は、コンフルエントな細胞シートとして機械的(ポリマー)バックボーン上に直接培養されるか、またはリングやストリップなどの足場内の三次元作動構造に成形される。ほとんどの場合、ビオロボットは心筋細胞シート6,7を使用して作製される。なぜなら、これらの細胞は、外部刺激なしで自然収縮を示す本来の能力を有するからである。一方、骨格筋細胞シートに関する報告は、膜脱分極を開始するためにインビトロで収縮を開始する刺激の必要性のために制限されている8 。
このプロトコールは、最初に、薄いPDMSカンチレバーで作られた機能化された生物学的アクチュエータ上に心筋細胞を播種する方法を記載する。次に、水泳プロフィールの種蒔きと分析について詳しく説明します。カンチレバーは、フィブロネクチンなどの細胞接着タンパク質で機能化され、心筋細胞とコンフルエントに播種される。デバイスが収縮した細胞は、カンチレバーを曲げてアクチュエータとして動作させます。細胞が成熟するにつれて、時間の経過と共に、我々は、細胞の表面のストレスの変化を追跡する。カンチレバー曲げ。ここで開発された生物学的アクチュエータは、線維芽細胞または誘導された多能性幹細胞などの任意の細胞型の収縮特性を、それらが分化する際に決定するために使用することができる。
バイオロボットに関する以前の研究の多くは、生物学的アクチュエータの開発に焦点を当てていたが、バイオロボットアーキテクチャと機能能力の最適化はほとんど無視されていた。最近、いくつかの研究が、自然に触発されたバイオロボットの水泳モードの実施を実証している。例えば、鞭毛に基づく動き6 、クラゲの推進力9 、およびバイオハイブリッド線4を有する水泳ビオロボットが設計されている。文学の他の研究とは異なり、ここでは、機械的なバックボーンの特性を変化させて自己安定化構造を作り出すことに焦点を当てる。この研究で開発されたバイオロボットは、一定のピッチ、ロール、およびイムを維持することができる泳ぐにつれて水深が広がります。これらのパラメータは、各ベースコンポジットの厚さを変えることによって変更できます。 PDMSアクチュエータ、水中バイノロボット、およびデバイスの機能化の開発に関わる製造工程は、この2部構成の記事のパート1と最近の作業7で詳細に説明されています。ここで開発された技術は、貨物配送などのさまざまな用途に適した、非常に効率的な新規のビオロボットの開発を目指しています。
この研究に従った分離プロセスは、以前の研究10および最近公開された研究7に記載されたプロセスと同様である。 PDMSアクチュエータおよびバイオロボットデバイスを製造するために使用される微細加工方法は、この2部構成の原稿の第1部に詳細に記載されている。この原稿のプロトコールセクションは、作製されたPDMSに心筋細胞を播種するステップctuatorおよびbiorobotを細胞接着タンパク質で機能化した。
プロトコル
ここに記載されているすべての手順は、承認されたプロトコールを使用し、Notre Dame大学の機関動物管理および使用委員会の規則に従って行われています。
1.細胞の播種と培養
- 開始する前に、10%ウシ胎仔血清(FBS)および1%ペニシリン抗生物質(DMEM完全)を添加した小型漏斗、ピペット、および温かいダルベッコ改変イーグル培地(DMEM)を必要な項目に調製する。
- 機能化されたデバイス(生物学的アクチュエータまたはバイオロボット)と共にT-25フラスコを取ります。装置の準備、機能化、および細胞播種前の保存に関する詳細については、この2部構成の原稿の第1部第4節を参照のこと。
- 小さな、正方形のプラスチックシートを巻くことによって作ることができる漏斗を準備する。それをT-25フラスコの内部にある生物学的アクチュエータまたはビオロボの上に置きます。デバイス全体にフィットするように幅の広い端の直径を調整するフラスコの上部が締め付けられたときにぴったり合うように高さを調整します。
- ビオロボットの場合は、磁石を使用して、播種プロセスの間、フラスコの底部の所定の位置にデバイスを保持します。
注:ここでは、単一のネオジムディスクマグネット(直径1.26インチ)を使用しましたが、類似のサイズと強度の任意のマグネットを使用して、磁気ニッケル-PDMS複合ベースでビオロボットを押さえることもできます。 - 使用前に少なくとも30分間、プラスチックシートをUV滅菌する。
- ビオロボットの場合は、磁石を使用して、播種プロセスの間、フラスコの底部の所定の位置にデバイスを保持します。
- 漏斗の底とフラスコの間に大きな隙間がないことを確認してください。
- 1.6×10 7細胞/ mLの密度で完全なDMEM中の心筋細胞を再懸濁し、漏斗を通して装置上に懸濁液400μLをゆっくりと滴下する。血球計または他の細胞計数器を使用して、得られた細胞の数を決定する。
- 装置と漏斗を邪魔することなくゆっくりと装置をインキュベータ内に戻すhin。 37℃で24時間培養する。
- インキュベーション期間の後、漏斗をゆっくりと取り出し、PBSでサンプルを静かに洗浄し、10mLの新鮮なDMEMでフラスコを補充する。
注:ビオロボットの場合は、デバイスが浮いているように磁石を取り外します。
2.生化学的特徴付け
- カルシウム流入アッセイ
注:カルシウム流入アッセイは、細胞相互接続性を評価するために実施される。蛍光カルシウムイオン特異的色素を細胞に負荷する手順は、以前に確立されたプロトコール11に記載された方法に従う。- まず、必要な材料、フルオ-4-アセトメチル(AM)エステル、非イオン性界面活性剤ポリオール( 表の表を参照 )、タイロードの塩溶液を準備します。
- 長いピンセットを使用して、装置を培養フラスコから35mmのペトリ皿に静かに移し、2mLのTyrode塩溶液 。
- 別の遠心チューブで、暖かいタイロード溶液(37℃に加温)1 mLを採り、3-5μLのストック溶液を添加します(作業濃度:3〜5μM)ポリオール(作業濃度:0.2%)。試料溶液を、カルシウム指示薬、fluo-4、および0.2%非イオン性界面活性剤を補った暖かいTyrode溶液で置換する。 37℃で25〜30分間インキュベートする。
- 色素溶液を除去し、新鮮なTyrode溶液で穏やかに試料を洗浄する。新たに2 mLの新鮮なDMEM中のサンプルを37℃でさらに30分間完全に再インキュベートする。
注:このアッセイおよび関連ビデオの結果は、以前に発表された研究7に記載されています。
- 免疫蛍光
注:すべてのサンプルの二重免疫染色は、以前に確立されたプロトコール> 12。- PBS中の10%ヤギ血清(GS)、PBS中の0.1%の細胞溶解洗剤(材料表参照)、diH 2 O中の4%パラホルムアルデヒド(PFA)、PBS中の4%パラホルムアルデヒド(PFA) - マウスモノクローナル抗体心筋トロポニンIおよび抗ウサギモノクローナル抗体コネキシン-43)、二次抗体(Alexa 594コンジュゲートおよびヤギ抗マウスIgG(H + L)Alexa 488コンジュゲート)およびDAPI。
注意:パラホルムアルデヒドは発癌性です。 - フラスコから目的のサンプルを取り出し、PBSで2回穏やかに洗浄します。サンプルの準備と機能化の詳細については、この2部構成の原稿の第1部のセクション4を参照してください。
- 小さなカバースリップ(直径:12 mmまたは15 mm)にPBSの滴を加える。デバイスのベースをピンセットで静かに持ち、端のはさみを使用して薄いPDMSアーム(カンチレバー、 図1 )を切断し、そこからベースの上端に接続しますe。カンチレバーアームを細胞接着面を上に向けて液滴に移す。 PBS液滴は、細胞の乾燥を防止する。
- 前述のように、4%PFAでサンプルを固定し、サンプルの二重免疫染色を行います。
- 免疫染色の後、サンプルを抗フェードマウント試薬を使用してきれいなスライドガラスにマウントし、24時間暗所で静かに放置する。
- すべてのサンプルについて手順を繰り返します。
注:このアッセイの結果および関連する画像は、以前に発表された研究7で詳細に論じられている。
- PBS中の10%ヤギ血清(GS)、PBS中の0.1%の細胞溶解洗剤(材料表参照)、diH 2 O中の4%パラホルムアルデヒド(PFA)、PBS中の4%パラホルムアルデヒド(PFA) - マウスモノクローナル抗体心筋トロポニンIおよび抗ウサギモノクローナル抗体コネキシン-43)、二次抗体(Alexa 594コンジュゲートおよびヤギ抗マウスIgG(H + L)Alexa 488コンジュゲート)およびDAPI。
3.イメージング
- T-25フラスコをCO 2インキュベーターに直立させ、インキュベーター内にイメージングシステムを準備します。ズームレンズ( 表の表を参照)を使用して、カメラ( 表の表を参照)を使用してデバイスを記録します。光源の場合、LEDライトのストリップを使用してください。
注:ここでは白色光LEDストリップが使用されていましたが、通常のLEDも使用できます。 - カメラをオペレーティングシステムに接続し、カメラ固有のソフトウェアを開きます( 表の表を参照 )。トップパネルの[ファイル]タブの下にあるカメラ画像をクリックして、すべてのカメラオプションを開き、正しいカメラを選択します。
- ソフトウェア内のトップパネルのタブのリストから「ライブ」を選択します。
- レンズダイヤルを調整して、手動でピントを合わせてください。トップパネルから「関心領域(ROI)をトリミングする」を選択します。次に、生物学的アクチュエータデバイスとカンチレバーアームを囲むビデオフレームに手作業で矩形を描き、ROIをマークします。
注:適切なROIを選択すると、イメージファイルのサイズが最小限に抑えられます。- biorobotsの場合、デバイスの水泳動作を記録するために画面全体をキャプチャします。
注:ビオロボのROIを描く必要はありません
- biorobotsの場合、デバイスの水泳動作を記録するために画面全体をキャプチャします。
- 録画を開始する前に、画面の上部パネルのいずれかのタブから「カメラ設定」を選択します。ライブ画像の露出とピクセル比率を調整するか、手動で値を入力してフレームレートを設定します。フレームレートを約30±2 fpsに設定します。
注:露出とピクセル比率を変更すると、ライブ画像の明るさとコントラストが変わります。 - ソフトウェアの上部パネルから "Record"ボタンをクリックすると、1,000 x 1,000ピクセル解像度のアクチュエータのビデオを正確に30秒間記録することができます。すべてのサンプルに対してこのプロセスを繰り返します。
静止した基盤上の生物学的アクチュエータの画像分析
- カスタムスクリプトを実行するプログラミングソフトウェア( 例えば、 Matlab)を使用して画像を分析する。材料の表を参照してくださいと補足ファイルを参照してください。
注意:スクリプトは、記録されたビデオの各フレームを表示し、カンチレバーのポイントの画像上の調整を記録するユーザーのマウス入力を受け取り、最小二乗フィッティングを介して入力ポイントを通過する円の直径および中心を計算し、入力および計算されたすべてのデータを後で使用するためにエクスポートします。- アイコンをクリックしてプログラミングソフトウェアを開きます。上部のメニューバーから「ファイル」 - >「開く」をクリックし、画像解析用の.mスクリプトファイルを選択します。記録されたTIFFイメージが.mファイルと同じフォルダにあることを確認します。 "実行"をクリックしてスクリプトを実行します。
注意:変更のために対話型ディスプレイがポップアップ表示されます。 - 実際のプログラムを開始するには "再生"を押してください。 「開く」ボタンをクリックして、分析されるTIFFファイルを探します。
- 「ベース&34;ボタンをクリックし、カンチレバーが上部のベースに取り付けられているポイントをクリックします。 Enterを押します。これはカンチレバーベースの位置を示すために各フレームの画像上に四角いマーカーを置く。
- 「スケール」ボタンをクリックし、ガラスビーズの片側を手動でクリックします。マウスポインタをガラスビーズの反対側に持ってきて「Enter」を押します。
注:これは、ガラスビーズの直径を測定する線を描くはずです。ガラスビーズは直径3mmなので、表示されるピクセルと3mmの関係になります。 - [分析]ボタンをクリックします。カンチレバーの基部を表す最初の四角いマーカーから短い距離でカンチレバーに沿ってクリックします。
- [分析]ボタンをクリックします。次にカンチレバーの基部を表す最初の四角いマーカーから短い距離でカンチレバーに沿ってクリックします。先端を含むカンチレバーに沿ってクリックし続け、Enterキーを押します完了しました。これは、カンチレバー上でクリックされた各点に「x」を配置します。
注意:正方形のマーカーとxマーカーの座標に基づいて、円の中心と直径は最小二乗フィッティング関数を使用して計算されます(使用するスクリプトの補足ファイルを参照)。 xマーカーと四角いマーカーを通過する円は、画像上に自動的に重ね合わされます。 - 重ね合わせた円がカンチレバーの輪郭を正しくトレースするかどうかを確認してください。
注:カンチレバーが非常に平坦な場合、カンチレバーのプロファイルが正しくトレースされているかどうかを判断することは困難です。 図3を参照してください。 - "次のフレーム"ボタンをクリックします。これは、TIFFファイルの次のフレームに切り替わります。ベースとスケールは、前のステップからすでに設定されています。
- TIFFファイル内のすべてのフレームが完了するまで、手順4.1.5〜4.1.7を繰り返します。いったんすべてのフレームが処理されると「エクスポート」ボタンをクリックします。
注:これは、解析されたカンチレバーのTIFFファイル名を含むスプレッドシートファイルを作成します。カンチレバーのどちら側(左または右)を分析するかを含むファイル名を編集します。
- アイコンをクリックしてプログラミングソフトウェアを開きます。上部のメニューバーから「ファイル」 - >「開く」をクリックし、画像解析用の.mスクリプトファイルを選択します。記録されたTIFFイメージが.mファイルと同じフォルダにあることを確認します。 "実行"をクリックしてスクリプトを実行します。
- スプレッドシート内のストレスの計算
- カンチレバーの表面応力「σ」を次の式を用いて計算する:
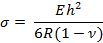
ここで、E、R、 v 、hはそれぞれヤング率、曲率半径、ポアソン比、カンチレバーの厚さである。
注:カンチレバーの厚さは、感度を変更するために変更することができます。本研究では、E = 750 kPa、v = 0.49、h = 25μm13,14とした。 - ステップ4.2.1の式を使用して表面応力を計算します。を開きます。xlsスプレッドシートファイル。出力には、最初に基底と円のx座標とy座標、次に曲率半径を示す複数の列があります。これらに基づいてクリックされた各点のx座標とy座標を計算します。
注:時間経過画像フレームにストレスをプロットすると、時間の経過とともにカンチレバーに加わる力の変化が示されます。トラフは、心筋細胞の弛緩中のカンチレバーに対する応力、または細胞牽引力によるカンチレバーにかかる静的ストレスを示す。ピークは、心筋細胞の拍動によって及ぼされたカンチレバーの動的応力を示す。この値は、心筋細胞の収縮によって生じる力の最大量に対応する。
- カンチレバーの表面応力「σ」を次の式を用いて計算する:
5.スイミングバイオロボッツの解析
- イメージ解析ソフトウェアを使用してビオロボの位置を記録する。
注:使用されるソフトウェアについては、材料リストを参照してください。セクションです。- 画像解析ソフトウェア(ImageJなど)を開きます。 "File"と "Open"を押し、スイミングバイオロボットビデオファイルを選択します。 "OK"をクリックし、プログラムにファイルをロードさせます。スプレッドシートソフトウェアを開きます。
- ロードされたバイオロボットビデオでは、既知の寸法( 例えば、生物学的アクチュエータに埋め込まれた直径3mmのガラスビーズ)の参照を見つける。
注:寸法がわかっているオブジェクトはすべて動作します。これにより、各動画のピクセルと縦の比率が決まります。 - 「ストレート」ツールを使用して、ガラスビーズを横切る線を描きます。 [分析]をクリックし、[スケールを設定]を選択します。 「既知の距離」フィールドを「3000μm」に設定し、「OK」をクリックします。
注:これは、xとy座標をマイクロメートルに設定します。 - マーカーとして機能するように、フレーム間で揺動しないポイントをデバイス上で選択します。
注意:ベースのコーナーを選択することをお勧めします。 - 最初のフレームの5.1.4で選択したポイントをポイントします。スプレッドシートにx座標とy座標を記録します。
- 画像分析ソフトウェアのウィンドウに戻り、右矢印キーを押して次のフレームに変更します。マーカーを再度ポイントし(ステップ5.1.4から)、スプレッドシートにx座標とy座標を記録します。
- すべてのフレームについて手順5.1.6を繰り返します。
- 座標のスプレッドシートを使用して、biorobotの水泳パラメータを計算します。
- 各ビデオの既知のフレームレートからフレーム間の期間を計算します。
- フレーム間のx座標とy座標の変化を計算して、合計距離を含めて移動距離を求めます。
- 最大変化からの収縮の振幅をy軸に沿って計算する。 2つの収縮の間の期間の逆数から各ビオロボの鼓動頻度を決定する。
- Cx方向に動いた総時間と距離から各装置の遊泳速度を計算する。
- 分析された各バイオロボットビデオについて、ステップ5.2を繰り返します。
- 各測定パラメータを標準化する。
注:すべての値を標準化して、違いをより視覚的に視覚化します。このプロトコルは、低周波収縮(水平LF)を伴う水平モードのビオロボット( 図4 ) 7に関する正規化を示す 。
6.タンパク質発現の解析
注: 2.2.4および2.2.5で調製したサンプルを共焦点顕微鏡を用いて画像化した。画像は、同時に3つのチャネル、すなわち、460nm、488nm、および594nmで、20倍、40倍および60倍の倍率で順次取得された。各サンプルの異なる位置から40倍の倍率で5枚の画像のセットを捕捉し、各チャンネルを個々の.TIFFとして保存したファイル。露光設定は、使用された対物レンズの倍率によって決定され、その倍率でのすべての捕捉に対して一定に設定された。
- 画像解析ソフトウェアを開き、「ファイル」 - >「開く」を選択して画像をロードします。
- イメージフレームに四角形のポリゴンを描き、ROIをマークします。 "Analyze" - > "Measure"を選択して平均蛍光強度を測定します。
- ステップ6.2を繰り返して、すべてのサンプルから強度測定値を収集し、各条件についてそれぞれの平均強度を計算する。
注:ここで、異なる条件とは、1日目、2日目、6日目までの異なる時点を指します。 - 結果をスプレッドシートにエクスポートして、統計解析やデータプロットの作成を行います。
結果
図1のデバイスの模式図とスクリーンショットに示すように、薄いPDMSカンチレバー(厚さ25μm)と心筋細胞で作られた生物学的アクチュエータは、水泳バイオロボットのコアを構成します。細胞は培養24時間後に収縮を示し始め、カンチレバーアームの曲げが2日目まで観察された。装置の側面プロファイルを毎日記録し、表面応力をカンチレ?...
ディスカッション
ここで概説した手順は、心筋細胞の付着を促進するPDMSベースのアクチュエータおよびビオロボットのための成功した播種方法を記載する。さらに、細胞の挙動および装置の性能を特徴付ける画像取得およびその後の分析のプロセスが記載された。
我々は、24時間後にカンチレバーアーム上の細胞の自発収縮を観察した;収縮の強度は経時的に着実に増加し続け、6日目に最...
開示事項
著者は何も開示することはない。
謝辞
MT Holleyはルイジアナ理事会のGraduate Fellowsプログラムによって支持されており、C. DanielsonはHoward Hughes Medical Institute教授プログラムの支援を受けています。この研究は、NSFグラント番号:1530884によって支持されている。
資料
| Name | Company | Catalog Number | Comments |
| Chemicals and reagents | |||
| Cardiomyocytes (primary cardiac cells) | Charles River | NA | Isolated from 2-day old neonatal Sprague Dawley rats |
| Dulbecco’s modified eagle’s media (DMEM) | Hyclone Laboratories | 16750-074 | with 4500 mg/L glucose, 4.0 mM L-glutamine, and 110 mg/L sodium pyruvate |
| Fetalclone III serum | Hyclone industries, GE | 16777-240 | Fetal bovin serum (FBS) |
| Dulbecco’s phosphate buffer (PBS) | Sigma-Aldrich | D1408-100ML | |
| Penicillin-G sodium salt | Sigma-Aldrich | P3032 | |
| Goat serum | Sigma-Aldrich | G9023 | |
| 4,6-diamidino-2-phenylindole dihydrocholride powder (DAPI) | Sigma-Aldrich | D9542 | |
| Fibronectin from bovine plasma | Sigma-Aldrich | F1141 | Solution (1 mg/ml) |
| Calcein-AM and ethidium homodimer-1 kit (Live/Dead Assay) | Molecular Probes | L3224 | |
| Calcium Fluo-4, AM | Molecular Probes | F14217 | calcium indicator dye |
| Tyrodes salt solution | Sigma-Aldrich | T2397 | buffer solution |
| Pluronic F-127 | Molecular Probes | P3000MP | nonionic surfactant-20 % solution in Dimethylsiloxane (DMSO) |
| 16% Parafomaldehyde | Electron microscopy | 15710 | Caution: Irritant and combustible |
| Triton x-100 | Sigma-Aldrich | X-100 100 mL | cell lyses detergent, (4-(1,1,3,3-Tetramethylbutyl)phenyl-polyethylene glycol, t-Octylphenoxypolyethoxyethanol, Polyethylene glycol tert-octylphenyl ether) |
| ProLong gold antifade reagent | Molecular Probes | P10144 | Mounting agent |
| Alexa Fluor 594 Phalloidin | Molecular Probes | A12381 | Actin filament marker |
| Goat anti-rabbit IgG (H+L) secondary antibody, Alexa Fluor 594 conjugate | Molecular Probes | A-11012 | |
| pha | Molecular Probes | A-11001 | |
| Anti-connexin 43 antibody | Abcam | ab11370 | Gap junction marker |
| Anti-cardiac troponin I antibody | Abcam | ab10231 | Contractile protein |
| 16% EM grade paraformaldehyde solution | Electron microscopy | 100503-916 | |
| Polydimethylsiloxane (PDMS) | Elsevier | Sylgard 184 | |
| Materials and Equipment | |||
| Camera | Thor Labs | DCC1545M | |
| LED light strip | NA | NA | Any white LED without spectrum emission |
| Confocal microscope | Nikkon C2 | NA | Confocal microscope with three filter set. |
| Zooming lens | Infinity | Model# 252120 | |
| Software | |||
| Matlab | Mathworks | NA | Used in Section 4) for biological actuator analysis. |
| Image J | National Institute of Health | NA | Java-based image processing software. Used in Section 5) for biorobot analysis. Free Image Processing and Analysis software in java. (https://imagej.nih.gov/ij/) |
| Thor Cam | Thor Labs | NA | Camera operating software |
参考文献
- Feinberg, A. W. Biological Soft Robotics. Annu. Rev. Biomed. Eng. 17, 243-265 (2015).
- Akiyama, Y., et al. Room Temperature Operable Autonomously Moving Bio-Microrobot Powered by Insect Dorsal Vessel Tissue. PLOS ONE. 7, 38274 (2012).
- Herr, H., Dennis, R. G. A swimming robot actuated by living muscle tissue. J. NeuroEng Rehabil. 1, 6 (2004).
- Park, S., et al. Phototactic guidance of a tissue-engineered soft-robotic ray. Science. 353 (6295), 158-162 (2016).
- Cvetkovic, C., et al. Three-dimensionally printed biological machines powered by skeletal muscle. Proc. Natl. Acad. Sci. 111, 10125-10130 (2014).
- Williams, B. J., Anand, S. V., Rajagopalan, J., Saif, M. T. A. A self-propelled biohybrid swimmer at low Reynolds number. Nat. Commun. 5, (2014).
- Holley, M. T., Nagarajan, N., Danielson, C., Zorlutuna, P., Park, K. Development and characterization of muscle-based actuators for self-stabilizing swimming biorobots. Lab. Chip. 16, 3473-3484 (2016).
- Hopkins, P. M. Skeletal muscle physiology. Contin Educ Anaesth Crit Care Pain. 6, 1-6 (2006).
- Nawroth, J., et al. A tissue-engineered jellyfish with biomimetic propulsion. Nat Biotechnol. 30 (8), 729-797 (2012).
- Ehler, E., Moore-Morris, T., Lange, S. Isolation and Culture of Neonatal Mouse Cardiomyocytes. J. Vis. Exp. JoVE. (79), e50154 (2013).
- Bers, D. M. Calcium Fluxes Involved in Control of Cardiac Myocyte Contraction. Circ. Res. 87, 275-281 (2000).
- Shin, S. R., et al. Carbon-Nanotube-Embedded Hydrogel Sheets for Engineering Cardiac Constructs and Biological actuators. ACS Nano. 7, 2369-2380 (2013).
- Park, J., et al. Real-Time Measurement of the Contractile Forces of Self-Organized Cardiomyocytes on Hybrid Biopolymer Microcantilevers. Anal. Chem. 77, 6571-6580 (2005).
- Tamayo, J., et al. Quantification of the surface stress in microcantilever biosensors: revisiting Stoney's equation. Nanotechnology. 23, 475702 (2012).
- Nunes, S. S., et al. Biowire: a platform for maturation of human pluripotent stem cell-derived cardiomyocytes. Nat. Methods. 10, 781-787 (2013).
- Louch, W. E., Sheehan, K. A., Wolska, B. M. Methods in Cardiomyocyte Isolation, Culture, and Gene Transfer. J. Mol. Cell. Cardiol. 51, 288-298 (2011).
- Alford, P. W., Feinberg, A. W., Sheehy, S. P., Parker, K. K. Biohybrid thin films for measuring contractility in engineered cardiovascular muscle. Biomaterials. 31, 3613-3621 (2010).
- Sfakiotakis, M., Lane, D. M., Davies, J. B. C. Review of fish swimming modes for aquatic locomotion. IEEE J. Ocean. Eng. 24, 237-252 (1999).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved