Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Мышцы на основе сердечной мышцы и самостабилизирующий биоробот - часть 2
В этой статье
Резюме
В этом исследовании биологический актуатор и самостабилизирующийся плавательный биоробот с функционализированными эластомерными кантилеверными рукавами высеиваются с кардиомиоцитами, культивируются и характеризуются их биохимическими и биомеханическими свойствами с течением времени.
Аннотация
В последние годы были разработаны гибридные устройства, которые состоят из живой клетки или тканевого компонента, объединенного с синтетической механической основой. Эти устройства, называемые биороботами, питаются исключительно силой, создаваемой сократительной активностью живого компонента, и, благодаря их многочисленным присущим преимуществам, могут быть альтернативой обычным полностью искусственным роботам. Здесь мы расскажем о методах проращивания и характеризации биологического актуатора и биоробота, который был спроектирован, изготовлен и функционализирован в первой части этой статьи из двух частей. Изготовленные биологические приводы и устройства биоробота, состоящие из основания полидиметилсилоксана (PDMS) и тонкопленочного кантилевера, были функционализированы для прикрепления клеток фибронектином. После функционализации неонатальные кардиомиоциты крысы высевали на консоль PDMS с высокой плотностью, что приводило к образованию конфлюэнтного листа клеток. Устройства отображались каждый день, и движение кантиБыло проанализировано плечо рычага. На второй день после посева мы наблюдали изгиб консольных рычагов из-за сил, оказываемых клетками во время спонтанных сокращений. При количественном анализе изгиба кантилевера наблюдалось постепенное увеличение поверхностного напряжения, оказываемого клетками по мере их созревания во времени. Аналогично, мы наблюдали движение биоробота из-за приведения консольного рычага PDMS, который действовал как плавник. При количественном определении плавательных профилей устройств наблюдались различные двигательные моды, на которые влиял угол покоя плавника. Направление движения и частота биений также определялись углом покоя плавника, и наблюдалась максимальная скорость плавания 142 мкм / с. В этой рукописи мы описываем процедуру заполнения сфабрикованных устройств кардиомиоцитами, а также оценки активности биологического актуатора и биоробота.
Введение
Биороботы - это устройства, основанные на живых клетках, которые встроены в механическую основу, которая обычно состоит из мягких эластичных материалов, таких как PDMS или гидрогели 1 . Клетки подвергаются ритмическим сокращениям, либо спонтанно, либо в ответ на стимулы, и, таким образом, функционируют как исполнительный механизм. Мощность, вырабатываемая при сокращении клеток, приводит в действие различные биороботы. Млекопитающие клетки сердца (кардиомиоциты) и скелетные мышечные клетки часто используются для активации биоробота из-за их сократительных свойств. Помимо кардиомиоцитов и скелетных мышечных клеток были использованы другие типы клеток, такие как мышечные ткани насекомых 2 и эксплантированные мышечные ткани 3 . Мышечные ткани насекомых позволяют работать биологическим актуаторам при комнатной температуре.
Функции и характеристики биоробота в основном определяются прочностью и согласованностью биологического привода ( т.е., Мышечные клетки), тогда как механическая структура позвоночника в первую очередь определяет механизмы локомоции, стабильности и мощности. Поскольку эти устройства управляются исключительно силами, генерируемыми ячейками, химических загрязнителей и рабочих шумов нет. Поэтому они образуют энергосберегающую альтернативу другим обычным роботам. В различных литературных источниках обсуждались различные способы интеграции живых клеток и тканей в биороботы 1 , 4 , 5 . Достижения в области микротехнологий и методов тканевой инженерии позволили разработать биороботы, которые могут ходить, захватывать, плавать или накачивать 5 , 6 . В общем, клетки культивируют непосредственно на механической (полимерной) скелете в качестве слитого клеточного листа или они формованы в трехмерные исполнительные структуры внутри каркасов, таких как кольца и полосы. Чаще всего, биороботыИзготовленных с использованием листов 6 , 7 кардиомиоцитов, так как эти клетки обладают врожденной способностью демонстрировать спонтанное сокращение без внешних раздражителей. С другой стороны, сообщения о листах клеток скелетных мышц ограничены из-за их потребности в стимулах для инициации сокращений в пробирке , чтобы инициировать деполяризацию мембраны 8 .
Этот протокол вначале описывает, как отбирать кардиомиоциты на функционализированном биологическом приводе, сделанном из тонкого кантилевера PDMS. Затем он подробно описывает посев и анализ плавательных профилей. Кантилевер функционализирован клеточным клеточным белком, таким как фибронектин, и высевается в сливной последовательности с кардиомиоцитами. Поскольку ячейки, посеянные на устройстве, сокращаются, они заставляют кантилевер согнуть и таким образом действовать как исполнительный механизм. Со временем, когда клетки созревают, мы отслеживаем изменения поверхностного стресса на устройстве, анализируя видеороликиИзгиб кантилевера. Разработанный здесь биологический актуатор может быть использован для определения сократительных свойств любого типа клеток, таких как фибробласты или индуцированные плюрипотентные стволовые клетки, поскольку они подвергаются дифференциации.
Большая часть ранних исследований по биороботам была сосредоточена на разработке биологических актуаторов, в то время как оптимизация архитектуры биоробота и функциональных возможностей в основном игнорировалась. Недавно несколько исследований продемонстрировали реализацию режимов плавания в биороботах, которые вдохновлены природой. Например, были спроектированы плавающие биороботы с движением на основе жгутиков 6 , движением медуз 9 и биогибридическими лучами 4 . В отличие от других работ в литературе, здесь мы сосредоточимся на изменении свойств механической основы для создания самостабилизирующей структуры. Биоробот, развитый в этом исследовании, способен поддерживать постоянную подачу, крен и imКак она плавает. Эти параметры могут быть изменены путем изменения толщины каждого базового композита. Этапы изготовления, связанные с разработкой привода PDMS, погружаемого биоробота и функционализацией устройства, подробно описаны в первой части этой статьи из двух частей, а также в нашей недавней работе 7. Разработанная здесь техника может проложить Способ разработки новых, высокоэффективных биороботов для различных применений, таких как доставка грузов.
Процесс изоляции, использованный в этом исследовании, аналогичен процессу, описанному в более ранней работе 10 , а также в недавно опубликованной работе 7 . Методы микроизбрания, используемые для изготовления приводов ПДМС и устройств биоробота, подробно описаны в части 1 этой двухчастной рукописи. Раздел протокола этой рукописи описывает шаги, вовлеченные в посев кардиомиоцитов на сфабрикованную PDMS aCtuator и биоробот после их функционализации клеточными клеточными белками.
протокол
Все описанные здесь процедуры были выполнены с использованием утвержденного протокола и в соответствии с положениями Комитета по институциональному уходу и использованию животных Университета Нотр-Дам.
1. Клеточное поселение и культура
- Перед началом подготовьте необходимые предметы: небольшую воронку, пипетки и теплую модифицированную по Дульбекко среду Игла (DMEM), дополненную 10% фетальной бычьей сывороткой (FBS) и 1% антибиотика пенициллина (полная DMEM).
- Возьмите колбы Т-25 вместе с функционализированным устройством (биологическим приводом или биороботом) внутри него. Обратитесь к разделу 4 части 1 этой двухчастной рукописи за деталями относительно подготовки устройства, его функционализации и хранения до посева клеток.
- Подготовьте воронку, которая может быть сделана путем прокатки небольшого квадратного пластикового листа. Поместите его над биологическим приводом или биороботом внутри колбы Т-25. Отрегулируйте диаметр более широкого конца, чтобы он подходил ко всему устройствуИ высоту так, чтобы она плотно прилегла, когда верхняя часть колбы затянута.
- Для биороботов используйте магнит, чтобы удерживать устройство на дне колбы на протяжении всего процесса посева.
Примечание : здесь использовался один неодимовый дисковый магнит (диаметром 1,26 дюйма), но любой магнит подобного размера и прочности может также использоваться для удержания биоробота с композитным основанием магнитного никель-ПДМС. - УФ стерилизовать пластиковый лист в течение как минимум 30 минут перед использованием.
- Для биороботов используйте магнит, чтобы удерживать устройство на дне колбы на протяжении всего процесса посева.
- Убедитесь, что между основанием воронки и колбой нет большого зазора.
- Ресуспендируют кардиомиоциты в DMEM полной при плотности 1,6 x 10 7 клеток / мл и медленно опускают 400 мкл суспензии на устройство через воронку. Используйте гемоцитометр или любой другой счетчик клеток, чтобы определить количество полученных клеток.
- Медленно переместите систему обратно в инкубатор, не нарушая работу устройства, и воронкугин. Культура в течение 24 часов при 37 ° C.
- После инкубационного периода медленно удаляют воронку, осторожно промывают образец PBS и снова наполняют колбу 10 мл свежего DMEM.
Примечание. Для биороботов удалите магнит, чтобы устройство находилось на плаву.
2. Биохимическая характеристика
- Анализ потока кальция
Примечание : анализ потока кальция проводится для оценки межсоединения клеток. Процедура загрузки клеток флуоресцентным, кальций-ионным красителем следует за процессом, описанным в ранее установленном протоколе 11 .- Сначала приготовьте необходимые материалы, сложный эфир фторо-4-ацетометил (АМ) кальция, неионный поверхностно-активный полиол (см. Таблицу материалов ) и солевой раствор Tyrode.
- Используя длинные пинцеты, аккуратно переносите устройство из культуральной колбы в 35-миллиметровую чашку Петри с 2 мл соли Торода Тион.
- В отдельную пробирку для центрифугирования берут 1 мл теплого раствора Tyrode (нагревают до 37 o C) и добавляют 3-5 мкл исходного красителя кальция флюро-4 AM (рабочая концентрация: 3-5 мкМ) и равную часть неионогенного поверхностно-активного вещества Полиол (рабочая концентрация: 0,2%). Замените раствор образца теплым раствором Tyrode, дополненным красителем индикатора кальция, fluo-4 и 0,2% неионогенным поверхностно-активным веществом. Инкубируйте в течение 25 - 30 минут при 37 ° C.
- Удалите раствор красителя и аккуратно промойте образец свежим раствором Tyrode. Повторно инкубируйте образец в 2 мл свежего DMEM в течение еще 30 минут при 37 ° C перед визуализацией.
Примечание. Результаты этого анализа и связанного с ним видео приведены в опубликованной ранее работе 7 .
- иммунофлюоресценция
Примечание : двойное иммунное окрашивание всех образцов проводили по ранее установленному протоколу> 12.- Сначала готовят 10% козьей сыворотки (GS) в фосфатно-буферном солевом растворе (PBS), 4% параформальдегиде (PFA) в диH 2 O, 0,1% моющем средстве для лизиса клеток (см. Таблицу материалов ) в PBS, Мышиные моноклональные антитела к сердечному тропонину-I и антикроличьи моноклональные антитела коннексины-43), вторичные антитела (конъюгат Alexa 594 и конъюгат козы против мышиного IgG (H + L) Alexa 488) и DAPI.
Предостережение : Параформальдегид является канцерогенным. - Удалить интересующий образец из колбы и осторожно промыть его дважды PBS. Обратитесь к разделу 4 части 1 этой двухчастной рукописи за деталями относительно подготовки и функционализации образца.
- Добавить капельницу PBS на небольшое покровное стекло (диаметр 12 мм или 15 мм). Аккуратно удержите основание устройства с помощью пинцета и вырежьте тонкие плечи PDMS (консоль, рис. 1 ), используя ножницы с конца, где он соединяется с верхней частью основанияе. Перенесите кронштейны кантилевера на капельку с прикрепленной к ячейке стороной вверх. Капелька PBS предотвратит высыхание клеток.
- Закрепите образцы 4% PFA и выполните двойное иммуноокрашивание образцов, как описано ранее 12 .
- После иммунного окрашивания образцы помещают на чистую стеклянную скользящую поверхность с использованием анти-увядающего реагента для установки и откладывают, не трогая, в темноте в течение 24 часов.
- Повторите процедуру для всех образцов.
Примечание. Результаты этого анализа и связанных с ним изображений подробно обсуждаются в ранее опубликованной работе 7 .
- Сначала готовят 10% козьей сыворотки (GS) в фосфатно-буферном солевом растворе (PBS), 4% параформальдегиде (PFA) в диH 2 O, 0,1% моющем средстве для лизиса клеток (см. Таблицу материалов ) в PBS, Мышиные моноклональные антитела к сердечному тропонину-I и антикроличьи моноклональные антитела коннексины-43), вторичные антитела (конъюгат Alexa 594 и конъюгат козы против мышиного IgG (H + L) Alexa 488) и DAPI.
3. Отображение
- Поместите колбу Т-25 вертикально в CO 2 -инкубатор и подготовьте систему формирования изображения внутри инкубатора. Запишите устройство с помощью камеры (см. Таблицу материалов ) с помощью зум- объектива (см. Таблицу материалов ). Для источника света,Используйте полосу светодиодных огней.
Примечание: здесь использовалась полоска светодиодов белого света, но любые нормальные светодиоды также будут работать. - Подключите камеру к операционной системе и откройте программное обеспечение камеры (см. Таблицу материалов ). Щелкните изображение камеры под вкладкой «Файл» на верхней панели, чтобы открыть все параметры камеры, и выберите нужную камеру.
- Выберите «live» из списка вкладок на верхней панели программного обеспечения.
- Вручную вставьте изображение в фокус, отрегулировав шкалу объектива. Выберите «Обрезать до интересующей области (ROI)» с верхней панели. Затем вручную нарисуйте прямоугольник в кадре видеоизображения, охватывающий биологическое исполнительное устройство и кронштейны консолей, чтобы отметить ROI.
Примечание . Выбор подходящего значения ROI минимизирует размер файлов изображений.- В случае биороботов захватите весь экран, чтобы записать плавающее движение устройства.
ПРИМЕЧАНИЕ. Нет необходимости рисовать рентабельность для биороботов
- В случае биороботов захватите весь экран, чтобы записать плавающее движение устройства.
- Перед началом записи выберите «Настройки камеры» на одной из вкладок в верхней панели на экране. Установите частоту кадров, отрегулировав экспозицию и соотношение пикселей в реальном изображении, сдвинув планку для каждого или вручную введя значения. Установите частоту кадров примерно 30 ± 2 кадр / с.
Примечание. Изменение экспозиции и соотношения пикселей изменяет яркость и контрастность живого изображения. - Нажмите кнопку «Запись» на верхней панели программного обеспечения, чтобы начать запись видеороликов исполнителей с разрешением 1000 x 1000 пикселей ровно 30 секунд. Повторите процесс для всех образцов.
4. Анализ изображений биологических актуаторов на стационарной основе
- Проанализируйте изображения, используя программное обеспечение ( например, Matlab), запускающее пользовательский скрипт. См. Таблицу материалов и Дополнительный файл для получения дополнительной информации .
Примечание. Сценарий отображает каждый кадр записанных видеороликов, принимает ввод мыши пользователя, чтобы записывать координаты точек кантилевера на изображениях, вычисляет диаметр и центр круга, который проходит введенные точки, с помощью метода наименьших квадратов, и Экспортирует все введенные и рассчитанные данные для дальнейшего использования.- Откройте программное обеспечение, щелкнув значок. Нажмите «Файл» → «Открыть» в строке меню вверху и выберите файл сценария .m для анализа изображений. Убедитесь, что записанные изображения в формате TIFF находятся в одной папке с файлом .m. Нажмите «Запустить», чтобы запустить скрипт.
Примечание. Появится диалоговое окно для изменения. - Нажмите «play» для запуска текущей программы. Нажмите кнопку «Открыть» и найдите файл TIFF, который будет анализироваться.
- Нажмите кнопку "base & #34; И затем нажмите на точку, где консоль прикрепляется к основанию наверху; Нажмите enter. Это поместит квадратный маркер на изображении для каждого кадра, чтобы обозначить расположение основания кантилевера.
- Нажмите кнопку «Масштаб», а затем вручную щелкните по одному краю стеклянной бусины. Принесите указатель мыши на противоположную сторону стеклянной бусины и нажмите «Enter».
Примечание. Для этого необходимо начертить линию, измеряющую диаметр стеклянной бусины. Поскольку стеклянная бусина имеет диаметр 3 мм, это будет относиться к отображаемым пикселям 3 мм. - Нажмите кнопку «Анализировать». Щелкните вдоль кантилевера на небольшом расстоянии от первого квадратного маркера, который представляет основание кантилевера.
- Нажмите кнопку «Анализировать». Затем щелкните мышью вдоль кантилевера на небольшом расстоянии от первого квадратного маркера, который представляет основание кантилевера. Продолжайте нажимать вдоль кантилевера, включая подсказку, и нажимайте клавишу ввода, когдасделанный. Это поместит «x» в каждую точку, нажатую на кантилевер.
Примечание . На основе координации квадратного маркера и маркеров x центр и диаметр круга будут вычисляться с использованием функции наименьшего квадратичного подбора (см. Прилагаемый дополнительный файл для используемого сценария). Круг, который пропускает маркеры x и квадратный мейкер, будет автоматически наложен на изображение. - Проверьте, правильно ли наложенная окружность прослеживает профиль кантилевера.
Примечание : Когда кантилевер очень плоский, трудно судить, правильно ли прорисован профиль кантилевера. См . Рисунок 3 . - Нажмите кнопку «Следующий кадр». Это переключится на следующий кадр в файле TIFF. Базис и масштаб уже установлены с предыдущего шага.
- Повторите шаги с 4.1.5 по 4.1.7, пока все фреймы в файле TIFF не будут завершены. Как только все кадры были процеНажмите «Экспорт».
Примечание . Это создаст файл электронной таблицы с именем файла TIFF для только что проанализированного кантилевера. Отредактируйте имя файла, чтобы указать, какая сторона (слева или справа) кантилевера была проанализирована.
- Откройте программное обеспечение, щелкнув значок. Нажмите «Файл» → «Открыть» в строке меню вверху и выберите файл сценария .m для анализа изображений. Убедитесь, что записанные изображения в формате TIFF находятся в одной папке с файлом .m. Нажмите «Запустить», чтобы запустить скрипт.
- Вычисление напряжения в электронной таблице.
- Вычислите поверхностное напряжение «σ» на кантилевере, используя следующее уравнение:
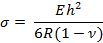
Где E, R, v и h - модуль Юнга, радиус кривизны, коэффициент Пуассона и толщина кантилевера соответственно.
Примечание : Толщина кантилевера может быть изменена для изменения чувствительности. В этом исследовании значения были следующими: E = 750 кПа, v = 0,49 и h = 25 мкм 13 , 14 . - Вычислите поверхностное напряжение, используя уравнение, приведенное на этапе 4.2.1. Открой .Xls файл таблицы. Обратите внимание, что на выходе есть несколько столбцов, показывающих сначала координаты x и y основания и круга, а затем радиус кривизны. Вычислите координаты x и y каждой точки, нажатой на основе этих.
Примечание. Нанесение напряжений на кадры изображения замедленного действия показывает изменение силы, действующей на кантилевер с течением времени. Прогибы показывают напряжение на кантилевере во время релаксации кардиомиоцитов или статическое напряжение, действующее на кантилевер из-за сил тяги клеток. Пики показывают динамическое напряжение на кантилевере, которое было вызвано биением кардиомиоцитов. Это значение соответствует максимальной величине силы, создаваемой сокращением кардиомиоцитов.
- Вычислите поверхностное напряжение «σ» на кантилевере, используя следующее уравнение:
5. Анализ плавательных биороботов
- Запишите положение биоробота с помощью программного обеспечения для анализа изображений.
Примечание. Список материалов для программного обеспечения,Есть раздел.- Откройте программное обеспечение для анализа изображений ( например, ImageJ). Нажмите «Файл» и «Открыть» и выберите видеофайл плавательного биоробота. Нажмите «ОК» и дайте программе загрузить файл. Откройте программу для работы с электронными таблицами.
- В загруженном видеоролике биоробота найдите ссылку на известные размеры ( например, стеклянный шарик диаметром 3 мм, который был встроен в биологический привод).
Примечание. Любой объект с известным размером будет работать. Это определит отношения пикселей к длине в каждом видео. - Используйте инструмент «Прямой», чтобы нарисовать линию поперек стеклянной бусины. Нажмите «Анализ» и выберите «Установить масштаб». Установите поле «Известное расстояние» на «3000 мкм» и нажмите «ОК».
Примечание : Это установит координаты x и y на микрометры. - Выберите точку на устройстве, которая не качается между кадрами, чтобы действовать как маркер.
Заметка:Рекомендуется выбирать угол основания. - Укажите на выбранную точку в 5.1.4 в первом кадре. Запишите координаты x и y в электронной таблице.
- Вернитесь в окно программного обеспечения анализа изображений и нажмите клавишу со стрелкой вправо, чтобы перейти к следующему кадру. Снова укажите маркер (шаг 5.1.4) и запишите координаты x и y в электронной таблице.
- Повторите шаг 5.1.6 для всех кадров.
- Рассчитайте параметры плавания биоробота с помощью электронной таблицы координат 7 .
- Рассчитать период между кадрами с известной частотой кадров для каждого видео.
- Вычислить изменение координат x и y между кадрами, чтобы найти перемещенное расстояние, включая общее расстояние.
- Рассчитайте амплитуду сокращения от максимального изменения вдоль оси y. Определите частоту биений для каждого биоробота по сравнению с периодом между двумя сокращениями.
- САллюмируйте скорость плавания каждого устройства из общего времени и расстояния, перемещаемого в направлении х.
- Повторите шаг 5.2 для каждого видеоролика биоробота, который был проанализирован.
- Нормализовать каждый измеряемый параметр.
Примечание : нормализовать все значения, чтобы лучше визуализировать различия. Этот протокол демонстрирует нормализацию в отношении горизонтального режима биоробота с низкочастотными сокращениями (горизонтальный НЧ) ( рисунок 4 ) 7 .
6. Анализ экспрессии белка
Примечание: смонтированные образцы, подготовленные на этапах 2.2.4 и 2.2.5, были отображены с использованием конфокального микроскопа. Изображения были получены с увеличением 20X, 40X и 60X последовательно по трем каналам одновременно: 460 нм, 488 нм и 594 нм. Набор из 5 изображений был захвачен при 40-кратном увеличении, с разных позиций для каждого образца, и каждый канал был сохранен как индивидуальный .TIFFфайл. Установка экспозиции была определена увеличением используемого объектива и была установлена постоянной для всех снимков при этом увеличении.
- Откройте программу анализа изображений и выберите «Файл» → «Открыть», чтобы загрузить изображения.
- Нарисуйте прямоугольный многоугольник на рамке изображения, чтобы отметить ROI. Выберите «Analyze» -> «Measure», чтобы измерить среднюю интенсивность флуоресценции.
- Повторите шаг 6.2, чтобы собрать измерения интенсивности из всех проб и вычислить соответствующую среднюю интенсивность для каждого условия.
Примечание . Здесь другое условие относится к разным временным точкам, как в, день 1, день 2 и до дня 6. - Экспортируйте результаты в электронную таблицу для дальнейшего статистического анализа и для создания графиков данных.
Результаты
Биологический исполнительный механизм, выполненный из тонкого кантилевера PDMS (толщиной 25 мкм) и кардиомиоцитов, составляет ядро плавательного биоробота, как показано на схеме и скриншоте устройств на рисунке 1 . Клетки начинают проявлять схватки через 24 ч...
Обсуждение
Процедура, описанная здесь, описывает успешный метод высева для приводов и биороботов на основе PDMS, который облегчает прикрепление кардиомиоцитов. Кроме того, описан процесс получения изображений и последующий анализ, который характеризует поведение ячеек и производительность устро...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
MT Holley поддерживается программой Graduate Fellows Совета регентов штата Луизиана, а К.Дениэлсона поддерживает программа профессоров Медицинского института Ховарда Хьюза. Это исследование поддерживается грантом NSF № 1530884.
Материалы
| Name | Company | Catalog Number | Comments |
| Chemicals and reagents | |||
| Cardiomyocytes (primary cardiac cells) | Charles River | NA | Isolated from 2-day old neonatal Sprague Dawley rats |
| Dulbecco’s modified eagle’s media (DMEM) | Hyclone Laboratories | 16750-074 | with 4500 mg/L glucose, 4.0 mM L-glutamine, and 110 mg/L sodium pyruvate |
| Fetalclone III serum | Hyclone industries, GE | 16777-240 | Fetal bovin serum (FBS) |
| Dulbecco’s phosphate buffer (PBS) | Sigma-Aldrich | D1408-100ML | |
| Penicillin-G sodium salt | Sigma-Aldrich | P3032 | |
| Goat serum | Sigma-Aldrich | G9023 | |
| 4,6-diamidino-2-phenylindole dihydrocholride powder (DAPI) | Sigma-Aldrich | D9542 | |
| Fibronectin from bovine plasma | Sigma-Aldrich | F1141 | Solution (1 mg/ml) |
| Calcein-AM and ethidium homodimer-1 kit (Live/Dead Assay) | Molecular Probes | L3224 | |
| Calcium Fluo-4, AM | Molecular Probes | F14217 | calcium indicator dye |
| Tyrodes salt solution | Sigma-Aldrich | T2397 | buffer solution |
| Pluronic F-127 | Molecular Probes | P3000MP | nonionic surfactant-20 % solution in Dimethylsiloxane (DMSO) |
| 16% Parafomaldehyde | Electron microscopy | 15710 | Caution: Irritant and combustible |
| Triton x-100 | Sigma-Aldrich | X-100 100 mL | cell lyses detergent, (4-(1,1,3,3-Tetramethylbutyl)phenyl-polyethylene glycol, t-Octylphenoxypolyethoxyethanol, Polyethylene glycol tert-octylphenyl ether) |
| ProLong gold antifade reagent | Molecular Probes | P10144 | Mounting agent |
| Alexa Fluor 594 Phalloidin | Molecular Probes | A12381 | Actin filament marker |
| Goat anti-rabbit IgG (H+L) secondary antibody, Alexa Fluor 594 conjugate | Molecular Probes | A-11012 | |
| pha | Molecular Probes | A-11001 | |
| Anti-connexin 43 antibody | Abcam | ab11370 | Gap junction marker |
| Anti-cardiac troponin I antibody | Abcam | ab10231 | Contractile protein |
| 16% EM grade paraformaldehyde solution | Electron microscopy | 100503-916 | |
| Polydimethylsiloxane (PDMS) | Elsevier | Sylgard 184 | |
| Materials and Equipment | |||
| Camera | Thor Labs | DCC1545M | |
| LED light strip | NA | NA | Any white LED without spectrum emission |
| Confocal microscope | Nikkon C2 | NA | Confocal microscope with three filter set. |
| Zooming lens | Infinity | Model# 252120 | |
| Software | |||
| Matlab | Mathworks | NA | Used in Section 4) for biological actuator analysis. |
| Image J | National Institute of Health | NA | Java-based image processing software. Used in Section 5) for biorobot analysis. Free Image Processing and Analysis software in java. (https://imagej.nih.gov/ij/) |
| Thor Cam | Thor Labs | NA | Camera operating software |
Ссылки
- Feinberg, A. W. Biological Soft Robotics. Annu. Rev. Biomed. Eng. 17, 243-265 (2015).
- Akiyama, Y., et al. Room Temperature Operable Autonomously Moving Bio-Microrobot Powered by Insect Dorsal Vessel Tissue. PLOS ONE. 7, 38274 (2012).
- Herr, H., Dennis, R. G. A swimming robot actuated by living muscle tissue. J. NeuroEng Rehabil. 1, 6 (2004).
- Park, S., et al. Phototactic guidance of a tissue-engineered soft-robotic ray. Science. 353 (6295), 158-162 (2016).
- Cvetkovic, C., et al. Three-dimensionally printed biological machines powered by skeletal muscle. Proc. Natl. Acad. Sci. 111, 10125-10130 (2014).
- Williams, B. J., Anand, S. V., Rajagopalan, J., Saif, M. T. A. A self-propelled biohybrid swimmer at low Reynolds number. Nat. Commun. 5, (2014).
- Holley, M. T., Nagarajan, N., Danielson, C., Zorlutuna, P., Park, K. Development and characterization of muscle-based actuators for self-stabilizing swimming biorobots. Lab. Chip. 16, 3473-3484 (2016).
- Hopkins, P. M. Skeletal muscle physiology. Contin Educ Anaesth Crit Care Pain. 6, 1-6 (2006).
- Nawroth, J., et al. A tissue-engineered jellyfish with biomimetic propulsion. Nat Biotechnol. 30 (8), 729-797 (2012).
- Ehler, E., Moore-Morris, T., Lange, S. Isolation and Culture of Neonatal Mouse Cardiomyocytes. J. Vis. Exp. JoVE. (79), e50154 (2013).
- Bers, D. M. Calcium Fluxes Involved in Control of Cardiac Myocyte Contraction. Circ. Res. 87, 275-281 (2000).
- Shin, S. R., et al. Carbon-Nanotube-Embedded Hydrogel Sheets for Engineering Cardiac Constructs and Biological actuators. ACS Nano. 7, 2369-2380 (2013).
- Park, J., et al. Real-Time Measurement of the Contractile Forces of Self-Organized Cardiomyocytes on Hybrid Biopolymer Microcantilevers. Anal. Chem. 77, 6571-6580 (2005).
- Tamayo, J., et al. Quantification of the surface stress in microcantilever biosensors: revisiting Stoney's equation. Nanotechnology. 23, 475702 (2012).
- Nunes, S. S., et al. Biowire: a platform for maturation of human pluripotent stem cell-derived cardiomyocytes. Nat. Methods. 10, 781-787 (2013).
- Louch, W. E., Sheehan, K. A., Wolska, B. M. Methods in Cardiomyocyte Isolation, Culture, and Gene Transfer. J. Mol. Cell. Cardiol. 51, 288-298 (2011).
- Alford, P. W., Feinberg, A. W., Sheehy, S. P., Parker, K. K. Biohybrid thin films for measuring contractility in engineered cardiovascular muscle. Biomaterials. 31, 3613-3621 (2010).
- Sfakiotakis, M., Lane, D. M., Davies, J. B. C. Review of fish swimming modes for aquatic locomotion. IEEE J. Ocean. Eng. 24, 237-252 (1999).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены