需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
心肌肌细胞基致动器和自稳定Biorobot - 第2部分
摘要
在这项研究中,生物致动器和具有功能化的弹性悬臂的自稳定游泳混合动物用心肌细胞接种,培养并表征其随时间的生物化学和生物力学性质。
摘要
近年来,已经开发了由与合成机械骨架集成的活细胞或组织组分组成的混合装置。被称为双子座的这些装置仅由活体部件的收缩活动所产生的力量驱动,并且由于其许多固有的优点,可以替代传统的全人造机器人。在这里,我们将描述在这篇两部分文章的第一部分中设计,制造和功能化的生物致动器和biorobot的种子和特征的方法。由聚二甲基硅氧烷(PDMS)和薄膜悬臂组成的制造的生物致动器和双穴装置功能化用于纤连蛋白的细胞附着。在功能化之后,将新生大鼠心肌细胞以高密度接种到PDMS悬臂上,产生汇合的细胞片。这些装置每天都被成像,并且运动着分析杠杆臂。在播种后第二天,我们观察到由于在自发收缩期间由细胞施加的力,悬臂的弯曲。通过对悬臂弯曲的定量分析,观察到细胞随着时间的推移逐渐增加,细胞表面应力逐渐增长。同样,我们观察到由于作为翅片的PDMS悬臂的致动而引起的Biorobot的运动。在对装置的游泳轮廓进行定量时,观察到各种推进模式,其受到翅片的静止角度的影响。运动方向和跳动频率也由翅片的静止角确定,观察到最大游泳速度为142μm/ s。在这份手稿中,我们描述了使用心肌细胞填充制造的装置的过程,以及生物致动器和biorobot活动的评估。
引言
双子座是基于活细胞的装置,其结合在通常由软弹性材料如PDMS或水凝胶1组成的机械骨架内。细胞会自发地或响应于刺激而进行节律性收缩,从而起到致动器的作用。从细胞收缩产生的力量驱动各种biorobots。由于其收缩性质,哺乳动物心脏细胞(心肌细胞)和骨骼肌细胞通常用于生物手术致动。除了心肌细胞和骨骼肌细胞外,还使用了其他细胞类型,例如昆虫肌肉组织2和外植体肌肉组织3 。昆虫肌肉组织使得能够在室温下操作生物致动器。
biorobot的功能和性能主要取决于生物致动器的强度和一致性( 即,。肌肉细胞),而机械骨架结构主要决定运动,稳定性和功率的机制。由于这些装置仅由电池产生的力驱动,所以没有化学污染物或操作噪声。因此,它们与其他常规机器人形成了节能替代品。各种文献来源讨论了将活细胞和组织整合到biorobots 1,4,5中的不同方法。微型加工和组织工程技术的进步使得能够开发可以步行,抓地力,游泳或泵送的5号飞机的6,6。通常,将细胞作为汇合的细胞片材直接培养到机械(聚合物)主链上,或者它们被模制成支架例如环和条带中的3维致动结构。最常见的是biorobots使用心肌细胞片6,7制造 ,因为这些细胞具有在没有外部刺激的情况下表现出自发收缩的先天能力。另一方面,关于骨骼肌细胞片的报道是有限的,因为它们需要刺激以在体外引发收缩以引发膜去极化8 。
该协议首先描述了如何将心肌细胞种植在由薄PDMS悬臂制成的功能化生物致动器上。然后详细描述游泳剖面的种子和分析。悬臂用细胞粘附蛋白如纤连蛋白进行功能化,并与心肌细胞融合。随着细胞在装置上的接合,它们使悬臂弯曲,从而作为致动器。随着时间的推移,随着细胞的成熟,我们通过分析视频来跟踪设备表面应力的变化悬臂弯曲。这里开发的生物致动器可用于确定任何细胞类型的收缩性质,例如成纤维细胞或诱导的多能干细胞,因为它们经历分化。
早期的Biorobots研究一直集中在开发生物执行器上,而Biorobot架构和功能能力的优化在很大程度上被忽视。最近有一些研究表明,在自然界受到启发的Biorobots中实施游泳模式。例如,已经设计了具有基于鞭毛的运动6 ,水母推进9和生物混合射线4的游泳芭比娃娃。与文学中的其他作品不同,这里我们着重于改变机械骨架的性质,以创建一个自稳定结构。在这项研究中开发的biorobot能够保持恒定的音调,滚动和静音游泳深度,游泳。可以通过改变每个基础复合材料的厚度来修改这些参数。在开发PDMS执行器,潜水手电筒和设备功能化过程中涉及的制造步骤在本文的两部分文章的第1部分以及我们最近的工作中进行了详细描述7。这里开发的技术可以铺设开发用于各种应用的新颖,高效的Biorobots的方式,例如货物交付。
本研究中遵循的隔离过程类似于早期工作10中描述的过程,以及最近发表的工作。用于制造PDMS执行器和双子座装置的微加工方法在这两部分手稿的第1部分中有详细描述。该手稿的协议部分描述了将心肌细胞接种到制造的PDMS上的步骤a在使用细胞粘附蛋白进行功能化之后,它们可以用于制造和制造。
研究方案
这里描述的所有程序都是使用经批准的方案并按照圣母大学机构动物护理和使用委员会的规定进行的。
细胞播种与培养
- 在开始之前,准备所需的物品:一个小漏斗,移液管和补充有10%胎牛血清(FBS)和1%青霉素抗生素(DMEM完成)的Dulbecco改良Eagle培养基(DMEM)。
- 将T-25烧瓶与其内的功能化装置(生物执行器或biorobot)一起使用。有关细胞播种前的器械制备,功能化和储存的详细信息,请参阅本两部分手稿的第1部分第4部分。
- 准备一个漏斗,可以通过滚动一个小的方形塑料片制成。将其放在T-25烧瓶内的生物致动器或者Biorobot上。调整较宽端的直径以适应整个设备并且高度使得当烧瓶的顶部被拧紧时它紧贴地配合。
- 对于Biorobots,在整个播种过程中,使用磁铁将设备固定在烧瓶底部。
注意:在这里,使用单个钕磁铁磁体(直径为1.26"),但是也可以使用任何具有相似尺寸和强度的磁体来用磁性镍-PDMS复合材料基座来压住电池。 - 紫外线消毒塑料片至少30分钟,然后使用。
- 对于Biorobots,在整个播种过程中,使用磁铁将设备固定在烧瓶底部。
- 确保漏斗底座和烧瓶之间没有很大的间隙。
- 以1.6×10 7个细胞/ mL的密度将DMEM中的心肌细胞重悬于DMEM中,并通过漏斗将400μL悬浮液缓慢滴入该装置。使用血细胞计数器或任何其他细胞计数器来确定获得的细胞数量。
- 慢慢地将系统移回孵化器,而不会干扰设备和漏斗欣。在37℃培养24小时。
- 孵化期后,慢慢取出漏斗,用PBS轻轻洗涤样品,并用10ml新鲜的DMEM填充烧瓶。
注意:对于Biorobots,取出磁铁,使设备浮动。
生化表征
- 钙通量测定
注意:进行钙通量测定以评估细胞互连性。用荧光,钙离子特异性染料加载细胞的步骤遵循先前建立的方案11中描述的方法 。- 首先,准备所需的材料,氟磷酸4-乙酰甲基(AM)酯,非离子表面活性剂多元醇(参见表格材料 )和泰罗德盐溶液。
- 使用长镊子,将设备从培养瓶轻轻转移到带有2 mL Tyrode盐溶液的35 mm培养皿灰。
- 在单独的离心管中,取1mL温热的Tyrode溶液(加热至37℃),并加入3-5μL的库存钙fluo-4 AM染料(工作浓度:3-5μM)和等份的非离子表面活性剂多元醇(工作浓度:0.2%)。用补充有钙指示剂染料,fluo-4和0.2%非离子表面活性剂的温热Tyrode溶液代替样品溶液。在37°C孵育25-30分钟。
- 取出染料溶液,用新鲜的Tyrode溶液轻轻洗涤样品。在2 mL新鲜的DMEM中,将样品在37°C下再次孵育30分钟,然后再进行成像。
注意:该测定结果和相关视频在以前发表的工作7中提供 。
- 免疫荧光
注意:所有样品的双重免疫染色按照以前建立的方案进行> 12。- 首先,在磷酸盐缓冲盐溶液(PBS)中制备10%山羊血清(GS),在PBS中的diH 2 O,0.1%细胞裂解洗涤剂(参见材料表 )中的4%多聚甲醛(PFA),一抗 - 单克隆抗体心肌肌钙蛋白-1和抗兔单克隆抗体连接蛋白-43),二抗(Alexa 594缀合物和山羊抗小鼠IgG(H + L)Alexa 488缀合物)和DAPI。
注意:多聚甲醛致癌。 - 从烧瓶中取出感兴趣的样品,用PBS轻轻洗两次。有关样品制备和功能化的详细信息,请参阅本两部分手稿的第1部分第4部分。
- 将小滴PBS添加到小盖玻片上(直径:12mm或15mm)。用镊子轻轻握住设备的底座,然后用剪刀将薄的PDMS臂(悬臂, 图1 )从连接到底部的顶部剪开即将悬臂移动到液滴上,细胞粘附侧朝上。 PBS液滴将防止细胞干燥。
- 用4%PFA固定样品,并对样品进行双重免疫染色,如前所述12 。
- 免疫染色后,使用防褪色安装试剂将样品安装在干净的玻璃片上,并在黑暗中搁置24小时。
- 重复所有样品的程序。
注意:该测定结果和相关图像在以前发表的工作中进行了深入的讨论。
- 首先,在磷酸盐缓冲盐溶液(PBS)中制备10%山羊血清(GS),在PBS中的diH 2 O,0.1%细胞裂解洗涤剂(参见材料表 )中的4%多聚甲醛(PFA),一抗 - 单克隆抗体心肌肌钙蛋白-1和抗兔单克隆抗体连接蛋白-43),二抗(Alexa 594缀合物和山羊抗小鼠IgG(H + L)Alexa 488缀合物)和DAPI。
3.成像
- 将T-25烧瓶放在CO 2培养箱中,并将培养箱内的成像系统准备好。使用变焦镜头记录设备(参见材料表 )(参见材料表 )。对于光源,使用一条LED灯。
注意:这里使用了一条白光LED,但任何普通LED也可以工作。 - 将相机连接到操作系统并打开相机专用软件(请参见"材料表" )。单击顶部面板中"文件"选项卡下的相机图像,打开所有相机选项,然后选择正确的相机。
- 从软件中顶部面板的选项卡列表中选择"实时"。
- 通过调整镜头拨盘手动将图像调焦。从顶部面板选择"切割到感兴趣区域(ROI)"。然后,在视频帧中手动绘制矩形,包围生物执行器装置和悬臂,以标记ROI。
注意:选择适当的ROI最小化图像文件的大小。- 在biorobots的情况下,捕获整个屏幕以记录设备的游泳动作。
注意:没有必要画出Biorobots的ROI
- 在biorobots的情况下,捕获整个屏幕以记录设备的游泳动作。
- 开始录制之前,从屏幕顶部面板的其中一个选项卡中选择"摄像机设置"。通过为每个图形滑动条或通过手动输入值来调整实时图像的曝光和像素比来设置帧速率。将帧速率设置为约30±2 fps。
注意:改变曝光和像素比率会改变实时图像的亮度和对比度。 - 点击软件顶部面板上的"录制"按钮,开始录制1000 x 1,000像素分辨率的执行器视频30秒。对所有样品重复该过程。
4.固定基地生物执行器图像分析
- 使用运行自定义脚本的编程软件( 例如 Matlab)分析图像。见材料表 荣格和补充文件进一步细节。
注意:脚本显示记录视频的每一帧,接收用户的鼠标输入,记录图像上悬臂点的协调,通过最小二乘拟合计算通过输入点的圆的直径和中心,输出所有输入和计算的数据供进一步使用。- 点击图标打开编程软件。单击顶部菜单栏中的"文件" - >"打开",并选择.m脚本文件进行图像分析。确保记录的TIFF图像与.m文件在同一文件夹中。单击"运行"运行脚本。
注意:将弹出交互式显示以进行更改。 - 按"播放"启动实际程序。单击"打开"按钮,找到要分析的TIFF文件。
- 点击"base"按钮,然后单击悬臂连接到顶部的基座;进入。这将在每个帧的图像上放置一个方形标记来表示悬臂底座的位置。
- 点击"比例"按钮,然后手动点击玻璃珠的一个边缘。将鼠标指针指向玻璃珠的相对侧,然后按"Enter"键。
注意:这应该画一条线来测量玻璃珠的直径。由于玻璃珠的直径为3毫米,这将与显示的像素相关3毫米。 - 点击"分析"按钮。点击悬臂,距离代表悬臂底座的第一个方形标记一小段距离。
- 点击"分析"按钮。然后,从与代表悬臂底座的第一个方形标记的距离很短的位置点击悬臂。继续沿着悬臂单击,包括提示,然后按回车完成。这将在点击悬臂的每个点上放置一个"x"。
注意:基于方形标记和x标记的协调,圆的中心和直径将使用最小二乘拟合函数计算(参考所附脚本使用的补充文件)。通过x标记和方形制作器的圆将自动叠加在图像上。 - 检查叠加圆圈是否正确跟踪悬臂轮廓。
注意:当悬臂非常平坦时,很难判断悬臂梁的轮廓是否正确。参见图3 。 - 点击"下一帧"按钮。这将切换到TIFF文件中的下一帧。基数和比例已经从上一步设置。
- 重复步骤4.1.5到4.1.7,直到TIFF文件中的所有帧都已完成。一旦所有的帧都被处理了点击"导出"按钮。
注意:这将使具有刚被分析的悬臂的TIFF文件名的电子表格文件。编辑文件名以包括分析悬臂的哪一侧(左侧或右侧)。
- 点击图标打开编程软件。单击顶部菜单栏中的"文件" - >"打开",并选择.m脚本文件进行图像分析。确保记录的TIFF图像与.m文件在同一文件夹中。单击"运行"运行脚本。
- 计算电子表格中的压力。
- 使用下列公式计算悬臂梁上的表面应力"σ"
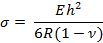
其中E,R, v和h分别为杨氏模量,曲率半径,泊松比和悬臂厚度。
注意:可以改变悬臂的厚度以改变灵敏度。在本研究中,值如下:E = 750kPa,v = 0.49,h =25μm13,14。 - 使用步骤4.2.1中的方程计算表面应力。打开 。xls电子表格文件。注意,输出具有多个列,首先显示基底和圆的x和y坐标,然后显示曲率半径。基于这些计算点击的每个点的x和y坐标。
注意:在延时图像帧上绘制应力显示随时间施加在悬臂上的力的变化。槽表示在心肌细胞松弛期间悬臂上的应力或由于细胞牵引力施加在悬臂上的静应力。这些峰显示悬臂的动态应力,这是通过心肌细胞的跳动而产生的。该值对应于由心肌细胞收缩产生的最大力量。
- 使用下列公式计算悬臂梁上的表面应力"σ"
5.游泳运动员分析
- 使用图像分析软件记录biorobot的位置。
注意:请参阅材料列表中的软件是部分。- 打开图像分析软件( 例如 ImageJ)。按"文件"和"打开",然后选择游泳biorobot视频文件。点击"确定",让程序加载文件。打开电子表格软件。
- 在装载的biorobot视频中,找到已知尺寸的参考( 例如,嵌入生物致动器中的直径为3毫米的玻璃珠)。
注意:任何具有已知尺寸的对象都可以正常工作。这将确定每个视频中的像素与长度之比。 - 使用"直"工具在玻璃珠上画一条线。点击"分析",然后选择"设置比例"。将"已知距离"字段设置为"3,000μm",然后单击"确定"。
注意:这将将x和y坐标设置为微米。 - 选择设备上不会在帧之间摆动的点作为标记。
注意:建议选择基地的一角。 - 指向第一帧5.1.4中的选定点。在电子表格上记录x和y坐标。
- 切换回图像分析软件窗口,然后按向右箭头键切换到下一帧。再次指向标记(从步骤5.1.4),并在电子表格上记录x和y坐标。
- 对所有帧重复步骤5.1.6。
- 使用坐标7的电子表格计算biorobot的游泳参数。
- 从每个视频的已知帧速率计算帧之间的周期。
- 计算帧之间的x和y坐标的变化,以找到移动的距离,包括总距离。
- 根据沿y轴的最大变化计算收缩幅度。从两次收缩期间的倒数确定每个biorobot的跳动频率。
- C从x方向移动的总时间和距离计算每个设备的游泳速度。
- 对分析的每个biorobot视频重复步骤5.2。
- 归一化每个测量参数。
注意:规范化所有值以更好地可视化差异。该协议表示相对于具有低频收缩(水平LF)的水平模式Biorobot的归一化( 图4 )。
6.蛋白质表达分析
注意:使用共焦显微镜对步骤2.2.4和2.2.5中制备的安装样品进行成像。在三个通道中以20X,40X和60X放大顺序获得图像:460nm,488nm和594nm。以40X放大率从每个样本的不同位置捕获一组5个图像,每个通道作为个体保存.TIFF文件。曝光设置由所使用的物镜的放大倍率确定,并且在该放大倍数下对所有捕获物设定为恒定。
- 打开图像分析软件,选择"文件" - >"打开"加载图像。
- 在图像框架上绘制矩形多边形以标记ROI。选择"分析" - >"测量"来测量平均荧光强度。
- 重复步骤6.2收集所有样本的强度测量值,并计算每个条件的相应平均强度。
注意:这里,不同的条件是指不同的时间点,如第1天,第2天和第6天。 - 将结果导出到电子表格中,以进一步进行统计分析和生产数据图。
结果
由薄PDMS悬臂(25μm厚)和心肌细胞构成的生物致动器构成游泳制冷机的核心, 如图1所示装置的示意图和截图所示 。细胞在培养24小时后开始出现收缩,第2天观察到悬臂的弯曲。每天记录装置的侧面轮廓,并且使用以下方法从悬臂的弯曲量化表面应力定制图像分析脚本7 。静态和动态应力每天从表面应力中提取(
讨论
这里概述的步骤描述了一种成功的基于PDMS的致动器和双子座的种子方法,其有助于心肌细胞的附着。此外,描述了表征单元的行为和设备的性能的图像采集和后续分析的过程。
24小时后观察到悬臂的细胞自发收缩;收缩强度随着时间的推移不断增加,在第6天达到最大值,其后强度缓慢下降。尽管生物致动器的悬臂只有4毫米长,但观察到高达2.5毫米的大偏转,特别是在培养6天...
披露声明
作者没有什么可以披露的。
致谢
MT Holley由路易斯安那州理事会研究生研究员计划支持,C. Danielson由霍华德·休斯医学院教授课程支持。本研究得到NSF批准号:1530884的支持。
材料
| Name | Company | Catalog Number | Comments |
| Chemicals and reagents | |||
| Cardiomyocytes (primary cardiac cells) | Charles River | NA | Isolated from 2-day old neonatal Sprague Dawley rats |
| Dulbecco’s modified eagle’s media (DMEM) | Hyclone Laboratories | 16750-074 | with 4500 mg/L glucose, 4.0 mM L-glutamine, and 110 mg/L sodium pyruvate |
| Fetalclone III serum | Hyclone industries, GE | 16777-240 | Fetal bovin serum (FBS) |
| Dulbecco’s phosphate buffer (PBS) | Sigma-Aldrich | D1408-100ML | |
| Penicillin-G sodium salt | Sigma-Aldrich | P3032 | |
| Goat serum | Sigma-Aldrich | G9023 | |
| 4,6-diamidino-2-phenylindole dihydrocholride powder (DAPI) | Sigma-Aldrich | D9542 | |
| Fibronectin from bovine plasma | Sigma-Aldrich | F1141 | Solution (1 mg/ml) |
| Calcein-AM and ethidium homodimer-1 kit (Live/Dead Assay) | Molecular Probes | L3224 | |
| Calcium Fluo-4, AM | Molecular Probes | F14217 | calcium indicator dye |
| Tyrodes salt solution | Sigma-Aldrich | T2397 | buffer solution |
| Pluronic F-127 | Molecular Probes | P3000MP | nonionic surfactant-20 % solution in Dimethylsiloxane (DMSO) |
| 16% Parafomaldehyde | Electron microscopy | 15710 | Caution: Irritant and combustible |
| Triton x-100 | Sigma-Aldrich | X-100 100 mL | cell lyses detergent, (4-(1,1,3,3-Tetramethylbutyl)phenyl-polyethylene glycol, t-Octylphenoxypolyethoxyethanol, Polyethylene glycol tert-octylphenyl ether) |
| ProLong gold antifade reagent | Molecular Probes | P10144 | Mounting agent |
| Alexa Fluor 594 Phalloidin | Molecular Probes | A12381 | Actin filament marker |
| Goat anti-rabbit IgG (H+L) secondary antibody, Alexa Fluor 594 conjugate | Molecular Probes | A-11012 | |
| pha | Molecular Probes | A-11001 | |
| Anti-connexin 43 antibody | Abcam | ab11370 | Gap junction marker |
| Anti-cardiac troponin I antibody | Abcam | ab10231 | Contractile protein |
| 16% EM grade paraformaldehyde solution | Electron microscopy | 100503-916 | |
| Polydimethylsiloxane (PDMS) | Elsevier | Sylgard 184 | |
| Materials and Equipment | |||
| Camera | Thor Labs | DCC1545M | |
| LED light strip | NA | NA | Any white LED without spectrum emission |
| Confocal microscope | Nikkon C2 | NA | Confocal microscope with three filter set. |
| Zooming lens | Infinity | Model# 252120 | |
| Software | |||
| Matlab | Mathworks | NA | Used in Section 4) for biological actuator analysis. |
| Image J | National Institute of Health | NA | Java-based image processing software. Used in Section 5) for biorobot analysis. Free Image Processing and Analysis software in java. (https://imagej.nih.gov/ij/) |
| Thor Cam | Thor Labs | NA | Camera operating software |
参考文献
- Feinberg, A. W. Biological Soft Robotics. Annu. Rev. Biomed. Eng. 17, 243-265 (2015).
- Akiyama, Y., et al. Room Temperature Operable Autonomously Moving Bio-Microrobot Powered by Insect Dorsal Vessel Tissue. PLOS ONE. 7, 38274 (2012).
- Herr, H., Dennis, R. G. A swimming robot actuated by living muscle tissue. J. NeuroEng Rehabil. 1, 6 (2004).
- Park, S., et al. Phototactic guidance of a tissue-engineered soft-robotic ray. Science. 353 (6295), 158-162 (2016).
- Cvetkovic, C., et al. Three-dimensionally printed biological machines powered by skeletal muscle. Proc. Natl. Acad. Sci. 111, 10125-10130 (2014).
- Williams, B. J., Anand, S. V., Rajagopalan, J., Saif, M. T. A. A self-propelled biohybrid swimmer at low Reynolds number. Nat. Commun. 5, (2014).
- Holley, M. T., Nagarajan, N., Danielson, C., Zorlutuna, P., Park, K. Development and characterization of muscle-based actuators for self-stabilizing swimming biorobots. Lab. Chip. 16, 3473-3484 (2016).
- Hopkins, P. M. Skeletal muscle physiology. Contin Educ Anaesth Crit Care Pain. 6, 1-6 (2006).
- Nawroth, J., et al. A tissue-engineered jellyfish with biomimetic propulsion. Nat Biotechnol. 30 (8), 729-797 (2012).
- Ehler, E., Moore-Morris, T., Lange, S. Isolation and Culture of Neonatal Mouse Cardiomyocytes. J. Vis. Exp. JoVE. (79), e50154 (2013).
- Bers, D. M. Calcium Fluxes Involved in Control of Cardiac Myocyte Contraction. Circ. Res. 87, 275-281 (2000).
- Shin, S. R., et al. Carbon-Nanotube-Embedded Hydrogel Sheets for Engineering Cardiac Constructs and Biological actuators. ACS Nano. 7, 2369-2380 (2013).
- Park, J., et al. Real-Time Measurement of the Contractile Forces of Self-Organized Cardiomyocytes on Hybrid Biopolymer Microcantilevers. Anal. Chem. 77, 6571-6580 (2005).
- Tamayo, J., et al. Quantification of the surface stress in microcantilever biosensors: revisiting Stoney's equation. Nanotechnology. 23, 475702 (2012).
- Nunes, S. S., et al. Biowire: a platform for maturation of human pluripotent stem cell-derived cardiomyocytes. Nat. Methods. 10, 781-787 (2013).
- Louch, W. E., Sheehan, K. A., Wolska, B. M. Methods in Cardiomyocyte Isolation, Culture, and Gene Transfer. J. Mol. Cell. Cardiol. 51, 288-298 (2011).
- Alford, P. W., Feinberg, A. W., Sheehy, S. P., Parker, K. K. Biohybrid thin films for measuring contractility in engineered cardiovascular muscle. Biomaterials. 31, 3613-3621 (2010).
- Sfakiotakis, M., Lane, D. M., Davies, J. B. C. Review of fish swimming modes for aquatic locomotion. IEEE J. Ocean. Eng. 24, 237-252 (1999).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。