Method Article
長期のライブイメージング
要約
このプロトコルは、長期のex vivo培養およびショウジョウバエ成虫ディスクのライブイメージングのための詳細な方法を記載しています。それは目のディスクのライブイメージングの10時間の期間内に光受容体の分化と個眼回転を示します。プロトコルは簡単で、高価なセットアップを必要としません。
要約
ライブイメージングは、連続的にリアルタイムでダイナミックな細胞や発達過程を追跡する機能を提供します。 ショウジョウバエの幼虫成虫は、このような細胞の増殖、分化、成長、移動、アポトーシス、競争、細胞-細胞シグナリング、およびコンパートメントの境界形成など多くの生物学的プロセスを研究するために使用されています。しかし、長期のex vivoでの文化や成虫のライブイメージングのための方法には多くの努力にもかかわらず、満足のいくものではなかったです。最近、我々は、長期ex vivoで培養し、最大18時間成虫のライブイメージングのための方法を開発しました。培養培地中で高いインスリン濃度を使用することに加えて、低融点アガロースは、撮像期間中にドリフトを防ぐためにディスクを埋め込むために使用されました。このレポートは、一例として目触角ディスクを使用します。感光R3 / 4特異mδ0.5-GA4の発現は、その感光体differenを実証するために行きましたtiationと個眼回転は10時間ライブイメージング期間中観察することができます。これは、この簡単な方法を説明する詳細なプロトコルです。
概要
ショウジョウバエの幼虫成虫は、生物学的メカニズムの多種多様の研究のために有利な実験システムとなっています。これらのディスクは、2つの上皮層によって構築嚢のような構造を胚上皮から陥入となり、Peripodial上皮(PE)及び適切なディスク(DP)1、2。成虫盤細胞が増殖し、徐々に幼虫と蛹の段階で区別し、最終的には成人の身体構造へと発展します。成虫のフラットでシンプルな2層構造に、彼らは幼虫から解剖したときに観察することが容易です。しかし、多くのグループによって、いくつかの努力にもかかわらず、成虫の長期培養のための現在の方法では満足のいくものではなかったです。我々は最近、最大18時間の複数の成虫の正常な発達を維持することができる培養法を開発し、それがライブイメージング3ことを可能にしますアップ。培養方法は、細胞分化および移動をサポートすることができ、それだけで7-12時間、細胞増殖をサポートすることができ、ディスクの成長をサポートすることができません。培養液中の主な違いは、インスリン3の高濃度です。方法は簡単で、特別な通気や媒体循環は必要ありません。
最もよく研究成虫の一つは目を触角です。 ショウジョウバエの目は、約800個眼を築いています。それぞれ個眼は、8個の光受容体細胞(R1-R8)から構成されています。幼虫の眼ディスクにおいて、光受容体細胞は、前4、5の後方から眼ディスクを横切って掃引形態形成畦間(MF)の通路下記分化します。個眼における光受容体は、R2 / R5、R3 / R4、R1 / R6、及びR7 6続いR8、で始まり、シーケンスに分化します。背側での個眼とVEの眼ディスクのntral半分は、反対のキラリティー7,8で得られた、反対方向に90°の回転を受けます。回転プロセスは、2つの段階で起こる:最初に、45°回転で始まり、MFの背後にある第六の個眼列で完了する。第二の45°の回転は、約行16 9、10で終了します。本研究では、培養とライブ画像目のディスクに、この方法を介して観察することができる正常な細胞分化および動態を実証するために、R3 / 4特異mδ0.5-GA4 11によってマーク、個眼の回転を用います。
プロトコル
1.予備実験のセットアップ
- mδ0.5-GAL4と5日間、25℃での文化の下で核緑色蛍光タンパク質(GFP)を発現するハエの卵を収集します。
- アガロースが完全に溶解するまで、1Xリン酸緩衝生理食塩水(PBS)10mLにアガロース低融点のマイクロ波0.7グラム。使用するまで37℃のインキュベーターで0.7%低融点ゲルを保ちます。
- 以上12時間、70%エタノールで、鉗子、鋏42ミリメートル×0.17ミリメートルカバースリップ、9ウェルガラススポットプレート、及び磁気培養チャンバを含むすべての機器を滅菌します。
- 2%ウシ胎児血清(FBS)、0.5%のペニシリン-ストレプトマイシン、および1.25 mg / mlとインスリンを補充したシュナイダーのショウジョウバエ培地:培地3を準備します。汚染を避けるために、細胞培養フード中の培地を調製します。 4°Cで調製した培養培地を保存し、月以内に使用しました。
- 解剖プラットフォームと実験者を」クリーン解剖を開始する前の70%エタノールで手を。
2.ディスクの解剖
- 空気は70%エタノールからすべての機器を乾燥させます。
- フライバイアルから三齢幼虫を選択します。フライバイアルからの汚染を避けるために、廃棄物を取り除くために1×PBSで3回に幼虫を洗います。
- 解剖顕微鏡下で9ウェルガラススポットプレートで(室温で)培養培地1mlで洗浄幼虫を解剖。
- 後端から道の約1/3でピンセット及び口のフックに別の鉗子で幼虫を把握します。内部組織を解放するために、反対方向に2つの鉗子を引き出します。
- 口のフックに取り付けたアイ - 脳複合体から唾液腺、脂肪体、およびキューティクルを削除します。腹側神経索がまだ接続されている場合は、はさみでそれを切り取っ。
- 共同組織片を除去するために、口のフックと鉗子の1ペアを把握するために鉗子の1ペアを使用します背部における脳および目のディスクをnnects。
注:この組織が削除されていない場合、2目触角ディスクは、互いと脳に近くなります。この組織、脳、眼、触角ディスクが三角形を形成するための目のディスクは次にカバースリップ上に平らではないであろう。 - 腹上方位置に複合体全体を回転させます。脳にフックやディスクを接続するフィラメントを削除します。
注:フィラメントが削除されていない場合口のフックが削除されたときに、目触角が2枚に分割されます。- 口のフックを外します。処理中に目のディスクを傷つけないように注意してください。
注:目のディスクは、現在培地中の遊離および専用光茎によって脳に接続されています。
- 口のフックを外します。処理中に目のディスクを傷つけないように注意してください。
3.取付
- 空気乾燥及び42ミリメートル×0.17ミリメートルのカバーガラスでチャンバーのコンポーネントを組み立てます。目を保持するためにカバースリップの中央部にOリングの二重層を添付電子アガロース。
- カバーガラスでチャンバーを組み立てます。ステージ受容体42上ミリメートル×0.17ミリメートルカバースリップを置きます。カバースリップ上のシリコンOリングを置きます。ベースを置きます。シールロッカーをロックします( 図1)カバーを配置します。
- 注意深く10-200μLチップで20μLマイクロピペットを用いて、Oリングの中心に切開眼 - 脳複合体を移します。
- 媒体の大部分を除去し、試料を(37℃で)0.7%低融点アガロースの12μLを加えます。
注:目のディスクの位置は、アガロースの凝固前に、ピンセットで変更することができます。アガロースは5分以内に凝固します。- Oリングの中心まで室温で培養培地1mlを加えます。各Oリングは、4個のサンプルまでセットすることができます。アガロースは、サンプルのドリフトを回避するために、Oリングに接着されていることを確認してください。
注:メディアのいかなる通気や循環が必要ありません。
- Oリングの中心まで室温で培養培地1mlを加えます。各Oリングは、4個のサンプルまでセットすることができます。アガロースは、サンプルのドリフトを回避するために、Oリングに接着されていることを確認してください。
4.共焦点顕微鏡
- 温度を平衡化するために30分間倒立共焦点顕微鏡のステージ上のチャンバを置き。これは、撮像中にZ軸のずれを防止することができます。
- 長期的なライブイメージングする前に、組織は、微分干渉顕微鏡による損傷がないかどうかを確認してください。
- 光毒性を避けるために、2 mWの下のレーザーパワーを使用しています。イメージング用の40倍の目標を使用してください。
- 1μmの光学的間隔で12分で62μmのZスタック画像を取得します。 10時間の合計にわたってスキャンの40サイクルを取得します。各サイクルは、イメージングおよび休止の3分の12分が含まれていることを確認。
結果
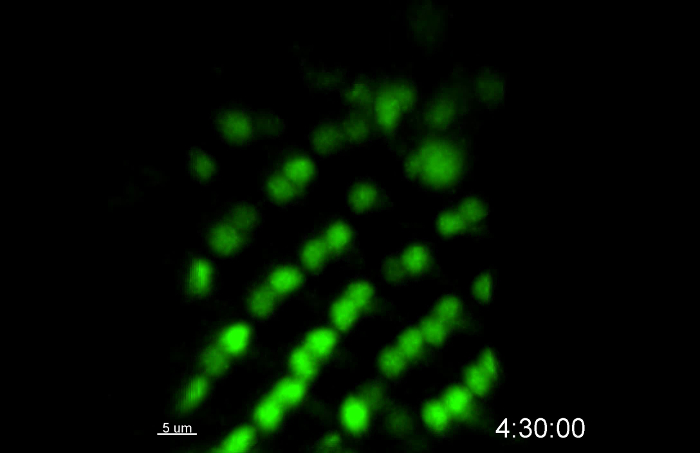
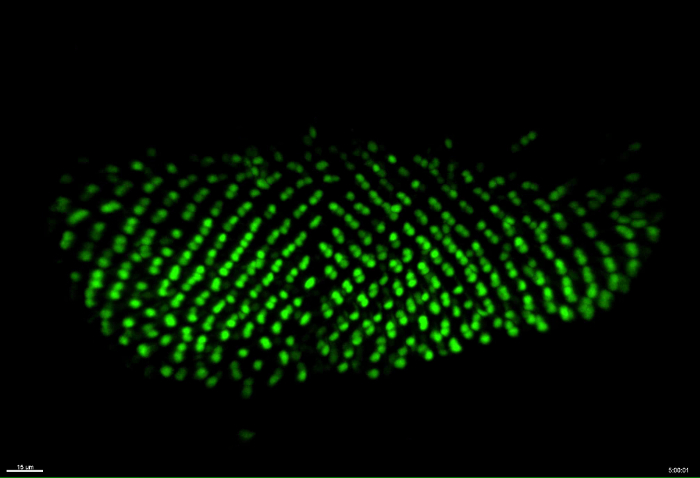
この例では、R3 / R4の感光体は、感光体の分化をモニターするためにmδ0.5-GA4で標識しました。 mδ0.5-GA4は、R3及びR4のための、ならびに個眼回転処理のための優れたマーカー製造、R4における強い発現およびR 11における弱い発現を駆動します。 映画1において、R3及びR4は、GFPで標識しました。 10時間ライブイメージングセッションの開始時に、個眼クラスター( 図2Aおよびムービー1)と終了時の個眼クラスターの14行( 図 2B)の8行がありました。個眼分化の速度は、 インビボディスク7、8、9、10、11で1.5~2時間/行の速度に近いある行当たり1.67時間でしたS = "外部参照"> 12、13、14。 R3及びR4の相対位置に基づいて、個眼回転がライブイメージング( 図2A「A 『』、B」、およびB 『』)の間にex vivoで培養されたディスクで発生しました。単一R3 / R4クラスタは映画2の最初のフレームに白い球を標識しました。初めに、R3 / R4軸は、赤道( 図2Cおよびムービー2)に対して垂直であるように見えます。その後、それぞれ、( 図2C '' ')、H 3( 図2C')、6( 図2C '')で15°、30°、及び45°回転して見える、及び9。このデータは、この方法は、10時間ライブイメージング中に感光体の分化を維持することができることを示唆しています。
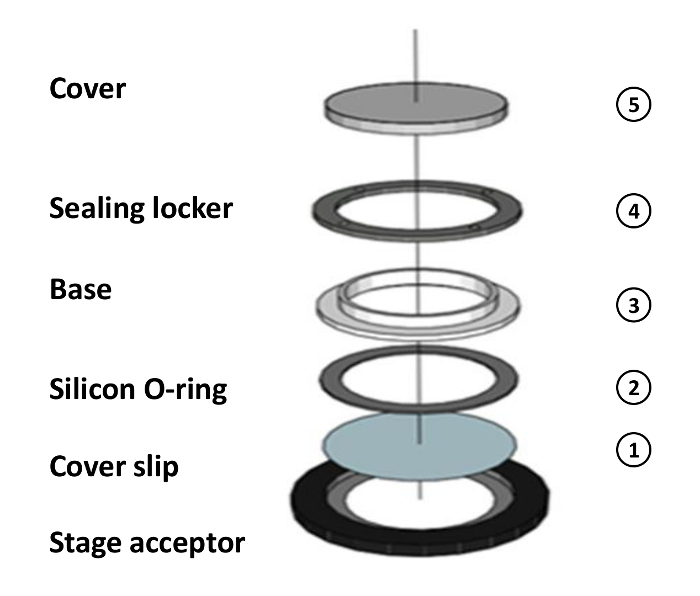
Figu1再:チャンバーアセンブリの概略図。チャンバアセンブリの概略図:(1)ステージアクセプターダブル層のOリング付きカバースリップを置きます。 (2)カバースリップ上のシリコンOリングを置き。 (3)ベースを置き。 (4)シールロッカーをロックします。 (5)Oリングの中心にサンプルをロードし、カバーを置きます。 この図の拡大版をご覧になるにはこちらをクリックしてください。
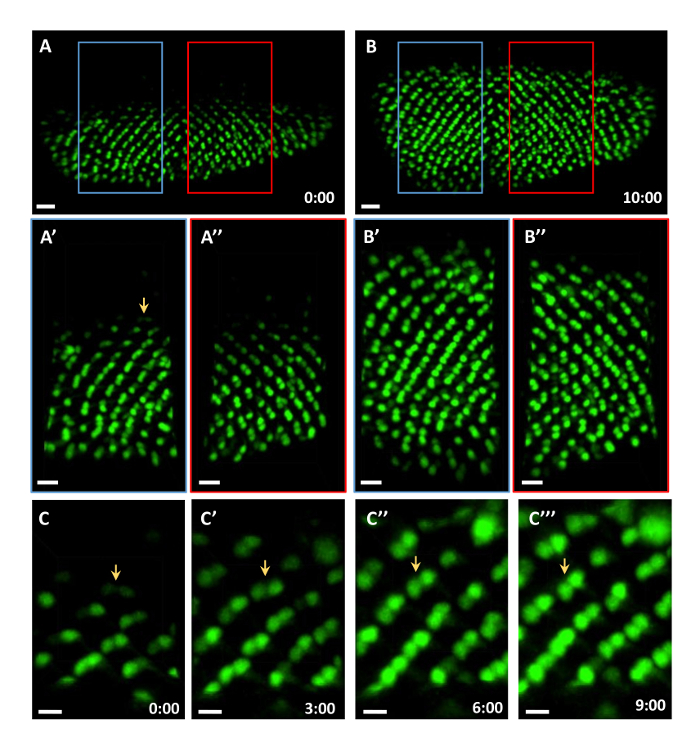
図2:R3 / R4分化及び回転のライブイメージング。 R3 / R4は、ライブイメージングの10時間の間、核状GFPを発現mδ0.5-GAL4で標識されました。すべての数値は作品1から捕獲されました。 (A)最初に撮影した画像。 ( > A'-A ")左( A ' )と右( A" )の囲まれた領域から拡大された画像。 ( B )10時間の終わりに撮影された画像。 ( B'-B " )左( B ' )と右( B" )の囲み領域から拡大した画像。 ( CC '' ' )R3 / R4ペアの回転を示すために、単一のR3 / R4ペア(A'に矢印でマークされています)が時間経過しています。スケールバーは、それぞれA、B、Cで15μm、10μm、5μmです。すべての数値は最大強度のz投影です。時間スケールはh:分で表示されます。 この図の拡大版を見るには、ここをクリックしてください。
映画1:rce.jove.com/files/ftp_upload/55748/Movie_1.avi」ターゲット= 『_空白』>この映画をダウンロードするにはこちらをクリックしてください。
ディスカッション
本研究では、 ショウジョウバエ成虫の長期的なライブイメージング実験のための詳細なプロトコルを提供します。私たちは、ディスクの損傷を避けるためにしてカバースリップに近いディスクの取り付けを可能にするために慎重な解剖の練習に多くの時間を費やしました。我々は、組織を保持するためにポリ-L-リジン(PLL)及びアガロース低融点を試みました。最後に、低融点アガロースは、組織を保持するためのより良い能力を示しました。唯一目のディスクは10時間ライブイメージング期間中の光受容体の分化と個眼回転の正常な発生を実証するために、本論文で使用したもののに示されているように、この方法はまた、少なくとも一つの他のディスク、翼ディスクに適用することができます以前の研究3。また、培養液の準備とライブイメージングのセットアップは簡単ですし、通気や媒体循環を必要としません。
連続ライブイメージングは、生物学的前夜の明確な時間的順序を提供することができますnts。私たちは、眼の椎間板におけるグリアの分化および移動の以前の報告において、眼球3の前に移動した後、グリアが既存のグリアから分化するという直接的な証拠を提供した。長期間のエクスビボ培養は、KAEDE蛍光タンパク質の光変換などの細胞の特異的なレーザー活性化標識が、その挙動に従うことを可能にする3 。また、培地に直接添加される化学物質の試験にも対応できます。したがって、これは薬物スクリーニングプラットフォームとして使用することができる。いくつかの動的プロセスは数分または数秒以内に発生するため、高い時間分解能が必要です。時間分解能を高めるために、薄いシート顕微鏡15,16またはスピニングディスク顕微鏡17が良い選択肢となり得る。
現在の培養条件は完全ではありません。ディスクの拡張はサポートされていません。セルproliferationは、最大12時間3に対してサポートされています。 エクスビボ培養で12時間後、光受容体の分化の速度が3減少し始めます。これは、特定の栄養素やホルモンの欠如に起因する可能性があります。この培地中の主要な違いは、インスリンの高濃度であるので、哺乳動物のインスリンは、内因性のインスリン様ペプチドの機能を模倣する部分であってもよいです。ハエ抽出物、昆虫血糖トレハロース、及び脱皮ホルモン20-ヒドロキシの種々の濃度の添加は、3有益ではなかったです。しかし、12〜18時間の培養期間は、多くの発生過程を研究するのに十分です。幼虫成虫を培養するための代替培養法は、3を比較した、と私たちの培養およびイメージング条件は、ライブイメージングのための最長時間ウィンドウと最も明快さを提供します。ライブ幼虫と蛹内のディスクは、直接画像化することができますが18、19、20、21、22は 、観察用の解像度と時間窓が限られています。後期幼虫と蛹のディスクは、長い時間の23、24のために培養することができますが、ディスクは重要な形態形成を受けます。フラット、2D幼虫ディスクを利用するには、私たちの培養およびイメージング法は、これまでの最適なソリューションです。
開示事項
著者は、彼らが競合する金融利害関係を持たないことを宣言します。
謝辞
私たちは、フライ食品を準備し、共焦点顕微鏡で彼らの助けのために、そして蘇-ピン・リーとIMBイメージングコアにフライストックを維持するためのチョン-ラン・スとゆうチーヤンに感謝しています。この研究は、101から2321-B-001 -004、NSC 100から2321-B-001 -012、NSC 102から2321-B-001 -002、MOST 103から2311-B-001 YHS(NSCへの助成金によって支援されました国家科学委員会と中国の共和国の科学技術省から-035 -MY3)。
資料
| Name | Company | Catalog Number | Comments |
| Low-melting agarose | AMRESCO | 0815-25G | |
| Phosphate-buffered Saline (PBS) | AMRESCO | 0780-2PK | |
| 42 mm x 0.17 mm cover slips | PST | G401-42 | |
| Schneider’s Drosophila medium | Thermo | 21720-024 | |
| Fetal Bovine Serum (FBS) | Sigma | F9665 | |
| Penicillin-streptomycin | GIBCO | 759 | |
| Insulin | Sigma | I9278 | |
| Culture chamber | PECON | POC-R2 Cell Cultivation System | |
| 40X objective | C-Apochromat 40X/1.2W Korr objective | ||
| Fly strain:nls.GFP | Bloominggton | 4775 |
参考文献
- Cohen, S. M., Bate, M., Martinez-Arias, A. Imaginal disc development. The Development of Drosophila melanogaster. 2, 747-842 (1993).
- Auerbach, C. The development of the legs, wings and halteres in wild type and some mutant strains of Drosophila melanogaster. Proc. R. Soc. Edinb. B. 58, 787-815 (1936).
- Tsao, C. K., Ku, H. Y., Lee, Y. M., Huang, Y. F., Sun, Y. H. Long-term Ex Vivo Culture and Live Imaging of Drosophila Larval Imaginal Discs. PLoS One. 11 (9), e0163744 (2016).
- Ready, D. F., Hanson, T. E., Benzer, S. Development of the Drosophila retina, a neurocrystalline lattice. Dev Biol. 53 (2), 217-240 (1976).
- Wolff, T., Ready, D. F. The beginning of pattern formation in the Drosophila compound eye: the morphogenetic furrow and the second mitotic wave. Development. 113 (3), 841-850 (1991).
- Tomlinson, A., Ready, D. F. Neuronal differentiation in Drosophila ommatidium. Dev Biol. 120 (2), 366-376 (1987).
- Wolff, T., Ready, D. F. . The Development of Drosophila Melanogaster. , 1277-1316 (1993).
- Adler, P. N. Planar signaling and morphogenesis in Drosophila. Dev Cell. 2 (5), 525-535 (2002).
- Choi, K. W., Benzer, S. Migration of glia along photoreceptor axons in the developing Drosophila eye. Neuron. 12 (2), 423-431 (1994).
- Strutt, D. I., Mlodzik, M. Ommatidial polarity in the Drosophila eye is determined by the direction of furrow progression and local interactions. Development. 121 (12), 4247-4256 (1995).
- Gaengel, K., Mlodzik, M. Egfr signaling regulates ommatidial rotation and cell motility in the Drosophila eye via MAPK/Pnt signaling and the Ras effector Canoe/AF6. Development. 130 (22), 5413-5423 (2003).
- Li, C., Meinertzhagen, I. A. Conditions for the primary culture of eye imaginal discs from Drosophila melanogaster. J Neurobiol. 28 (3), 363-380 (1995).
- Carthew, R. W. Pattern formation in the Drosophila eye. Curr Opin Genet Dev. 17 (4), 309-313 (2007).
- Treisman, J. E. Retinal differentiation in Drosophila. Wiley Interdiscip Rev Dev Biol. 2 (4), 545-557 (2013).
- Huisken, J., Swoger, J., Del Bene, ., Wittbrodt, F., J, E. H., Stelzer, Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305 (5686), 1007-1009 (2004).
- Keller, P. J., Stelzer, E. H. Quantitative in vivo imaging of entire embryos with Digital Scanned Laser Light Sheet Fluorescence Microscopy. Curr Opin Neurobiol. 18 (6), 624-632 (2008).
- Winter, P. W., Shroff, H. Faster fluorescence microscopy: advances in high speed biological imaging. Curr Opin Chem Biol. 20, 46-53 (2014).
- Bosveld, F., et al. Mechanical Control of Morphogenesis by Fat/Dachsous/Four-Jointed Planar Cell Polarity Pathway. Science. 336 (6082), 724-727 (2012).
- Ghannad-Rezaie, M., Wang, X., Mishra, B., Collins, C., Chronis, N. Microfluidic Chips for In Vivo Imaging of Cellular Responses to Neural Injury in Drosophila Larvae. Plos One. 7 (1), (2012).
- Heemskerk, I., Lecuit, T., LeGoff, L. Dynamic clonal analysis based on chronic in vivo imaging allows multiscale quantification of growth in the Drosophila wing disc. Development. 141 (11), 2339-2348 (2014).
- Taylor, J., Adler, P. N. Cell rearrangement and cell division during the tissue level morphogenesis of evaginating Drosophila imaginal discs. Dev Biol. 313 (2), 739-751 (2008).
- Ward, R. E., Reid, P., Bashirullah, A., D'Avino, P. P., Thummel, C. S. GFP in living animals reveals dynamic developmental responses to ecdysone during drosophila metamorphosis. Dev Biol. 256 (2), 389-402 (2003).
- Gibbs, S. M., Truman, J. W. Nitric oxide and cyclic GMP regulate retinal patterning in the optic lobe of Drosophila. Neuron. 20 (1), 83-93 (1998).
- Fristrom, J. W., Logan, W. R., Murphy, C. Synthetic and Minimal Culture Requirements for Evagination of Imaginal of Drosophila-Melanogaster in-Vitro. Dev Biol. 33 (2), 441-456 (1973).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved