Method Article
A lungo termine Imaging in diretta di
In questo articolo
Riepilogo
Questo protocollo descrive un metodo dettagliato per il lungo termine coltura ex vivo e in vivo imaging di un disco immaginale Drosophila. Dimostra la differenziazione dei fotorecettori e la rotazione ommatidial entro il periodo di 10 h di immagini dal vivo del disco occhio. Il protocollo è semplice e non richiede l'installazione costosa.
Abstract
Immagini dal vivo offre la possibilità di monitorare continuamente i processi cellulari e dello sviluppo dinamico in tempo reale. Drosophila dischi imaginal larvali sono stati utilizzati per studiare molti processi biologici, quali la proliferazione cellulare, la differenziazione, la crescita, migrazione, apoptosi, concorrenza, segnalazione cellula-cellula, e la formazione confine compartimentale. Tuttavia, i metodi per il lungo termine ex vivo della cultura e immagini dal vivo dei dischi immaginali non sono stati soddisfacenti, nonostante i molti sforzi. Recentemente, abbiamo sviluppato un metodo per il lungo termine ex vivo la cultura e l'imaging dal vivo di dischi immaginali per un massimo di 18 ore. Oltre a utilizzare una concentrazione elevata di insulina nel mezzo di coltura, un agarosio bassofondente è stato utilizzato anche per incorporare il disco per evitare che deriva durante il periodo di imaging. Questo rapporto utilizza i dischi eye-antennomero come esempio. / 4-specifico espressione fotorecettore R3 mδ0.5-GA4 stata seguita per dimostrare che fotorecettore differenziazione e rotazione ommatidial possono essere osservati durante un periodo imaging dal vivo 10 h. Questo è un protocollo dettagliato descrive questo metodo semplice.
Introduzione
I Drosophila larvali dischi imaginali sono stati un sistema sperimentale favorita per lo studio di una grande varietà di meccanismi biologici. Questi dischi invaginate dall'epitelio embrionale e diventano strutture sac-come costruito da due strati epiteliali, Peripodial Epitelio (PE) e Disc Proper (DP) 1, 2. Le cellule disco imaginal proliferano e progressivamente differenziano durante gli stadi larvali e pupe ed eventualmente sviluppare nelle strutture corporee degli adulti. A causa della struttura a due strati piatta e semplice dei dischi imaginali, sono facili da osservare quando sezionato da larve. Tuttavia, nonostante molti sforzi da molti gruppi, i metodi attuali per la cultura a lungo termine dei dischi immaginali non sono stati soddisfacenti. Abbiamo recentemente messo a punto un metodo di coltura che può sostenere il normale sviluppo di molteplici dischi immaginali per un massimo di 18 ore e che permette l'imaging dal vivo 3 . Il metodo di coltura può supportare la differenziazione e migrazione cellulare, ma può sostenere la proliferazione cellulare solo per 7-12 ore e non può sostenere la crescita disco. La differenza principale nel mezzo di coltura è l'alta concentrazione di insulina 3. Il metodo è semplice, e non richiede alcun particolare aerazione o medio circolazione.
Uno dei dischi immaginali più studiato è il disco di eye-antenne. L'occhio di Drosophila è costruita di circa 800 ommatidi. Ogni ommatidium comprende otto fotorecettori (R1-R8). Nel disco occhio larvale, le cellule visive differenziare dopo il passaggio del Morfogenetica Solco (MF), che spazia attraverso il disco occhio da posteriore ad anteriore 4, 5. I fotorecettori in un ommatidium differenziano in sequenza, cominciando con R8, seguita da R2 / R5, R3 / R4, R1 / R6, R7 e 6. L'ommatidi nella dorsale e vemetà ntral del disco dell'occhio subiscono una rotazione di 90 ° in senso opposto, con conseguente chiralità opposta 7, 8. Il processo di rotazione avviene in due fasi: in primo luogo, una rotazione di 45 ° inizia a ed è completato alla sesta fila ommatidi dietro la MF; la seconda rotazione di 45 ° si completa in circa 16 fila 9, 10. Questo studio ha utilizzato rotazione ommatidial, contrassegnata dalla R3 / 4-specifici mδ0.5-GA4 11, per dimostrare la differenziazione cellulare normale e dinamiche che possono essere osservati attraverso questo metodo di coltura e vivere immagine disco occhio.
Protocollo
Impostazione 1. Pre-sperimentale
- Raccogliere un uovo mosca che esprime nucleare proteina fluorescente verde (GFP) sotto mδ0.5-GAL4 e la cultura a 25 ° C per 5 giorni.
- Microonde 0,7 g di agarosio bassofondente in 10 mL di 1x salina tamponata con fosfato (PBS) finché l'agarosio è completamente sciolto. Mantenere il gel bassofondente 0,7% in un incubatore a 37 ° fino al momento dell'uso.
- Sterilizzare tutti gli utensili, tra cui pinze, forbici, 42 mm x 0,17 mm coprioggetto, di una piastra di vetro 9-well, e una camera di coltura magnetico, con il 70% di etanolo per più di 12 ore.
- Preparare il terreno di coltura 3: media Drosophila Schneider integrato con 2% di siero fetale bovino (FBS), 0,5% di penicillina-streptomicina, e 1,25 mg / ml di insulina. Per evitare la contaminazione, preparare il mezzo in una cappa di coltura cellulare. Conservare il terreno di coltura preparato a 4 ° C ed utilizzato entro un mese.
- Pulire la piattaforma dissezione e lo sperimentatore's mani con il 70% di etanolo prima di iniziare la dissezione.
Dissection 2. Disco
- Far asciugare tutta l'attrezzatura dal 70% di etanolo.
- Seleziona una larva terzo instar da una fiala mosca. Per evitare la contaminazione dalla fiala mosca, lavare la larva in 1x PBS 3x per rimuovere i rifiuti.
- Sezionare la larva pulito in 1 ml di terreno di coltura (a RT) nel posto piatto di vetro 9-bene sotto un microscopio di dissezione.
- Afferrare la larva con un paio di pinze a circa un terzo della distanza tra l'estremità posteriore e un altro pinza del gancio bocca. Tirare le due pinze in direzioni opposte per rilasciare i tessuti interni.
- Rimuovere le ghiandole salivari, il grasso corporeo, e cuticola dal complesso occhio-cervello attaccato al gancio bocca. Se il cordone nervoso ventrale è ancora attaccato, tagliare con le forbici.
- Utilizzare un paio di pinze per afferrare il gancio bocca e una coppia di pinze per rimuovere un pezzo di tessuto che connects il cervello e dischi degli occhi nella parte dorsale.
NOTA: Se questo tessuto non viene rimosso, i due dischi eye-antenne saranno vicini l'uno all'altro e il cervello. I dischi oculari verranno quindi non piatte sul vetrino perché questo tessuto, il cervello, e il disco eye-antennale formeranno un triangolo. - Ruotare l'intero complesso ad una posizione ventrale-alto. Rimuovere il filamento che collega il gancio o disco al cervello.
NOTA: Se il filamento non viene rimosso, il disco occhio-antennale si dividerà in due pezzi quando il gancio bocca viene rimosso.- Rimuovere il gancio bocca. Fare attenzione a non danneggiare il disco occhio durante il processo.
NOTA: Il disco occhio è ora gratuito nel medio e solo collegata al cervello attraverso il gambo ottica.
- Rimuovere il gancio bocca. Fare attenzione a non danneggiare il disco occhio durante il processo.
3. Montaggio
- Aria secca e assemblare i componenti della camera con un 42 copri oggetto x 0,17 millimetri. Collegare un doppio strato di O-ring al centro del vetrino per tenere the agarosio.
- Montare la camera con coprioggetto. Mettere i 42 mm x 0,17 millimetri vetrino sul palco accettore. Posizionare l'anello O-silicio sul vetrino. Posizionare la base. Bloccare l'armadietto di tenuta e posizionare il coperchio (Figura 1).
- Trasferire accuratamente il complesso occhio-cervello sezionato al centro di O-ring con una micropipetta 20 l con una punta di 10-200 microlitri.
- Rimuovere la maggior parte del mezzo e aggiungere 12 ml di 0,7% agarosio bassofondente (a 37 ° C) al campione.
NOTA: La posizione del disco occhio può essere modificata con una pinza prima della solidificazione del agarosio. L'agarosio si solidifica entro 5 minuti.- Aggiungere 1 ml di terreno di coltura a temperatura ambiente al centro di O-ring; ciascun O-ring può caricare fino a 4 campioni. Assicurarsi che l'agarosio è incollato alla O-ring per evitare la deriva del campione.
NOTA: Non aerazione o di circolazione del mezzo è necessaria.
- Aggiungere 1 ml di terreno di coltura a temperatura ambiente al centro di O-ring; ciascun O-ring può caricare fino a 4 campioni. Assicurarsi che l'agarosio è incollato alla O-ring per evitare la deriva del campione.
4. Microscopia confocale
- Posizionare la camera sulla scena di un microscopio confocale invertito per 30 minuti per equilibrare la temperatura. Questo può evitare la dispersione asse Z durante l'imaging.
- Prima di immagini dal vivo a lungo termine, controllare se il tessuto è intatto dal microscopio a contrasto di interferenza differenziale.
- Per evitare la fototossicità, utilizzare un laser di potenza inferiore al 2 mW. Utilizzare un obiettivo 40X per l'imaging.
- Acquisire 62 um immagini Z-stack di 12 min con un intervallo ottico di 1 um. Acquisire 40 cicli di scansione per un totale di 10 h. Assicurarsi che ogni ciclo contiene 12 min di imaging e 3 min di riposo.
Risultati
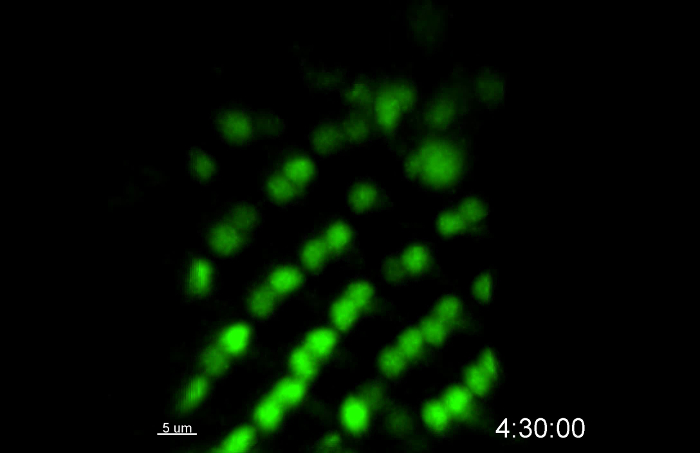
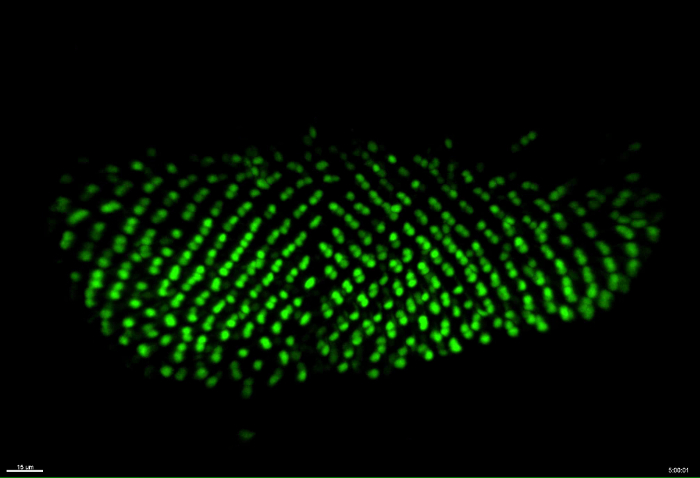
In questo esempio, i fotorecettori R3 / R4 sono stati marcati con mδ0.5-GA4 per monitorare differenziazione dei fotorecettori. mδ0.5-GA4 spinge forte espressione in R4 ed espressione debole in R3 11, rendendolo un eccellente indicatore di R3 e R4, nonché per il processo di rotazione ommatidial. Nel film 1, R3 e R4 sono stati etichettati con GFP. All'inizio del 10 h sessione live-imaging, c'erano 8 file di cluster ommatidial (Figura 2A e film 1) e 14 righe di cluster ommatidial alla fine (Figura 2B). Il tasso di differenziazione ommatidial era 1,67 h per riga, che è vicino al tasso di 1,5-2 h / riga dischi in vivo 7, 8, 9, 10, 11,s = "xref"> 12, 13, 14. Sulla base delle posizioni relative di R3 e R4, rotazione ommatidial verificato nel disco coltivate ex vivo durante l'imaging in tempo reale (Figura 2A 'A '', B', e B ''). Un singolo gruppo R3 / R4 è stato marcato con una sfera bianca nel primo fotogramma del film 2. In principio, l'asse R3 / R4 sembra essere perpendicolare all'equatore (Figura 2C e film 2). Quindi sembra ruotare di 15 °, 30 °, e 45 ° a 3 (Figura 2C '), 6 (Figura 2C '') e 9 (figura 2C ''') h, rispettivamente. Questi dati suggeriscono che questo metodo può sostenere la differenziazione dei fotorecettori durante la 10 ore di immagini in diretta.
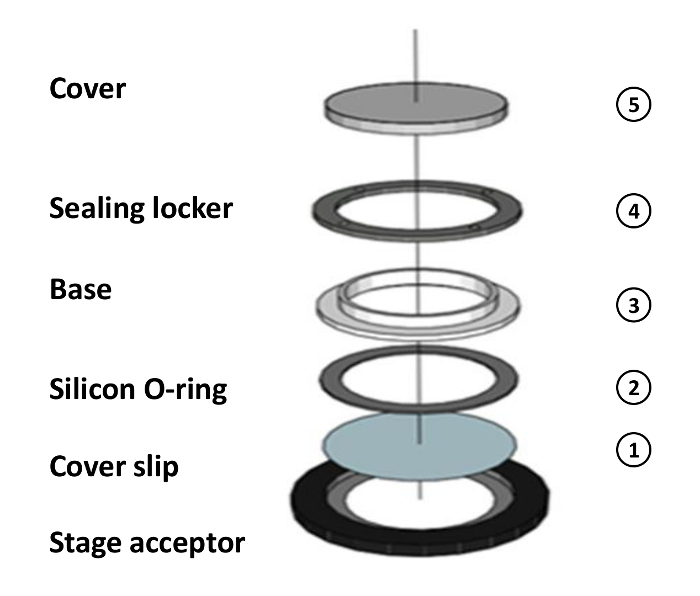
Figure 1: Schema dell'Assemblea Camera. Schema di montaggio della camera: (1) Inserire il coprioggetto doppio strato O-ring-attaccato sulla accettore palco. (2) Inserire l'O-ring silicio sul vetrino. (3) Posizionare la base. (4) Bloccare l'armadietto di tenuta. (5) Caricare il campione al centro della O-ring e posizionare il coperchio. Si prega di cliccare qui per vedere una versione più grande di questa figura.
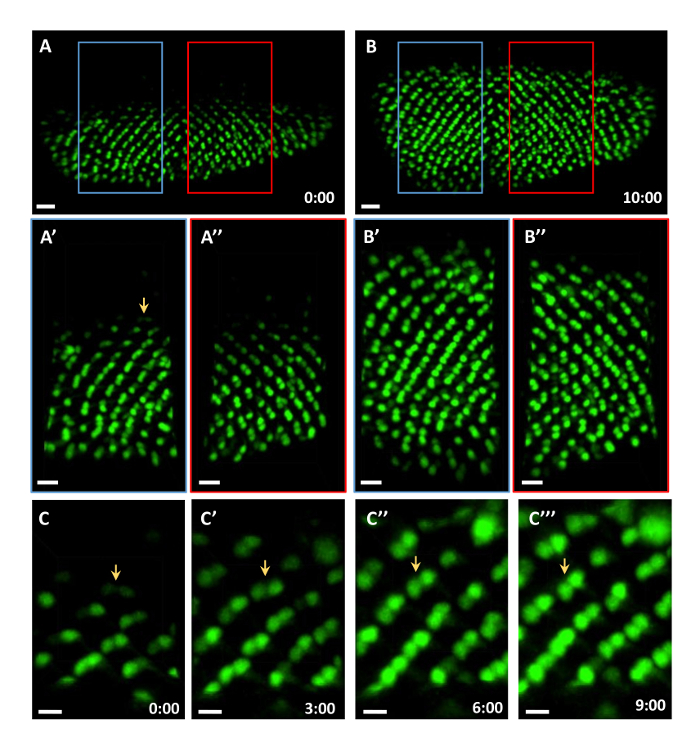
Figura 2: Imaging vivo di R3 / R4 Differenziazione e rotazione. R3 / R4 etichettato con mδ0.5-GAL4 espressione forma nucleare GFP per 10 h di imaging dal vivo. Tutte le figure sono state catturate dal film 1. (A) Immagine catturata all'inizio. ( > A'-A") Immagine ingrandita dalla zona in scatola a sinistra (A') e destra (A"). (B) immagine presa al termine del periodo di 10 h. (B'-B") Immagine ingrandita dalla zona in scatola a sinistra (B') e destra (B"). (CC '' ') Una singola coppia R3 / R4 (contrassegnata da una freccia in A') è seguita nel tempo per mostrare la rotazione della coppia R3 / R4. Barre di scala = 15 micron, 10 micron e 5 micron in A, B, e C, rispettivamente. Tutte le figure sono di massima intensità z-proiezioni. La scala temporale è mostrata in h: min. Si prega di cliccare qui per vedere una versione più grande di questa figura.
Film 1:rce.jove.com/files/ftp_upload/55748/Movie_1.avi" target = '_ blank'> Clicca qui per scaricare questo film.
Discussione
In questo studio, mettiamo a disposizione un protocollo dettagliato per un esperimento di imaging dal vivo a lungo termine su dischi immaginali Drosophila. Abbiamo passato un sacco di tempo praticando la dissezione attenta per evitare danni disco e per consentire il fissaggio del disco vicino alle lamelle. Abbiamo provato Poli-L-lisina (PLL) e basso punto di fusione agarosio per tenere il tessuto; Alla fine, l'agarosio a bassa fusione ha mostrato una migliore capacità di trattenere il tessuto. Anche se solo il disco occhio è stato utilizzato in questo documento per dimostrare la normale verificarsi di differenziazione dei fotorecettori e rotazione ommatidial durante il periodo in vivo imaging 10 h, questo metodo può essere applicato ad almeno un altro disco, il disco ala, come dimostrato in un studio precedente 3. Inoltre, la preparazione del mezzo di coltura e la configurazione di imaging in tempo reale sono semplici e non richiedono l'aerazione o medio circolazione.
Continuo immagini dal vivo in grado di fornire una chiara sequenza temporale di vigilia biologicanti. Nella nostra precedente relazione di differenziazione glia e la migrazione nel disco occhio, abbiamo fornito la prova diretta che glia avvolgenti differenziano dalla glia esistente dopo la migrazione a anteriore del disco occhio 3. A lungo termine ex vivo della cultura consente la specifica di etichettatura laser-attivata di cellule, come la foto-conversione della proteina fluorescente KAEDE, a seguire i loro comportamenti 3. Può ospitare anche la sperimentazione di sostanze chimiche che vengono aggiunti direttamente al mezzo di coltura; Quindi, può essere utilizzato come piattaforma di screening farmaco. Da qualche processo dinamico verifica entro minuti o secondi, è richiesta un'elevata risoluzione temporale. Per migliorare la risoluzione temporale, foglio microscopia ottica 15, 16 o filatura disco microscopia 17 può essere una buona opzione.
La condizione cultura attuale non è perfetta. Non supporta la crescita del disco. cellulare proliferation è supportata solo fino a 12 h 3. Dopo 12 ore in coltura ex vivo, il tasso di differenziazione dei fotorecettori inizia a diminuire 3. Ciò può essere dovuto alla mancanza di determinate sostanze nutritive o ormoni. Poiché la differenza principale in questo terreno di coltura è l'alta concentrazione di insulina, l'insulina mammiferi può essere parzialmente mimando la funzione di peptidi insulino-simile endogeni. L'aggiunta di estratto di volare, l'insetto trealosio di zucchero nel sangue, e varie concentrazioni dell'ormone muta 20-hydroxyecdysone, non erano favorevoli 3. Tuttavia, il periodo di coltura 12-18 h è sufficiente per studiare molti processi di sviluppo. Metodi di coltura alternativi per la coltura dischi immaginali larvali sono stati confrontati 3, e la nostra coltura e di imaging condizioni fornisce la finestra di tempo più lungo e più chiarezza per l'imaging dal vivo. Sebbene i dischi all'interno di larve vive e pupe possono essere esposte direttamente18, 19, 20, 21, 22, la finestra risoluzione e il tempo per le osservazioni sono limitate. Tardi larvale e dischi pupa possono essere coltivate per lungo tempo 23, 24, ma i dischi subiscono significativa morfogenesi. Per sfruttare le piane, dischi larvali 2D, il nostro metodo di coltura e di imaging è la soluzione migliore finora.
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari in competizione.
Riconoscimenti
Siamo grati a Chun-lan Hsu e Yu-Chi Yang per la preparazione del cibo mosca e il mantenimento delle scorte mosca, e Su-Ping Lee e l'IMB Imaging Nucleo per il loro aiuto con la microscopia confocale. Questo studio è stato sostenuto da sovvenzioni a YHS (NSC 101-2321-B-001 -004, NSC 100-2321-B-001 -012, NSC 102-2321-B-001 -002, PIÙ 103-2311-B-001 -035 -MY3) dal Consiglio nazionale della Scienza e il Ministero della Scienza e della Tecnologia della Repubblica Popolare cinese.
Materiali
| Name | Company | Catalog Number | Comments |
| Low-melting agarose | AMRESCO | 0815-25G | |
| Phosphate-buffered Saline (PBS) | AMRESCO | 0780-2PK | |
| 42 mm x 0.17 mm cover slips | PST | G401-42 | |
| Schneider’s Drosophila medium | Thermo | 21720-024 | |
| Fetal Bovine Serum (FBS) | Sigma | F9665 | |
| Penicillin-streptomycin | GIBCO | 759 | |
| Insulin | Sigma | I9278 | |
| Culture chamber | PECON | POC-R2 Cell Cultivation System | |
| 40X objective | C-Apochromat 40X/1.2W Korr objective | ||
| Fly strain:nls.GFP | Bloominggton | 4775 |
Riferimenti
- Cohen, S. M., Bate, M., Martinez-Arias, A. Imaginal disc development. The Development of Drosophila melanogaster. 2, 747-842 (1993).
- Auerbach, C. The development of the legs, wings and halteres in wild type and some mutant strains of Drosophila melanogaster. Proc. R. Soc. Edinb. B. 58, 787-815 (1936).
- Tsao, C. K., Ku, H. Y., Lee, Y. M., Huang, Y. F., Sun, Y. H. Long-term Ex Vivo Culture and Live Imaging of Drosophila Larval Imaginal Discs. PLoS One. 11 (9), e0163744 (2016).
- Ready, D. F., Hanson, T. E., Benzer, S. Development of the Drosophila retina, a neurocrystalline lattice. Dev Biol. 53 (2), 217-240 (1976).
- Wolff, T., Ready, D. F. The beginning of pattern formation in the Drosophila compound eye: the morphogenetic furrow and the second mitotic wave. Development. 113 (3), 841-850 (1991).
- Tomlinson, A., Ready, D. F. Neuronal differentiation in Drosophila ommatidium. Dev Biol. 120 (2), 366-376 (1987).
- Wolff, T., Ready, D. F. . The Development of Drosophila Melanogaster. , 1277-1316 (1993).
- Adler, P. N. Planar signaling and morphogenesis in Drosophila. Dev Cell. 2 (5), 525-535 (2002).
- Choi, K. W., Benzer, S. Migration of glia along photoreceptor axons in the developing Drosophila eye. Neuron. 12 (2), 423-431 (1994).
- Strutt, D. I., Mlodzik, M. Ommatidial polarity in the Drosophila eye is determined by the direction of furrow progression and local interactions. Development. 121 (12), 4247-4256 (1995).
- Gaengel, K., Mlodzik, M. Egfr signaling regulates ommatidial rotation and cell motility in the Drosophila eye via MAPK/Pnt signaling and the Ras effector Canoe/AF6. Development. 130 (22), 5413-5423 (2003).
- Li, C., Meinertzhagen, I. A. Conditions for the primary culture of eye imaginal discs from Drosophila melanogaster. J Neurobiol. 28 (3), 363-380 (1995).
- Carthew, R. W. Pattern formation in the Drosophila eye. Curr Opin Genet Dev. 17 (4), 309-313 (2007).
- Treisman, J. E. Retinal differentiation in Drosophila. Wiley Interdiscip Rev Dev Biol. 2 (4), 545-557 (2013).
- Huisken, J., Swoger, J., Del Bene, ., Wittbrodt, F., J, E. H., Stelzer, Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305 (5686), 1007-1009 (2004).
- Keller, P. J., Stelzer, E. H. Quantitative in vivo imaging of entire embryos with Digital Scanned Laser Light Sheet Fluorescence Microscopy. Curr Opin Neurobiol. 18 (6), 624-632 (2008).
- Winter, P. W., Shroff, H. Faster fluorescence microscopy: advances in high speed biological imaging. Curr Opin Chem Biol. 20, 46-53 (2014).
- Bosveld, F., et al. Mechanical Control of Morphogenesis by Fat/Dachsous/Four-Jointed Planar Cell Polarity Pathway. Science. 336 (6082), 724-727 (2012).
- Ghannad-Rezaie, M., Wang, X., Mishra, B., Collins, C., Chronis, N. Microfluidic Chips for In Vivo Imaging of Cellular Responses to Neural Injury in Drosophila Larvae. Plos One. 7 (1), (2012).
- Heemskerk, I., Lecuit, T., LeGoff, L. Dynamic clonal analysis based on chronic in vivo imaging allows multiscale quantification of growth in the Drosophila wing disc. Development. 141 (11), 2339-2348 (2014).
- Taylor, J., Adler, P. N. Cell rearrangement and cell division during the tissue level morphogenesis of evaginating Drosophila imaginal discs. Dev Biol. 313 (2), 739-751 (2008).
- Ward, R. E., Reid, P., Bashirullah, A., D'Avino, P. P., Thummel, C. S. GFP in living animals reveals dynamic developmental responses to ecdysone during drosophila metamorphosis. Dev Biol. 256 (2), 389-402 (2003).
- Gibbs, S. M., Truman, J. W. Nitric oxide and cyclic GMP regulate retinal patterning in the optic lobe of Drosophila. Neuron. 20 (1), 83-93 (1998).
- Fristrom, J. W., Logan, W. R., Murphy, C. Synthetic and Minimal Culture Requirements for Evagination of Imaginal of Drosophila-Melanogaster in-Vitro. Dev Biol. 33 (2), 441-456 (1973).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon