このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
培養海馬神経細胞のシナプス小胞エンドサイトーシスを測定
要約
光顕微鏡によるシナプス小胞タンパク質と融合した 1p-169 と吸収小胞の電子顕微鏡によるシナプス小胞エンドサイトーシスが検出されました。
要約
エンドサイトーシス、時にシナプス小胞の融合は小胞リサイクルそしてこうして神経反復焼成時におけるシナプス伝達の維持を可能にする神経終末で取得されます。病理学の条件に障害エンドサイトーシスは、シナプスの強さと脳の機能の低下につながります。ここでは、我々 は哺乳類神経培養海馬シナプスにおけるシナプス小胞エンドサイトーシスを測定するために使用方法を説明します。我々 は pHluorin、増加 pH 敏感な緑色蛍光タンパク質を小胞の内腔側でシナプトフィジンと VAMP2/シナプトブレビンを含むシナプス小胞膜タンパク質を融合することでシナプス小胞タンパク質エンドサイトーシスを監視、pH として蛍光強度が増加します。エキソサイトーシス、時小胞内腔 pH が増加し、pH は酸性再エンドサイトーシス小胞内腔中。したがって、pHluorin の蛍光強度の増加は減少を示す標識のシナプス小胞タンパク質のエンドサイトーシスに対し融合を示します。PHluorin イメージング法を使用して、エンドサイトーシスを記録するに加え、膜小胞エンドサイトーシスの監視西洋わさびペルオキシダーゼ (HRP) 摂取量の電子顕微鏡検査 (EM) 測定による小胞によって。最後に、我々 は神経末端の穴を形成する高カリウム誘起脱分極後様々 な時を監視しました。HRP 吸収と膜ピット形成の時間的経過は、エンドサイトーシスの時間コースを示します。
概要
神経伝達物質は、シナプス小胞に格納され、エキソサイトーシスによってリリースされました。シナプス小胞膜および蛋白質は、エンドサイトーシス、によって、開口放出の次のラウンドで再利用します。シナプス小胞エンドサイトーシスは、細胞膜から突き出た小胞を削除しますシナプス小胞のプールを維持するため重要です。酸性情況で急冷、中性 pH で蛍光 pH 敏感な緑色蛍光タンパク質 pHluorin は、エンドサイトーシス時間コース ライブ セル1,2,3を測定する使用されています。PHluorin 蛋白質は通常シナプトフィジンや VAMP2/シナプトブレビンなどのシナプス小胞タンパク質の内腔側に接続されています。でも、pHluorin はシナプス小胞の 5.5 の pH ルーメンで急冷され。細胞膜に小胞の融合を公開、pH が 7.3 〜 細胞外の溶液に小胞の内腔 pHluorin 蛍光性の増加の結果します。エキソサイトーシス後、シナプス小胞蛋白質それら回復小胞内小胞再酸性化に続いてのエンドサイトーシスによる増加の蛍光が崩壊します。崩壊は、エンドサイトーシスと小胞の再酸性化を反映しているが、再酸性化がほとんど条件1,4エンドサイトーシスよりも速いのでそれ主のエンドサイトーシスを反映します。再酸性の時定数は 3-4 秒または 10 よりも一般に高速は5,6に少ない s 以上の小胞エンドサイトーシス4,5に必要な。シナプス小胞タンパク質を取得するかどうかを決定する 5.5 の pH の 4 Morpholineethanesulfonic 酸 (MES) 溶液 (25 mM) を用いた酸焼入れ実験を使用ことができます実験が再酸性からエンドサイトーシスを区別するために必要な場合エンドサイトーシス1,3,4を介して原形質膜。したがって、pHluorin 蛍光強度増加エキソおよびエンドサイトーシス、残高反映して反映されます神経刺激後減少特にエンドサイトーシス。
確率誘発リリースと自発的な解放9および pHluorin イメージングがエンドサイトーシスの時間のコースもシナプス小胞プール7、8サイズを測定するだけではなく使えます。多くの要因とエンドサイトーシスなどカルシウム、水溶性 NSF 添付ファイル蛋白質受容体 (スネア) 蛋白質、脳由来神経栄養 factor(BDNF)、カルシニューリンの調節に関与するタンパク質は、pHluorin イメージング1を使用して識別されています。,2,10,11,12,13,14,15,16. 唯一の第一次ニューロンではなく観察17神経芽細胞腫、さらに、神経伝達物質の放出が検出できます。最近では、pHluorin 亜種、下流、mOrange、pHTomato は、単一シナプス18,19で複数の要因を同時記録を監視するため開発されました。たとえば、pHTomato シナプトフィジンと融合され遺伝的コード化カルシウム インジケーター (GCaMP5K) とシナプス小胞の融合およびシナプス コンパートメント20の Ca2 +流入監視に使用します。そのため、シナプス蛋白質に接続されている pHluorin は、エンドサイトーシスとエキソサイトーシスとの関係を分析する有用な方法を提供します。
EM は一般的エンドサイトーシス中の微細構造の変化を示す高空間分解能のためのエンドサイトーシスを研究するために使用する別の方法です。2 つの一般的な領域は、神経細胞21内の病理学的変化を視覚化し、小胞蛋白質22を追跡する機能です。特に、シナプス小胞の取り込み、膜の曲率の観察 periactive ゾーンにクラスリン被覆し、エンドソーム構造が EM3,23,24,25 で可能 ,26,,2728。EM で定着剤による奇形などの潜在的なアーティファクトは、エンドサイトーシス、影響を与える可能性があります、データ分析は労働集約型、解像度は細胞構造を視覚化するための魅力的な機会を提供します。潜在的な定着性の問題と EM の時間分解能の限界は、凍結、エンドサイトーシス27の間に現在の繊細な構造の安定化の高速で非化学メソッドを提供する高圧で克服できます。
プロトコル
注: 次のプロトコルは、pHluorin イメージング法と培養海馬ニューロン pHluorin モニター シナプス小胞タンパク質吸収細胞内で使用されている EM 方法を説明しますと、EM はシナプス小胞の取り込みを検出し、。微細構造変化します
。動物のケアとプロシージャの NIH ガイドラインに従った NIH 動物ケアおよび使用委員会によって承認されました
。1 です。 pHluorin イメージング
- 海馬ニューロンの文化
- 4 mM NaHCO 3 と 5 mM HEPES を組み合わせることによって準備海馬バッファー (HB) 5 M NaOH で pH 7.3 に調整。Neurobasal、中 2 %b27、0.5 mM L グルタミンと 1% ペニシリン-ストレプトマイシンを混合することによって培養液を作る。さらに、HB バッファーと 20% の混合物を準備ウシ胎児血清 (FBS HB/20%).
注: この養殖のプロトコルは、Sankaranarayanan、ら に基づいてください。 29 日 呉 、ら 24 - 培養液に 2 日目に生後 0 日間マウスの子犬の首をはねるし、4 ° C HB/20% FBS に脳を抽出します。脳幹、視床、なったを公開するを削除します。脳幹と視床の除去によってそれを公開した後、なったを分析し、新鮮な 4 ° C HB/20% FBS に転送します
。 注: 通常、利回りは約 4 x 10 5 セル/mL 1 匹の子犬 (2 つなった) のです。ピンセットやはさみを使用して付着膜をきれいにし、新鮮な 4 ° C HB/20% FBS に転送します。海馬歯状回を引っ張り出すと、はさみで切断することによって、subiculum を分離し、新鮮な 4 ° C HB/20% FBS に転送します 。
- 約 10 スライスに端から端までを切断することによって各海馬を分割し、15 mL のポリプロピレンの円錐管にそれらを転送します 。
- を解決する組織を可能にした後 HB/20% FBS の 10 mL で洗浄し、HB の 10 mL で 3 回洗う 。
- は 137 mM の NaCl、KCl 5 mM、7 mM Na2HPO 4 25 mM HEPES、消化ソリューションを準備し、5 M NaOH で pH 7.2 に調整します。なったから上澄みを削除します。トリプシンの 10 mg と 1 mg DNase の消化液 2 mL を加えるし、サンプル ペレットに直接滅菌 0.22 μ m 膜を介してフィルターします 。
- なった 37 ° C で 5 分間インキュベートし、HB/20% FBS の 10 mL で 2 回洗浄し、HB の 10 mL で 1 回洗浄.
- 解離 MgSO 4 mg を 6 セル ∙ 7 H 2 O と DNase の 1 mg 2 mL HB と、なった上に滅菌フィルター滅菌 0.22 μ m のフィルターを通してペレットします。軽く気泡を導入することを避けるために世話をしながらの慎重な triturating によって細胞を切り離します。2 分のために解決する組織微粒子を許可し、別のチューブに上清をゆっくり転送します 。
- 追加 3 mL HB/20% FBS に細胞懸濁液、および遠心分離、または 1,000 rpm、4 ° C で 10 分。上澄みを廃棄し、培地の再懸濁します 。
- プレート 60,000 セル、coverslip オフ流出なしのポリ-D-リジン コーティングされた直径 25 mm coverslip の 150 μ L の培地の中断します。めっき後に予め温めておいた培 2 h の 2 mL を追加します。Coverslips 6 ウェル培養プレートまたは滅菌シャーレに保持されます 。
- 37 ° c 5% で維持する細胞の CO 2 は、14-21 日録音前の培地のインキュベーターを加湿しました。培地の上半分を週に 2 回変更文化成長中です 。
- 4 mM NaHCO 3 と 5 mM HEPES を組み合わせることによって準備海馬バッファー (HB) 5 M NaOH で pH 7.3 に調整。Neurobasal、中 2 %b27、0.5 mM L グルタミンと 1% ペニシリン-ストレプトマイシンを混合することによって培養液を作る。さらに、HB バッファーと 20% の混合物を準備ウシ胎児血清 (FBS HB/20%).
- トランスフェクション
- メッキ後、6-7 日 transfect シナプトフィジン pHluorin 2 X (SpH) または海馬ニューロンに VAMP2 pHluorin。SpH、サイトメガロ ウイルス (CMV) のプロモーターは、pcDNA3 ベクトル 30 に挿入を使用します。VAMP2-pHluorin を使用して pCI ベクトル 31 挿入 CMV プロモーター 。
- は、1 μ g のプラスミドを用いた標的細胞に脂質キャリアを使用していずれかのベクトルを transfect します。Transfection のため血清を欠いている、プロトコル手順 1.1.1 から培を使用します。毒性を軽減するトランスフェクション後中 2 h を変更します
。 注: ボタンで、SpH の低式の場合細胞が健康でない限り、DNA 濃度を脂質キャリアと 2 μ g または培養時間を増加します。通常、4-10 セル (0.006 0.008%) 神経細胞のトランスフェクションした 。
- 光顕微鏡
- 119 mM 2 mM の CaCl 2、2.5 mM KCl、25 mM HEPES (pH 7.4) 30 mM グルコース 2 mM MgCl 2、0.01 mM 6-cyano-7-nitroquinoxaline-2,3-dione (塩化ナトリウムから成る生理食塩水の準備CNQX) は、0.05 mM DL-2-アミノ-5-phosphonovaleric 酸 (AP5)。刺激、潤滑剤、シール剤を使用してリークを回避することができるイメージング室培養培地プレートと場所から観察を取る。ガラス、カバーガラスのプレートから商工会議所への転送中にすぐに食塩通常 750 μ L を追加して乾燥させない
。 注: CNQX と AP5 再発活動の可能性のあるシナプスの活動をブロックするために使用されました。配置する前に倒立蛍光顕微鏡の商工会議所は商工会議所が漏れていないことを確認するのに洗浄ティッシュを使用します。屈折率の変化の結果通常生理食塩水および水浸オイルの混合によって記録中にフォーカスの変更を引き起こす遅い漏れ 。
- メタルハライド ランプとレンズの刺激と
- 画像 60 X で広視野倒立顕微鏡上 (1.4 開口) オイルの液浸を記録します。480 の励起ピーク設定フィルター pHluorin を視覚化するフリップ マニュアル 500 550 nm 発光フィルター、490 nm ロングパス鏡 nm。電子乗算電荷結合デバイス (EMCCD) カメラを使用して 2 x 2 のビニングと 100 ms 毎の画像をキャプチャします
。 注: いくつかの機能は、退色、画像キャプチャ間隔を含むを避けるために適切な条件を達成してフィルター処理に考慮すべき、ビニング、機器に依存しています。共焦点レーザー顕微鏡の場合、レーザー パワーと暴露時間退色を避けるために見なす必要があります。刺激がなければ、少なくとも 3 分を記録した後セットアップを決定し、少なくとも 10 の記録を行った退色をチェックするための刺激がなければ s. - は、各実験の研究分析の容易さのための高密度エリアを選択します。ブートン、ボタン間の連続式の円形または楕円形の表現パターンに重点を置いて、緑の蛍光性信号によって transfected セルを識別します 。
- を使用して 1 刺激による誘発エンドサイトーシス ms パルス、20 mA 活動電位 (AP) パルス刺激装置から供給および白金電極刺激・ アイソレーション ・ ユニット内で配信。刺激と細胞回復中にわたって蛍光活性をイメージします
。 注: 死んでいるセルの場合式生活研究より強かったし、ボタン間斑点状のパターンを示した 。
- 画像 60 X で広視野倒立顕微鏡上 (1.4 開口) オイルの液浸を記録します。480 の励起ピーク設定フィルター pHluorin を視覚化するフリップ マニュアル 500 550 nm 発光フィルター、490 nm ロングパス鏡 nm。電子乗算電荷結合デバイス (EMCCD) カメラを使用して 2 x 2 のビニングと 100 ms 毎の画像をキャプチャします
- 119 mM 2 mM の CaCl 2、2.5 mM KCl、25 mM HEPES (pH 7.4) 30 mM グルコース 2 mM MgCl 2、0.01 mM 6-cyano-7-nitroquinoxaline-2,3-dione (塩化ナトリウムから成る生理食塩水の準備CNQX) は、0.05 mM DL-2-アミノ-5-phosphonovaleric 酸 (AP5)。刺激、潤滑剤、シール剤を使用してリークを回避することができるイメージング室培養培地プレートと場所から観察を取る。ガラス、カバーガラスのプレートから商工会議所への転送中にすぐに食塩通常 750 μ L を追加して乾燥させない
- 画像解析
- 単一のブートンで蛍光強度を分析するため設定を地域の関心 (ROI) 1.5 倍の 1.5 μ m 正方形;ブートンのサイズは約 1.5 μ m 使用退色を確認し、背景として減算への刺激の前にトレース内です 。
- 正規化蛍光式 (ΔF) を変更:
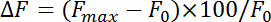
、F 最大 F 0 を参照してください最大増加刺激後・ ベースライン蛍光、それぞれ。として測定するエンドサイトーシス速度減衰率最初 4-10 s pHluorin 蛍光の最大のポイントの後。エンドサイトーシスの継手ベースライン モノラル指数関数にするピーク増加から pHluorin 蛍光減衰時定数 (τ) を取得します 。
2。電子顕微鏡
- 準備ポリ-D-リジン コーティング 6 ウェル プレート、常温で 1 h の各ウェルに 0.01% 無菌ろ過ポリ-D-リジン溶液 1.5 mL を適用し、滅菌水で 3 回を洗浄します。分析、文化、1.1.1、1.1.2、1.1.3 の手順のように海馬ニューロンをそれぞれ保持します 。
- 準備 31.5 mM の NaCl、2 mM CaCl 2、90 mM KCl、25 mM HEPES (pH 7.4) 30 mM グルコースとして HRP に高 K + 刺激ソリューション pH 5 m 7.4 に調整する 2 mM MgCl 2、CNQX 0.01 mM、0.05 mM AP5、5 mg/mL HRP、NaOH。
- 1.5 ml の高い海馬ニューロンの文化を刺激するため K + 刺激ソリューション室温 (呼ばれる K +) 各ウェルに 1.5 mL の添加により 90 で s。90 の HRP を 5 mg/mL の同じ濃度を適用 (R と呼ばれる) 静止状態で s、生理食塩水で。回収サンプルの K + サンプル高 K + 刺激ソリューションを適用し、急速に洗って食塩に置き換えるし、10 分間インキュベート
- 固定および汚損
- pH 7.4 で 21.4 グラム/L の Na cacodylate を使用して 0.1 M Na cacodylate バッファーを準備します。室温で少なくとも 1 時間 0.1 M Na cacodylate バッファーの 4% グルタルアルデヒドでセルを修復します。7 分の 0.1 M Na cacodylate バッファーで 3 回洗って 。
- 準備ジアミノベンジジン (軽打) ソリューションでは、0.5 mg/mL から成る軽く H 2 O 2 ddH 2 O、0.22 μ m フィルターでフィルターで 0.3%。3 回 7 分の 0.1 M Na cacodylate バッファーを 37 ° c. の洗浄で 30 分の 1.5 mL DAB ソリューションを適用します
。 注意: DAB は有害と疑われる発がん性物質です。手袋、白衣を使用してください
。 注: 軽打とラベリング H 2 O 2、その酸化による HRP により触媒とに発生します。サンプルでは、増加する信号のコンポーネントの結果に小さな増加。HRP の濃度を増加させる、触媒の効果がスピードアップします。H 2 O 2 の十分に大きい濃度 32 をラベリングの効果を阻害すると HRP、副反応を衰弱させるを可能にします。今回、このラベリング システムの濃度は現在利用可能な研究 33 , 34 に基づいて選ばれた 。
- では、0.1 M Na cacodylate 緩衝固定の記事、4 ° C で 1 時間に 1% OsO 4 の 1.5 mL でニューロンを孵化させなさい。7 分の 0.1 M Na cacodylate バッファーの 1.5 mL で 3 回洗って
。 注意: 毒性と OsO 4 の反応性のため氷のサンプルをおいて化学フードは孵化に冷蔵庫を使用する多くの場合望ましい 。
- 準備 0.1 M 酢酸緩衝液 13.61 グラム/L のナトリウム酢酸と 11.43 mL/L 氷酢酸で ph 5.0。1.5 mL の 0.1 M 酢酸緩衝液 pH 5.0 7 分間で 3 回洗浄し、pH 5.0 4 で 1 時間で 0.1 M 酢酸緩衝液で 1.5 mL 1 %005. incubate ° C. 洗浄 3 回 7 分の 1.5 mL の 0.1 M 酢酸緩衝液と 。
- エポキシを埋め込む
- シングル 1.5 mL 各 7 分、50%、70%、90% のエタノールの洗浄とニューロンの文化を脱水し、3 は発煙のフード 7 分 1.5 mL 100% エタノールの洗浄です 。
- ミックス 485 mL/L bisphenol-A-(epichlorhydrin) エポキシ樹脂、160 mL/L ドデセニル無水コハク酸 (性)、340 mL/L メチル-5-ノルボルネン-2, 3-ジカルボン酸 (NMA) と 15 mL/L 2,4,6-トリス (dimethylaminomethyl) フェノール (DMP 30) エポキシを作成するには樹脂です。ミックスが徹底的に、空気の泡を削除する真空下で格納します
。 注: それは特にそれらが肉眼に目に見えるよりも小さい樹脂に空気の泡を削除する重要なので断面中に樹脂のキャビティを引き起こす可能性が 。
- 50% エポキシとエタノールを置き換えることによってサンプル樹脂、シェーカーで室温で 30 分間エタノールを 70% エタノール シェーカーで室温で 30 分間のエポキシ樹脂そして潜入 。
- スイッチ エポキシ 100% エポキシ樹脂でソリューションを樹脂し、50 ° C 追加新鮮な 100% エポキシで 1 時間孵化と新鮮な 100% エポキシ樹脂の 50 ° C の実行の 2 つの取引所で 10 分間インキュベート樹脂し、50 ° c 夜間、60 ・ #17 でのセキュリティを強化することができます。6;36 h 以上を強化するための C.
- ムーティ ウェル プレートから宝石商の各サンプルを削除 ' s ハンドソー。密な濃度は、倒立顕微鏡を使用し、ミクロトームによる区分のための 70 に 80 nm ブロックのセルの関心の領域を選択します。ミクロトーム チャック内カットの領域をマウントし、ミクロトームをロードします。ミクロトームでチャックを置き、エッジ ブロックの表面に平行にダイヤモンド ナイフをマウントします。個々 のグリッドに直接 70 に 80 nm 厚のセクションを収集します 。
- は、重量、1% 溶液を水に酢酸ウランを溶解し、個別に重量によって 3% の解決のため水にクエン酸鉛を溶解します。15 分間の 1% 水溶液 005. とし、試料のコントラストを改善するために 5 分間 3% 水溶液鉛クエン酸によるセクションを counterstain 。
- EM イメージング
- 電子顕微鏡セクションと 10,000-20, 000 × 3 の主な倍率で CCD のデジタル カメラ画像を記録確認します 。
- 統計
- t を実行-制御と実験サンプル平均と標準誤差測定 (s.e.m.) を比較することによって大きな違いを識別するためにテストします 。
結果
脂質キャリア メソッドを使用して、SpH に表現された海馬ニューロン ボタン (図 1 a) の同定を可能にします。電気刺激誘発細胞エキソサイトーシスと蛍光強度の増加に対応。蛍光 (ΔF) の増加は、刺激 (図 1 b) を終了することによって停止されました。増加の蛍光は、エンドサイトーシスにより、低速の減少が続いた。VAMP2-pH...
ディスカッション
ここでは、シナプス小胞エンドサイトーシスを監視するための 2 つの方法を示します。最初のメソッドでは、pHluorin transfected ニューロンのシナプス小胞タンパク質と融合し、その後電気刺激を監視しました。第二に、kcl と HRP 取り込みの EM イメージングを使用しました。2 つの理由のためにさまざまな刺激を使いました。まず、高カリウム施肥は文化のすべてのニューロンの脱分極を誘導し?...
開示事項
著者が明らかに何もありません。
謝辞
朱永陵先生にありがとう VAMP2 phluorin を提供するため、シナプトフィジン pHluorin2x 構造と博士ジェームズ e. ロスマンを提供します。彼らのテクニカル サポートおよびヘルプ、博士スーザン ・ チェンと組織プラスミノーゲンアクテベータ電子顕微鏡施設のバージニア クロッカーに感謝します。この作品は国立研究所の神経疾患と脳卒中学内研究プログラム米国の生命研究イニシアティブ プログラム (韓国生物医学科学者フェローシップ プログラム)、韓国研究所からの助成金によって支持されました。バイオ サイエンスとバイオ テクノロジー、大韓民国。
資料
| Name | Company | Catalog Number | Comments |
| Lipofectamine LTX with Plus | Thermo Fisher | 15338-100 | Transfection of plasmid DNA including synaptophysin or VAMP2-pHluorin |
| neurobasal medium | Thermo Fisher | 21103-049 | Growth medium for neuron, Warm up to 37°C before use |
| B27 | Thermo Fisher | 17504-044 | Gradient for neuronal differentiation |
| Glutamax | Thermo Fisher | 35050-061 | Gradient for neuronal culture |
| Poly-D-Lysine coated coverslip | Neuvitro | GG-25-pdl | Substrate for neuronal growth and imaging of pHluorin |
| Trypsin XI from bovine pancrease | Sigma | T1005 | Neuronal culture-digest hippocampal tissues |
| Deoxyribonuclease I from bovine pancreas | Sigma | D5025 | Neuronal culture-inhibits viscous cell suspension |
| pulse stimulator | A-M systems | model 2100 | Apply electrical stimulation |
| Slotted bath with field stimulation | Warner Instruments | RC-21BRFS | Apply electrical stimulation |
| stimulus isolation unit | Warner Instruments | SIU102 | Apply electrical stimulation |
| lubricant | Dow corning | 111 | pHluorin imaging-seal with coverslip and imaging chamber, avoid leak from chamber |
| AP5 | Tocris | 3693 | Gradient for normal saline, selective NMDA receptor antagonist, inhibit postsynaptic activity which have potential for recurrent activity |
| CNQX | Tocris | 190 | Gradient for normal saline, competitive AMPA/kainate receptor antagonist, inhibit postsynaptic activity which have potential for recurrent activity |
| Illuminator | Nikon | C-HGFI | Metal halide light source for pHluorin |
| EMCCD camera | Andor | iXon3 | pHluorin imaging, detect pHluorin fluorescence intensity |
| Inverted microscopy | Nikon | Ti-E | Imaging for synaptophysin or VAMP2 pHluorin transfected cells |
| NIS-Elements AR | Nikon | NIS-Elements Advanced Research | Software for imaging acquisition and analysis |
| Igor Pro | WaveMetrics | Igor pro | Software for imaging analysis and data presentation |
| imaging chamber | Warner Instruments | RC21B | pHluorin imaging, apply field stimulation on living cells |
| poly-l-lysine | Sigma | P4832 | Electron microscopy, substrate for neuronal growth, apply on multiwell plate for 1 h at room temperature then wash with sterilized water 3 times |
| Horseradish peroxidase(HRP) | Sigma | P6782 | Electron microscopy, labeling of endocytosed synaptic vesicles by catalyzing DAB in presence hydrogen peroxide, final concentration is 5 mg/mL in normal saline, make fresh before use |
| Na cacodylate | Electron Microscopy Sciences | 12300 | Electron microscopy, buffer for fixatives and washing, final concentration is 0.1 N |
| 3,3′-Diaminobenzidine(DAB) | Sigma | D8001 | Electron microscopy, labeling of endocytosed synaptic vesicles, substrate for HRP, final concentration is 0.5 mg/mL in DDW and filtered, make fresh before use |
| Hydrogen peroxide solution | Sigma | H1009 | Electron microscopy, labeling of endocytosed synaptic vesicles by inducing HRP-DAB reaction, final concentration is 0.3% in DDW, make fresh before use |
| glutaraldehyde | Electron Microscopy Sciences | 16365 | Electron microscopy, fixatives, final concentration is 4% in Na-cacodylate buffer, make fresh before use, shake well before to use |
| TEM | JEOL | 200CX | Electron microscopy, imaging of endocytosed vesicles and ultrastructural changes |
| CCD digital camera | AMT | XR-100 | Electron microscopy, capturing images |
| Lead citrate | Leica microsystems | 16707235 | Electron microscopy, grid staining |
参考文献
- Sankaranarayanan, S., Ryan, T. A. Real-time measurements of vesicle-SNARE recycling in synapses of the central nervous system. Nature cell biol. 2 (4), 197-204 (2000).
- Sun, T., Wu, X. S., et al. The role of calcium/calmodulin-activated calcineurin in rapid and slow endocytosis at central synapses. J Neurosci. 30 (35), 11838-11847 (2010).
- Wu, X. -. S. S., Lee, S. H., et al. Actin Is Crucial for All Kinetically Distinguishable Forms of Endocytosis at Synapses. Neuron. 92 (5), 1020-1035 (2016).
- Granseth, B., Odermatt, B., Royle, S. J., Lagnado, L. Clathrin-mediated endocytosis is the dominant mechanism of vesicle retrieval at hippocampal synapses. Neuron. 51 (6), 773-786 (2006).
- Atluri, P. P., Ryan, T. A. The kinetics of synaptic vesicle reacidification at hippocampal nerve terminals. J Neurosci. 26 (8), 2313-2320 (2006).
- Royle, S. J., Granseth, B., Odermatt, B., Derevier, A., Lagnado, L. Imaging phluorin-based probes at hippocampal synapses. Methods Mol Biol. 457, 293-303 (2008).
- Moulder, K. L., Mennerick, S. Reluctant vesicles contribute to the total readily releasable pool in glutamatergic hippocampal neurons. J Neurosci. 25 (15), 3842-3850 (2005).
- Li, Z., Burrone, J., Tyler, W. J., Hartman, K. N., Albeanu, D. F., Murthy, V. N. Synaptic vesicle recycling studied in transgenic mice expressing synaptopHluorin. Proc Natl Acad Sci U S A. 102 (17), 6131-6136 (2005).
- Morris, R. G. Elements of a neurobiological theory of hippocampal function: the role of synaptic plasticity, synaptic tagging and schemas. Eur J Neurosci. 23 (11), 2829-2846 (2006).
- Sankaranarayanan, S., Ryan, T. A. Calcium accelerates endocytosis of vSNAREs at hippocampal synapses. Nat Neurosci. 4 (2), 129-136 (2001).
- Balaji, J., Armbruster, M., Ryan, T. A. Calcium control of endocytic capacity at a CNS synapse. J Neurosci. 28 (26), 6742-6749 (2008).
- Ferguson, S. M., Brasnjo, G., et al. A selective activity-dependent requirement for dynamin 1 in synaptic vesicle endocytosis. Science. 316 (5824), 570-574 (2007).
- Baydyuk, M., Wu, X. S., He, L., Wu, L. G. Brain-derived neurotrophic factor inhibits calcium channel activation, exocytosis, and endocytosis at a central nerve terminal. J Neurosci. 35 (11), 4676-4682 (2015).
- Wu, X. S., Zhang, Z., Zhao, W. D., Wang, D., Luo, F., Wu, L. G. Calcineurin is universally involved in vesicle endocytosis at neuronal and nonneuronal secretory cells. Cell Rep. 7 (4), 982-988 (2014).
- Zhang, Z., Wang, D., et al. The SNARE proteins SNAP25 and synaptobrevin are involved in endocytosis at hippocampal synapses. J Neurosci. 33 (21), 9169-9175 (2013).
- Wu, L. -. G. G., Hamid, E., Shin, W., Chiang, H. -. C. C. Exocytosis and endocytosis: modes, functions, and coupling mechanisms. Annu Rev Physiol. 76 (1), 301-331 (2014).
- Daniele, F., Di Cairano, E. S., Moretti, S., Piccoli, G., Perego, C. TIRFM and pH-sensitive GFP-probes to evaluate neurotransmitter vesicle dynamics in SH-SY5Y neuroblastoma cells: cell imaging and data analysis. J Vis Exp. (95), e52267 (2015).
- Shaner, N. C., Lin, M. Z., et al. Improving the photostability of bright monomeric orange and red fluorescent proteins. Nat Methods. 5 (6), 545-551 (2008).
- Li, Y., Tsien, R. W. pHTomato, a red, genetically encoded indicator that enables multiplex interrogation of synaptic activity. Nat Neurosci. 15 (7), 1047-1053 (2012).
- Leitz, J., Kavalali, E. T. Fast retrieval and autonomous regulation of single spontaneously recycling synaptic vesicles. Elife. 3, e03658 (2014).
- Bisht, K., El Hajj, H., Savage, J. C., Sánchez, M. G., Tremblay, M. -. &. #. 2. 0. 0. ;. Correlative Light and Electron Microscopy to Study Microglial Interactions with β-Amyloid Plaques. J Vis Exp. (112), e54060 (2016).
- Schikorski, T. Monitoring Synaptic Vesicle Protein Sorting with Enhanced Horseradish Peroxidase in the Electron Microscope. High-Resolution Imaging of Cellular Proteins: Methods and Protocols. , 327-341 (2016).
- Kononenko, N. L., Puchkov, D., et al. Clathrin/AP-2 mediate synaptic vesicle reformation from endosome-like vacuoles but are not essential for membrane retrieval at central synapses. Neuron. 82 (5), 981-988 (2014).
- Wu, Y., O'Toole, E. T., et al. A dynamin 1-, dynamin 3- and clathrin-independent pathway of synaptic vesicle recycling mediated by bulk endocytosis. eLife. 2014 (3), e01621 (2014).
- Heuser, J. E., Reese, T. S. Evidence for recycling of synaptic vesicle membrane during transmitter release at the frog neuromuscular junction. J Cell Biol. 57 (2), 315-344 (1973).
- Ceccarelli, B., Hurlbut, W. P., Mauro, A. Turnover of transmitter and synaptic vesicles at the frog neuromuscular junction. J Cell Biol. 57 (2), 499-524 (1973).
- Watanabe, S., Rost, B. R., et al. Ultrafast endocytosis at mouse hippocampal synapses. Nature. 504 (7479), 242-247 (2013).
- Watanabe, S., Trimbuch, T., et al. Clathrin regenerates synaptic vesicles from endosomes. Nature. 515 (7526), 228-233 (2014).
- Sankaranarayanan, S., Atluri, P. P., Ryan, T. A. Actin has a molecular scaffolding, not propulsive, role in presynaptic function. Nat Neurosci. 6 (2), 127-135 (2003).
- Zhu, Y., Xu, J., Heinemann, S. F. Two pathways of synaptic vesicle retrieval revealed by single-vesicle imaging. Neuron. 61 (3), 397-411 (2009).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394 (6689), 192-195 (1998).
- Arnao, M. B. B., Acosta, M., del Rio, J. A. A., García-Cánovas, F. Inactivation of peroxidase by hydrogen peroxide and its protection by a reductant agent. Biochim Biophys Acta. 1038 (1), 85-89 (1990).
- Deák, F., Schoch, S., et al. Synaptobrevin is essential for fast synaptic-vesicle endocytosis. Nat Cell Biol. 6 (11), 1102-1108 (2004).
- Clayton, E. L., Evans, G. J. O., Cousin, M. A. Bulk synaptic vesicle endocytosis is rapidly triggered during strong stimulation. J Neurosci. 28 (26), 6627-6632 (2008).
- Kavalali, E. T., Jorgensen, E. M. Visualizing presynaptic function. Nat Neurosci. 17 (1), 10-16 (2014).
- Wienisch, M., Klingauf, J. Vesicular proteins exocytosed and subsequently retrieved by compensatory endocytosis are nonidentical. Nat Neurosci. 9 (8), 1019-1027 (2006).
- Fernández-Alfonso, T., Kwan, R., Ryan, T. A. Synaptic vesicles interchange their membrane proteins with a large surface reservoir during recycling. Neuron. 51 (2), 179-186 (2006).
- Gimber, N., Tadeus, G., Maritzen, T., Schmoranzer, J., Haucke, V. Diffusional spread and confinement of newly exocytosed synaptic vesicle proteins. Nat Commun. 6, 8392 (2015).
- Nicholson-Fish, J. C., Smillie, K. J., Cousin, M. A. Monitoring activity-dependent bulk endocytosis with the genetically-encoded reporter VAMP4-pHluorin. J Neurosci Methods. 266, 1-10 (2016).
- Burrone, J., Li, Z., Murthy, V. N. Studying vesicle cycling in presynaptic terminals using the genetically encoded probe synaptopHluorin. Nat Protoc. 1 (6), 2970-2978 (2006).
- Wisse, E., Braet, F., et al. Fixation methods for electron microscopy of human and other liver. World journal of gastroenterology. 16 (23), 2851-2866 (2010).
- Magidson, V., Khodjakov, A. Circumventing Photodamage in Live-Cell Microscopy. Methods in Cell Biology. 114, 545-560 (2013).
- Søndergaard, C. R., Garrett, A. E., et al. Structural artifacts in protein-ligand X-ray structures: implications for the development of docking scoring functions. J Med Chem. 52 (18), 5673-5684 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved