Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Измеряя эндоцитоза синаптических пузырьков в культивированный Нейроны гиппокампа
В этой статье
Резюме
Синаптических пузырьков эндоцитоза обнаруживается световой микроскопии pHluorin сливается с синаптических пузырьков белка и электронной микроскопии везикул поглощения.
Аннотация
Во время эндоцитоза расплавленный синаптических пузырьков извлекаются на нервные окончания, позволяя для рециркуляции везикул и, таким образом, поддержание синаптической передачи во время повторяющихся нервных стрельбы. Нарушением эндоцитоза в патологических условиях приводит к уменьшается в синаптической силы и мозга функции. Здесь мы описываем методы, используемые для измерения эндоцитоза синаптических пузырьков на млекопитающих гиппокампа синапсов в нейрональных культуры. Мы мониторинг синаптических пузырьков белка эндоцитоза путем сплавления синаптических везикулярного мембранный белок, включая synaptophysin и VAMP2/Синаптобревин, на стороне везикулярного lumenal, с pHluorin, рН чувствительных Зеленый флуоресцирующий белок, который увеличивает его увеличивает интенсивность флуоресценции как pH. Во время экзоцитоз везикулярной люмен рН увеличивается, тогда как во время эндоцитоза везикулярного люмен рН восстановления подкисленных. Таким образом увеличение интенсивности флуоресценции pHluorin указывает фьюжн, а уменьшение эндоцитоза помечены синаптических пузырьков белка. Помимо использования метода pHluorin изображений для записи эндоцитоза, мы контролируется везикулярного мембраны эндоцитоза измерениями электронной микроскопии (EM) хрен пероксидазы (ПХ) поглощения везикулы. Наконец мы за формирование нервных терминал мембраны ямы в разное время после высокой калия индуцированной деполяризации. Время курс HRP поглощения и мембраны яму формирования указывает время курс эндоцитоз.
Введение
Медиаторы хранятся в синаптических пузырьков и выпущенный экзоцитоз. Синаптических везикул мембранных белков затем учитываются путем эндоцитоза и повторно в следующем раунде экзоцитоз. Эндоцитоза синаптических пузырьков имеет важное значение для поддержания синаптических пузырьков бассейны и удаляет выступающих везикулы от плазматической мембраны. РН чувствительных Зеленый флуоресцирующий белок pHluorin, которая угасает в кислотных обстоятельствах и dequenched в нейтральном pH, был использован для измерения времени эндоцитоза курсы в живой клетки1,2,3. PHluorin белок обычно прикрепляется к lumenal стороне синаптических пузырьков белков, таких как synaptophysin или VAMP2/Синаптобревин. В состоянии покоя pHluorin закаленного в 5,5 рН люмен синаптических пузырьков. Сплавливание Vesicle к плазматической мембраны предоставляет везикулярного просвета в внеклеточной решение, где pH ~ 7.3, что привело к увеличению в pHluorin флуоресценции. После экзоцитоз увеличение флуоресценции распадов, благодаря эндоцитоза синаптических пузырьков белков, следуют везикул повторного подкисления в рамках этих восстановленных везикулы. Хотя распад отражает эндоцитоза и везикулярного восстановление подкисления, она главным образом отражает эндоцитоза, потому что восстановление подкисления быстрее, чем эндоцитоза в большинстве условий1,4. Постоянная времени восстановления подкисления является 3-4 s или менее5,6, который обычно быстрее, чем 10 s или более необходимые для везикул эндоцитоза4,5. Если эксперименты необходимо различать эндоцитоза от повторного подкисления, кислоты тушения эксперименты, используя 4-Morpholineethanesulfonic кислота (MES) решение (25 мм) с рН 5,5 может использоваться для определения, извлекаются ли белки синаптических пузырьков из плазматической мембраны через эндоцитоза1,3,4. Таким образом увеличение интенсивности флуоресценции pHluorin отражает баланс экзо - и эндоцитоза, и уменьшение после стимуляции нерва конкретно отражает эндоцитоз.
pHluorin изображений может использоваться не только для того, чтобы измерить время курс эндоцитоза, но и размер синаптических пузырьков бассейны7,8, и вероятность вызвали выпуска и спонтанное выпуск9. Многие факторы и белков, участвующих в регулировании эндоцитоза, таких как кальций, растворимые NSF-вложение белка рецептора (SNARE) белки, factor(BDNF) мозга нейротрофического и кальциневрина были определены с использованием pHluorin изображений1 , 2 , 10 , 11 , 12 , 13 , 14 , 15 , 16. Кроме того, освобождение нейромедиатора могут быть обнаружены в нейроны не только основного, но в нейробластома клеток с TIRFM17. Недавно варианты pHluorin, dsRed, mOrange и pHTomato были разработаны для мониторинга одновременной записи множества факторов в одном синапса18,19. К примеру pHTomato сливается с synaptophysin и используется с индикатором генетически закодированный кальция (GCaMP5K) для мониторинга Пресинаптический везикул фьюжн и Ca2 + приток в постсинаптической отсека20. Таким образом pHluorin, придает синаптических белков предоставляет полезный метод для анализа взаимосвязи между эндоцитоза и экзоцитоз.
EM является еще одним методом, обычно используется для изучения эндоцитоза, благодаря высоким пространственным разрешением, которая показывает ультраструктурные изменения во время эндоцитоз. Две общие области являются способность визуализировать патологические изменения в нейрональных клеток21 и отслеживать везикул белки22. В частности наблюдение за поглощение синаптических пузырьков, мембраны кривизны покрытием Клатрин в зоне periactive, и от англ структуры возможны с EM3,23,24,25 ,26,27,28. В то время как EM включает потенциальных артефактов, таких как фиксатор индуцированной пороков, которые могут повлиять на эндоцитоза, и анализ данных является трудоемким, резолюция обеспечивает привлекательной возможностью для визуализации клеточной структуры. Под высоким давлением, замораживания, предоставляя быстрый и не химический метод стабилизации деликатные структуры, присутствующие во время эндоцитоза27может преодолеть потенциальные фиксирующие проблемы и ограничения в EM временное разрешение.
протокол
Примечание: следующий протокол описывает методы визуализации pHluorin и EM методы, используемые в культивированный Нейроны гиппокампа. pHluorin мониторы синаптических пузырьков белка поглощения в живых клетках и EM обнаруживает усвоение синаптических пузырьков и ультраструктурные изменения.
Уход за животными и процедура руководящими низ и были одобрены NIH животных ухода и использования Комитетом.
1. pHluorin Imaging
- гиппокампа нейрон культуры
- подготовить гиппокампа буфера (HB), объединив 4 мм NaHCO 3 и 5 мм HEPES и приспособиться к рН 7.3 с 5 M NaOH. Сделайте питательной среды, смешивая neurobasal средний, 2% B27, 0.5 мм L-глютамина и 1% пенициллин стрептомицином. Кроме того, приготовить смесь из буфера HB с 20% плода Bovine сыворотки (HB/20% FBS).
Примечание: Этот культивирования протокол основан на Санкаранараянан, и др. 29 и Ву и др. 24 - обезглавить щенков мыши между послеродовой день 0 день 2 в культурной среде и извлеките мозга на 4 ° C HB/20% FBS. Удаление мозга и таламус подвергать гиппокампах. Вскрыть в гиппокампах, после разоблачения его путем удаления ствола мозга и таламус и передать свежие 4 ° C HB/20% FBS.
Примечание: Как правило, урожайность-около 4 x 10 5 клеток/мл для одного щенка (два гиппокампах). Очистить от приставшей мембраны, с помощью пинцета или ножницы, а затем передать свежие 4 ° C HB/20% FBS. Раскрутите зубчатой извилины и изолировать subiculum путем резать с ножницами, а затем передать свежие 4 ° C HB/20% FBS. - Разделить каждый гиппокампа, путем разрезания от начала до конца, около 10 ломтиками и передавать их на 15 мл полипропиленовые Конические трубки.
- После позволяя ткани поселиться, мыть с 10 мл HB/20% FBS, а затем вымыть три раза с 10 мл HB.
- Готовят раствор пищеварение 137 мм NaCl, 5 мм KCl, 7 мм Na2HPO 4 и 25 мм HEPES и приспособиться к рН 7,2 с 5 M NaOH. Удалите из гиппокампах супернатант. Добавить 10 мг трипсина и 1 мг DNase к 2 мл раствора пищеварение и процеживают через стерильную 0,22 мкм мембраны непосредственно на образце Пелле.
- Инкубировать гиппокампах 5 минут при 37 ° C, а затем мыть дважды с 10 мл HB/20% FBS и затем промойте раз 10 мл HB.
- Разбить ячейки с 6 мг, MgSO 4 ∙ 7 H 2 O и 1 мг DNase 2 мл HB и стерильным фильтром на гиппокампах Пелле через стерильную 0,22 мкм фильтром. Аккуратно отделить клетки, тщательно растирая, заботясь, чтобы избежать воздушных пузырей. Разрешить частиц тканей поселиться за 2 мин, а затем медленно супернатант в другой трубки.
- Добавить 3 мл HB/20% FBS в суспензии клеток и центрифуги или 10 мин при температуре 4 ° C и 1000 об/мин. Отменить супернатант и Ресуспензируйте в среде культуры.
- Плита 60000 клетки приостановлено в 150 мкл питательной среды на поли-D-лизин покрытием диаметром 25-мм coverslip, без разлива от coverslip. Добавьте 2 мл подогретым культуры среднего 2 ч после покрытия. Coverslips сохраняются в 6-ну культивирования пластин или стерильной Петри.
- Сохранить клетки при 37 ° C в 5% CO 2 увлажняется инкубатора в питательную среду для 14-21 дней до записи. Во время роста культуры, изменить в верхней половине среды дважды в неделю.
- подготовить гиппокампа буфера (HB), объединив 4 мм NaHCO 3 и 5 мм HEPES и приспособиться к рН 7.3 с 5 M NaOH. Сделайте питательной среды, смешивая neurobasal средний, 2% B27, 0.5 мм L-глютамина и 1% пенициллин стрептомицином. Кроме того, приготовить смесь из буфера HB с 20% плода Bovine сыворотки (HB/20% FBS).
- Transfection
- 6-7 дней после покрытия, transfect synaptophysin-pHluorin 2 X (SpH) или VAMP2-pHluorin в Нейроны гиппокампа. Для SpH используйте промоутер цитомегаловирусом (CMV), вставляется в вектор pcDNA3 30. Для VAMP2-pHluorin, используйте ЦМВ промоутер вставлен в pCI вектор 31.
- Transfect либо вектор перевозчиком липидов в клетки-мишени, используя 1 мкг плазмиды. Использование культуры среднего от протокола шаг 1.1.1, который не хватает сыворотки, для transfection. Изменение среднего 2 ч после трансфекции снижения токсичности.
Примечание: В случае низкой выражение SpH в boutons, увеличение концентрации ДНК 2 мкг или время инкубации с перевозчиком липидов, если клетки вредны. Как правило, 4-10 клеток (0,006-0,008%) нейронов были transfected.
- Светлую микроскопию
- подготовьте нормальный физиологический раствор состоит из 119 мм NaCl, 2 мм CaCl 2, 2,5 мм KCl, 25 мм HEPES (рН 7,4), глюкозы 30 мм, 2 мм MgCl 2, 6-cyano-7-nitroquinoxaline-2,3-dione (0,01 мм CNQX) и 0,05 мм DL-2-амино-5-phosphonovaleric кислоты (AP5). Возьмите coverslip от культуры средних плита и место на изображений камеры, что позволяет поле стимуляции, используя смазка и герметика, чтобы избежать утечки. Не давая стекла сухой во время передачи coverslip от пластины в камере, сразу добавляя 750 мкл нормальный физиологический раствор.
Примечание: CNQX и AP5 были использованы для блокирования постсинаптических деятельность, которая имеет потенциал для периодических активности. Прежде чем поместить камеру на Перевернутый флуоресцентным микроскопом, используйте очистки ткани для подтверждения, что палата не сливать. Медленная утечка вызывает изменения фокуса во время записи путем смешивания нормальной солевой раствор и погружения нефти, что приводит к изменениям в преломления. - Стимуляции и записи
- изображения на Перевернутый widefield микроскопом с 60 X (1.4 числовая апертура) масло погружения линзы с металлогалогенные лампы. Визуализация pHluorin с фильтром Набор для возбуждения пик 480 Нм, зеркалом длинный пас 490 Нм, 500-550 нм фильтра выбросов и ручной флип затвора. Захват изображения каждые 100 мс, с 2 x 2 биннинга, с использованием камеры электрона умножения заряда в сочетании устройства (EMCCD).
Примечание: Некоторые функции должны рассматриваться для обеспечения надлежащих условий для избежания Фотообесцвечивание, включая интервал захвата изображения и фильтрации и биннинга, которая зависит от оборудования. В случае конфокальная томография, лазер сила и выдержка времени следует рассматривать во избежание Фотообесцвечивание. Установка был определен после записи по крайней мере 3 мин без стимула и запись была выполнена по крайней мере 10 s без стимула для проверки Фотообесцвечивание. - Выбор области с высокой плотностью boutons для удобства анализа в каждом эксперименте. Определить transfected клеток по их зеленой флуоресценцией сигнала, с упором на круглой или овальной выражение закономерности в бутона и постоянное выражение между boutons.
- Вызывают эндоцитоза поле стимуляция с помощью 1 мс пульс, 20 мА потенциал действия (AP) поставляется от импульсов стимулятора и доставлены через Платиновый электрод в изолятор стимул. Изображения флуоресценции активность в течение стимуляции и во время восстановления клеток.
Примечание: В случае омертвевшие клетки, выражение было сильнее, чем жизнь boutons и показал пятнистый узор между boutons.
- изображения на Перевернутый widefield микроскопом с 60 X (1.4 числовая апертура) масло погружения линзы с металлогалогенные лампы. Визуализация pHluorin с фильтром Набор для возбуждения пик 480 Нм, зеркалом длинный пас 490 Нм, 500-550 нм фильтра выбросов и ручной флип затвора. Захват изображения каждые 100 мс, с 2 x 2 биннинга, с использованием камеры электрона умножения заряда в сочетании устройства (EMCCD).
- подготовьте нормальный физиологический раствор состоит из 119 мм NaCl, 2 мм CaCl 2, 2,5 мм KCl, 25 мм HEPES (рН 7,4), глюкозы 30 мм, 2 мм MgCl 2, 6-cyano-7-nitroquinoxaline-2,3-dione (0,01 мм CNQX) и 0,05 мм DL-2-амино-5-phosphonovaleric кислоты (AP5). Возьмите coverslip от культуры средних плита и место на изображений камеры, что позволяет поле стимуляции, используя смазка и герметика, чтобы избежать утечки. Не давая стекла сухой во время передачи coverslip от пластины в камере, сразу добавляя 750 мкл нормальный физиологический раствор.
- Анализ изображений
- Для анализа интенсивности флуоресценции в один бутон, установите вверх региона интерес (ROI) как 1,5 x 1,5 мкм квадратных; Размер бутона находится в около 1,5 мкм. Использование следы до стимуляции для проверки Фотообесцвечивание и вычитание фона.
- Нормализовать флуоресценции изменить (ΔF) с уравнением:
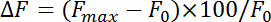
где F Макс и F 0 ссылаются на максимальное увеличение после стимуляции и базовые флуоресценции, соответственно. Измерьте эндоцитоза ставки как скорость распада во время первых 4-10 s после точки максимальной pHluorin флуоресценции. Получение постоянной времени (τ) эндоцитоза путем установки флуоресценции распад pHluorin от пик увеличения базовой линии с моно Показательная функция.
2. Электронная микроскопия
- подготовить поли-D-лизин покрытием 6-ну пластина применения 1,5 мл раствора 0,01% стерильная фильтрация поли-D-Лизин для каждой скважины, за 1 ч при комнатной температуре, то мытье три раза с стерилизации воды. Вскрыть, культура и соответственно поддерживать нейроны гиппокампа как шаги 1.1.1, 1.1.2 и 1.1.3,.
- Подготовить высокий решение стимуляции K + с ПХ 31,5 мм NaCl, 2 мм CaCl 2, 90 мм KCl, 25 мм HEPES (рН 7,4), глюкозы 30 мм, 2 мм MgCl 2, 0,01 мм CNQX, 0,05 мм AP5 и 5 мг/мл HRP, затем отрегулируйте к пэ-ашу 7.4 с 5 М NaOH.
- Стимулировать культуру гиппокампа нейрона с 1,5 мл высокий K + стимуляции решение при комнатной температуре (упоминаемый как K +) путем добавления 1,5 мл в каждую лунку для 90 s. В состояние покоя (именуемый R), применить такой же концентрации 5 мг/мл HRP для 90 s, но с нормальной солевой раствор. Для восстановления образца, применять высокие K + стимуляции раствор с K + образца, затем быстро вымыть и заменить с физиологическим и инкубировать на 10 мин
- Фиксации и окраски
- подготовить 0,1 М Na cacodylate буфер с помощью 21.4 гр/Л Na cacodylate на рН 7,4. Исправьте клетки с 4% глютаральдегид в 0,1 М Na cacodylate буфер для по крайней мере 1 ч при комнатной температуре. Вымойте три раза с 0,1 М Na cacodylate буфер для 7 мин.
- Решение подготовить Диаминобензидин (DAB), состоящая из 0.5 мг/мл DAB с 0,3% H 2 O 2 в ddH 2 O и 0,22 мкм фильтром. Применить DAB 1,5 мл раствора для 30 минут при 37 ° C. мыть три раза с 0,1 М Na cacodylate буфер для 7 мин.
Предупреждение: DAB является канцерогеном токсичных и подозреваемых. Пожалуйста, используйте перчатки и халатах.
Примечание: Маркировки с DAB происходит из-за его окисления H 2 O 2, катализируемые ПХ. Небольшое увеличение в результате компоненты в увеличение сигнала в образце. Повышение концентрации HRP ускоряет эффект катализатора. Достаточно большой концентрации H 2 O 2 позволяют изнурительных побочных реакций с ПХ, ингибирующих эффект маркировки 32. В этой работе, концентрации этой системы маркировки были выбраны на основе имеющихся в настоящее время исследования 33 , 34. - Инкубировать нейронов с 1,5 мл 1% OsO 4 в буфер cacodylate Na 0,1 М за 1 ч при температуре 4 ° C как после фиксации. Вымойте три раза с 1,5 мл 0,1 М Na cacodylate буфера для 7 мин.
ВНИМАНИЕ: Из-за токсичности и реактивности OsO 4, сохраняя образца на льду в химической капот во многих случаях предпочтительнее использование холодильник для инкубации. - Подготовка 0,1 М натрия ацетата буфер с 13.61 г/Л натрия ацетат и 11.43 мл/Л Ледниковая укусная кислота при pH 5,0. Вымойте три раза с 1,5 мл 0,1 М ацетат буфера при pH 5,0 за 7 мин и проинкубируйте с 1.5 мл 1% уранила ацетат в буфере ацетата 0,1 М при pH 5,0 за 1 ч в 4 ° C. мыть три раза с 1,5 мл 0,1 М ацетат буфер для 7 мин.
- Эпоксидной встраивание
- обезвоживает нейрон культуры с моет одного 1,5 мл 50%, 70% и 90% этанола, 7 мин в каждой и затем 3 моет по 1,5 мл 100% этанола для 7 мин в зонта.
- Смесь 485 мл/Л bisphenol-A-(epichlorhydrin) эпоксидная смола, 160 мл/Л dodecenyl янтарной ангидрид (DDSA), 340 мл/Л метил-5-норборненом-2,3-дикарбоновых ангидрид (НМА) и 15 мл/Л 2,4,6-трис (диметиламинометил) фенола (DMP-30) для создания эпоксидной смола. Смесь тщательно, затем хранить под вакуумом для удаления воздушных пузырей.
Примечание: Очень важно для удаления пузырьков воздуха в смоле, особенно тех, которые меньше, чем видимый невооруженным глазом, потому что они могут вызвать полостей в смолы при резании. - Инфильтрата, образец, заменив этанола с 50% эпоксидной смолы в этанол 30 мин при комнатной температуре на шейкер, то 70% эпоксидных смол в этиловом спирте в течение 30 мин при комнатной температуре на шейкере.
- Переключатель эпоксидной смолы раствор с 100% эпоксидной смолы и проинкубируйте втечение 10 мин свежего 100% эпоксидной смолы на 50 ° C. выполнение двух обменов с инкубаций за 1 ч при 50 ° C. Добавить свежие 100% эпоксидной смолы и позволить затвердеть на 50 ° C в одночасье и затем на 60 & #17 6; C для более чем 36 h затвердеть.
- Удалить каждый образец от Мути ну пластины с ювелир ' s ножовка. Выберите регионы интереса, плотные концентрации клеток, с помощью инвертированного микроскопа света, а затем вырезать 70 до 80 Нм блоки для разрезания микротома. Смонтировать отрезока региона в Чак микротома и загрузить микротома. Поместите зажимной патрон в микротома и смонтировать Алмазный нож с лезвием параллельно поверхности блока. Собирать секции толщиной 70 до 80 Нм непосредственно на отдельных сетках.
- Распустить уранила ацетат в воду на 1% раствор по весу и отдельно растворить свинца цитрат в воду на 3% раствор по весу. Counterstain разделы погружение с 1% водного раствора уранила ацетат 15 мин, а затем цитрат 3% водного раствора свинца на 5 минут, чтобы улучшить контраст образцов.
- EM изображений
- изучить разделы с просвечивающий электронный микроскоп и записи изображений с цифровой камеры CCD в первичной увеличение 10 000-20, 000 X 3.
- Статистика
- выполняет t-тест для определения существенных различий, сравнивая среднее значение и стандартную ошибку измерения (s.e.m.) между элементом управления и экспериментальных образцов.
Результаты
С помощью метода перевозчик липидов, SpH была выражена в Нейроны гиппокампа, позволяя для идентификации boutons (рис. 1a). Электрическая стимуляция клеток индуцированной экзоцитоз и соответствующее увеличение интенсивности флуоресценции. Увеличение флуоре...
Обсуждение
Здесь мы продемонстрировать два метода для мониторинга синаптических пузырьков эндоцитоз. В первом методе мы наблюдает pHluorin сливается с протеином синаптических пузырьков в transfected нейронов и впоследствии электрически стимулировали. Во-вторых мы использовали EM изображений HRP поглощен?...
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Мы благодарим д-р Ён-Линг Zhu за предоставление synaptophysin-pHluorin2x конструкцию и д-р Джеймс э. Ротман для обеспечения VAMP2-phluorin. Мы благодарим д-р Сьюзен Чэн и Вирджиния Crocker NINDS микроскопии фонда за их техническую поддержку и помощь. Эта работа была поддержана Национальный институт неврологических нарушений и инсульта интрамуральных исследовательской программы в США и Грант от KRIBB исследовательской инициативе программы (корейский биомедицинских ученый программа стипендий), Корея научно-исследовательский институт Бионауки и биотехнологии, Республика Корея.
Материалы
| Name | Company | Catalog Number | Comments |
| Lipofectamine LTX with Plus | Thermo Fisher | 15338-100 | Transfection of plasmid DNA including synaptophysin or VAMP2-pHluorin |
| neurobasal medium | Thermo Fisher | 21103-049 | Growth medium for neuron, Warm up to 37°C before use |
| B27 | Thermo Fisher | 17504-044 | Gradient for neuronal differentiation |
| Glutamax | Thermo Fisher | 35050-061 | Gradient for neuronal culture |
| Poly-D-Lysine coated coverslip | Neuvitro | GG-25-pdl | Substrate for neuronal growth and imaging of pHluorin |
| Trypsin XI from bovine pancrease | Sigma | T1005 | Neuronal culture-digest hippocampal tissues |
| Deoxyribonuclease I from bovine pancreas | Sigma | D5025 | Neuronal culture-inhibits viscous cell suspension |
| pulse stimulator | A-M systems | model 2100 | Apply electrical stimulation |
| Slotted bath with field stimulation | Warner Instruments | RC-21BRFS | Apply electrical stimulation |
| stimulus isolation unit | Warner Instruments | SIU102 | Apply electrical stimulation |
| lubricant | Dow corning | 111 | pHluorin imaging-seal with coverslip and imaging chamber, avoid leak from chamber |
| AP5 | Tocris | 3693 | Gradient for normal saline, selective NMDA receptor antagonist, inhibit postsynaptic activity which have potential for recurrent activity |
| CNQX | Tocris | 190 | Gradient for normal saline, competitive AMPA/kainate receptor antagonist, inhibit postsynaptic activity which have potential for recurrent activity |
| Illuminator | Nikon | C-HGFI | Metal halide light source for pHluorin |
| EMCCD camera | Andor | iXon3 | pHluorin imaging, detect pHluorin fluorescence intensity |
| Inverted microscopy | Nikon | Ti-E | Imaging for synaptophysin or VAMP2 pHluorin transfected cells |
| NIS-Elements AR | Nikon | NIS-Elements Advanced Research | Software for imaging acquisition and analysis |
| Igor Pro | WaveMetrics | Igor pro | Software for imaging analysis and data presentation |
| imaging chamber | Warner Instruments | RC21B | pHluorin imaging, apply field stimulation on living cells |
| poly-l-lysine | Sigma | P4832 | Electron microscopy, substrate for neuronal growth, apply on multiwell plate for 1 h at room temperature then wash with sterilized water 3 times |
| Horseradish peroxidase(HRP) | Sigma | P6782 | Electron microscopy, labeling of endocytosed synaptic vesicles by catalyzing DAB in presence hydrogen peroxide, final concentration is 5 mg/mL in normal saline, make fresh before use |
| Na cacodylate | Electron Microscopy Sciences | 12300 | Electron microscopy, buffer for fixatives and washing, final concentration is 0.1 N |
| 3,3′-Diaminobenzidine(DAB) | Sigma | D8001 | Electron microscopy, labeling of endocytosed synaptic vesicles, substrate for HRP, final concentration is 0.5 mg/mL in DDW and filtered, make fresh before use |
| Hydrogen peroxide solution | Sigma | H1009 | Electron microscopy, labeling of endocytosed synaptic vesicles by inducing HRP-DAB reaction, final concentration is 0.3% in DDW, make fresh before use |
| glutaraldehyde | Electron Microscopy Sciences | 16365 | Electron microscopy, fixatives, final concentration is 4% in Na-cacodylate buffer, make fresh before use, shake well before to use |
| TEM | JEOL | 200CX | Electron microscopy, imaging of endocytosed vesicles and ultrastructural changes |
| CCD digital camera | AMT | XR-100 | Electron microscopy, capturing images |
| Lead citrate | Leica microsystems | 16707235 | Electron microscopy, grid staining |
Ссылки
- Sankaranarayanan, S., Ryan, T. A. Real-time measurements of vesicle-SNARE recycling in synapses of the central nervous system. Nature cell biol. 2 (4), 197-204 (2000).
- Sun, T., Wu, X. S., et al. The role of calcium/calmodulin-activated calcineurin in rapid and slow endocytosis at central synapses. J Neurosci. 30 (35), 11838-11847 (2010).
- Wu, X. -. S. S., Lee, S. H., et al. Actin Is Crucial for All Kinetically Distinguishable Forms of Endocytosis at Synapses. Neuron. 92 (5), 1020-1035 (2016).
- Granseth, B., Odermatt, B., Royle, S. J., Lagnado, L. Clathrin-mediated endocytosis is the dominant mechanism of vesicle retrieval at hippocampal synapses. Neuron. 51 (6), 773-786 (2006).
- Atluri, P. P., Ryan, T. A. The kinetics of synaptic vesicle reacidification at hippocampal nerve terminals. J Neurosci. 26 (8), 2313-2320 (2006).
- Royle, S. J., Granseth, B., Odermatt, B., Derevier, A., Lagnado, L. Imaging phluorin-based probes at hippocampal synapses. Methods Mol Biol. 457, 293-303 (2008).
- Moulder, K. L., Mennerick, S. Reluctant vesicles contribute to the total readily releasable pool in glutamatergic hippocampal neurons. J Neurosci. 25 (15), 3842-3850 (2005).
- Li, Z., Burrone, J., Tyler, W. J., Hartman, K. N., Albeanu, D. F., Murthy, V. N. Synaptic vesicle recycling studied in transgenic mice expressing synaptopHluorin. Proc Natl Acad Sci U S A. 102 (17), 6131-6136 (2005).
- Morris, R. G. Elements of a neurobiological theory of hippocampal function: the role of synaptic plasticity, synaptic tagging and schemas. Eur J Neurosci. 23 (11), 2829-2846 (2006).
- Sankaranarayanan, S., Ryan, T. A. Calcium accelerates endocytosis of vSNAREs at hippocampal synapses. Nat Neurosci. 4 (2), 129-136 (2001).
- Balaji, J., Armbruster, M., Ryan, T. A. Calcium control of endocytic capacity at a CNS synapse. J Neurosci. 28 (26), 6742-6749 (2008).
- Ferguson, S. M., Brasnjo, G., et al. A selective activity-dependent requirement for dynamin 1 in synaptic vesicle endocytosis. Science. 316 (5824), 570-574 (2007).
- Baydyuk, M., Wu, X. S., He, L., Wu, L. G. Brain-derived neurotrophic factor inhibits calcium channel activation, exocytosis, and endocytosis at a central nerve terminal. J Neurosci. 35 (11), 4676-4682 (2015).
- Wu, X. S., Zhang, Z., Zhao, W. D., Wang, D., Luo, F., Wu, L. G. Calcineurin is universally involved in vesicle endocytosis at neuronal and nonneuronal secretory cells. Cell Rep. 7 (4), 982-988 (2014).
- Zhang, Z., Wang, D., et al. The SNARE proteins SNAP25 and synaptobrevin are involved in endocytosis at hippocampal synapses. J Neurosci. 33 (21), 9169-9175 (2013).
- Wu, L. -. G. G., Hamid, E., Shin, W., Chiang, H. -. C. C. Exocytosis and endocytosis: modes, functions, and coupling mechanisms. Annu Rev Physiol. 76 (1), 301-331 (2014).
- Daniele, F., Di Cairano, E. S., Moretti, S., Piccoli, G., Perego, C. TIRFM and pH-sensitive GFP-probes to evaluate neurotransmitter vesicle dynamics in SH-SY5Y neuroblastoma cells: cell imaging and data analysis. J Vis Exp. (95), e52267 (2015).
- Shaner, N. C., Lin, M. Z., et al. Improving the photostability of bright monomeric orange and red fluorescent proteins. Nat Methods. 5 (6), 545-551 (2008).
- Li, Y., Tsien, R. W. pHTomato, a red, genetically encoded indicator that enables multiplex interrogation of synaptic activity. Nat Neurosci. 15 (7), 1047-1053 (2012).
- Leitz, J., Kavalali, E. T. Fast retrieval and autonomous regulation of single spontaneously recycling synaptic vesicles. Elife. 3, e03658 (2014).
- Bisht, K., El Hajj, H., Savage, J. C., Sánchez, M. G., Tremblay, M. -. &. #. 2. 0. 0. ;. Correlative Light and Electron Microscopy to Study Microglial Interactions with β-Amyloid Plaques. J Vis Exp. (112), e54060 (2016).
- Schikorski, T. Monitoring Synaptic Vesicle Protein Sorting with Enhanced Horseradish Peroxidase in the Electron Microscope. High-Resolution Imaging of Cellular Proteins: Methods and Protocols. , 327-341 (2016).
- Kononenko, N. L., Puchkov, D., et al. Clathrin/AP-2 mediate synaptic vesicle reformation from endosome-like vacuoles but are not essential for membrane retrieval at central synapses. Neuron. 82 (5), 981-988 (2014).
- Wu, Y., O'Toole, E. T., et al. A dynamin 1-, dynamin 3- and clathrin-independent pathway of synaptic vesicle recycling mediated by bulk endocytosis. eLife. 2014 (3), e01621 (2014).
- Heuser, J. E., Reese, T. S. Evidence for recycling of synaptic vesicle membrane during transmitter release at the frog neuromuscular junction. J Cell Biol. 57 (2), 315-344 (1973).
- Ceccarelli, B., Hurlbut, W. P., Mauro, A. Turnover of transmitter and synaptic vesicles at the frog neuromuscular junction. J Cell Biol. 57 (2), 499-524 (1973).
- Watanabe, S., Rost, B. R., et al. Ultrafast endocytosis at mouse hippocampal synapses. Nature. 504 (7479), 242-247 (2013).
- Watanabe, S., Trimbuch, T., et al. Clathrin regenerates synaptic vesicles from endosomes. Nature. 515 (7526), 228-233 (2014).
- Sankaranarayanan, S., Atluri, P. P., Ryan, T. A. Actin has a molecular scaffolding, not propulsive, role in presynaptic function. Nat Neurosci. 6 (2), 127-135 (2003).
- Zhu, Y., Xu, J., Heinemann, S. F. Two pathways of synaptic vesicle retrieval revealed by single-vesicle imaging. Neuron. 61 (3), 397-411 (2009).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394 (6689), 192-195 (1998).
- Arnao, M. B. B., Acosta, M., del Rio, J. A. A., García-Cánovas, F. Inactivation of peroxidase by hydrogen peroxide and its protection by a reductant agent. Biochim Biophys Acta. 1038 (1), 85-89 (1990).
- Deák, F., Schoch, S., et al. Synaptobrevin is essential for fast synaptic-vesicle endocytosis. Nat Cell Biol. 6 (11), 1102-1108 (2004).
- Clayton, E. L., Evans, G. J. O., Cousin, M. A. Bulk synaptic vesicle endocytosis is rapidly triggered during strong stimulation. J Neurosci. 28 (26), 6627-6632 (2008).
- Kavalali, E. T., Jorgensen, E. M. Visualizing presynaptic function. Nat Neurosci. 17 (1), 10-16 (2014).
- Wienisch, M., Klingauf, J. Vesicular proteins exocytosed and subsequently retrieved by compensatory endocytosis are nonidentical. Nat Neurosci. 9 (8), 1019-1027 (2006).
- Fernández-Alfonso, T., Kwan, R., Ryan, T. A. Synaptic vesicles interchange their membrane proteins with a large surface reservoir during recycling. Neuron. 51 (2), 179-186 (2006).
- Gimber, N., Tadeus, G., Maritzen, T., Schmoranzer, J., Haucke, V. Diffusional spread and confinement of newly exocytosed synaptic vesicle proteins. Nat Commun. 6, 8392 (2015).
- Nicholson-Fish, J. C., Smillie, K. J., Cousin, M. A. Monitoring activity-dependent bulk endocytosis with the genetically-encoded reporter VAMP4-pHluorin. J Neurosci Methods. 266, 1-10 (2016).
- Burrone, J., Li, Z., Murthy, V. N. Studying vesicle cycling in presynaptic terminals using the genetically encoded probe synaptopHluorin. Nat Protoc. 1 (6), 2970-2978 (2006).
- Wisse, E., Braet, F., et al. Fixation methods for electron microscopy of human and other liver. World journal of gastroenterology. 16 (23), 2851-2866 (2010).
- Magidson, V., Khodjakov, A. Circumventing Photodamage in Live-Cell Microscopy. Methods in Cell Biology. 114, 545-560 (2013).
- Søndergaard, C. R., Garrett, A. E., et al. Structural artifacts in protein-ligand X-ray structures: implications for the development of docking scoring functions. J Med Chem. 52 (18), 5673-5684 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены