JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
교양된 Hippocampal 신경에 시 냅 스 소포 Endocytosis를 측정
요약
시 냅 스 소포 endocytosis pHluorin 시 냅 스 소포 단백질 융합의 가벼운 현미경에 의해 및 소포 통풍 관의 전자 현미경 검사 법에 의해 검출 된다.
초록
Endocytosis, 동안 융합된 시 냅 스 소포는 신경 단자, 소포 재활용 및 따라서 반복적인 신경 발생 중 시 냅 시스 전송의 유지 보수에 대 한 허용에서 검색 됩니다. 병 적인 조건에서 장애인된 endocytosis 시 냅 스 강도 및 뇌 기능 감소에 지도 한다. 여기, 우리 포유류 hippocampal 신경 문화에서 시 냅 스에서 시 냅 스 소포 endocytosis를 측정 하는 데 사용 하는 방법을 설명 합니다. 우리는 등 synaptophysin VAMP2/synaptobrevin, pHluorin, 증가 하는 pH에 민감한 녹색 형광 성 단백질으로 기공을 lumenal 측면에서 시 냅 스 기공을 막 단백질을 융합 하 여 시 냅 스 소포 단백질 endocytosis를 모니터링의 형광 강도 pH로 증가합니다. Exocytosis, 동안 기공을 루멘 pH 증가, endocytosis 기공을 루멘 동안 pH는 다시 acidified. 따라서, pHluorin 형광 강도의 증가 나타냅니다 퓨전, 반면 감소의 이라는 시 냅 스 소포 단백질 endocytosis를 나타냅니다. 기록 endocytosis를 pHluorin 이미징 메서드를 사용 하 여, 우리 소포에 의해 양 고추냉이 과산화 효소 (HRP) 통풍 관의 전자 현미경 (EM) 측정 하 여 기공을 막 endocytosis 모니터링. 마지막으로, 우리는 높은 칼륨 유도 도발은 후 다양 한 시간에 신경 터미널 막 구 덩이의 형성을 모니터링합니다. HRP 통풍 관 및 막 구 덩이 형성의 시간 과정 endocytosis의 시간 과정을 나타냅니다.
서문
신경 전달 물질 시 냅 스 소포에 저장 되며 exocytosis 발표. 시 냅 스 소포 막과 단백질은 endocytosis에 의해 내 면 그리고 exocytosis의 다음 라운드에서 다시. 시 냅 스 소포 endocytosis 시 냅 스 소포 풀을 유지 관리 하는 것이 중요 하다 고 플라즈마 막에서 튀어나온 소포를 제거 합니다. Endocytosis 시간 과정에 라이브 셀1,,23측정 하는 신랄 한 상황에서 침묵 중립 pH에 dequenched, pH에 민감한 녹색 형광 단백질 pHluorin 사용 되었습니다. PHluorin 단백질 시 냅 스 소포 단백질, synaptophysin 등 VAMP2/synaptobrevin의 lumenal 측에 일반적으로 붙어 있다. 휴식, pHluorin 시 냅 스 소포의 5.5 pH 루멘에 침묵 이다. 원형질 막에 소포 융해 노출 pH가 7.3 ~ extracellular 해결책에 기공을 루멘 pHluorin 형광에 있는 증가 결과로. Exocytosis, 뒤에 그 복구 된 소포 내 기 다시 산성화 시 냅 스 소포 단백질 endocytosis 인해 증가 형광 자연 붕괴 후 감퇴 반영 endocytosis 기공을 다시 산성화, 비록 그것은 대부분 반영 한다 endocytosis, 다시 산성화 endocytosis 대부분 조건1,4보다 빠릅니다 때문에. 다시 산성화의 시간 상수는 3-4 s 또는 더 적은5,6일반적으로 10 보다 더는 s 이상의 소포 endocytosis4,5에 필요한. 실험 다시 산성화 endocytosis를 구별 하기 위하여 필요한 경우 4-Morpholineethanesulfonic 산 (MES) 솔루션 (25 mM)를 사용 하 여 ph 5.5의 산 성 냉각 실험 시 냅 스 소포 단백질 검색할지 여부를 결정 하 사용할 수 있습니다. endocytosis1,,34를 통해 원형질 막. 따라서, pHluorin 형광 강도 증가 및 endocytosis, 균형을 반영 하 고 신경 자극 후 감소는 endocytosis에 구체적으로 반영 한다.
pHluorin 이미징 뿐만 아니라 endocytosis, 시간 과정 뿐만 아니라 시 냅 스 소포 풀7,8의 크기를 측정 하는 데 사용할 수 있습니다 그리고 갖는 릴리스 자발적인 가능성이 릴리스9. 많은 요인과 단백질 endocytosis, 칼슘, 수용 성 NSF 부착 단백질 수용 체 (올 무) 단백질, 두뇌 파생 된 neurotrophic factor(BDNF) calcineurin 등 규제에 관련 된 확인 된 pHluorin 이미징1 를 사용 하 여 , 2 , 10 , 11 , 12 , 13 , 14 , 15 , 16.만 주 신경에서 하지만 TIRFM17신경 세포에서 신경 전달 물질의 릴리스를 검출 될 수 또한. 최근, pHTomato, mOrange, dsRed, pHluorin 변종 단일 시 냅 스18,19에서 여러 요인의 동시 녹음을 모니터링 하기 위한 개발 되었다. 예를 들어 pHTomato 되어 synaptophysin 융합과 연 접 소포 융해와 Ca2 + 유입 postsynaptic 구획20에서 유전자 인코딩된 칼슘 표시기 (GCaMP5K)와 함께 사용. 따라서, pHluorin 시 냅 스 단백질에 부착 된 endocytosis 및 exocytosis 사이의 관계를 분석 하는 유용한 방법을 제공 합니다.
그들은 일반적으로 endocytosis endocytosis 동안 ultrastructural 변화를 보여주는 높은 공간 해상도 인해 공부 하는 데 사용 하는 또 다른 방법은. 2 개의 일반적인 신경 세포21 내 병 적인 변화를 시각화 하 고 소포 단백질22를 추적 하는 기능입니다. 특히, 시 냅 스 소포 통풍 관, 막 곡률의 관찰 periactive 영역에서 clathrin으로 코팅 하 고 endosomal 구조는 그들3,,2324,25 가능 ,26,,2728. EM 정착 액 유도 기형 등의 잠재적인 아티팩트를 포함 하는 동안 endocytosis, 영향을 줄 수 있는 그리고 데이터 분석은 노동 집약, 세포의 구조를 시각화 하는 매력적인 기회를 제공 하는 해상도. 통 문제 및 EM 시간적 해상도 제한 동결, endocytosis27중 섬세 한 구조를 안정화의 빠르고 비 화학 제품 방법을 제공 하는 높은 압력에 의해 극복할 수 있습니다.
프로토콜
참고: 다음 프로토콜 pHluorin 이미징 방법 및 교양 hippocampal 신경. pHluorin 모니터 시 냅 스 소포 단백질 통풍 관에 살아있는 세포에 사용 되는 EM 방법에 설명 하 고 그들 시 냅 스 소포의 감지 및 ultrastructural 변경.
동물 보호 및 절차 NIH 지침을 따라와 NIH 동물 관리 및 사용 위원회에 의해 승인 했다.
1. pHluorin 이미징
- Hippocampal 신경 문화
- 준비 해 마 버퍼 (HB) 4mm NaHCO 3 및 5 mM HEPES 결합 하 여 5 M NaOH로 pH 7.3에 조정. 보통 2 %B27, 0.5 m m L-글루타민 및 1% 페니실린 스 neurobasal를 혼합 하 여 문화 매체를 확인 합니다. 또한, HB 버퍼 20%의 혼합물 준비 소 태아 혈 청 (HB/20% FBS).
참고:이 자란 프로토콜 기반 Sankaranarayanan, 외. 29 고 우 외. 24 - 출생 후 0 하루에 하루 2 문화 매체로 사이 마우스 강아지 목을 벨 및 4 ° C HB/20% FBS에 두뇌를 추출. 노출은 된 시상 및 brainstem를 제거 합니다. 후, 시상 및 brainstem의 제거에 의해 노출 된, 밖으로 해 부 고 신선한 4 ° c HB/20% FBS.
참고: 일반적으로, 비중은 약 4 x 10 1 강아지 (두 된) 5 셀/mL입니다. 핀셋 이나가 위를 사용 하 여 접착 막 떨어져 청소 그 후에 신선한 4 ° C HB/20% FBS 전송 가 이랑 풀가 위, 절단 하 여는 subiculum 분리 그리고 신선한 4 ° c HB/20% FBS 전송. - 끝에 약 10 조각으로 절단 하 여 각 해 마를 분할 하 고 폴 리 프로필 렌 15 mL 원뿔 튜브에 그들을 전송.
- 허용한 후에 정착 조직, HB/20% FBS의 10 mL로 씻어 하 고 다음 세 번의 HB 10 mL로 씻어.
- 137 mM NaCl, KCl 5mm, 7mm Na2HPO 4, 25mm HEPES의 소화 솔루션을 준비 하 고 5 M NaOH로 pH 7.2에 조정. 상쾌한 고 된에서 제거. 소화 솔루션의 2 개 mL를 trypsin의 10 mg와 DNase의 1 밀리 그램을 추가 하 고 샘플 펠 릿에 직접 살 균 0.22 μ m 멤브레인 통해 필터링.
- 된 37 ° C에서 5 분 동안 품 어 다음 HB/20% FBS의 10 mL로 두 번 세척 하 고 다음 한 번 HB의 10 mL로 씻어.
- 해리 MgSO 4의 6 mg와 셀 ∙ 7 H 2 O 및 2 mL HB에는 된 살 균 필터를 1mg DNase의 메 마른 0.22 μ m 필터를 통해 작은. 부드럽게 주의 분쇄 하 여 세포를 분리, 돌보는 동안 공기 도입 방지 하기 거품. 2 분 동안 정착 조직 입자를 허용 하 고 다음 천천히 다른 튜브에는 상쾌한 전송.
- 추가 3 mL HB/20% FBS 세포 현 탁 액, 그리고 원심 분리기 또는 4 ° C에서와 1000 rpm 10 분. 삭제는 상쾌한 고 문화 매체에서 resuspend.
- 플레이트 60000 세포는 coverslip에서 유출 없이 폴 리-D-리 코팅 25 m m 직경 coverslip에 150 µ L 문화 매체에. 도금 후 미리 데워 진된 문화 매체 2 h의 2 개 mL를 추가 합니다. Coverslips 6-잘 자란 또는 멸 균 페 트리 디쉬에 유지 됩니다.
- 5%에서 37 ° C에서 유지 세포 CO 2 14-21 일 녹화 전에 대 한 문화 매체에 인큐베이터 습도. 동안 문화 성장 매체의 상반신 일주일에 두 번 변경.
- 준비 해 마 버퍼 (HB) 4mm NaHCO 3 및 5 mM HEPES 결합 하 여 5 M NaOH로 pH 7.3에 조정. 보통 2 %B27, 0.5 m m L-글루타민 및 1% 페니실린 스 neurobasal를 혼합 하 여 문화 매체를 확인 합니다. 또한, HB 버퍼 20%의 혼합물 준비 소 태아 혈 청 (HB/20% FBS).
- Transfection
- 도금, 후 6-7 일 synaptophysin-pHluorin 2 X transfect (SpH) 또는 hippocampal 신경으로 VAMP2-pHluorin. SpH, 세포 (CMV) 발기인, 30 pcDNA3 벡터 삽입을 사용 합니다. VAMP2-pHluorin를 사용 하 여 pCI 벡터 31에 삽입 CMV 발기인.
- 1 µ g의 플라스 미드를 사용 하 여 대상 세포에 지질 여 두 벡터 transfect. 혈 청 부족, 프로토콜 단계 1.1.1에서 문화 매체를 사용 하 여 있는 transfection에 대 한. 독성을 줄이기 위해 transfection 후 매체 2 h 변경.
참고: 낮은 표현의 SpH는 boutons에서,의 경우 증가 지질 캐리어와 2 µ g 또는 보육 시간 DNA 농도 세포 건강 하지 않는. 일반적으로, 4-10 셀 (0.006 0.008%)의 transfected 했다.
- 가벼운 현미경
- 119 mM NaCl, 2mm CaCl 2, 2.5 m m KCl, 25mm HEPES (pH 7.4), 포도 당 30 m m, 2 m m MgCl 2, 6-cyano-7-nitroquinoxaline-2,3-dione (0.01 m m의 준비 정상적인 염 분 솔루션 구성 CNQX), 그리고 0.05 mM DL-2-아미노-5-phosphonovaleric 산 (AP5). 배양 접시와 장소에서 coverslip 필드 자극, 윤활제 및 실 란 트를 사용 하 여 누수를 피하기 위해 허용 하는 이미징 챔버를 가져가 라. 유리 접시에서 챔버는 coverslip의 전송 중 즉시 750 µ L 정상적인 염 분 솔루션을 추가 하 여 건조 시키는 피하십시오.
참고: CNQX와 AP5 재발 활동에 대 한 잠재력이 postsynaptic 활동을 차단 하 사용 되었다. 거꾸로 형광 현미경에는 챔버를 배치 하기 전에 청소 티슈를 사용 하 여 챔버 누설 하지 않는 것인지. 굴절 인덱스에 변화 귀착되는 일반 식 염 수와 침수 오일의 혼합 하 여 녹음 하는 동안 포커스 변경 하면 느린 새. - 금속 할로겐 램프와 자극 및 기록
- 60 X 거꾸로 widefield 현미경에
- 이미지 (1.4 숫자 조리개) 기름 침수 렌즈. 480의 여기 피크에 대 한 설정 필터 pHluorin 시각화 nm, 490 nm 긴 패스 거울, 500-550 nm 방출 필터와 수동 플립 셔터. 이미지 마다 100 ms, 2 x 2 비 닝와 전자 멀티 충전 결합 장치 (EMCCD) 카메라를 사용 하 여 캡처.
참고: 여러 기능 고려해 야 이미지 캡처 간격을 포함 하 여 photobleaching을 피하기 위해 적절 한 상태를 달성 하 고 필터링 하 고 범주화는 장비에 의존. 공초점 이미지의 경우 레이저 전원 및 노출 시간을 photobleaching을 피하기 위해 고려해 야 합니다. 자극 없이 3 분 이상 녹화 후 설치 결정 했다 고 녹음 적어도 10 수행한 photobleaching를 확인 하는 자극 없이 s. - 각 실험에 분석의 용이성을 위해 boutons의 높은 밀도와 영역을 선택합니다. Bouton과 boutons 사이 연속 식에 원형 또는 타원형 식 패턴에 중점을 두고 그들의 녹색 형광 신호에 의해 transfected 세포를 식별.
- 1를 사용 하 여 필드 자극에 의해 유발 endocytosis ms 펄스, 20 mA 활동 전위 (AP) 펄스 자극에서 공급 하 고 자극 격리 단위 내의 백 금 전극을 통해 전달. 자극의 및 셀 복구 하는 동안에 걸쳐 형광 활동 이미지.
참고: 죽은 세포의 경우 식 생활 boutons 보다 강한와 boutons 사이 누 덕 누 덕 패턴을 보였다.
- 이미지 (1.4 숫자 조리개) 기름 침수 렌즈. 480의 여기 피크에 대 한 설정 필터 pHluorin 시각화 nm, 490 nm 긴 패스 거울, 500-550 nm 방출 필터와 수동 플립 셔터. 이미지 마다 100 ms, 2 x 2 비 닝와 전자 멀티 충전 결합 장치 (EMCCD) 카메라를 사용 하 여 캡처.
- 119 mM NaCl, 2mm CaCl 2, 2.5 m m KCl, 25mm HEPES (pH 7.4), 포도 당 30 m m, 2 m m MgCl 2, 6-cyano-7-nitroquinoxaline-2,3-dione (0.01 m m의 준비 정상적인 염 분 솔루션 구성 CNQX), 그리고 0.05 mM DL-2-아미노-5-phosphonovaleric 산 (AP5). 배양 접시와 장소에서 coverslip 필드 자극, 윤활제 및 실 란 트를 사용 하 여 누수를 피하기 위해 허용 하는 이미징 챔버를 가져가 라. 유리 접시에서 챔버는 coverslip의 전송 중 즉시 750 µ L 정상적인 염 분 솔루션을 추가 하 여 건조 시키는 피하십시오.
- 이미지 분석
- 단일 bouton의 형광 강도 분석, 설정까지 한 지역의 관심 (ROI) 1.5 x 1.5 µ m 평방; bouton는 크기가 약 1.5 µ m. 사용 흔적 자극 photobleaching에 대 한 확인을 배경으로 빼기 전에 내.
- Normalize 형광 변화 (δ) 방정식:
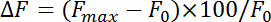
어디 최대 F와 F 0 참조 최대한 증가 자극 후 그리고 초기 형광, 각각. 측정 endocytosis 요금 감퇴의 속도으로 첫 번째 동안 4-10 s pHluorin 형광의 최대 시점 이후. 모노 지 수 기능으로 기준선에 피크 증가에서 pHluorin 형광 붕괴를 피팅 하 여 endocytosis의 시간 상수 (τ)를 취득.
2. 전자 현미경
- 준비 폴 리 D Lysine을 실 온에서 1 h에 대 한 각 영역 0.01% 살 균 필터링 폴 리-D-리 솔루션의 1.5 mL를 적용 다음 소독된 물으로 세 번 세척 하 여 6 잘 플레이트 코팅. 해 부, 문화, 및 각각 1.1.1, 1.1.2, 1.1.3, 단계에서 hippocampal 신경 유지.
- 준비 HRP 31.5 m NaCl, 2mm CaCl 2, 90 m KCl, 25mm HEPES (pH 7.4), 포도 당 30 m m, m m로 높은 K + 자극 솔루션 2 mM MgCl 2, 0.01 m CNQX m, 0.05 m m AP5, 및 5 mg/mL HRP, pH 7.4 5 m에 조정 NaOH.
90 (라고도 K +) 각 음을 1.5 mL의 추가 의해 실 온에서
- Stimulate 1.5 mL 높은 hippocampal 신경 문화권 K + 자극 솔루션 s. 휴식 상태 (R 라고도 함)에 적용 5 mg/mL HRP 90의 동일한 농도 s, 하지만 정상적인 염 분 해결책. 복구 샘플 K + 예제와 마찬가지로 높은 K + 자극 솔루션 적용 다음 빠르게 세척 및 정상적인 염 분 고 10 분에 대 한 품 어
- 고정 및 얼룩
- pH 7.4에서 21.4 g/L Na cacodylate를 사용 하 여 0.1 m M 나 cacodylate 버퍼를 준비. 0.1 m M 나 cacodylate 버퍼 실내 온도에 적어도 1 시간에에서 4%도 함께 셀을 수정 합니다. 3 시간 7 분 0.1 m M 나 cacodylate 버퍼와 세척.
- 준비 Diaminobenzidine (한 덩어리) 솔루션, 0.5 mg/mL의 구성 0.3% H 2 O 2 ddH 2 O, 및 0.22 μ m 필터와 필터를 줘 봐. 3 시간 7 분 0.1 m M 나 cacodylate 버퍼와 37 ° C. 세척에서 30 분 동안 1.5 mL DAB 솔루션 적용.
주의: 소량 의심과 독성 발암 물질 이다. 장갑 및 실험실 외 투를 사용 하시기 바랍니다.
참고: DAB로 의해 발생 합니다 그것의 산화로 인해 H 2 O 2, HRP에 의해 촉매로. 샘플에서 증가 신호 구성 결과의 작은 증가 합니다. HRP의 농도 증가 속도 촉매의 효과. H 2 O 2의 큰 농도 허용 측 반응, HRP와 쇠 약 32 라벨의 효과 억제 합니다. 이 작품에서는,이 라벨 시스템의 농도 현재 사용할 수 있는 연구 33 , 34에 따라 선정 됐다. - 1.5 mL의 0.1 m M 나 cacodylate 버퍼 고정 게시물 4 ° C에서 1 시간에에서 1% OsO 4와 뉴런을 품 어. 7 분 0.1 m M 나 cacodylate 버퍼의 1.5 mL로 세 번 세척.
주의: 독성 및 OsO 4의 반응성 화학 후드에 얼음 샘플을 유지 보다는 많은 경우에는 보육에 대 한 냉장고를 사용 하 여. - 준비 0.1 M 나트륨 아세테이트 버퍼 13.61 g/L 나트륨 아세테이트와 11.43 mL/L 빙 초 산 pH 5.0에서 함께. 1.5 mL 0.1 M 아세테이트 버퍼 pH 7 분 5.0로 세 번 세척 및 pH 5.0 4에서 1 h에서 0.1 M 아세테이트 버퍼에 1.5 mL 1 %uranyl 아세테이트와 품 어 ° C. 씻어 3 시간 7 분 1.5 mL 0.1 M 아세테이트 버퍼.
- 에폭시 포함
- 각 7 분 50%, 70% 및 90% 에탄올의 단일 1.5 mL 세척으로 신경 문화 탈수 하 고 다음 3 1.5 mL 100% 에탄올 증기 두건에서 각각 7 분의 세척.
- 믹스 485 mL/L bisphenol-A-(epichlorhydrin) 만들 에폭시 에폭시 수 지, 160 mL/L dodecenyl 호박 무수 물 (DDSA), 우리 모두의 340 mL/L 메 틸-5-Norbornene-2, 3-Dicarboxylic 무수 물 (NMA), 그리고 15 mL/L 2,4,6-트리 스 (dimethylaminomethyl) 페 놀 (DMP-30) 수 지입니다. 믹스 철저 하 게, 공기 방울을 제거 하는 진공에서 다음 저장.
참고: 그것은 특히 그 보다는 육안에 보이는 작은 수 지에서 기포를 제거 하는 중요 한 그들은 단면 중 수 지에 구멍을 일으킬 수 있기 때문. - 70% 에폭시 수 지 통에 실 온에서 30 분 동안 에탄올에 다음 50% 에폭시와 에탄올을 대체 하 여 샘플 통에 실 온에서 30 분 동안 에탄올에 수 지 침투.
- 스위치 에폭시 솔루션 100% 에폭시 수 지와 수 지와 1 h 50 ° C. 추가 신선한 100% 에폭시에 대 한 외피와 신선한 100% 에폭시 수 지의 50 ° C. 수행 2 교류에서 10 분 동안 품 어 수 지 고 50 ° C 하룻밤 사이에 그리고 60 & # 17에서 보안을 강화 하 6; 보안을 강화 하 여 36 h에 대 한 C.
- Muti-잘 접시에서 보석으로 각 샘플을 제거 ' s 톱. 관심, 셀, 거꾸로 가벼운 현미경을 사용 하 여 다음 잘라 톰에 의해 단면에 대 한 70 ~ 80 nm 블록의 조밀한 농도 영역을 선택 합니다. 로드는 톰을 톰 척에 컷된 영역을 탑재 합니다. 톰에 물림 쇠를 놓고 블록의 표면에 평행한 가장자리 다이아몬드 칼을 탑재 합니다. 직접 개별 격자에 70 ~ 80 nm 두께의 섹션을 수집.
- 무게, 1%의 솔루션에 대 한 물으로 uranyl 아세테이트를 녹이 고 별도로 무게 3% 솔루션 물으로 리드 시트르산을 디졸브. 15 분 동안 1% 수성 uranyl 아세테이트와 다음 샘플의 명암을 개선 하기 위해 5 분 동안 3% 수성 리드 시트르산 침수에 의해 섹션 counterstain.
- EM 이미징
- 전송 전자 현미경으로 섹션 및 10000-20, 000 X 3의 기본 확대 CCD 디지털 카메라와 함께 이미지를 기록 검사.
- 통계
- t 수행-제어 및 실험 샘플 사이의 평균 및 측정 (s.e.m.)의 표준 오차를 비교 하 여 상당한 차이 식별 하기 위해 테스트.
결과
지질 캐리어 메서드를 사용 하 여, SpH 표현 hippocampal 신경에 있는 boutons (그림 1a)의 식별에 대 한 허용. 셀의 전기 자극 형광 강도 exocytosis, 그리고 증가 유도 한다. 형광 (δ)의 증가 자극 (그림 1b)를 종료 하 여 중단 됐다. 증가 형광 endocytosis 인해 느린 감소에 선행 되었다. VAMP2-pHluorin, 경우 VAMP2 자극4후는 bouton에?...
토론
여기 우리는 시 냅 스 소포 endocytosis를 모니터링 하기 위한 두 가지 방법을 보여 줍니다. 첫 번째 방법에서 우리 pHluorin transfected 신경에 시 냅 스 소포 단백질 융합 하 고 그 후 전기 자극을 모니터링. KCl에 의해 유도 된 둘째, 우리 EM 이미징 HRP 통풍 관의 사용. 우리는 두 가지 이유로 다른 자극을 사용. 첫째, 높은 칼륨 응용 문화에 모든 뉴런의 도발은 유도. 이 우리의 EM 방법론은 비 자극과 자극 뉴?...
공개
저자는 공개 없다.
감사의 말
우리 감사 박사 용 링 Zhu synaptophysin pHluorin2x 구조, 및 박사 제임스 E. 로스 VAMP2 phluorin를 제공 하기 위한 제공. 우리가 그들의 기술 지원 및 도움말에 대 한 박사 수잔 쳉과 버지니아 크 로커 NINDS 전자 현미경 시설의 감사합니다. 이 작품은 신경 성 질환의 국가 학회 및 미국 및 생명 공학 연구소 연구 이니셔티브 프로그램 (한국 생명 과학자 친목 프로그램), 한국 연구 학회에서에서 부여에 선 교내 연구 프로그램에 의해 지원 되었다 생명 과학, 생명 공학, 한국
자료
| Name | Company | Catalog Number | Comments |
| Lipofectamine LTX with Plus | Thermo Fisher | 15338-100 | Transfection of plasmid DNA including synaptophysin or VAMP2-pHluorin |
| neurobasal medium | Thermo Fisher | 21103-049 | Growth medium for neuron, Warm up to 37°C before use |
| B27 | Thermo Fisher | 17504-044 | Gradient for neuronal differentiation |
| Glutamax | Thermo Fisher | 35050-061 | Gradient for neuronal culture |
| Poly-D-Lysine coated coverslip | Neuvitro | GG-25-pdl | Substrate for neuronal growth and imaging of pHluorin |
| Trypsin XI from bovine pancrease | Sigma | T1005 | Neuronal culture-digest hippocampal tissues |
| Deoxyribonuclease I from bovine pancreas | Sigma | D5025 | Neuronal culture-inhibits viscous cell suspension |
| pulse stimulator | A-M systems | model 2100 | Apply electrical stimulation |
| Slotted bath with field stimulation | Warner Instruments | RC-21BRFS | Apply electrical stimulation |
| stimulus isolation unit | Warner Instruments | SIU102 | Apply electrical stimulation |
| lubricant | Dow corning | 111 | pHluorin imaging-seal with coverslip and imaging chamber, avoid leak from chamber |
| AP5 | Tocris | 3693 | Gradient for normal saline, selective NMDA receptor antagonist, inhibit postsynaptic activity which have potential for recurrent activity |
| CNQX | Tocris | 190 | Gradient for normal saline, competitive AMPA/kainate receptor antagonist, inhibit postsynaptic activity which have potential for recurrent activity |
| Illuminator | Nikon | C-HGFI | Metal halide light source for pHluorin |
| EMCCD camera | Andor | iXon3 | pHluorin imaging, detect pHluorin fluorescence intensity |
| Inverted microscopy | Nikon | Ti-E | Imaging for synaptophysin or VAMP2 pHluorin transfected cells |
| NIS-Elements AR | Nikon | NIS-Elements Advanced Research | Software for imaging acquisition and analysis |
| Igor Pro | WaveMetrics | Igor pro | Software for imaging analysis and data presentation |
| imaging chamber | Warner Instruments | RC21B | pHluorin imaging, apply field stimulation on living cells |
| poly-l-lysine | Sigma | P4832 | Electron microscopy, substrate for neuronal growth, apply on multiwell plate for 1 h at room temperature then wash with sterilized water 3 times |
| Horseradish peroxidase(HRP) | Sigma | P6782 | Electron microscopy, labeling of endocytosed synaptic vesicles by catalyzing DAB in presence hydrogen peroxide, final concentration is 5 mg/mL in normal saline, make fresh before use |
| Na cacodylate | Electron Microscopy Sciences | 12300 | Electron microscopy, buffer for fixatives and washing, final concentration is 0.1 N |
| 3,3′-Diaminobenzidine(DAB) | Sigma | D8001 | Electron microscopy, labeling of endocytosed synaptic vesicles, substrate for HRP, final concentration is 0.5 mg/mL in DDW and filtered, make fresh before use |
| Hydrogen peroxide solution | Sigma | H1009 | Electron microscopy, labeling of endocytosed synaptic vesicles by inducing HRP-DAB reaction, final concentration is 0.3% in DDW, make fresh before use |
| glutaraldehyde | Electron Microscopy Sciences | 16365 | Electron microscopy, fixatives, final concentration is 4% in Na-cacodylate buffer, make fresh before use, shake well before to use |
| TEM | JEOL | 200CX | Electron microscopy, imaging of endocytosed vesicles and ultrastructural changes |
| CCD digital camera | AMT | XR-100 | Electron microscopy, capturing images |
| Lead citrate | Leica microsystems | 16707235 | Electron microscopy, grid staining |
참고문헌
- Sankaranarayanan, S., Ryan, T. A. Real-time measurements of vesicle-SNARE recycling in synapses of the central nervous system. Nature cell biol. 2 (4), 197-204 (2000).
- Sun, T., Wu, X. S., et al. The role of calcium/calmodulin-activated calcineurin in rapid and slow endocytosis at central synapses. J Neurosci. 30 (35), 11838-11847 (2010).
- Wu, X. -. S. S., Lee, S. H., et al. Actin Is Crucial for All Kinetically Distinguishable Forms of Endocytosis at Synapses. Neuron. 92 (5), 1020-1035 (2016).
- Granseth, B., Odermatt, B., Royle, S. J., Lagnado, L. Clathrin-mediated endocytosis is the dominant mechanism of vesicle retrieval at hippocampal synapses. Neuron. 51 (6), 773-786 (2006).
- Atluri, P. P., Ryan, T. A. The kinetics of synaptic vesicle reacidification at hippocampal nerve terminals. J Neurosci. 26 (8), 2313-2320 (2006).
- Royle, S. J., Granseth, B., Odermatt, B., Derevier, A., Lagnado, L. Imaging phluorin-based probes at hippocampal synapses. Methods Mol Biol. 457, 293-303 (2008).
- Moulder, K. L., Mennerick, S. Reluctant vesicles contribute to the total readily releasable pool in glutamatergic hippocampal neurons. J Neurosci. 25 (15), 3842-3850 (2005).
- Li, Z., Burrone, J., Tyler, W. J., Hartman, K. N., Albeanu, D. F., Murthy, V. N. Synaptic vesicle recycling studied in transgenic mice expressing synaptopHluorin. Proc Natl Acad Sci U S A. 102 (17), 6131-6136 (2005).
- Morris, R. G. Elements of a neurobiological theory of hippocampal function: the role of synaptic plasticity, synaptic tagging and schemas. Eur J Neurosci. 23 (11), 2829-2846 (2006).
- Sankaranarayanan, S., Ryan, T. A. Calcium accelerates endocytosis of vSNAREs at hippocampal synapses. Nat Neurosci. 4 (2), 129-136 (2001).
- Balaji, J., Armbruster, M., Ryan, T. A. Calcium control of endocytic capacity at a CNS synapse. J Neurosci. 28 (26), 6742-6749 (2008).
- Ferguson, S. M., Brasnjo, G., et al. A selective activity-dependent requirement for dynamin 1 in synaptic vesicle endocytosis. Science. 316 (5824), 570-574 (2007).
- Baydyuk, M., Wu, X. S., He, L., Wu, L. G. Brain-derived neurotrophic factor inhibits calcium channel activation, exocytosis, and endocytosis at a central nerve terminal. J Neurosci. 35 (11), 4676-4682 (2015).
- Wu, X. S., Zhang, Z., Zhao, W. D., Wang, D., Luo, F., Wu, L. G. Calcineurin is universally involved in vesicle endocytosis at neuronal and nonneuronal secretory cells. Cell Rep. 7 (4), 982-988 (2014).
- Zhang, Z., Wang, D., et al. The SNARE proteins SNAP25 and synaptobrevin are involved in endocytosis at hippocampal synapses. J Neurosci. 33 (21), 9169-9175 (2013).
- Wu, L. -. G. G., Hamid, E., Shin, W., Chiang, H. -. C. C. Exocytosis and endocytosis: modes, functions, and coupling mechanisms. Annu Rev Physiol. 76 (1), 301-331 (2014).
- Daniele, F., Di Cairano, E. S., Moretti, S., Piccoli, G., Perego, C. TIRFM and pH-sensitive GFP-probes to evaluate neurotransmitter vesicle dynamics in SH-SY5Y neuroblastoma cells: cell imaging and data analysis. J Vis Exp. (95), e52267 (2015).
- Shaner, N. C., Lin, M. Z., et al. Improving the photostability of bright monomeric orange and red fluorescent proteins. Nat Methods. 5 (6), 545-551 (2008).
- Li, Y., Tsien, R. W. pHTomato, a red, genetically encoded indicator that enables multiplex interrogation of synaptic activity. Nat Neurosci. 15 (7), 1047-1053 (2012).
- Leitz, J., Kavalali, E. T. Fast retrieval and autonomous regulation of single spontaneously recycling synaptic vesicles. Elife. 3, e03658 (2014).
- Bisht, K., El Hajj, H., Savage, J. C., Sánchez, M. G., Tremblay, M. -. &. #. 2. 0. 0. ;. Correlative Light and Electron Microscopy to Study Microglial Interactions with β-Amyloid Plaques. J Vis Exp. (112), e54060 (2016).
- Schikorski, T. Monitoring Synaptic Vesicle Protein Sorting with Enhanced Horseradish Peroxidase in the Electron Microscope. High-Resolution Imaging of Cellular Proteins: Methods and Protocols. , 327-341 (2016).
- Kononenko, N. L., Puchkov, D., et al. Clathrin/AP-2 mediate synaptic vesicle reformation from endosome-like vacuoles but are not essential for membrane retrieval at central synapses. Neuron. 82 (5), 981-988 (2014).
- Wu, Y., O'Toole, E. T., et al. A dynamin 1-, dynamin 3- and clathrin-independent pathway of synaptic vesicle recycling mediated by bulk endocytosis. eLife. 2014 (3), e01621 (2014).
- Heuser, J. E., Reese, T. S. Evidence for recycling of synaptic vesicle membrane during transmitter release at the frog neuromuscular junction. J Cell Biol. 57 (2), 315-344 (1973).
- Ceccarelli, B., Hurlbut, W. P., Mauro, A. Turnover of transmitter and synaptic vesicles at the frog neuromuscular junction. J Cell Biol. 57 (2), 499-524 (1973).
- Watanabe, S., Rost, B. R., et al. Ultrafast endocytosis at mouse hippocampal synapses. Nature. 504 (7479), 242-247 (2013).
- Watanabe, S., Trimbuch, T., et al. Clathrin regenerates synaptic vesicles from endosomes. Nature. 515 (7526), 228-233 (2014).
- Sankaranarayanan, S., Atluri, P. P., Ryan, T. A. Actin has a molecular scaffolding, not propulsive, role in presynaptic function. Nat Neurosci. 6 (2), 127-135 (2003).
- Zhu, Y., Xu, J., Heinemann, S. F. Two pathways of synaptic vesicle retrieval revealed by single-vesicle imaging. Neuron. 61 (3), 397-411 (2009).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394 (6689), 192-195 (1998).
- Arnao, M. B. B., Acosta, M., del Rio, J. A. A., García-Cánovas, F. Inactivation of peroxidase by hydrogen peroxide and its protection by a reductant agent. Biochim Biophys Acta. 1038 (1), 85-89 (1990).
- Deák, F., Schoch, S., et al. Synaptobrevin is essential for fast synaptic-vesicle endocytosis. Nat Cell Biol. 6 (11), 1102-1108 (2004).
- Clayton, E. L., Evans, G. J. O., Cousin, M. A. Bulk synaptic vesicle endocytosis is rapidly triggered during strong stimulation. J Neurosci. 28 (26), 6627-6632 (2008).
- Kavalali, E. T., Jorgensen, E. M. Visualizing presynaptic function. Nat Neurosci. 17 (1), 10-16 (2014).
- Wienisch, M., Klingauf, J. Vesicular proteins exocytosed and subsequently retrieved by compensatory endocytosis are nonidentical. Nat Neurosci. 9 (8), 1019-1027 (2006).
- Fernández-Alfonso, T., Kwan, R., Ryan, T. A. Synaptic vesicles interchange their membrane proteins with a large surface reservoir during recycling. Neuron. 51 (2), 179-186 (2006).
- Gimber, N., Tadeus, G., Maritzen, T., Schmoranzer, J., Haucke, V. Diffusional spread and confinement of newly exocytosed synaptic vesicle proteins. Nat Commun. 6, 8392 (2015).
- Nicholson-Fish, J. C., Smillie, K. J., Cousin, M. A. Monitoring activity-dependent bulk endocytosis with the genetically-encoded reporter VAMP4-pHluorin. J Neurosci Methods. 266, 1-10 (2016).
- Burrone, J., Li, Z., Murthy, V. N. Studying vesicle cycling in presynaptic terminals using the genetically encoded probe synaptopHluorin. Nat Protoc. 1 (6), 2970-2978 (2006).
- Wisse, E., Braet, F., et al. Fixation methods for electron microscopy of human and other liver. World journal of gastroenterology. 16 (23), 2851-2866 (2010).
- Magidson, V., Khodjakov, A. Circumventing Photodamage in Live-Cell Microscopy. Methods in Cell Biology. 114, 545-560 (2013).
- Søndergaard, C. R., Garrett, A. E., et al. Structural artifacts in protein-ligand X-ray structures: implications for the development of docking scoring functions. J Med Chem. 52 (18), 5673-5684 (2009).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유