É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Medindo a endocitose da vesícula sináptica nos neurônios Hippocampal culturas
Neste Artigo
Resumo
Endocitose da vesícula sináptica é detectada pela microscopia de luz de pHluorin fundido com proteínas de vesículas sinápticas e por microscopia eletrônica de absorção da vesícula.
Resumo
Durante a endocitose, fundidas vesículas sinápticas são recuperadas em terminais nervosos, permitindo a reciclagem de vesículas e, portanto, a manutenção da transmissão sináptica durante o disparo repetitivo do nervo. Endocitose prejudicada em condições patológicas leva a diminuições em funções sinápticas de força e cérebro. Aqui, descrevemos os métodos utilizados para medir a endocitose da vesícula sináptica na sinapse hippocampal mamífera na cultura neuronal. Temos monitorado endocitose de proteínas de vesícula sináptica pela fusão de uma proteína de membrana vesicular sináptica, incluindo Sinaptofisina e VAMP2/synaptobrevin da, o lado lumenal vesicular, com pHluorin, uma proteína fluorescente verde sensíveis ao pH que aumenta sua intensidade de fluorescência como o pH aumenta. Durante a exocitose, pH do lúmen vesicular aumenta, Considerando que durante o lúmen vesicular endocitose pH é re-acidificado. Assim, um aumento da intensidade de fluorescência pHluorin indica fusão, enquanto uma diminuição indica endocitose da proteína rotulados vesícula sináptica. Além de usar o pHluorin método de imagem para gravar endocitose, temos monitorado endocitose da membrana vesicular por microscopia de elétron (EM) medições de absorção de Horseradish peroxidase (HRP) por vesículas. Finalmente, temos monitorado a formação dos poços de membrana terminal do nervo em vários momentos após a despolarização induzida por potássio alto. O tempo de curso de formação de poço de captação e membrana HRP indica o tempo de curso de endocitose.
Introdução
Os neurotransmissores são armazenados em vesículas sinápticas e liberados por exocitose. A membrana da vesícula sináptica e a proteína são então internalizadas por endocitose e reutilizadas na próxima rodada de exocitose. Endocitose das vesículas sinápticas é importante para a manutenção de piscinas de vesícula sináptica e remove salientes vesículas de membrana plasmática. O pHluorin sensíveis ao pH proteína verde fluorescente, que é saciada em circunstâncias ácidas e dequenched em pH neutro, tem sido usado para medir tempo de endocitose cursos em vivem células1,2,3. A proteína de pHluorin normalmente é unida ao lado lumenal das proteínas de vesículas sinápticas, tais como Sinaptofisina ou VAMP2/synaptobrevin da. No resto, pHluorin é extinguido no lúmen 5.5 pH das vesículas sinápticas. Fusão de vesículas para a membrana plasmática apresenta o lúmen vesicular à solução extracelular onde o pH é ~ 7.3, resultando em um aumento na fluorescência do pHluorin. Após a exocitose, decompõe-se o aumento da fluorescência, devido a endocitose das proteínas de vesículas sinápticas seguido por re-acidificação de vesículas dentro dessas vesículas recuperadas. Embora a decadência reflete tanto a endocitose e a re-acidificação vesicular, principalmente reflete endocitose, porque re-acidificação é mais rápido que endocitose na maioria das condições1,4. A constante de tempo de re-acidificação é 3-4 s ou menos5,6, que é geralmente mais rápido que o 10 s ou mais necessários para vesículas endocitose4,5. Se experimentos são necessários para distinguir a endocitose de re-acidificação, ácidos resfriamento experimentos usando a solução de (MES) ácido 4-Morpholineethanesulfonic (25 mM) com um pH de 5,5 podem ser usados para determinar se as proteínas de vesículas sinápticas são recuperadas da membrana plasmática através de endocitose1,3,4. Assim, o aumento de intensidade de fluorescência pHluorin reflete um equilíbrio de exo e endocitose, e a diminuição após a estimulação do nervo especificamente reflete endocitose.
pHluorin imagem pode ser usada não apenas para medir o tempo de curso de endocitose, mas também o tamanho da vesícula sináptica piscinas7,8, e9de lançamento a probabilidade de lançamento evocado e espontânea. Muitos fatores e proteínas envolvidas na regulação da endocitose, tais como cálcio, solúvel NSF-acessório da proteína do receptor (SNARE) proteínas, neurotrófico derivado do cérebro factor(BDNF) e calcineurina foram identificadas usando pHluorin de imagens1 , 2 , 10 , 11 , 12 , 13 , 14 , 15 , 16. Além disso, a liberação do neurotransmissor pode ser detectada nos neurônios não apenas primários, mas em células de neuroblastoma com TIRFM17. Recentemente, pHTomato, dsRed, mOrange e variantes de pHluorin foram desenvolvidos para o monitoramento de gravações simultâneas de vários fatores em uma única sinapse18,19. Por exemplo, pHTomato tem sido fundido com Sinaptofisina e usado com um indicador de cálcio geneticamente codificado (GCaMP5K) para monitorar fusão de vesícula pré-sináptica e Ca2 + influxo no compartimento pós-sináptica20. Portanto, pHluorin ligado a proteínas sinápticas fornece um método útil para analisar a relação entre endocitose e exocitose.
É outro método comumente usado para estudar a endocitose, devido a alta resolução espacial que mostra as alterações ultra-estruturais durante a endocitose. Duas áreas gerais são a capacidade de visualizar as alterações patológicas dentro de células neuronais21 e faixa de proteínas de vesícula22. Em particular, a observação da absorção da vesícula sináptica, curvatura de membrana revestida por Clatrina na zona de periactive, e CDDP estruturas são possíveis com EM3,23,24,25 ,26,,27,28. Enquanto EM envolve artefatos potenciais, tais como malformações induzidas pelo fixador, que pode afetar a endocitose e análise de dados é de trabalho intensivo, que a resolução prevê uma oportunidade atraente para visualizar a estrutura celular. Potenciais problemas de fixador e a limitação em resolução temporal EM podem ser superados por alta pressão, congelamento, fornecendo um método rápido e não-químicas de estabilizar as delicadas estruturas presentes durante a endocitose27.
Protocolo
Nota: O seguinte protocolo descreve os métodos de imagem pHluorin e métodos EM neurônios hippocampal culta. pHluorin monitores vesícula sináptica proteína absorção em células vivas e EM detecta a absorção da vesícula sináptica e as alterações ultra-estruturais.
cuidados com animais e procedimento seguiu as diretrizes do NIH e foram aprovados pelo Comitê de uso e cuidados do Animal NIH.
1. pHluorin Imaging
- cultura neurônio Hippocampal
- preparar hipocampo Buffer (HB) combinando NaHCO 3 de 4 mM e 5 mM HEPES e ajustar o pH 7.3 com 5 M de NaOH. Fazer o meio de cultura misturando neurobasal médio, 2% B27, 0.5 mM L-glutamina e 1% penicilina-estreptomicina. Além disso, prepare uma mistura do buffer de HB com 20% de soro Fetal bovino (HB/20% FBS).
Nota: Este protocolo cultivo baseia-se na Serra, et al 29 e Wu et al 24 - decapitar filhotes de rato entre pós-Natal dia 0 ao dia 2 em meio de cultura e extrair o cérebro em 4 ° C HB/20% FBS. Retire o tronco cerebral e tálamo para expor o hipocampo. Dissecar para fora o hipocampo, após expor-lo pela remoção do tronco cerebral e tálamo e transferir para a 4 ° C HB/20% FBS.
Nota: Normalmente, o rendimento é em torno de 4 x 10 5 células/mL para um filhote de cachorro (dois hipocampo). Limpar as membranas aderente, usando uma pinça ou tesoura, então a transferência para a 4 ° C HB/20% FBS. Desenrole o giro denteado e isolar o subiculum cortando com uma tesoura e, em seguida, transferir a 4 ° C HB/20% FBS. - Dividir cada hipocampo, por um corte de ponta a ponta, em cerca de 10 fatias e transfira para um tubo cónico polipropileno de 15 mL.
- Depois permitindo que o tecido resolver, lavar com 10 mL de HB/20% FBS e depois lavar três vezes com 10ml de HB.
- Preparar a solução de digestão de 137 mM de NaCl, 5 mM KCl, 7mm Na2HPO 4 e 25mm HEPES e ajustar o pH 7.2 com 5 M de NaOH. Retire o sobrenadante do hipocampo. Adicionar 2 mL de solução de digestão 10 mg de tripsina e 1 mg de DNase e filtrar através de uma membrana esterilizada 0,22 µm diretamente sobre a pelota amostra.
- Incubar o hipocampo por 5 min a 37 ° C, em seguida, lave duas vezes com 10 mL de HB/20% FBS e então lave uma vez com 10 mL de HB.
- Dissociar as células com 6 mg de MgSO 4 ∙ 7 H 2 O e 1 mg de DNase 2ml HB e filtro estéril sobre o hipocampo de pelotas através de um filtro de 0,22 µm estéril. Delicadamente, dissocia as células por moer cuidado, enquanto tendo o cuidado de evitar a introdução de bolhas de ar. Permitir que as partículas de tecido repousar por 2 min e em seguida lentamente transfira o sobrenadante para outro tubo.
- , Adicionar 3 mL HB/20% FBS para a suspensão de células e centrífuga ou 10 min a 4 ° C e 1.000 rpm. Desprezar o sobrenadante e ressuspender em meio de cultura.
- Placa de 60.000 células suspendidas em meio de cultura de 150 µ l sobre uma lamela de diâmetro de 25 mm de poli-D-lisina revestido, sem derramamento da lamela. Adicione 2 mL de meio de cultura previamente aquecido 2 h após chapeamento. As lamelas são mantidas em placas de cultivo de 6 boas ou pratos de Petri estéril.
- Células mantêm a 37 ° C em um 5% CO 2 humedecidas incubadora em meio de cultura por 14-21 dias antes da gravação. Durante o crescimento da cultura, mudar a metade superior do meio duas vezes por semana.
- preparar hipocampo Buffer (HB) combinando NaHCO 3 de 4 mM e 5 mM HEPES e ajustar o pH 7.3 com 5 M de NaOH. Fazer o meio de cultura misturando neurobasal médio, 2% B27, 0.5 mM L-glutamina e 1% penicilina-estreptomicina. Além disso, prepare uma mistura do buffer de HB com 20% de soro Fetal bovino (HB/20% FBS).
- Transfection
- 6-7 dias após o chapeamento, transfect Sinaptofisina-pHluorin 2 X (SpH) ou VAMP2-pHluorin em neurônios hippocampal. Para SpH, use um promotor de citomegalovírus (CMV), inserido em um vetor de pcDNA3 30. Para VAMP2-pHluorin, use um promotor CMV inserido em um vetor de pCI 31.
- Transfect qualquer vector por transportadora de lipídios em células-alvo, usando 1 µ g de plasmídeo. Use o meio de cultura de passo protocolo 1.1.1, que carece de soro, para o transfeccao. Alterar o meio 2 h após a transfeccao para reduzir a toxicidade.
Nota: Em caso de baixa expressão da SpH nos boutons, aumente a concentração de DNA de 2 µ g ou o tempo de incubação com a transportadora de lipídios, a menos que as células são insalubres. Normalmente, as células 4-10 (0,006-0,008%) de neurônios foram transfectadas.
- Microscopia de luz
- preparar solução salina normal é composto por 119 mM NaCl, 2 mM CaCl 2, 2,5 mM KCl, 25mm HEPES (pH 7,4), glicose de 30 mM, 2 mM MgCl 2, 6-cyano-7-nitroquinoxaline-2,3-dione (0.01 mM CNQX) e 0,05 mM ácido DL-2-amino-5-phosphonovaleric (AP5). Leve uma lamela da placa de meio de cultura e coloque em uma câmara de imagem que permite a estimulação do campo, usando lubrificante e selante para evitar vazamentos. Evite deixar o vidro seco durante a transferência de uma lamela da placa para a câmara, adicionando imediatamente a solução salina normal de 750 µ l.
Nota: CNQX AP5 utilizaram e bloquear a atividade pós-sináptica, que tem o potencial para atividade recorrente. Antes de colocar uma câmara em um microscópio de fluorescência invertido, use lenço de limpeza para confirmar que a câmara não vaza. Vazamento lento provoca alterações de foco durante a gravação, pela mistura de óleo normal saline e imersão, que resulta em mudanças no índice de refração. - Estimulação e gravação de imersão de óleo
- imagem em um microscópio invertido widefield com um 60 X (1.4 abertura numérica) lente com uma lâmpada de iodetos metálicos. Visualizar pHluorin com um filtro definido para um pico de excitação de 480 nm, um espelho de passe longo 490 nm, um filtro de emissão 500-550 nm e um obturador manual de aleta. Capturar imagens cada 100 ms, com binning 2x2, usando uma câmera de elétron multiplicando carga acoplado dispositivo (EMCCD).
Nota: Vários recursos devem ser considerados para atingir as condições apropriadas para evitar fotobranqueamento, incluindo o intervalo de captura de imagem e filtrar e binning, que são dependentes de equipamentos. No caso da imagem latente confocal, tempo de alimentação e exposição do laser deve ser considerado para evitar fotobranqueamento. A instalação foi determinada após a gravação de pelo menos 3 min sem estímulo e a gravação foi realizada pelo menos 10 s sem estímulo para verificar se há fotobranqueamento. - Escolher uma área com alta densidade de boutons para facilidade de análise em cada experimento. Identificar células transfectadas por seu sinal de fluorescência verde, com ênfase em padrões de expressão redondas ou ovais no bouton e expressão contínua entre boutons.
- Induzir endocitose por estimulação de campo usando um 1 pulso de ms, 20 mA ação potencial (AP) fornecida a partir de um estimulador de pulso e entregues através de um eletrodo de platina dentro da unidade de isolamento de estímulo. Atividade de fluorescência da imagem no decorrer da estimulação e durante a recuperação celular.
Nota: No caso de células mortas, expressão foi mais forte do que viver boutons e mostrou um padrão desigual entre boutons.
- imagem em um microscópio invertido widefield com um 60 X (1.4 abertura numérica) lente com uma lâmpada de iodetos metálicos. Visualizar pHluorin com um filtro definido para um pico de excitação de 480 nm, um espelho de passe longo 490 nm, um filtro de emissão 500-550 nm e um obturador manual de aleta. Capturar imagens cada 100 ms, com binning 2x2, usando uma câmera de elétron multiplicando carga acoplado dispositivo (EMCCD).
- preparar solução salina normal é composto por 119 mM NaCl, 2 mM CaCl 2, 2,5 mM KCl, 25mm HEPES (pH 7,4), glicose de 30 mM, 2 mM MgCl 2, 6-cyano-7-nitroquinoxaline-2,3-dione (0.01 mM CNQX) e 0,05 mM ácido DL-2-amino-5-phosphonovaleric (AP5). Leve uma lamela da placa de meio de cultura e coloque em uma câmara de imagem que permite a estimulação do campo, usando lubrificante e selante para evitar vazamentos. Evite deixar o vidro seco durante a transferência de uma lamela da placa para a câmara, adicionando imediatamente a solução salina normal de 750 µ l.
- Análise de imagem
- Para analisar a intensidade de fluorescência em um único bouton, definido por uma região de interesse (ROI) como uma de 1,5 x 1,5 µm quadrados; o tamanho de um bouton é dentro traços cerca 1,5 µm. uso antes da estimulação para verificar fotobranqueamento e subtrair como pano de fundo.
- Normalize fluorescência muda (ΔF) com a equação:
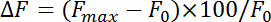
onde F máx e F 0 referem-se a máximo aumento após estimulação e fluorescência de base, respectivamente. Medir as endocitose taxas como a taxa de decaimento durante os primeiros 4-10 s após o ponto máximo da fluorescência de pHluorin. Obter a constante de tempo (τ) de endocitose por encaixe o decaimento de fluorescência pHluorin do pico aumento da linha de base com uma mono-exponencial função.
2. Microscopia eletrônica de
- Prepare uma poli-D-lisina revestido 6 placa aplicando 1,5 mL de solução de poli-D-lisina 0,01% estéril filtrada a cada poço por 1h à temperatura ambiente e, em seguida, lavar três vezes com água esterilizada. Dissecar, cultura e manter os neurônios hippocampal como em etapas 1.1.1, 1.1.2 e 1.1.3, respectivamente.
- Prepare uma solução de estimulação K + alta com HRP como 31,5 mM NaCl, 2 mM CaCl 2, 90 mM KCl, 25mm HEPES (pH 7,4), glicose de 30 mM, 2 mM MgCl 2, 0,01 mM CNQX, 0,05 mM AP5 e 5 mg/mL HRP, então ajustam o pH 7,4 com 5 M NaOH.
Solução de estimulação de K +
- estimular a cultura de neurônio hippocampal com 1,5 mL de alta à temperatura ambiente (referida como K +) por adição de 1,5 mL para cada poço para 90 s. Na condição de repouso (referida como R), aplicar a mesma concentração de 5mg/mL HRP para 90 s, mas com solução salina normal. Para o exemplo de recuperação, aplicar solução de estimulação alta K + como com a amostra de K +, em seguida, rapidamente lavar substituir com solução salina normal e incubar durante 10 min.
- Fixação e coloração
- preparar o tampão de cacodylate at 0,1 M usando at cacodylate de 21,4 g/L pH 7,4. Consertar as células com 4% de glutaraldeído no buffer de cacodylate at 0.1 M pelo menos 1 h à temperatura ambiente. Lavar três vezes com 0,1 M at cacodylate o buffer para 7 min cada.
- Solução de preparar diaminobenzidina (DAB), composto de 0,5 mg/mL de DAB com 0,3% H 2 O 2 em ddH 2 O e filtrar com um filtro de 0,22 µm. Aplicar 1,5 mL de solução DAB por 30 min a 37 ° C. lavar três vezes com 0,1 M at cacodylate o buffer para 7 min cada.
Cuidado: DAB é um carcinógeno tóxico e suspeito. Por favor, use luvas e jalecos.
Nota: Etiquetando com DAB ocorre devido à sua oxidação por H 2 O 2, como catalisada por HRP. Pequenos aumentos nos componentes resultam em um sinal de aumento na amostra. Aumentando a concentração de HRP acelera o efeito do catalisador. Suficientemente grandes concentrações de H 2 O 2 permitem debilitante reações colaterais com HRP, inibindo o efeito da rotulagem 32. Neste trabalho, as concentrações deste sistema de rotulagem foram escolhidas com base na pesquisa atualmente disponíveis 33 , 34. - Incubar os neurônios com 1,5 mL de 1% OsO 4 no buffer de cacodylate at 0,1 M por 1 h a 4 ° C, como fixação de postar. Lavar três vezes com 1,5 mL de tampão de cacodylate de nd de 0,1 M por 7 min cada.
Atenção: Devido à toxicidade e reatividade de OsO 4, mantendo a amostra no gelo em uma capa de química é preferível em muitos casos usar uma geladeira para a incubação. - Preparar 0,1 M de tampão de acetato de sódio com 13,61 g/L de sódio acetato e 11,43 mL/L de ácido acético glacial em pH 5,0. Lavar três vezes com tampão de acetato 1,5 mL 0,1 M em pH 5.0 para 7 min cada e incubar com acetato de uranilo 1,5 mL 1% em tampão de acetato 0,1 M em pH 5.0 para 1 h a 4 ° C. Wash três vezes com tampão de acetato 1,5 mL 0,1 M por 7 min cada.
- Epóxi incorporação
- desidratar a cultura neurônio com lavagens único 1,5 mL de etanol a 50%, 70% e 90%, para 7 min em cada um e em seguida 3 lavagens de 1,5 mL de etanol a 100% por 7 min em uma coifa.
- Mix 485 mL/L bisphenol-A-(epichlorhydrin) epóxi resina, anidrido de 160 mL/L dodecenilo succínico (DDSA), 340 mL/L metil-5-Norborne-2,3-dicarboxílico fenol 2.4.6-tris (dimetilaminometil) anidrido (NMA) e 15 mL/L (DMP-30) para criar o epóxi resina. Mistura cuidadosamente, em seguida, armazenar sob vácuo para remover as bolhas de ar.
Nota: É fundamental para remover as bolhas de ar na resina, especialmente aqueles de menor do que é visível a olho nu, porque eles podem causar cáries na resina durante o corte. - Infiltrar a amostra, substituindo o etanol com epóxi de 50% de resina em etanol por 30 min à temperatura ambiente em um shaker, então 70% epóxi resina em etanol por 30 min à temperatura ambiente num agitador.
- Interruptor o epóxi resina solução com resina epóxi de 100% e incubar durante 10 min a 50 bolsas de executar 2 ° C. de resina epóxi de 100% fresco com incubação por 1h em 50 ° C. Adicionar fresco 100% epóxi resina e permite a endurecer a 50 ° C durante a noite e depois no 60 & #17 6. o; C por mais de 36 h endurecer.
- Retire a placa de muti cada amostra com um joalheiro ' Serra de s. Selecione as regiões de interesse, densas concentrações de células, usando um microscópio invertido e depois cortar blocos de 70 a 80 nm para secionar pelo micrótomo. Montar a região de corte no mandril de micrótomo e carregar o micrótomo. Posicione o chuck em micrótomo e montar uma faca de diamante com a borda paralela à superfície do bloco. Recolher seções de espessura de 70 a 80 nm diretamente sobre grades individuais.
- Dissolver acetato de uranilo em água para uma solução de 1%, em peso e separadamente dissolver o citrato de chumbo na água para uma solução de 3% em peso. Counterstain as seções por submersão com acetato de uranilo aquosa de 1% por 15 min e, em seguida, citrato de chumbo aquoso 3% por 5 min aumentar o contraste das amostras.
- Imagem EM
- examinar as seções com um microscópio eletrônico de transmissão e gravar imagens com uma câmera digital CCD em uma ampliação primária de 10.000-20, 000 X 3.
- Estatísticas
- executar um t-teste para identificar diferenças significativas comparando-se a média e o desvio-padrão de medida (no MEV mostrou) entre o controle e amostras experimentais.
Resultados
Usando o método de transportadora de lipídios, SpH foi expressa em neurônios hippocampal, permitindo a identificação de boutons (Figura 1a). Estimulação elétrica das células induzidas por exocitose e um correspondente aumento na intensidade de fluorescência. O aumento na fluorescência (ΔF) foi interrompido por encerrar o estímulo (Figura 1b). O aumento da fluorescência foi seguido por uma diminuição lenta, devido ...
Discussão
Aqui demonstramos dois métodos para monitorar a endocitose da vesícula sináptica. O primeiro método, temos monitorado pHluorin fundiu-se com uma proteína de vesícula sináptica nos neurônios transfectadas e posteriormente eletricamente estimulado. Em segundo lugar, usamos EM imagem latente de captação HRP como induzida por KCl. Usamos diferentes estímulos por duas razões. Primeiro, aplicação elevada de potássio induz a despolarização dos neurônios todos na cultura. Isso facilita o exame EM, dado que a no...
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Agradecemos o Dr. Yong-Ling Zhu por prevê construção Sinaptofisina-pHluorin2x e Dr. James E. Rothman fornecendo VAMP2-phluorin. Agradecemos o Dr. Susan Cheng e Virginia Crocker da facilidade de microscopia eletrônica de NINDS pelo apoio técnico e ajuda. Este trabalho foi financiado pelo Instituto Nacional de Disorders Neurological e curso Intramural Research Program nos EUA e uma bolsa da KRIBB iniciativa programa de pesquisa (Korean biomédica cientista Fellowship Program), Instituto de pesquisa da Coreia do Biociências e biotecnologia, República da Coreia.
Materiais
| Name | Company | Catalog Number | Comments |
| Lipofectamine LTX with Plus | Thermo Fisher | 15338-100 | Transfection of plasmid DNA including synaptophysin or VAMP2-pHluorin |
| neurobasal medium | Thermo Fisher | 21103-049 | Growth medium for neuron, Warm up to 37°C before use |
| B27 | Thermo Fisher | 17504-044 | Gradient for neuronal differentiation |
| Glutamax | Thermo Fisher | 35050-061 | Gradient for neuronal culture |
| Poly-D-Lysine coated coverslip | Neuvitro | GG-25-pdl | Substrate for neuronal growth and imaging of pHluorin |
| Trypsin XI from bovine pancrease | Sigma | T1005 | Neuronal culture-digest hippocampal tissues |
| Deoxyribonuclease I from bovine pancreas | Sigma | D5025 | Neuronal culture-inhibits viscous cell suspension |
| pulse stimulator | A-M systems | model 2100 | Apply electrical stimulation |
| Slotted bath with field stimulation | Warner Instruments | RC-21BRFS | Apply electrical stimulation |
| stimulus isolation unit | Warner Instruments | SIU102 | Apply electrical stimulation |
| lubricant | Dow corning | 111 | pHluorin imaging-seal with coverslip and imaging chamber, avoid leak from chamber |
| AP5 | Tocris | 3693 | Gradient for normal saline, selective NMDA receptor antagonist, inhibit postsynaptic activity which have potential for recurrent activity |
| CNQX | Tocris | 190 | Gradient for normal saline, competitive AMPA/kainate receptor antagonist, inhibit postsynaptic activity which have potential for recurrent activity |
| Illuminator | Nikon | C-HGFI | Metal halide light source for pHluorin |
| EMCCD camera | Andor | iXon3 | pHluorin imaging, detect pHluorin fluorescence intensity |
| Inverted microscopy | Nikon | Ti-E | Imaging for synaptophysin or VAMP2 pHluorin transfected cells |
| NIS-Elements AR | Nikon | NIS-Elements Advanced Research | Software for imaging acquisition and analysis |
| Igor Pro | WaveMetrics | Igor pro | Software for imaging analysis and data presentation |
| imaging chamber | Warner Instruments | RC21B | pHluorin imaging, apply field stimulation on living cells |
| poly-l-lysine | Sigma | P4832 | Electron microscopy, substrate for neuronal growth, apply on multiwell plate for 1 h at room temperature then wash with sterilized water 3 times |
| Horseradish peroxidase(HRP) | Sigma | P6782 | Electron microscopy, labeling of endocytosed synaptic vesicles by catalyzing DAB in presence hydrogen peroxide, final concentration is 5 mg/mL in normal saline, make fresh before use |
| Na cacodylate | Electron Microscopy Sciences | 12300 | Electron microscopy, buffer for fixatives and washing, final concentration is 0.1 N |
| 3,3′-Diaminobenzidine(DAB) | Sigma | D8001 | Electron microscopy, labeling of endocytosed synaptic vesicles, substrate for HRP, final concentration is 0.5 mg/mL in DDW and filtered, make fresh before use |
| Hydrogen peroxide solution | Sigma | H1009 | Electron microscopy, labeling of endocytosed synaptic vesicles by inducing HRP-DAB reaction, final concentration is 0.3% in DDW, make fresh before use |
| glutaraldehyde | Electron Microscopy Sciences | 16365 | Electron microscopy, fixatives, final concentration is 4% in Na-cacodylate buffer, make fresh before use, shake well before to use |
| TEM | JEOL | 200CX | Electron microscopy, imaging of endocytosed vesicles and ultrastructural changes |
| CCD digital camera | AMT | XR-100 | Electron microscopy, capturing images |
| Lead citrate | Leica microsystems | 16707235 | Electron microscopy, grid staining |
Referências
- Sankaranarayanan, S., Ryan, T. A. Real-time measurements of vesicle-SNARE recycling in synapses of the central nervous system. Nature cell biol. 2 (4), 197-204 (2000).
- Sun, T., Wu, X. S., et al. The role of calcium/calmodulin-activated calcineurin in rapid and slow endocytosis at central synapses. J Neurosci. 30 (35), 11838-11847 (2010).
- Wu, X. -. S. S., Lee, S. H., et al. Actin Is Crucial for All Kinetically Distinguishable Forms of Endocytosis at Synapses. Neuron. 92 (5), 1020-1035 (2016).
- Granseth, B., Odermatt, B., Royle, S. J., Lagnado, L. Clathrin-mediated endocytosis is the dominant mechanism of vesicle retrieval at hippocampal synapses. Neuron. 51 (6), 773-786 (2006).
- Atluri, P. P., Ryan, T. A. The kinetics of synaptic vesicle reacidification at hippocampal nerve terminals. J Neurosci. 26 (8), 2313-2320 (2006).
- Royle, S. J., Granseth, B., Odermatt, B., Derevier, A., Lagnado, L. Imaging phluorin-based probes at hippocampal synapses. Methods Mol Biol. 457, 293-303 (2008).
- Moulder, K. L., Mennerick, S. Reluctant vesicles contribute to the total readily releasable pool in glutamatergic hippocampal neurons. J Neurosci. 25 (15), 3842-3850 (2005).
- Li, Z., Burrone, J., Tyler, W. J., Hartman, K. N., Albeanu, D. F., Murthy, V. N. Synaptic vesicle recycling studied in transgenic mice expressing synaptopHluorin. Proc Natl Acad Sci U S A. 102 (17), 6131-6136 (2005).
- Morris, R. G. Elements of a neurobiological theory of hippocampal function: the role of synaptic plasticity, synaptic tagging and schemas. Eur J Neurosci. 23 (11), 2829-2846 (2006).
- Sankaranarayanan, S., Ryan, T. A. Calcium accelerates endocytosis of vSNAREs at hippocampal synapses. Nat Neurosci. 4 (2), 129-136 (2001).
- Balaji, J., Armbruster, M., Ryan, T. A. Calcium control of endocytic capacity at a CNS synapse. J Neurosci. 28 (26), 6742-6749 (2008).
- Ferguson, S. M., Brasnjo, G., et al. A selective activity-dependent requirement for dynamin 1 in synaptic vesicle endocytosis. Science. 316 (5824), 570-574 (2007).
- Baydyuk, M., Wu, X. S., He, L., Wu, L. G. Brain-derived neurotrophic factor inhibits calcium channel activation, exocytosis, and endocytosis at a central nerve terminal. J Neurosci. 35 (11), 4676-4682 (2015).
- Wu, X. S., Zhang, Z., Zhao, W. D., Wang, D., Luo, F., Wu, L. G. Calcineurin is universally involved in vesicle endocytosis at neuronal and nonneuronal secretory cells. Cell Rep. 7 (4), 982-988 (2014).
- Zhang, Z., Wang, D., et al. The SNARE proteins SNAP25 and synaptobrevin are involved in endocytosis at hippocampal synapses. J Neurosci. 33 (21), 9169-9175 (2013).
- Wu, L. -. G. G., Hamid, E., Shin, W., Chiang, H. -. C. C. Exocytosis and endocytosis: modes, functions, and coupling mechanisms. Annu Rev Physiol. 76 (1), 301-331 (2014).
- Daniele, F., Di Cairano, E. S., Moretti, S., Piccoli, G., Perego, C. TIRFM and pH-sensitive GFP-probes to evaluate neurotransmitter vesicle dynamics in SH-SY5Y neuroblastoma cells: cell imaging and data analysis. J Vis Exp. (95), e52267 (2015).
- Shaner, N. C., Lin, M. Z., et al. Improving the photostability of bright monomeric orange and red fluorescent proteins. Nat Methods. 5 (6), 545-551 (2008).
- Li, Y., Tsien, R. W. pHTomato, a red, genetically encoded indicator that enables multiplex interrogation of synaptic activity. Nat Neurosci. 15 (7), 1047-1053 (2012).
- Leitz, J., Kavalali, E. T. Fast retrieval and autonomous regulation of single spontaneously recycling synaptic vesicles. Elife. 3, e03658 (2014).
- Bisht, K., El Hajj, H., Savage, J. C., Sánchez, M. G., Tremblay, M. -. &. #. 2. 0. 0. ;. Correlative Light and Electron Microscopy to Study Microglial Interactions with β-Amyloid Plaques. J Vis Exp. (112), e54060 (2016).
- Schikorski, T. Monitoring Synaptic Vesicle Protein Sorting with Enhanced Horseradish Peroxidase in the Electron Microscope. High-Resolution Imaging of Cellular Proteins: Methods and Protocols. , 327-341 (2016).
- Kononenko, N. L., Puchkov, D., et al. Clathrin/AP-2 mediate synaptic vesicle reformation from endosome-like vacuoles but are not essential for membrane retrieval at central synapses. Neuron. 82 (5), 981-988 (2014).
- Wu, Y., O'Toole, E. T., et al. A dynamin 1-, dynamin 3- and clathrin-independent pathway of synaptic vesicle recycling mediated by bulk endocytosis. eLife. 2014 (3), e01621 (2014).
- Heuser, J. E., Reese, T. S. Evidence for recycling of synaptic vesicle membrane during transmitter release at the frog neuromuscular junction. J Cell Biol. 57 (2), 315-344 (1973).
- Ceccarelli, B., Hurlbut, W. P., Mauro, A. Turnover of transmitter and synaptic vesicles at the frog neuromuscular junction. J Cell Biol. 57 (2), 499-524 (1973).
- Watanabe, S., Rost, B. R., et al. Ultrafast endocytosis at mouse hippocampal synapses. Nature. 504 (7479), 242-247 (2013).
- Watanabe, S., Trimbuch, T., et al. Clathrin regenerates synaptic vesicles from endosomes. Nature. 515 (7526), 228-233 (2014).
- Sankaranarayanan, S., Atluri, P. P., Ryan, T. A. Actin has a molecular scaffolding, not propulsive, role in presynaptic function. Nat Neurosci. 6 (2), 127-135 (2003).
- Zhu, Y., Xu, J., Heinemann, S. F. Two pathways of synaptic vesicle retrieval revealed by single-vesicle imaging. Neuron. 61 (3), 397-411 (2009).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394 (6689), 192-195 (1998).
- Arnao, M. B. B., Acosta, M., del Rio, J. A. A., García-Cánovas, F. Inactivation of peroxidase by hydrogen peroxide and its protection by a reductant agent. Biochim Biophys Acta. 1038 (1), 85-89 (1990).
- Deák, F., Schoch, S., et al. Synaptobrevin is essential for fast synaptic-vesicle endocytosis. Nat Cell Biol. 6 (11), 1102-1108 (2004).
- Clayton, E. L., Evans, G. J. O., Cousin, M. A. Bulk synaptic vesicle endocytosis is rapidly triggered during strong stimulation. J Neurosci. 28 (26), 6627-6632 (2008).
- Kavalali, E. T., Jorgensen, E. M. Visualizing presynaptic function. Nat Neurosci. 17 (1), 10-16 (2014).
- Wienisch, M., Klingauf, J. Vesicular proteins exocytosed and subsequently retrieved by compensatory endocytosis are nonidentical. Nat Neurosci. 9 (8), 1019-1027 (2006).
- Fernández-Alfonso, T., Kwan, R., Ryan, T. A. Synaptic vesicles interchange their membrane proteins with a large surface reservoir during recycling. Neuron. 51 (2), 179-186 (2006).
- Gimber, N., Tadeus, G., Maritzen, T., Schmoranzer, J., Haucke, V. Diffusional spread and confinement of newly exocytosed synaptic vesicle proteins. Nat Commun. 6, 8392 (2015).
- Nicholson-Fish, J. C., Smillie, K. J., Cousin, M. A. Monitoring activity-dependent bulk endocytosis with the genetically-encoded reporter VAMP4-pHluorin. J Neurosci Methods. 266, 1-10 (2016).
- Burrone, J., Li, Z., Murthy, V. N. Studying vesicle cycling in presynaptic terminals using the genetically encoded probe synaptopHluorin. Nat Protoc. 1 (6), 2970-2978 (2006).
- Wisse, E., Braet, F., et al. Fixation methods for electron microscopy of human and other liver. World journal of gastroenterology. 16 (23), 2851-2866 (2010).
- Magidson, V., Khodjakov, A. Circumventing Photodamage in Live-Cell Microscopy. Methods in Cell Biology. 114, 545-560 (2013).
- Søndergaard, C. R., Garrett, A. E., et al. Structural artifacts in protein-ligand X-ray structures: implications for the development of docking scoring functions. J Med Chem. 52 (18), 5673-5684 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados