Method Article
軟骨と皮膚組織類縁ミキシング ユニット Bioink Precellularization の小説のパッシブ バイオプリンティング
要約
軟骨や皮膚類似したナノセルロース アルギン酸ベース bioink を使用して bioprinted。Bioinks は、シングル ステップのパッシブ混合ユニットを介して印刷する前に cellularized いた。構成要素は、均一に cellularized する、高い生存率と分化の有利なマーカーを展示する示されました。
要約
バイオプリンティングは迅速かつ再現性のある組織エンジニア リング アプリケーションの構造作製のための強力な手法です。本研究ではミキシング ユニット新規パッシブを利用した bioink pre-cellularization 後軟骨や皮膚の類縁体を作製しました。この手法は、粘性の高い bioink に細胞懸濁液の混合に必要な手順を簡素化する目的で開発されました。バイオプリンティングを介して堆積されるフィラメントの解像度には、セルを持たない地域の堆積や針を詰まらせることができる大きな細胞塊の保持を避けるために印刷する前に細胞分布の均一性の保証が必要となります。急速にバイオプリンティング軟骨や皮膚の類縁体の前に bioink の細胞懸濁液をブレンドする能力を示します。両方の組織の類縁体は、4 週間培養できます。組織学的解析を示した細胞とコラーゲンとグリコサミノグリカン (Gag) のようなティッシュ特定の細胞外マトリックス (ECM) マーカーの沈着私それぞれ。
概要
近年、三次元 (3 D) バイオプリンティング技術は研究者、組織体の作製により広く利用するための技術を可能にアクセス可能になっています。バイオプリンティングは、多面的な組織構造の迅速かつ再現性のある加工を促進することによって医学研究に革命をもたらすことを約束します。バイオプリンティング技術の核心は、3 つの次元の (bioinks として知られている) 生体材料の蒸着を正確にコントロールする能力に産みます。これは、基質組成、生理活性因子およびネイティブの組織構造をより正確に要約することができますセルの異なる領域を持つ複雑な足場の生成可能です。
バイオプリンティング軟骨1肌2筋肉3骨4を含む多くの組織アプリケーション構造の作製に利用されています。これらの組織は、その本質的な横紋筋性マイクロ アーキテクチャ層によって成膜を介して反復に適しているためバイオプリンティングの魅力的です。特に、皮膚はバイオプリンティングなど層状に堆積技術により作製に適している明確に定義された多層構造5を持っています。さらに、バイオプリンティングことが出来、必要な解剖学的寸法を持つ構成要素を生成して、組織を修復する図形の欠陥します。患者固有のサイズと形状の6生体材料を生成する機能を含む多くの組織の部分的な修理のための要求に対処するために始めることができますが、皮膚病変範囲が異なりますから、軟骨損傷、骨欠損部に限らず患者。
本研究では pre-cellularized bioinks のバイオプリンティングによる 2 つの組織の類縁体 (関節軟骨と皮膚) を作製しました。十分な挑戦をすることができますセル実行可能性を維持しながら均一な細胞分布を確保できる細胞懸濁液と bioink のブレンドを確認します。Bioinks 押出経由バイオプリンティングに適した高粘度が多いため均一なブレンドを確保するため大規模な混合が必要.細胞に機械的な損傷することができます混合の過酷な条件下で発生して生存率に悪影響を及ぼします。研究は、7、8を混合などの準備中にインク ジェット印刷処理中にほとんどの細胞死が発生することを示しています。伝統的な混合攪拌9インク ジェット印刷10に適した低粘度 bioinks 十分かもしれないが、高粘度 bioink に細胞の混合押出バイオプリンティングに適しては難しくなります。この必要性をアドレス指定、ミキシング ノズルの使用は印刷プロセス11中 bioinks のブレンディングにより人気となっています。これらのミキサーは、重要12低レイノルズ数と流体の混合がマイクロ流体研究で広く利用されています。Bioink に細胞懸濁液をブレンドする連続的な混合プロセスの使用率の均一性印刷プロセスの間に可能になります。しかし、細胞懸濁液が、bioink と比較して低粘度を持っているので難しさが印刷プロセス9,13,14の間に細胞の沈降を防ぐために発生します。また、この問題に対処可能性があります印刷する前に bioink に細胞の混合します。
Bioink にブレンディングの際に細胞死を抑える最小限の手順番号の bioink に細胞をブレンドする受動的な混合装置に基づく手法を開発しました。混合ユニットを介して材料の流れを生成するカオス的混合で再現性をもってブレンド 2 つのコンポーネント一緒に15、16に十分です。このメソッドは、任意の bioink 押出バイオプリンティングのために適した、細胞懸濁液のブレンドを簡素化する主に開発されました。混合プロセスの手順の数は、ユーザー - 混合変化を除去するために最小化されました。セルが含まれる場合に特に、過剰な混合手順には、時間がかかり、すべての bioinks には適用されませんを指定できます。セカンダリが無菌性を保持するサンプルの損失を最小限に自己完結型混合プロセスの開発を目指しました。
本稿では、混合処理を最小限に抑え、高い細胞生存性と均一な分布の結果ユニット法パッシブを使用する bioink との細胞懸濁液のブレンドを示します。これらの pre-cellularized bioinks、軟骨や皮膚のいずれか 1 つまたは 2 つのセル型まで 6 週間培養しているそれぞれを持つ構築 bioprint に利用されています。利用されている bioink は、以前バイオプリンティング1への適合性を示しているアルギン酸ナノセルロース ブレンドです。
プロトコル
このプロトコル ・ チャーマーズ大学人間研究倫理委員会のガイドラインに従います。
注: すべての手順、滅菌バイオ セーフティ キャビネット内で行う。
1. 消耗品、Bioink、およびセルの準備
- 注射器 2 を取得、1 シリンジ (図 1、) は、細胞懸濁液、その他の注射器は、bioink (図 1b)。
- ルアー ロック接続経由でデュアル シリンジと結び付けることができる滅菌パッシブ混合装置 (図 1c) を取得します。
- 制御された速度で同時に滅菌注射器 2 からボリュームを押し出すことができます調剤ユニット (図 1d) を取得します。
注: この研究で利用する混合比は 10:1 です。したがって、10:1 の混合ユニットで必要に応じて 12 mL 注射器や 1 mL 注射器を使用します。 - 滅菌カートリッジ (図 1e) と直接に bioink と細胞懸濁液を混合する滅菌メス-メス ルアー ロック コネクタを取得します。
- 取得または細胞懸濁液とをブレンドするため、bioink を準備します。
注: このプロトコル ナノセルロース/アルギン酸ベース bioink が利用されました。この bioink は、ポスト印刷滅菌 100 mM CaCl2ソリューションの追加により架橋です。 - 0.5%/トリプシン EDTA 溶液を使用してセルをデタッチして、トリパン ブルー排除法17を使用してセルの合計数をカウントします。
注: このプロトコルで線維芽細胞が利用されました。 - 最終的な印刷の構成のどのような細胞密度が必要なを決定します。このターゲットの最終的な細胞密度を達成するために希釈する必要があります収穫細胞濃度次の方程式を使用して計算します。
注: このプロトコル 5 x 106セル/mL の最終的な細胞密度が利用されました。- 実験の目的のセルの濃度を選択: Cセル(セル/mL)。
- Bioink 必要に応じて、 Vbioink、目的の構成要素の合計数に基づいて量を計算します。
Vbioink V構築× NContructsを =
注: たとえば、コンストラクトあたり bioink の量は 100 μ L です。30 構造を印刷する場合は、必要な bioink 体積は 3 mL です。 - 必要なセルの数を計算します。
Nセル Cセル(1.1 × Vバイオリンク) を = - 1/10th bioink の容積の細胞 (N細胞) を再懸濁します。
V細胞懸濁液= 0.1 × Vバイオリンク
注: たとえば場合、Vbioink V細胞懸濁液3 mL = = 0.1 × 3 mL = 0.3 mL
2. 細胞懸濁液と Bioink の混合
- 細胞懸濁液の注射器に細胞懸濁液を転送します。
- 別の注射器に、bioink を転送または、bioink の入った注射を取得します。
- Bioink シリンジのプランジャーを引き、注射器を調剤ユニットに挿入します。ルアー ロック コネクタ上向き (図 1f1) と垂直方向にユニットを配置します。
- Bioink 注射器と同じような長さに細胞に注射器のピストンを引いて、調剤ユニット (図 1f2) 挿入します。
- ルアー ロック コネクタ (図 1f3) をねじることによって混合のユニットに両方の注射器を取り付けます。
- プライム調剤ユニットに注射器で空気を押し出すプッシュすることによって混合のシステム。ソリューション (図 1g4) ルアーロックに達する前にプライミングを停止します。
- プライミング後ルアー ロック コネクタ (図 1g5) 経由で混合の単位の末尾に充填カートリッジを取り付けます。添付ファイルの前に下部充填カートリッジでプランジャーが確実します。
- ゆっくりとカートリッジ (図 1i7) に bioink、細胞懸濁液を一緒に混合する調剤ユニット (図 1h6) を圧縮します。
- 充填カートリッジは、bioink 細胞の混合物を混合後連絡する滅菌ピペット先端部を下方にプランジャーを押してください。セル/bioink 混合物は混合のユニットに押し出されないように圧縮まで調剤してください。
- キャップ、カートリッジ、カートリッジ (ピストン側) の上に空気の泡を移動するのには、作業面に軽きます。
注: この時点で、セル/bioink 混合物は印刷用に準備です。以下のセクションには、特定のアプリケーションと印刷手順が概説されます。
3. 手動ヘラ混合と比較して混合装置を使用して細胞生存率の定量
- 80% 合流で 0.5%/トリプシン EDTA 溶液でひと繊維芽細胞 (通路 7) をデタッチし、数を数える、培地で培養後、bioink とブレンドすると最終的な濃度を達成するために十分な細胞密度で再懸濁します (1:10 セル: bioink 比) 5 x 10 の6セル/mL。
- ミキシング ユニット (ステップ 2) どちらか受動態を使用して bioink または両者の細胞生存率に及ぼす影響を評価するためのヘラでセルをブレンドします。
- ミキシング ユニット 1、2、または 3 回 100 ミリメートル CaCl2を使用して架橋用の金型に塗布する前にパッシブを使用して bioink にセルをブレンドします。
注: 追加ブレンドを実行するためには、注射器ではなく、カートリッジに直接セル/bioink をミックスします。その後、以前のプロトコルに従う混合ユニットを介して、細胞注射器コンポーネントなしのブレンドをリミックスします。 - 手巻き 100 mM CaCl2を使用して架橋用の金型に (各の混合時間) の混合物 30、60 日、90 s. 転送の期間のヘラを介してミキシングを使用して別の bioink にセルをブレンドします。
- ウェル プレートに架橋し、標準的な条件の下で文化の完成後サンプルを転送します。
- 文化の 1 日後の構成体を洗う (n = グループあたり 3-4) 30 分の無血清培地の染色液の構造で細胞を染色 (4 μ M カルセイン AM、1 μ M の ethidium によってホモ-1) 30 分間。
- 2 つの追加の時間を洗浄し、37 ° C で 1 時間の合計のための無血清培地のサンプルをインキュベート
4. 単一の細胞型で軟骨類縁体のバイオプリンティング
- アナログの目的の組織の 3 D モデルを描画します。バイオプリンティングの Gcode ファイルに変換し、bioprinter1Gcode ファイルをロードします。
注: このプロトコルでは、寸法 4.8 × 4.8 × 0.9 mm3正方形の構造は、STL ファイルとしてエクスポートされました。Gcode ファイルは、次の設定を使用して格子構造の生成された: 層の厚さ、0.3 mm;インフィル パターン、直線;面材密度、25%;速度 10 mm/s。 - 分離し、次の参照先のプロトコル1患者からプライマリ人間鼻軟骨 (hNC) を凍結します。
- 融解し凍結 hNCs を展開し、37 ° C で標準培養液を用いた単層培養で一度展開80-90% 0.5%/トリプシン EDTA 溶液合流点で細胞をデタッチして、トリパン ブルー排除プロトコルを使用してカウントします。通路 2 hNCs を使用してすべての実験を行った。
- 100 x 106セル/ml 300 μ L、bioink とブレンドするための準備として、50 μ g/mL アスコルビン酸、1% ペニシリン-ストレプトマイシン、10% 牛胎児血清を添加した培地の内、hNCs 再懸濁します。
- ブレンド ナノセルロース/アルギン酸に hNC 細胞懸濁液は、混合装置プロトコル、最終的な細胞濃度が 9 x 106セル/mL の 10:1 bioink:cell 懸濁液比でパッシブを bioink 次に基づいています。
- Bioprinter は殺菌紫外線暴露とワイプを介してダウン 70% エタノールを確認します。層流の場合のキャビネットを置くことによって無菌性を維持します。
- Bioink/細胞懸濁液のブレンドを含むカートリッジに滅菌印刷ノズルを接続し、bioprinter 挿入します。
- 手動で、またはプリンターに固有のプロトコルによって、bioprinter を調整します。
- Bioprint 格子、次の印刷パラメーターを使用してセルを含んだ構造: 25 kPa の圧力で 25 G 円錐ノズル。Bioprint 無細胞構造 (細胞用培地のセルを含まない配合) コントロールとして。
- 100 mM CaCl2 5 分すすぎのためのイオンのソリューション構成を追加することによって、構造を架橋し、培地 (37 ° C、5% CO2、および相対湿度 95%) の標準的な培養条件下で孵化させなさい。すべての 2 番目または 3 日目のメディアを変更します。
- 週 2 と 4 では、組織学的解析のためのサンプルを収集します。アルシアン青染色18を使用してギャグ用サンプルを染色します。
5. 2 種類の細胞と皮膚の類縁体のバイオプリンティング
- アナログ目的組織の 3 D モデルを描画し、バイオプリンティングの Gcode ファイルへ変換します。上の bioprinter Gcode ファイルをロードします。
注: このプロトコルでは、寸法 4.8 × 4.8 × 0.9 mm3正方形の構造は、STL ファイルとしてエクスポートされました。Gcode ファイルは、次の設定を使用して格子構造の生成された、: 層の厚さ、0.3 mm;インフィル パターン、直線;面材密度、25%;速度 10 mm/s。 - バイオプリンティングの bioink ブレンドのセルを準備します。皮膚類縁体の作製、2 つのセル型活かされています。2 つのセル型は、bioink、バイオプリンティングにブレンドされました。
- 主な HDF を取得します。50 μ G/ml アスコルビン酸、1% ペニシリン-ストレプトマイシン, 10% 牛胎児血清を添加した DMEM 成長媒体のこれらのセルを維持します。80-90% 0.5%/トリプシン EDTA 溶液およびカウントを用いて合流でセルをデタッチします。
- 分離し、次の参照先のプロトコル1患者からプライマリ hNC を凍結します。解凍し、単層培養による凍結 hNCs を展開します。80-90% 0.5%/トリプシン EDTA 溶液およびカウントを用いて合流でセルをデタッチします。
- 100 × 106セル/mL の成長媒体内で両方の細胞の種類を再懸濁します。100 x 106セル/mL メディアの 300 μ L の最終濃度を達成するために 1:1 の比率で一緒に細胞懸濁液を混ぜます。
- ブレンドの HDF と hNC ナノセルロース/アルギン酸に 50: 50 細胞懸濁液は混合装置プロトコル、最終的な細胞濃度が 9 x 106セル/mL の 10:1 bioink:cell 懸濁液比でパッシブ bioink 次を基づいています。
- Bioprinter 滅菌は無菌性を維持するキャビネット層流に配置されることを確認します。
- Bioink/細胞懸濁液のブレンドを含むカートリッジに滅菌印刷ノズルを接続し、bioprinter 挿入します。
- 手動でどちらかの bioprinter を調整またはプリンターに固有のプロトコル。
- Bioprint 格子、次の印刷パラメーターを使用してセルを含んだ構造: 25 kPa の圧力で 25 G 円錐ノズル。Bioprint 無細胞構造 (細胞用培地のセルを含まない配合) コントロールとして。
- 100 mM CaCl2 5 分すすぎのためのイオンのソリューション構成を追加することによって、構造を架橋し、培地 (37 ° C、5% CO2、および相対湿度 95%) の標準的な培養条件下で孵化させなさい。すべての 2 番目または 3 日目のメディアを変更します。
- 週 2 と 4 では、組織学的解析のためのサンプルを収集します。コラーゲンのサンプルを汚す私マッソンのヒアリン汚れ19を使用して生産します。
結果
本稿での結果は、2 つのセクションに分かれています。まず、細胞生存率を機械的方法または受動的な混合装置で混合後行った。次に、軟骨や皮膚の構造、培養され関連する組織学的マーカーを分析します。
細胞の分布において同種が登場します。ただし、ヘラ (図 2b) を使って手で混合のアクションは、受動的な混合装置 (図 2、) との混合よりももっと分散を持ちます。範囲、速度、およびヘラでミキシング技術はユーザーに大きく依存です。ただし、パッシブの混合ユニットで bioink に細胞をブレンド混合の標準化し、バッチの間で変動を最小限に抑えられます。さらに、30、60、90 s の混合時間 5 月 bioink を多量に細胞の大量の混合のために十分ではないです。ヘラで練りをより厳密なブレンドは必要かもしれません。比較では、受動的な混合装置を利用した良いブレンディングの際に bioink のセルの混合比を維持し、確実に均質な混合が行われる。また、サンプルの損失は、bioink に、ペトリ皿、チューブ、高粘度によるミキシング ツールの後ろに残すことが伝統的なミキシング テクニックと懸念です。混合ユニットを混合細胞生存率が高かった (> 90%)1、2、または 3 回。パッシブの混合ユニットが利用されたときは、遅い安定した描画速度で約 1 分を取ったブレンドします。30 と 60 s、90 を超えるための混合後高い生存率を示したヘラとの混合中混合の s は、他のグループと比較して生存率が大幅に低下 (77.9 ± 14%、 p < 0.05) (図 2c)。これは、過剰な混合細胞への損傷を引き起こす可能性があります。長期ライブ/デッドは、14 日と文化の日の後の染色は補足図 1に示すように。セル、14 日までに展開を開始、28 日目が広がっている高と良い生存率を示します。
文化後、軟骨や皮膚組織の類縁体は、組織を通じて分析しました。0, 14, 28 日で軟骨構造の解析は、量およびアルシアン ブルー染色 (図 3a-3_c) を示すようにギャグの報道の増加を示しています。汚れのない日 14 染色は細胞の近位の場所に限られている、0 日で気付いたは。しかし、文化の日 28 アルシアン ブルーは軟骨 ECM の形成を示す構造体で発見されます。Bioprinted 皮膚の構造は、コラーゲンの組織染色マッソンのヒアリン染色 (図 3d 3階) を利用した私を通じて分析しました。軟骨の構造と同様に、日 0 サンプル展示ないコラーゲン沈着。文化の日 14 セルの周りと構造体の表面に沿ってコラーゲンの相当な沈殿物が認められました。これは、構造表面とバルク内で密なコラーゲン層が発見されたと 28、日によってさらに強化されました。

図 1: ミキシング ユニット システム パッシブ。細胞懸濁液、(b) 12 mL シリンジ (e) (d) パッシブ混合ユニット、ユニットを分配する (c) bioink カートリッジ、bioink 注射器 (1) とセルの (f) アセンブリを充填用 (、) の 1 mL の注射器懸濁液の注射器 (2) 調剤単位に、パッシブの混合の単位の注射器 (3) 両方のメス-メス ルアー ロック コネクタ (4) の (g) 添付ファイル、充填カートリッジ (5) の添付ファイルの末尾に添付ファイルが完了するとアセンブリ、(h) 首相、ミキシング ユニット (6)、(私) 調剤ユニットを圧縮細胞懸濁液を混ぜて、bioink と充填カートリッジ (7) に分配する分配ユニットを押し下げていきます。この図の拡大版を表示するのにはここをクリックしてください。
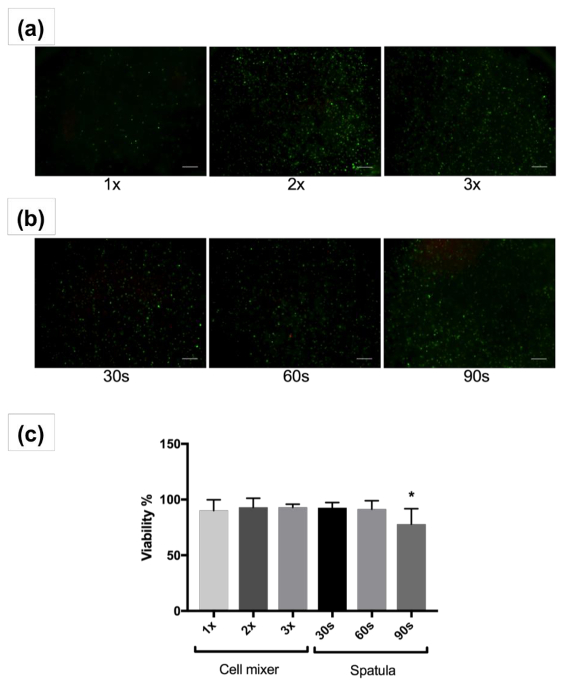
図 2: 細胞生存率画像と解析します。混合ユニット 1、2、または 3 時間パッシブと混合後ライブ (緑) と死者 (赤) ひと線維芽細胞を示す代表的なイメージ (、) または 1 日 3 D 30、60、90 秒 (b) をヘラ文化。4 倍の倍率で画像が表示されます。スケール バーを示す 200 μ m パーセント平均生存率 (c) 線維芽細胞の 1 日単位またはヘラと 3 D の文化を混合パッシブと混合した後。誤差範囲の平均値、標準偏差を示す * 0.005。この図の拡大版を表示するのにはここをクリックしてください。
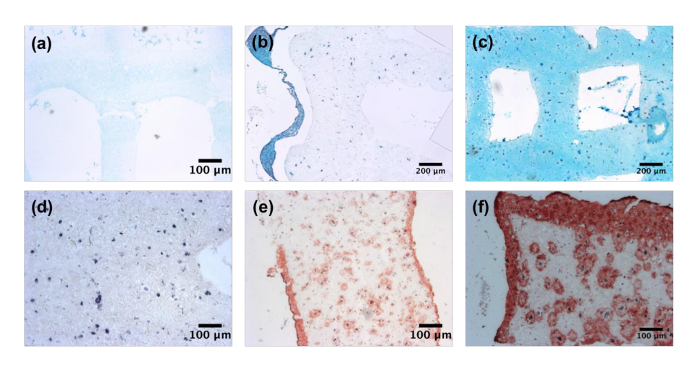
図 3:ティッシュ特定の細胞外マトリックス析出します。Bioprinted 軟骨構造は、14、および (c) 28 アルシアン青 (、) 日 0、(b) を利用したグリコサミノグリカンのステンド グラス。5 倍の倍率で撮影された画像。Bioprinted 皮膚構造コラーゲン染色私は一日 0、(e) 14、マッソンの Trichrome (d) を使用して、(f) 28。5 倍の倍率で撮影された画像。この図の拡大版を表示するのにはここをクリックしてください。
補足図 1: 28 (b) (、)、14 日目に細胞生存率。スケール バーは 200 μ m、緑は細胞、赤は死んだ細胞を指します。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
本稿で示されているように pre-cellularized bioinks は、bioprinted いずれかの軟骨を作製または 4 週間培養した類縁体の皮膚します。従来の混合方法より混合ユニット法パッシブを使用するブレンディング後の細胞生存率が高かった。さらに、混合ユニットを使用して描画処理の簡略化処理手順の数を最小限にでき、混合の範囲の一貫性の向上です。最終的には、この結果、bioink 内および構造群と実験群の間で両方の細胞分布の再現性が向上します。ギャグやコラーゲンなど組織 ECM の部品の蒸着文化の 4 週間後それぞれ軟骨と皮膚の両方の類縁体の観察されました。これは、混合技法と別組織目標を作製する選ばれた構築ジオメトリの両方の柔軟性を示します。軟骨や皮膚の類縁体の作製は、エンジニア リング組織目標のナノセルロース アルギン酸 bioink とバイオプリンティング法の両方使用の柔軟性を出展しました。調査の下の 2 つのコンポーネントについて説明します: (1) パッシブ ユニット法と (2) 類似する軟骨や皮膚内のセルの動作を混合します。
開発と、bioink に細胞懸濁液のブレンド技術の最適化は、これらのコンストラクトの作製のため最も重要でした。伝統的な低粘度ゲル材料とは異なり、bioinks の高粘度は印刷する前に bioink の pre-cellularization の難しさで起因しました。セル、bioink 混入する従来の方法に代わるとしてワンステップ細胞懸濁液の粘性 bioink に混合するためのプロトコルが開発され、議論。また、この混合組織構造の作製技術の実用的なアプリケーションが評価されました。このワンステップ混合方法に伝統的なミキシング テクニックが含まれて制御混合比、高と不規則なせん断応力の最小化にいくつかの利点があり、撹拌槽にサンプルを除去するためにクローズド システムを閉じます。ただし、この手法でセル/bioink をブレンドするため従来以上の利点を確保するためいくつかの重要な手順があります。細胞注射器のセルが中断して、よく混合する前に混合するために重要です。シリンジの解除とセルの転送の間の時間差の大きすぎると開始混合過程を細胞不均一な混合と印刷されたフィラメントの分布は、土砂を引き起こします。沈降が観測された、単純な反転 (2-3 回) ある場合混合の直前にパッシブ混合ユニット組立は、細胞を再懸濁し、混合する前に均一な分布を確実に十分です。また、注射器で空気の泡が排除されるまたは混合比の定数を確保する前に最小化が重要です。混合する前に bioink カートリッジの大きい空気泡が残っている場合は、ソリューションを実行する混合ユニットを介して追加の時間ように徹底的な混合をお勧めします。空気の泡が残っている場合、印刷カートリッジ/シリンジの穏やかなタップは残留気泡を転置できます。さらに、複数の材料を (いくつかの混合の単位または材料) を配合より複雑な構造のため必要がある場合が混在する bioinks/細胞懸濁液の濃度調節する必要が描画、適切な希釈後確認最終濃度を実現します。
他のブレンド処理の技法と比較してパッシブ混合単位は bioinks の cellularize への新しいアプローチです。ミキシングや攪拌ヘラや他のツールとデュアル ・ シリンジなどの他の混合技術とは異なりパッシブの混合ユニットは、バッチとユーザーの間でブレンドのより多くの一貫性をことができます。ヘラの混合など、マニュアルのミキシング技術の自然結果の範囲と混合率のユーザにバリエーションが広がる。また、クローズド システムなど、単位とデュアル ・ シリンジ混合混合パッシブ シャーレやチューブ内でマニュアルと比較してほとんどないサンプル損失がありません。
両方の組織の類縁体がこの原稿で作製した bioink の単一型と 1 つまたは 2 つのセル型成っていた。ただし、明確な細胞のタイプと異なる bioinks の領域を含むアーキテクチャの構成組織の類縁体のバイオプリンティング必要がありますもっと生理学的組織構造20,21、作製のため 22。特化したユニークな組成と bioinks または機能が異なる組成物または機能23、multimaterial の bioinks を作成するために既存の bioinks のいくつかの種類の混合によって生じるかもしれない。 24。これは皮、皮下層または bioink 組成25,26のグラデーションがの開発をするために必要かもしれない組織の領域を骨に軟骨などの組織遷移領域で特に重要かもしれませんネイティブの組織27は、これらの重要な地域。さらに、成長因子、モルフォゲン バイオプリンティング前 bioinks にブレンドする混合装置を利用できます。クローズドの混合システム サンプルの損失の除去は高価で、低濃度の生理活性因子の使用のために魅力的などこサンプル損失は、bioprinted コンス トラクターに彼らの最終的な集中に変化をもたらすことができます、特にグラデーションが関与しています。
混合ユニット本研究で利用したパッシブを含む任意のミキシング技術の制限は、機械的に敏感な細胞への損傷のリスクです。たとえば、このような幹細胞を分離した骨髄や胚、または誘導多能性幹細胞からのそれらが機械的損傷28,29になりやすい。混合法混合プロセスに関与するせん断力により細胞異常の機械的応力を与えるし、生存率30を維持するためにバランスする必要があります。主な線維芽細胞と軟骨細胞における使用は、良い生存率 (図 2) の結果より多くの研究が安全な混合率およびより敏感な細胞タイプの比を決定するため必要です。それまでは、混合が生存率を最大限に安定した低速レートで実行されることをお勧めします。さらに、本研究で選択されたセル密度は、以前の研究1に基づき決定されました。この細胞密度は、すべてのセル型の理想的かもしれない。特に、高濃度で細胞をブレンドすると、増加細胞間の接触細胞と組織形成31,32を向上させる可能性があります可能性があります。同様に、パッシブの混合ユニットは bioinks にセルの回転楕円体または他のセルの集計33をブレンドに適用される可能性があります。
提案し、ミキシング ユニット システム パッシブが粘性 bioink に細胞懸濁液を急速に混じることができるこの研究で実証します。細胞への機械的損傷のリスクがまだ残っているアプローチ ブレンド単一の研究内およびユーザー間での整合性をよりことができます。このアプローチを活用した pre-cellularized bioinks は、両方の軟骨を作製し、4 週間ほど培養した、ティッシュ特定の ECM マーカーの堆積を示す類似の皮膚に使用されました。今後の研究方向ミキシング ユニット システムより複雑な組織体の作製のための標準化された bioinks から特殊な bioinks をブレンドする受動の使用率に焦点を当てます。
開示事項
この原稿の著者 CELLINK LLC の従業員であります。
謝辞
著者の謝辞があります。
資料
| Name | Company | Catalog Number | Comments |
| STARTINK Kit | CELLINK | SK0001 | Kit that contained all the elements for the CELLMIXER procedure |
| Live/Dead Kit | Life Technologies | L3224 | Kit for the analysis of cell viability after mixing |
| Masson's Trichrome | Sigma Aldrich | HT15-1KT | Kit for the analysis of collagen I deposition in the skin constructs |
| Alcian Blue | Sigma Aldrich | B8438-250ML | Kit for the analysis of glycosaminoglycan deposition in the skin constructs |
| INKREDIBLE+ bioprinter | CELLINK | Gen1+ | Printer utilized in the study |
| DMEM with Glutamax | Thermofisher | 10566016 | Media for culture of the cells |
| 10% fetal bovine serum | Thermofisher | A3160402 | Media supplement |
| Penicillin-Streptomycin | Life Technologies | 15070063 | Media supplement |
| live cell imaging solution | thermofisher | A14291DJ | component utilized using live/dead imaging |
| inverted microscope | Olympus | IX73 | microscope utilized |
| a digital color camera | Olympus | XC10 | microscope camera utilized |
| cellSens imaging software | Olympus | n/a | stock software with the microscope |
| ImageJ | NIH | n/a | open source image analysis software |
| GraphPad Prism 7 | GraphPad | n/a | software for statistical analysis |
| Slic3r software (v1.2.9) | Slic3r | n/a | open-source software to convert .stl file to gcode |
| primary adult human dermal fibroblasts | ATCC | PCS-201-012 | cell source for fibroblasts |
参考文献
- Avila, H. M., Schwarz, S., Rotter, N., Gatenholm, P. 3D bioprinting of human chondrocyte-laden nanocellulose hydrogels for patient-specific auricular cartilage regeneration. Bioprinting. 1, 22-35 (2016).
- Lee, V., et al. Design and fabrication of human skin by three-dimensional bioprinting. Tissue Eng Part C Methods. 20 (6), 473-484 (2013).
- Costantini, M., et al. Microfluidic-enhanced 3D bioprinting of aligned myoblast-laden hydrogels leads to functionally organized myofibers in vitro and in vivo. Biomaterials. 131, 98-110 (2017).
- Fedorovich, N. E., et al. Biofabrication of Osteochondral Tissue Equivalents by Printing Topologically Defined, Cell-Laden Hydrogel Scaffolds. Tissue Eng Part C Methods. 18 (1), 33-44 (2011).
- Vijayavenkataraman, S., Lu, W. F., Fuh, J. Y. H. 3D bioprinting of skin: a state-of-the-art review on modelling, materials, and processes. Biofabrication. 8 (3), 032001 (2016).
- Peltola, S. M., Melchels, F. P. W., Grijpma, D. W., Kellomäki, M. A review of rapid prototyping techniques for tissue engineering purposes. Ann Med. 40 (4), 268-280 (2008).
- Xu, T., Jin, J., Gregory, C., Hickman, J. J., Boland, T. Inkjet printing of viable mammalian cells. Biomaterials. 26 (1), 93-99 (2005).
- Cui, X., Dean, D., Ruggeri, Z. M., Boland, T. Cell damage evaluation of thermal inkjet printed Chinese hamster ovary cells. Biotechnol Bioeng. 106 (6), 963-969 (2010).
- Parsa, S., Gupta, M., Loizeau, F., Cheung, K. C. Effects of surfactant and gentle agitation on inkjet dispensing of living cells. Biofabrication. 2 (2), 025003 (2010).
- Derby, B. Inkjet printing of functional and structural materials: fluid property requirements, feature stability, and resolution. Annu Rev Mater Res. 40, 395-414 (2010).
- Colosi, C., et al. Microfluidic Bioprinting of Heterogeneous 3D Tissue Constructs Using Low-Viscosity Bioink. Adv Mater. 28 (4), 677-684 (2016).
- Ober, T. J., Foresti, D., Lewis, J. A. Active mixing of complex fluids at the microscale. Proc Natl Acad Sci. 112 (40), 12293-12298 (2015).
- Shabnam, P., Madhuja, G., Frédéric, L., Karen, C. C. Effects of surfactant and gentle agitation on inkjet dispensing of living cells. Biofabrication. 2 (2), 025003 (2010).
- Chahal, D., Ahmadi, A., Cheung, K. C. Improving piezoelectric cell printing accuracy and reliability through neutral buoyancy of suspensions. Biotechnol Bioeng. 109 (11), 2932-2940 (2012).
- Niu, X., Lee, Y. -. K. Efficient spatial-temporal chaotic mixing in microchannels. J Micromech Microeng. 13 (3), 454 (2003).
- Liu, R. H., et al. Passive mixing in a three-dimensional serpentine microchannel. J Microelectromech Syst. 9 (2), 190-197 (2000).
- Strober, W. Trypan blue exclusion test of cell viability. Curr protoc immunol. , (2001).
- Scott, J., Dorling, J. Differential staining of acid glycosaminoglycans (mucopolysaccharides) by alcian blue in salt solutions. Histochem Cell Biol. 5 (3), 221-233 (1965).
- Garvey, W. Modified elastic tissue-Masson trichrome stain. Stain technol. 59 (4), 213-216 (1984).
- Xu, T., Zhao, W., Zhu, J. -. M., Albanna, M. Z., Yoo, J. J., Atala, A. Complex heterogeneous tissue constructs containing multiple cell types prepared by inkjet printing technology. Biomaterials. 34 (1), 130-139 (2013).
- Kolesky, D. B., et al. 3D bioprinting of vascularized, heterogeneous cell-laden tissue constructs. Adv Mater. 26 (19), 3124-3130 (2014).
- Kolesky, D. B., Homan, K. A., Skylar-Scott, M. A., Lewis, J. A. Three-dimensional bioprinting of thick vascularized tissues. Proc Natl Acad Sci. 113 (12), 3179-3184 (2016).
- Rutz, A. L., Hyland, K. E., Jakus, A. E., Burghardt, W. R., Shah, R. N. A multimaterial bioink method for 3D printing tunable, cell-compatible hydrogels. Adv Mater. 27 (9), 1607-1614 (2015).
- KÖpf, M., Campos, D. F. D., Blaeser, A., Sen, K. S., Fischer, H. A tailored three-dimensionally printable agarose-collagen blend allows encapsulation, spreading, and attachment of human umbilical artery smooth muscle cells. Biofabrication. 8 (2), 025011 (2016).
- Gurkan, U. A., et al. Engineering anisotropic biomimetic fibrocartilage microenvironment by bioprinting mesenchymal stem cells in nanoliter gel droplets. Mol Pharm. 11 (7), 2151-2159 (2014).
- Ma, Y., Ji, Y., Huang, G., Ling, K., Zhang, X., Xu, F. Bioprinting 3D cell-laden hydrogel microarray for screening human periodontal ligament stem cell response to extracellular matrix. Biofabrication. 7 (4), 044105 (2015).
- Lu, H. H., Thomopoulos, S. Functional attachment of soft tissues to bone: development, healing, and tissue engineering. Annu Rev Biomed Eng. 15, 201-226 (2013).
- Aguado, B. A., Mulyasasmita, W., Su, J., Lampe, K. J., Heilshorn, S. C. Improving viability of stem cells during syringe needle flow through the design of hydrogel cell carriers. Tissue Eng Part A. 18 (7-8), 806-815 (2011).
- Parisi-Amon, A., Mulyasasmita, W., Chung, C., Heilshorn, S. C. Protein-Engineered Injectable Hydrogel to Improve Retention of Transplanted Adipose-Derived Stem Cells. Adv Healthc Mater. 2 (3), 428-432 (2013).
- Qiu, X., De Jesus, J., Pennell, M., Troiani, M., Haun, J. B. Microfluidic device for mechanical dissociation of cancer cell aggregates into single cells. Lab Chip. 15 (1), 339-350 (2015).
- Cukierman, E., Pankov, R., Yamada, K. M. Cell interactions with three-dimensional matrices. Curr Opin Cell Biol. 14 (5), 633-640 (2002).
- Loessner, D., et al. Bioengineered 3D platform to explore cell-ECM interactions and drug resistance of epithelial ovarian cancer cells. Biomaterials. 31 (32), 8494-8506 (2010).
- Lin, R. Z., Chang, H. Y. Recent advances in three-dimensional multicellular spheroid culture for biomedical research. Biotechnol J. 3 (9-10), 1172-1184 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved