このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
リシン毒素チェーン (RTA) 酵母の人身売買に必要な細胞成分を識別するために簡単な蛍光レポーターの試金
要約
原稿で人身売買に関与する植物毒素リシン (RTA) のサブユニットは細胞傷害性のプロセスを殺す細胞のコンポーネントを識別するために酵母を用いた蛍光レポーターの試金の使用について述べる。
要約
細菌や植物 A/B 毒素は、真核細胞の細胞質内の細胞内ターゲットに到達し、最終的に殺す自然の人身売買経路を悪用します。このような A ・ B 毒素が酵素によって実行中の構成一般的に Asubunit (例えば、リシン毒素 (RTA))、1 つまたは複数のセルに特定のバインド毒素は細胞表面の受容器のために責任がある Bsubunit(s) をバインドします。方法の私達の現在の知識 A/B 毒素はエンドサイトーシスと細胞内タンパク質高等真核細胞での並べ替えのような基本的な細胞メカニズムを理解する助け細胞科学者を効率的に夢中にさせることができます。医療の観点から、患者に適切な治療ソリューションを見つける、最終的にがん治療のための治療毒素ベース アプリケーションの開発の主要な毒素の人身売買ルートを特定することが重要です同様に。
A のゲノム解析から B 毒素哺乳類細胞における人身売買は、時間がかかり、複雑で高価な A に関するいくつかの研究/酵母モデル生物酵母で B 毒素輸送が行われています。酵母と高等真核生物の細胞のより複雑な根本的な細胞プロセスであるにもかかわらず類似していると酵母で得られた非常に頻繁が哺乳類の状況に転送できます。
ここでは、酵母の RTA の細胞内輸送を分析するための高速かつ使いやすいレポーターアッセイをについて説明します。新しいアッセイの重要な利点は、細胞質に小胞体 (ER) から RTA レトロ-転だけを調査する機会が、むしろエンドサイトーシスと逆行性毒素細胞膜が輸送小胞体に。アッセイ生体内で翻訳後、RTA 毒性緑色蛍光タンパク質 (GFP) の蛍光性の放出を介しての間接測定ができる記者プラスミドを使用しています。RTA は、28 s rRNA depurination によって蛋白質の生合成の開始を効率的にできないため、この試金は、蛍光性の放出で、ホスト細胞タンパク質の同定を変化検出による細胞内の RTA 輸送に関わるでできます。
概要
細菌の生産する毒素によって感染症を患っている患者は、効率的な治療がまだ大きく不足しているので特に各社会医療システム、医療、金融負担が大きいを表しています。医学的に関連する A の複雑な中毒メカニズム、新たな治療戦略を開発する/コレラ毒素、志賀毒素、リシンなど B 毒素が完全に実装すべき新規の強力な試金に基づく分子レベルで理解する必要があります。
近年、いくつかの研究は A の分析を試みました酵母の放射性毒素など時間がかかり、コストがかかる方法を使用して哺乳類セル B 毒素輸送標識 siRNA ベースのスクリーニングと同様、1,2 /3をに近づきます。場合によっては、毒素が人身売買されている可視化体内蛍光顕微鏡による fluorophores が付いて、量子ドットや蛍光タンパク質4,5サブユニットを個々 の毒素の化学および/または遺伝的結合の後。残念ながら、そのような変更はしばしば毒素の不活性および/または変更の自然な特性に します。さまざまな科学的な質問の答えを直接別のエレガントな方法はlacZのルシフェラーゼなど蛍光タンパク質酵素レポーター系の使用 (例えばGFP やDiscosoma sp. 赤色けい光たんぱく質 (下流))。
本稿では、単純なプロトコルは、出芽酵母の細胞外応用 RTA の細胞内輸送に必要な細胞のコンポーネントを特定する説明します。それにより、GFP が続く ER インポート N ターミナル信号を含んでいる蛍光レポーター プラスミッドは GFP 蛍光性の放出後体内で RTA を介したタンパク質翻訳阻害を直接に測定するタンパク質生合成センサーとして機能します。翻訳6。RTA エンドサイトーシスおよび/または細胞内輸送が否定的 (または積極的に) 影響する野生型と比較して特定の酵母削除変異株の場合は GFP 蛍光発光6に増加 (または減少) を検出できます。
これまでのところ、酵母細胞における RTA 輸送の分析のすべてのメソッドは、RTA の小胞体-細胞質レトロ移行プロセスに制限されていました。このような人工的なシステム、ER インポート信号を含む RTA は自殺の表現型の1、7の結果誘導型プロモーターから表されます。リシンの B サブユニットの結合セル本稿に記載されている実験のセットアップで行方不明は同様にであり、したがって、完全に表さないリシン holotoxin 中毒8の自然状況、毒素トランスポート プラズマから膜小胞体、ゴルジ装置では、この新規アッセイで密接にまねることができます。興味深いことに、パイロット研究で得られた予備的な結果は、RTA 人身取引の経路がリシン holotoxin の中毒ルートに顕著な類似性を明らかにすることを示します。
要約すると、RTA エンドサイトーシスで選択した細胞蛋白質と酵母の人身売買の特定の役割を決定するこの方法を使用できます。さらに、この実験のセットアップは簡単に他のリボソームが出され、様々 な酵母や細菌種は、zymocin や志賀毒素などから分泌毒素を不活性化に適応する可能性があります。
プロトコル
注: 一般的な実験的ワークフローの概要については、図 1に描かれています。
注意: RTA は人間にとって猛毒です。安全性研究室許可 S2 (バイオ セーフティ レベル 2 に相当) が必要です。全体の実験の間に手袋を着用してください。
1. 異種発現大腸菌の彼の付けられた RTA
- エシェリヒア属大腸菌細胞発現プラスミド pET24-RTA(彼) の 6または標準エレクトロポレーション プロトコル9,10を使用して、空のベクター pET24a(+)に変換します。空のプラスミドを含むセルは、ネガティブ コントロールとして機能します。
- カナマイシンを含む (100 μ g/mL) LB プレート上の肯定的なクローンの選択後、RTA 発現プラスミドまたは 5 mL の LB 培地菅(カナマイシンの 100 μ g/ml の LB 培地) で空のベクターを含む細胞を接種し、37 ° C で 24 時間 220 rpm 間加温します。
- 5 mL の前培養で 1 L LB菅媒体を補完し、細胞が 0.8 〜 1.0 (約 3-4 h) の外径600に達するまで、37 ° C および 220 rpm でセルを孵化させなさい。その後、培養温度を 28 ° C に減らすし、H2o. イソプロピル-β-D-1-thiogalactopyranoside (IPTG) 原液の 1 M を準備
- 最終濃度 1 mM の IPTG を追加することによって尿細管性アシドーシス発現大腸菌を誘発します。
- 3.5 h 28 ° C で、220 rpm 10,000 × g、10 分、4 ° C で遠心分離によって細胞を収穫後 2 回の 5 mL の結合バッファー (500 mM の NaCl、10 mM のイミダゾールと 20 mM KH2PO4餌を洗浄します。、pH 7.4 を =) 10,000 x g と 4 ° C、10 分、5 mL の結合バッファーでペレットを再懸濁します。
注: プロトコルは一時停止することができますこの段階で、数日間 80 ° C でセルを格納できます。
2. アフィニ ティー ・ クロマトグラフィーによって彼の付けられた RTA の浄化
- 次のプロトコルを使って氷の上細胞を超音波照射: 15 s パルス (20 ミクロン)、30 秒一時停止。5 回、この手順を繰り返します。
- 細胞ライセート 21,000 x g と 4 ° C、15 分でを遠心し、上清滅菌注射器フィルター システム (0.2 μ m 孔サイズ) を使用してフィルターを適用します。
注: 正常に熱量のサンプルの細胞ペレットは、透明の枠線を表示します。 - 5 mL Ni2 +を搭載した自動浄化システムを使用して-、無菌ろ過エシェリヒア属大腸菌の培養上清から、RTA の彼の付けられた分数を浄化するアフィニ ティー ・ カラムを用いた。一般に、1 mL/分の溶出速度を使用し、非効率的な毒素結合と毒素活性の損失を防ぐために全体の浄化システムをクールします。
メモ: 効率的な RTA 浄化のパラメーターは表 1に表示されます。ベッカーらも参照してください。さらに情報9。- 簡単に言えば、平衡 20 ml の結合バッファー記憶域バッファーを削除するのアフィニ ティー ・ カラム。注射器を用いたアフィニ ティー ・ カラムに上清を滅菌フィルターを適用します。
- 25-35 mL の結合バッファー列からバインドされていないタンパク質を削除すると列を洗います。紫外線吸光度 280 まで洗濯の手順 nm に近い紫外線の初期値。
- 20-35 mL の溶出バッファーでバインドされた RTA 分数を溶出 (500 mM のイミダゾール、500 mM 20 mM KH2PO4pH, 塩化ナトリウム = 7.2) し (図 2 aおよび図 2 b) 氷のサンプルを保ちます。
注: RTA 画分の溶出は、UV 吸収の増加によって示されます。専ら非特異的結合タンパク質の混入を防ぐためにこの割合を収集するために注意してください。 - 西部のしみの分析12,13 (オプション) またはブルー染色11を実行する溶出サンプルの 20 μ L を使用します。尿細管性アシドーシスを検出および確認サンプル純度 (図 3) にプライマリ反彼の抗体 (1:1, 000) および二次対策-mouse-IgG-HRP (1:10, 000) を使用します。
- 5 mL 脱塩カラムの溶出の RTA 分数を脱塩し、0.8 M ソルビトールのサンプルを平衡します。
- 脱塩カラムで精製システムの親和性列に置き換えるし、最初 0.8 M ソルビトール 20 mL でコラムを平衡させ。
- RTA の溶出画分を注射器を介して列に適用されます。0.8 M ソルビトールの 100 mL で列を洗浄し、紫外線吸収が (図 2) を増大し始めるとすぐに 15 mL チューブに脱塩の RTA の画分を溶出します。
- 4 ° C で溶出 RTA 分数を格納します。
注: は、コンダクタンスが塩の汚染を避けるために増加したとき直接 RTA 分数サンプリングを停止します。脱塩のプロシージャのパラメーターは表 1 のとおりです。
- 10,000 x g で 4 ° C 30-180 分 1-2 mL の最終巻に 10 kDa カットオフ スピン列を使用して溶出の RTA 分数を集中し、3-4 週間の 4 ° C でサンプルを格納します。
注意: は、RTA の活動の完全な損失につながるを凍結からサンプルを凍結しないでください。 - 従来タンパク質定量キットを用いたタンパク質濃度を決定します。蛋白濃度は 1 〜 1.5 mg/mL の範囲でする必要があります。
注: RTA 傾向にあるタンパク質濃度が高すぎる場合の沈殿 (> 5 mg/mL)。
3. 酵母の変換および細胞壁の除去
- GFP レポーター プラスミド pRS315 K28SP- GFP と6標準的なリチウム アセテート変換方法14を使用して野生型または選択した酵母欠失変異株を変換します。ロイシン ドロップ アウト (d/o) 上のセルを孵化させなさい肯定的なクローンの選択の 2 〜 3 日の 30 ° C でのグルコース プレート (グルコース 2% 1.5% 寒天 0.5% 硫酸アンモニウム、0.17% 酵母窒素ベース (YNB)、ロイシンなし 0.087 %d/o のミックス)。
- 各板から 3 の異なる酵母クローンをピックアップし、220 rpm と OD600 ~ 30 ° C でロイシン d/o ラフィノース培地 (2% ラフィノース、0.5% 硫酸アンモニウム、0.17%、YNB、0.087 %d/o ロイシンなしミックス) 100 mL でクローンを接種する = 1.0 2.0 (10 x 2 47セル/mL)。
注: 別の酵母遺伝子破壊株の細胞の成長が違います。分光光度計による外径600を監視します。 - 外径600サンプルを希釈する外径 φ600の値を計算するには、= 0.1 0.3 (1:5、1:10 に希釈) 外径600分光光度計で測定。参考として、H2O ロイシン d/o raffionose 中の対応する量の補完を使用します。
- 仕上げステップ 3.5、496 μ spheroplasting バッファー (約 2 × 106スフェロプ ラスト) で 50 mL の spheroplasted 文化の 4 μ L を混合し、400 × g で 10 分間遠心した後。
- 10 mL H2O にペレットを再懸濁します蒸留、30 s、およびロイシン d/o ブドウ糖プレート (2% グルコース 1.5% 寒天 0.5% 硫酸アンモニウム、0.17%、YNB、ロイシンなし 0.087 %d/o のミックス) のサンプルの 10 μ L をプレートの渦サンプル。
- 30 ° C で 3 日間インキュベート細胞皿の上の成長細胞群れ体の合計数をカウントします。データ評価のため効率が 98% 以上でサンプルのみの使用 (細胞コロニー総数 < 40 植民地/プレート)。
4. GFP レポーター アッセイ測定 96 ウェルのプレート
- 96 ウェルのプレート (200 μ L/ウェル) にステップ 3.7 で得られた酵母細胞スフェロプ ラストをシードします。
- 70 μ 安定ロイシン d/o ラフィノース培陰性対照を追加 (Ni2 +の溶出液-親和性浄化された細胞ライセート空のベクトルを表現する IPTG によるエシェリヒア属大腸菌のセルから) または最終的な RTA 濃度 5 μ M (の RTA を精製160 グラム/L の RTA に対応する) 各井戸。
- すぐに、GFP 発現を誘導し、その後、測定を開始 30 μ L 安定ガラクトース ソリューション (30% ガラクトース、0.8 M ソルビトール) を追加します。
注: 実験につき少なくとも 3 の技術的なレプリケートを実行し、3 生物が酵母ごとにレプリケートします。 - 仕上げのサンプル準備 (手順 4.1 4.3) 後、蛍光リーダーの 96 ウェル プレートを置くし、測定を開始します。475/509 nm のフィルターが GFP 蛍光検出に必要なセットを使用します。振動直径 20 h (10 分間隔の測定) の時間帯にわたって 1 mm と 120 rpm、30 ° C での測定を実行します。
注: GFP フィルター セットは通常リーダーのすべてのシステムで利用可能です。温度、時間、間隔、および RTA の濃度の測定は、独自のニーズに調整できます。代表的な結果は、図 4のとおりです。 - オプション: 品質管理測定の内部コントロールを追加を使用します。ネガティブ コントロールを準備するには、30% ガラクトース (GFP 誘導なし) の代わりに 30 μ L 安定ロイシン d/o ラフィノース媒体を追加します。また、0.8 M ソルビトール安定 G418 溶液 (300 μ g/mL) 70 μ L を追加します。酵母における GFP の発現を防ぐために、タンパク質翻訳阻害剤 G418 はタンパク質を阻害する肯定的な制御として機能します。
- 次の式によると 20 h の時間ポイントのパーセントで GFP 蛍光を計算 (図 4 aを参照してください):
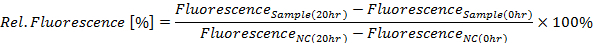 、NC はネガティブ コントロール
、NC はネガティブ コントロール
- また、各測定ポイントの相対的な GFP 蛍光を確認 (このケースの 10 分でまた見なさいステップ 4.4) 上記の同等化を使用して。図 4 bに示すように、GFP の蛍光強度 (y 軸) を時間 (x 軸) をかけてしみが付くことによってグラフを作成します。
結果
本稿で説明したプロトコルの一般的なワークフローについては、図 1、ほぼ成功した RTA 浄化と後続の GFP レポーター アッセイ実験のため単一の手順を要約します。プロトコルの個々 の手順の詳細な説明を見つけることが。図 2は、アフィニ ティー ・ クロマトグラフィー (図 2 a)、空のベクター コン?...
ディスカッション
上記プロトコルを実行すると、実験の成功を達成するために次の提案をお勧めします。
異種蛋白質の表現、1 mM の IPTG 濃度を超えないようにすることが重要です。IPTG 濃度 > プロモーターによって誘導される RTA 式および毒素の収率を下げる鉛 1 mM を阻害します。さらに、封入体形成、非効率的な折りたたみ、毒素の不活性化を防ぐために 28 ° C 以上の高温で細胞を栽?...
開示事項
著者が明らかに何もありません。
謝辞
本研究の一部は親切 (SFB 1027, A6) ドイツ研究基金からの助成金によってサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| Bacterial and yeast strains | |||
| E. coli BL21 DE3(Gold) | Aligent Technologies | 230130 | |
| S. cerevisiae BY4742 | Euroscarf | Y10000 | |
| S. cerevisiae BY4742 deletion mutants | Dharmacon | YSC1054 | whole collection |
| Name | Company | Catalog Number | Comments |
| Plasmids used in this protocol | |||
| pET24a(+) (Novagen) | Millipore | 69772-3 | |
| pET-RTA(His6) | Becker et al. (2016)3 | ||
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Zymolyase 20T | USBio | Z1000.250 | lytic enzyme for cell wall removal |
| LB broth medium | Thermo Scientific | 10855021 | 15 g agar was added for plate production |
| YNB | Thermo Scientific | DF0335-15-9 | |
| Ammonium sulfate | Sigma-Aldrich | A4418-100G | |
| Yeast drop-out mix supplemts without leucine | Sigma-Aldrich | Y1376-20G | |
| Agar | Sigma-Aldrich | 05040-100G | |
| D-glucose | Sigma-Aldrich | G8270-100G | |
| DTT | Sigma-Aldrich | 10197777001 | |
| D-raffinose | Sigma-Aldrich | 83400-25G | |
| D-sorbitol | Sigma-Aldrich | S1876-1KG | |
| D-galactose | Sigma-Aldrich | G0750-10MG | |
| G418 | Thermo Scientific | 11811031 | |
| IPTG | Sigma-Aldrich | I6758-1G | |
| Imidazole | Roth | 3899.1 | |
| PAGE ruler prestained | Fermentas | 26616 | protein ladder used for Western analysis |
| Name | Company | Catalog Number | Comments |
| Material for RTA purification, desalting and reader measurements | |||
| Spectrophotometer Ultrospec 2100 pro | Amersham | ||
| Soniprep 150 | MSE | old model, other models available | |
| Fluoroskan Ascent | Thermo Scientific | 5210470 | old model, not available anymore |
| ÄKTAPurifier | Thermo Scientific | 28406266 | Product is discontinued and replaced |
| HisTRAP HP column | GE Healthcare | 17-5248-02 | |
| HiTRAP desalting column | GE Healthcare | 11-0003-29 | |
| Midisart sterile filter | Sartorius | 16534K | 0.2 µm pore size |
| BCA protein assay kit | Pierce | 23225 | |
| 660 nm assay kit | Thermo Scientific | 22660 | |
| 96 well plates | Thermo Scientific | 260860 | |
| Name | Company | Catalog Number | Comments |
| Antibodies (optional) | |||
| Anti-Tetra-His | Qiagen | 34670 | primary antibody; 1:1,000 dilution |
| Anti-mouse-HRP | Sigma-Aldrich | A9044-2ML | secondary antibody, 1:10,000 dilution |
参考文献
- Li, S., et al. Folding-competent and folding-defective forms of ricin A chain have different fates after retrotranslocation from the endoplasmic reticulum. Mol Biol Cell. 21 (15), 2543-2554 (2010).
- Li, S., Spooner, R. A., Hampton, R. Y., Lord, J. M., Roberts, L. M. Cytosolic entry of Shiga-like toxin a chain from the yeast endoplasmic reticulum requires catalytically active Hrd1p. PLoS One. 7 (7), e41119 (2012).
- Moreau, D., et al. Genome-wide RNAi screens identify genes required for Ricin and PE intoxications. Dev Cell. 21 (2), 231-244 (2011).
- Giepmans, B. N., Adams, S. R., Ellisman, M. H., Tsien, R. Y. The fluorescent toolbox for assessing protein location and function. Science. 312 (5771), 217-224 (2006).
- Majoul, I. V., Bastiaens, P. I., Soling, H. D. Transport of an external Lys-Asp-Glu-Leu (KDEL) protein from the plasma membrane to the endoplasmic reticulum: studies with cholera toxin in Vero cells. J Cell Biol. 133 (4), 777-789 (1996).
- Becker, B., Schnoder, T., Schmitt, M. J. Yeast Reporter Assay to Identify Cellular Components of Ricin Toxin A Chain Trafficking. Toxins (Basel). 8 (12), (2016).
- Li, X. P., Baricevic, M., Saidasan, H., Tumer, N. E. Ribosome depurination is not sufficient for ricin-mediated cell death in Saccharomyces cerevisiae. Infect Immun. 75 (1), 417-428 (2007).
- Lord, J. M., Roberts, L. M., Robertus, J. D. Ricin: structure, mode of action, and some current applications. Faseb J. 8 (2), 201-208 (1994).
- Becker, B., Schmitt, M. J. Adapting yeast as model to study ricin toxin a uptake and trafficking. Toxins (Basel). 3 (7), 834-847 (2011).
- Seidman, C. E., Struhl, K., Sheen, J., Jessen, T. Introduction of plasmid DNA into cells. Curr Protoc Mol Biol. , (2001).
- Brunelle, J. L., Green, R. Coomassie blue staining. Methods Enzymol. 541, 161-167 (2014).
- Shapiro, A. L., Vinuela, E., Maizel, J. V. Molecular weight estimation of polypeptide chains by electrophoresis in SDS-polyacrylamide gels. Biochem Biophys Res Commun. 28 (5), 815-820 (1967).
- Towbin, H., Staehelin, T., Gordon, J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. 1979. Biotechnology. 24, 145-149 (1992).
- Ito, H., Fukuda, Y., Murata, K., Kimura, A. Transformation of intact yeast cells treated with alkali cations. J Bacteriol. 153 (1), 163-168 (1983).
- Vitetta, E. S., Yen, N. Expression and functional properties of genetically engineered ricin B chain lacking galactose-binding activity. Biochim Biophys Acta. 1049 (2), 151-157 (1990).
- Wales, R., Roberts, L. M., Lord, J. M. Addition of an endoplasmic reticulum retrieval sequence to ricin A chain significantly increases its cytotoxicity to mammalian cells. J Biol Chem. 268 (32), 23986-23990 (1993).
- Breslow, D. K., et al. A comprehensive strategy enabling high-resolution functional analysis of the yeast genome. Nat Methods. 5 (8), 711-718 (2008).
- Jablonowski, D., Schaffrath, R. Zymocin, a composite chitinase and tRNase killer toxin from yeast. Biochem Soc Trans. 35 (Pt 6), 1533-1537 (2007).
- Jablonowski, D., Schaffrath, R. Saccharomyces cerevisiae RNA polymerase II is affected by Kluyveromyces lactis zymocin. J Biol Chem. 277 (29), 26276-26280 (2002).
- Jablonowski, D., Frohloff, F., Fichtner, L., Stark, M. J., Schaffrath, R. Kluyveromyces lactis zymocin mode of action is linked to RNA polymerase II function via Elongator. Mol Microbiol. 42 (4), 1095-1105 (2001).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved