Method Article
セルのパラフィン包埋ブロックの免疫細胞化学による培養細胞の蛋白質発現レベルの定量
要約
現在、固定細胞の免疫蛍光染色バイオマーカ発現量の定量法選択時は形態情報も必要です。ここに提示されたこのプロトコルは、セルのパラフィン包埋ブロックの免疫細胞化学の別の方法を提供します。
要約
免疫蛍光染色は、現在バイオマーカ発現量の定量のための選択の方法細胞培養系における形態情報も必要です。免疫細胞のパラフィン包埋ブロック、ここに提示された染色プロトコルはパラフィン埋め込まれた固定細胞の免疫蛍光染色に優れた代替手段です。このプロトコルではトロンボプラスチン プラズマ法を用いた HeLa 細胞からパラフィンのセルブロックが準備され、免疫細胞化学 2 つの増殖マーカー、CKAP2 および ki-67 の評価を行った。核と HeLa 細胞の細胞質の形態セル ブロックのスライドでよく保存されていた。同時に、各種の CKAP2 および ki-67 染色パターン パラフィン癌組織免疫組織化学的に非常に類似していた。無血清条件下で HeLa 細胞の前培養を含む変更された細胞培養条件と建築情報を維持しながら効果を評価でした。結論としては、セルのパラフィン包埋ブロックの免疫細胞化学は免疫蛍光染色に優れた代替手段です。
概要
ほとんどの実験室は、通常はセルのパラフィン包埋ブロックは使用されません。むしろ、培養細胞を固定、パラフィン埋め込まれていない細胞は細胞内局在の研究で用いられます。これらの培養細胞を固定、発色ではなく蛍光を使用されています。したがって、免疫蛍光染色細胞文化1を用いた研究ではタンパク質の発現レベルの決定のための選択の方法は、現在。ただし、免疫蛍光染色のために準備されたスライドは、平面顕微鏡2の下で示されたものと違う画像を表示可能性があります蛍光顕微鏡下でのみ観察できます。また、免疫蛍光染色用のスライドの保存は、明るい光からの保護を必要とする、蛍光信号のイメージング蛍光信号3の損失のための繰り返された露出と弱くなります。セルのパラフィン包埋ブロックの免疫細胞化学からの結果は免疫組織のパラフィン包埋4からのそれらにかなり類似と臨床情報に簡単に変換できます。したがって、各種の優れた代替手段となります。ただし、セル ブロック準備されていない人気のある基礎研究所で。このプロトコルでは、その後、セル ブロック作製、免疫染色は、細胞培養研究の分野でこのメソッドの使用を促進するために提供されます。
セル ブロック作製の試みとユニークな方法は、彼らはすでに基礎研究4,5に臨床診断から適用されています。メソッドをされている様々 なセル ブロック準備報告4,6トロンボプラスチン プラズマ法はシンプルでコスト効率の高い、容易に適応可能であります。したがって、トロンボプラスチン プラズマ法4,5,6,7,本稿で提示されたプロトコルの8はセルのパラフィン包埋ブロックの作成に使用されます。
本研究ではトロンボプラスチン プラズマ細胞ブロックおよび 2 つの増殖マーカーを用いた免疫細胞化学法の準備の詳細な手順を示した。1 つのマーカーは最近分裂マーカー9,10,11; として報告されている細胞骨格関連タンパク質 2 (CKAP2)もう一つは Ki 67、最も有名な増殖マーカー12であります。代表的な方式を図 1に示します。
プロトコル
研究プロトコルは、制度見直し委員会の国立がんセンター、韓国 (NCCNCS-12-630) によって承認されました。
1. 試料 (30 分)
- (CCL 2、ATCC) の HeLa 細胞の文化、100 mm ディッシュで 10 mL 完全 DMEM 培地 (10% 牛胎児血清, 1% ペン-連鎖球菌) を使用します。HeLa 細胞の血清飢餓を準備するには、前研究11で説明するよう、ウシ胎児血清なし DMEM で合流の HeLa 細胞を 48 時間インキュベートします。
- セルをデタッチするには、2 mL リン酸緩衝生理食塩水 (PBS) で洗浄し、100 mm ディッシュあたり 2 mL 0.25 %edta トリプシンを追加します。その後、37 ° C で CO2インキュベーターで 2-3 分間インキュベートします。
- トリプシンを非アクティブ化する培養皿に完全 DMEM 培地 5 mL を追加し、剥離細胞を 15 mL チューブに転送します。その後、ペレットを形成する 10 分の 300 x g で細胞を遠心分離機します。
- 、上清を除去し、10 分間 300 × g で遠心分離によって 2 mL 冷 PBS で 2 回ペレットを洗ってください。
- 上清を除去した後細胞ペレットに 95% エタノール 1 mL を加えるし、ボルテックスによってエタノール細胞ペレットをミックスします。セル ブロック準備まで氷の上固定セルを保ちます。
2. セル ブロック準備 (1 時間 30 分)
- 凍結血漿の準備のため因数、健康なドナーの血液からの EDTA 血漿の収集し、13,000 x g で 10 分間遠心上清のプラズマを収集する因数 200 400 μ におよび microfuge の管します。使用するまで-80 ° c 因数を格納します。凍結血漿因数が準備ができたら、それらを取得し、5 分の 37 ° C で培養によるプラズマを解凍します。
- 10 分のための 700 x g で固定細胞を遠心分離し、上澄みを廃棄します。
- 2 滴 (約 200 μ L) とプラズマ、トロンボプラスチン、2 滴と 2 滴を 0.025 M 塩化カルシウムの細胞ペレットをミックスします。その後、ピペッティングでそれらをミックスします。
- 図 2 aに示すように、10 分間室温で細胞塊を形成する混合物を許可します。その後、注ぐと、ピペットで PBS を除去する 2 回 PBS のセル血栓を洗います。代表の白い細胞の塊を図 2 bに示します。
- ホルマリン、ろ紙の部分を湿らせ、事前に湿らせたろ紙を細胞の塊を包みます。図 2に示すように組織カセットにピンセットと凝血の混合物を配置します。
- ホルマリン固定のための 4 ° C で一晩緩衝ホルマリン (PBS で 10% ホルマリン) の 50 mL を含んでいるガラスの瓶に組織カセットの場所。
3. ティッシュの処理、パラフィン包埋 (一晩)
- ホルマリン固定細胞塊を含む組織カセットを読み込むティッシュ プロセッサで一晩11を前述のよう。ティッシュの処理は、水分除去とパラフィン埋め込む前に固定セルのエアコンです。研究組織を処理することがなく、処理手順を表 1に示すように、組織を実行します。
- (図 2 D) 溶融パラフィンにある金型そこに温水埋め込み駅と 60 分後にチェック入れます。
- 組織カセットから形成された細胞の塊を取るし、金型内で溶融パラフィンに配置。
- セルを含む金型に蓋のない新しい組織カセット溶融パラフィンの途中で凝固し、組織カセットと金型により溶融パラフィンを注ぐ場所です。そして、30 ~ 60 秒間冷たい板で固めるパラフィンをもらいます。
- 金型から組織カセットを区切ります。その後、パラフィン セル ブロックは各種の準備ができて。セルのパラフィン包埋ブロックの埋め込みセル血栓は、図 2Eの矢印によって示されます。
4. 各種 (1 h) のスライドの準備
- パラフィン セル ブロックのセル血栓のための領域を確認し、セル ブロックをミクロトームを使用して 3-4 μ m の厚さのスライスにカットします。図 2 fに示すように、ガラスのシラン コーティング スライドにパラフィン切片を置きます。
- 場所セクションはセクションのスライドに付着する 30 分の 37 ° C のオーブンでスライドします。
5. セル ブロック (6 h) の免疫細胞化学
注: 細胞セル ブロック セクションに染色、様々 なキットも使用できます (材料の表を参照してください)。すべてこのようなキットがある様々 な感度と特異性の変更に応じて。
- デ paraffinize に 4 分間、キシレンの 50 mL のセクションを孵化させなさい。
- 100% エタノールの脱水、2 分間で 2 回 95% エタノールと 2 分 80% エタノールでスライドを孵化させなさい。その後、10 分間流水でエタノールを削除します。
- 抗原検索のため瓶含む 40 mL トリス EDTA 検索バッファーの pH 9.0 では、スライドの配置し、30 分間鍋で沸騰させます。
- 洗浄は、流水の下で滑ると 4 ° c. で 10 分の 95% エタノールにそれらをインキュベートその後、簡単に識別のための Pap ペンをスライドに細胞染色領域をマークします。
- スライドを含む 0.2% 含有トリス緩衝生理食塩水で洗うトゥイーン 20 (TBS-T)、過酸化水素ブロックで孵化させなさいと (材料の表を参照してください)、残ペルオキシダーゼ活性を削除する 15 分の室温で。その後、TBS T 2 分の 3 倍にして、スライドを洗ってください。
- タンパク質のブロックの一次抗体を希釈して希釈した抗体溶液を準備 (材料の表を参照してください)。たとえば、一次抗体をすることができます CKAP2 希釈 1: 100、Ki 67 抗体レバレッジ。その後、1 h の希釈溶液 100 μ L のスライドを孵化させなさい。
- 5 回 2 分の TBS T で洗浄後暗闇の中で部屋の温度で 15 分はキットの一次抗体エンハンサーでスライドをインキュベートします。
- 4 回 2 分の TBS T で洗浄後 HRP ポリマー (と西洋ワサビペルオキシダーゼ標識二次抗体) の 2 滴を追加、スライド 30 分間室温で孵化させなさい。
- 5 回 2 分の TBS T で洗浄後、ジアミノベンジジン (軽打) 溶液 100 μ L を追加 (材料の表を参照)、3 分間スライドを孵化させなさいと。
- TBS T で 2 回洗浄後ヘマトキシリン液 (ヘマトキシリンの 100 μ L と 600 μ L の蒸留水の混合物) を 100 μ l 添加し、1 分のスライドを孵化させなさい。
- TBS T のスライドを一度洗浄した後脱水 2 分の 95% エタノールでインキュベートし、一度、95% エタノールに浸漬 2 回 100% エタノールに浸漬します。その後、5 分間のガラスの瓶に 40 mL キシレンのスライドを孵化させなさい。
- スライドがキシレンから乾燥、それぞれ coverslips をマウントします。
- 光顕微鏡を用いた染色パターンを観察します。
結果
ヘマトキシリンとエオシン染色スライド (図 3 a, B) セルのパラフィン包埋ブロックから、核のほとんどは、細胞の細胞質はそのままに、形態の保存が現在のプロトコル (優れていることを示唆しています。図 3 a)。免疫組織化学的染色で以前に報告された10として CKAP2 陽性だった観察、凝縮したクロマチン、有糸分裂紡錘体、細胞質 (図 4)。Ki 67 染色細胞核として期待される (図 4) 観察されました。だけ凝縮したクロマチン染色 CKAP2 と細胞分裂期細胞をした (図 4 a, Bの矢印を参照)。多くの CKAP2 陽性細胞は完全培地 (図 4 a) で孵化後に用意されていた非常に mitotic の HeLa 細胞で示されていた。比較では、血清飢餓 HeLa 細胞 (図 4 b) にほとんどの CKAP2 陽性細胞が 。高い細胞分裂の HeLa 細胞のほとんどが Ki 67 陽性 (図 4)。一方、血清飢餓 HeLa 細胞における Ki 67 陽性率は残った ~ 50% (図 4) と高かった。これらの結果は非常に匹敵する、以前レポート11、 CKAP2、Ki 67 よりも、がん細胞の増殖のマーカーをより信頼性の高いことを示唆しています。
不完全に準備されたセル ブロックで、細胞質から核を分離もあり、その結果、貧しい人々 の形態保存。冷蔵庫の固定セルの長いよりも一晩培養などの悪い結果が生じる。もう一つの重要な問題は、セルが優秀な形態にかかわらず、免疫細胞化学でよく汚れていないことです。この問題はセル血栓が小さい場合より頻繁に発生します。通常、染色強度は図 3 b; で示すように、正規細胞の塊が大きい、不規則な染色の可能性はきわめて低い。したがって、このプロトコルで我々 は大きな細胞塊を形成するためにプラズマ、トロンボプラスチン、塩化カルシウムのボリュームを増加しました。
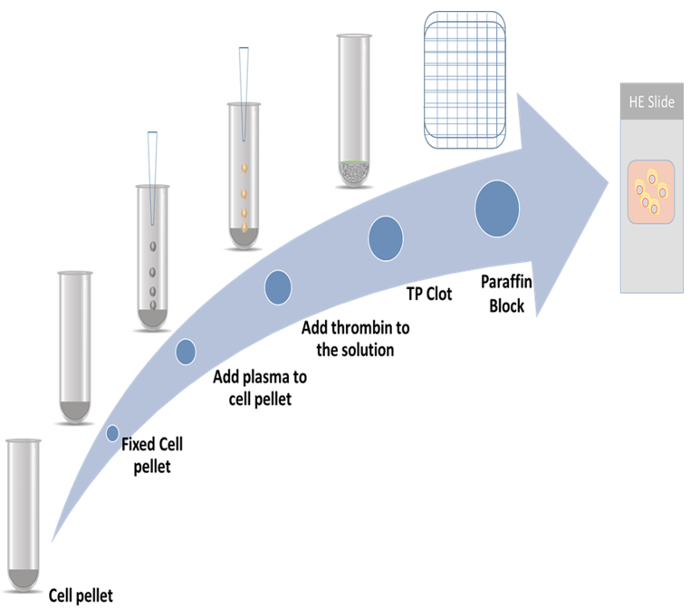
図 1: セル ブロック準備方式。この図の拡大版を表示するのにはここをクリックしてください。
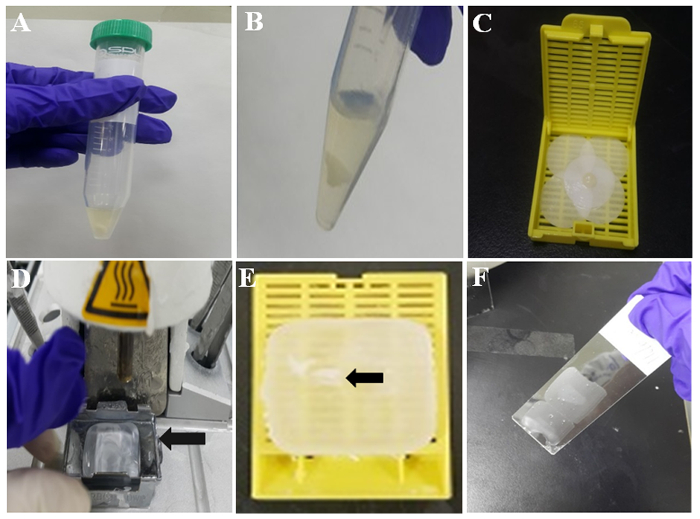
図 2: パラフィン セル ブロック準備の図。(管 A) トロンボプラスチン プラズマ細胞塊。(PBS 洗浄後 TP B) 細胞の塊。湿らせたろ紙上 (C) 細胞の塊。(溶融ワックス D) 組織埋め込み駅。金型 (矢印) は、凝固用溶融ワックスを保持しています。(E) パラフィン包埋細胞塊 (矢印) は、パラフィンまたはセルのパラフィン包埋ブロックに埋め込まれています。(F) 薄いパラフィン被覆スライドの中央部についてこの図の拡大版を表示するのにはここをクリックしてください。
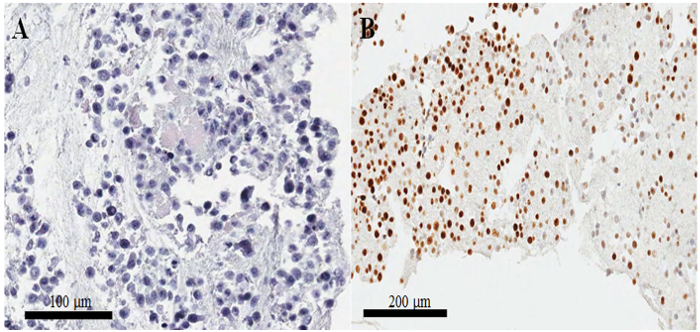
図 3: セル ブロック作製とヘマトキシリンとエオシン染色による品質確認します。(A) ヘマトキシリン--エオシン-染色セルブロック パラフィン埋め込まれたセクションの HeLa 細胞のイメージ。(セルブロック パラフィン埋め込まれたセクションを準備が不十分で各種 Ki 67 B) 不規則な染色します。スケール バーは、100 (A) と (B) 200 μ m です。この図の拡大版を表示するのにはここをクリックしてください。
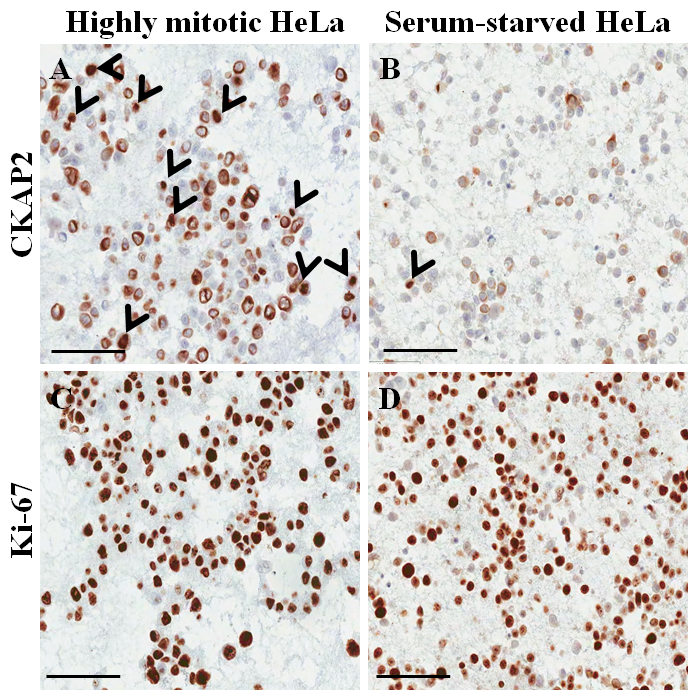
図 4: 免疫組織化学的染色 HeLa 細胞の細胞のパラフィン包埋ブロックします。(A) CKAP2 高分裂条件下で染色します。(B) CKAP2 血清飢餓条件下で染色します。(C) Ki 67 高分裂条件下で染色します。(D) Ki 67 血清飢餓条件下で染色します。100 μ m スケール バーが表示されます。矢印は、CKAP2 陽性細胞を示します。この図の拡大版を表示するのにはここをクリックしてください。
| プロシージャ | 手順 | ソリューション | 時間/温度 |
| 脱水症状 | 1 | 70% アルコール | 15 分/RT |
| 2 | 80% アルコール | 15 分/RT | |
| 3 | 95% アルコール | 15 分/RT | |
| 4 | 100% アルコール | 15 分/RT | |
| クリア | 1 | キシレン | 60 分/4 ° C |
| 2 | キシレン | 10 分/RT | |
| 3 | キシレン | 10 分/RT | |
| 4 | キシレン | 10 分/RT | |
| * RT、室内温度 |
表 1。組織の処理手順。
ディスカッション
固定細胞の免疫蛍光染色は現在形態情報1を維持しながら細胞におけるタンパク質発現量の定量のための選択の方法です。ただし、セルのパラフィン包埋ブロックの免疫細胞化学は優秀な代わりをすることができます。このプロトコルでセルのパラフィン包埋ブロックの試みとの準備のための詳細な手順が記載されているし、細胞研究のアプリケーションも容易に可能だと思います。
免疫細胞化学には、免疫蛍光染色にいくつかの利点があります。新鮮な培養細胞が必要ですが通常細胞の免疫蛍光染色、パラフィン セル ブロックはいくつかの年13の部屋の温度で保つことができます。さらに、セル ブロックで各種生体4日常的免疫組織化学で使用される同じ抗体を用いて細胞内発現パターンを探索できます。さらに、蛋白質のレベルや、事前培養細胞様々 な薬や様々 な文化の条件11の下で翻訳後修飾の変化を調べることができます。
免疫組織化学染色の利点と対照をなしてセルのパラフィン包埋ブロックの作成は時間がかかり、高価な14です。また、ほとんど研究所この手法で経験が不足して、このような状況の下で技術的なエラーが多い。最も一般的なエラーは、細胞形態の貧しい人々 の保存と貧しいまたは不規則な免疫パラフィン セル ブロック セクションに染色します。これらは、ほとんどの人は、最高のセル条件でセル ブロックを作ったり、細胞塊を形成する十分なソリューションを使用して回避できます。
現在のプロトコルの例として HeLa 細胞のセル ブロックを調製し、, 2 つの増殖マーカー、CKAP2 および以前に報告した11として、ki-67 の免疫細胞化学的染色を行った。各種、メディア牛胎児血清とのインキュベーション操られていた細胞と血清飢餓の影響はみられなかった。スライドあたり 4-5 μ m 厚のセル ブロック セクションのみを使用してセル ブロックから多くのスライドを用意できますので抗体の多数のこれらの準備されたパラフィン埋め込まれたセルのブロックを用いることができます。したがって、表現パターンの 2 つの条件に対応するは、いくつかの異なる抗体を評価できます。CKAP2 のパターンを染色と癌組織がすでにある Ki 67 報告9,10、11,12, 免疫組織化学染色の結果が簡単に評価される、ため、染色パターン免疫組織化学からのそれらにかなり類似していた。
結論としては、免疫染色パラフィン セルブロックの蛍光汚損; に優れた代替手段をすることができます。さらに、それ容易かつ確実に使用できますで形態情報を維持しながら細胞株における発現に関する基礎的研究。
開示事項
ないすべての著者は、利害の対立を宣言しています。
謝辞
この作品は、国立がんセンター、韓国 (1510121) と国立研究財団、韓国 (no から k. かに研究助成金によって支えられた.NRF-2015R1A2A2A04007432)。
資料
| Name | Company | Catalog Number | Comments |
| HeLa Cells | ATCC | HeLa (ATCC CCL-2) | |
| Ki-67 Antibody | Thermo Fisher Scientific | RM-9106-S1 | |
| Paraffin | Leica | 39601006 | |
| Xylene | Fisher SCientific | 1330-20-7,100-41-4 | |
| Ethenol | GD Chem | DJ16016 | |
| Hematoxylin | Agilent | 10118581 | |
| DAB Quanto Kit | Thermo Fisher Scientific | TA-125-QHDX, QHCX 170405 | |
| Ultravision LP detection Kit | Thermo Fisher Scientific | PBQ141209, LPB141209, LPH141210 | Kit for immunocytochemistry; contains protein block |
| TintoRetriever Pressure Cooker | Bio SB Corporation | BSB 7008 | |
| Tris-buffered saline | iNtRON Biotechnology | IBS-BT008 | |
| Tween 20 | USB Corporation | 115106 | |
| Thromboplastin | Neoplastin Cl Plus | NC0591432 | |
| Tris-EDTA retrival Buffer | Dignostic Biosystem | E625-A | |
| Trypsin EDTA | Thermo Fisher Scientific | 25200056 | |
| Fetal bovine serum (FBS) | Hyclone Laboratories Inc | SH30910.03 | |
| DMEM | Hyclone Laboratories Inc | SH30243.01 | |
| Antibiotic-Antimycotic, 100X | Thermo Fisher Scientific | 15240062 | |
| Ultra vision peroxide block H2O2 | Thermo Fisher Scientific | 02Q141212 | |
| Mounting Medium | Thermo Fisher Scientific | 363313 | |
| Pap-Pen | Vector Laboratories | H-4000 | |
| Filter Paper | GE Healthcare Life Sciences | 1001-0155 | |
| Calcium Chloride | Sigma-Aldrich | 21115-100ml | |
| Phosphate-buffered saline | PAA Laboratories | H21-002 | |
| Formalin | Daejung | 50-00-0 | |
| 15 ml tube | SPL Life Sciences | 50015 | |
| tissue processing cassette | Simport | M492-5 | |
| 100 mm culture dishes | BD Biosciences | 08-772E | |
| Glass Slide | Muto Pure Chemicals | 140712 | |
| Cover Glass | Marienfeld | 2262817 | |
| Glass Zar | Hyunil Lab-Mate | HIP-1027 | |
| Centrifuge | Eppendorf | 5810R | |
| Class II Laminar Flow Hood | Thermo Fisher Scientific | 1300 series A2 | |
| CO2 Incubator | Thermo Fisher Scientific | Series A2 | |
| Tissue Processor | Leica BioSystem | TP1020 | |
| Microtome | Thermo Fisher Scientific | HM340E | |
| Microscope | Olympus | CX-21 | |
| Paraffin embedding station | Thermo Fisher Scientific | EC 350-1, EC 350-2 | |
| Tissue Section Bath (Round) | CellPath | HCP-JAW-0100-00AEU | |
| Fume Hood | Hanyang Scientific Equipment Co. Ltd. | FH-150 |
参考文献
- Bhattacharyya, D., Hammond, A. T., Glick, B. S. High-quality immunofluorescence of cultured cells. Methods Mol Biol. 619, 403-410 (2010).
- Brown, C. M. Fluorescence microscopy - Avoiding the pit falls. J Cell Sci. 120, 1703-1705 (2007).
- Odell, I. D., Cook, D. Immunofluorescence Techniques. J Invest Dermatol. 133, e4 (2013).
- Kulkarni, M. B., Desai, S. B., Ajit, D., Chinoy, R. F. The utility of the thromboplastin-plasma cell-block technique for fine-needle aspiration and serous effusions. Diagn Cytopathol. 37 (2), 86-90 (2009).
- Shivakumarswamy, U., Arakeri, S. U., Karigowdar, M. H., Yelikar, B. Diagnostic utility of the cell block method versus the conventional smear study in pleural fluid cytology. J Cytol. 29 (1), 11-15 (2012).
- Nathan, N. A., Narayan, E., Smith, M. M., Horn, M. J. Cell block cytology: Improved preparation and its efficacy in diagnostic cytology. Am J Clin Pathol. 114 (4), 599-606 (2000).
- Keyhani-Rofagha, S., Vesey-Shecket, M. Diagnostic value, feasibility, and validity of preparing cell blocks from fluid-based gynecologic cytology specimens. Cancer. 96, 204-209 (2002).
- Young, N. A., Naryshkin, S., Katz, S. M. Diagnostic value of electron microscopy on paraffin-embedded cytologic material. Diagn Cytopathol. 9, 282-290 (1993).
- Jin, Y., Murakumo, Y., Ueno, K., Hashimoto, M., Watanabe, T., Shimoyama, Y., et al. Identification of a mouse cytoskeleton-associated protein, CKAP2, with microtubule-stabilizing properties. Cancer Sci. 95 (10), 815-821 (2004).
- Hong, K. U., Choi, Y. -. B., Lee, J. -. H., Kim, H. -. J., Kwon, H. -. R., Seong, Y. -. S., et al. Transient phosphorylation of tumor associated microtubule associated protein (TMAP)/cytoskeleton associated protein 2 (CKAP2) at Thr-596 during early phases of mitosis. Exp Mole Med. 40, 377-386 (2008).
- Sim, S. H., Bae, C. D., Kwon, Y., Hwang, H. -. L., Poojan, S., Hong, H. -. I., et al. CKAP2 (cytoskeleton-associated protein2) is a new prognostic marker in HER2-negative luminal type breast cancer. PLoS ONE. 12 (8), e0182107 (2017).
- Inwald, E. C., Klinkhammer-Schalke, M., Hofstadter, F., Zeman, F., Koller, M., Gerstenhauer, M., et al. Ki-67 is a prognostic parameter in breast cancer patients: results of a large population-based cohort of a cancer registry. Breast Cancer Res Treat. 139 (2), 539-552 (2013).
- Katikireddy, K. R., O'Sullivan, F. Immunohistochemical and immunofluorescence procedures for protein analysis. Methods Mol Biol. 784, 155-167 (2011).
- Beutner, E. H. Immunofluorescent staining: The fluorescent antibody method. Microbiol Mol Biol Rev. 25 (1), 49-76 (1961).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved