Method Article
Determinazione del livello di espressione della proteina in cellule coltivate di immunocitochimica su blocchi di paraffina celle
In questo articolo
Riepilogo
Attualmente, macchiatura immunofluorescente su celle fisse è il metodo di scelta per la determinazione dei livelli di espressione della proteina quando informazioni morfologiche sono anche necessari. Questo protocollo presentato qui fornisce un metodo alternativo di immunocitochimica su blocchi di paraffina delle cellule.
Abstract
Macchiatura immunofluorescente è attualmente il metodo di scelta per la determinazione dei livelli di espressione della proteina nei sistemi di coltura cellulare quando informazioni morfologiche sono anche necessari. Il protocollo di colorazione su blocchi di paraffina celle, presentati qui, immunocitochimica è un'ottima alternativa alla macchiatura immunofluorescente su celle fisse-paraffina-incastonato. In questo protocollo, un blocco di celle di paraffina da cellule HeLa è stato preparato utilizzando il metodo di tromboplastina-plasma e immunocitochimica è stata eseguita per la valutazione di due marcatori di proliferazione, CKAP2 e Ki-67. I nuclei e citoplasma morfologia delle cellule HeLa sono stati conservati bene nelle diapositive blocchetto delle cellule. Allo stesso tempo, il pattern di colorazione CKAP2 e Ki-67 nell'immunocitochimica erano abbastanza simili a quelle in immunoistochimica in tessuti di cancro di paraffina. Con condizioni di coltura delle cellule modificate, tra cui pre-incubazione delle cellule HeLa in condizioni privo di siero, l'effetto potrebbe essere valutato, preservando le informazioni dell'architettura. In conclusione, immunocitochimica su blocchi di paraffina celle è un'ottima alternativa alla macchiatura immunofluorescente.
Introduzione
Nella maggior parte dei laboratori, blocchi di paraffina celle non sono comunemente utilizzati. Piuttosto, fissa cellule coltivate, cellule non paraffina, sono impiegati negli studi di localizzazione subcellulare. Per quelli fissi cellule coltivate, è stato utilizzato fluorescenza invece di cromogeno. Di conseguenza, macchiatura immunofluorescente è attualmente il metodo di scelta per la determinazione dei livelli di espressione della proteina nella ricerca che impiegano cell culture1. Vetrini preparati per la macchiatura immunofluorescente, tuttavia, possono essere osservate solo nell'ambito di microscopia immunofluorescente, che potrebbe mostrare immagini abbastanza diverse da quelle indicate sotto aereo microscopia2. Inoltre, conservazione delle diapositive per la macchiatura immunofluorescente richiede protezione dalla luce brillante e segnali fluorescenti diventano più deboli con l'esposizione ripetuta per l'imaging a causa della perdita del segnale fluorescente3. Risultati da immunocitochimica su blocchi di paraffina celle sono molto simili a quelli di immunoistochimica su tessuti paraffina-incastonati4, ed essi possono essere facilmente tradotti in informazioni cliniche. Di conseguenza, immunocitochimica può essere un'ottima alternativa. Tuttavia, la preparazione del blocchetto delle cellule non è stato popolare in laboratori di ricerca di base. In questo protocollo, quindi, preparazione del blocchetto delle cellule e la macchiatura immunocytochemical sono disponibili per promuovere l'uso di questo metodo nel campo degli studi della coltura cellulare.
Immunocitochimica e preparazione del blocco di celle non sono metodi univoci, e sono già state applicate dalla diagnosi clinica alla ricerca di base4,5. Anche se la preparazione di blocco di celle vari metodi sono stati riportati4,6 tromboplastina-plasma metodo è semplice, economica e facilmente adattabile. Pertanto, nel protocollo presentato in questa carta, la tromboplastina-plasma metodo4,5,6,7,8 viene utilizzato per la preparazione di blocchi di celle di paraffina.
Nel presente studio, sono state dimostrate le procedure dettagliate per la preparazione di blocchi di celle di tromboplastina-plasma e il metodo di immunocitochimica impiegando due marcatori di proliferazione. Un marker è proteina citoscheletrica associata 2 (CKAP2), che recentemente è stata segnalata come un marcatore mitotica9,10,11; l'altro è Ki-67, che è il più noto di marcatore di proliferazione12. Lo schema rappresentativo è illustrato nella Figura 1.
Protocollo
Il protocollo di studio è stato approvato dal istituzionale Review Board della National Cancer Center, Corea (NCCNCS-12-630).
1. preparazione del campione (30 min)
- Per la coltura delle cellule HeLa (CCL-2, ATCC), è possibile utilizzare 10 mL liquido di DMEM completo (10% di siero fetale bovino, 1% penna-strep) in una piastra di coltura di 100 mm. Per preparare il siero-affamate cellule HeLa, incubare le cellule HeLa confluenti in DMEM senza siero bovino fetale per 48 ore, come descritto in un precedente studio11.
- Per staccare le cellule, lavarli con soluzione tampone fosfato (PBS) e 2 mL e aggiungere tripsina EDTA di 2 mL 0,25% per ogni piatto di cultura di 100 mm. Quindi, incubare per 2-3 min in incubatore a CO2 a 37 ° C.
- Aggiungere 5 mL di terreno DMEM completo di piastra di coltura per disattivare tripsina e trasferire le cellule indipendente per un tubo da 15 mL. Poi, centrifugare le cellule a 300 x g per 10 min formare una pallina.
- Rimuovere il surnatante e lavare la pallina due volte con 2 mL di PBS freddo mediante centrifugazione a 300 x g per 10 min.
- Dopo la rimozione del surnatante, aggiungere 1 mL di etanolo al 95% per il pellet cellulare e miscelare il pellet cellulare con etanolo nel Vortex. Mantenere le cellule fisse sul ghiaccio sino alla preparazione del blocchetto delle cellule.
2. cell-block preparazione (1h 30 min)
- Per la preparazione di plasma congelato aliquote, raccogliere plasma EDTA da sangue di donatore sano e centrifugare a 13.000 x g per 10 min. raccogliere il plasma surnatante aliquota 200-400 µ l ciascuna in microfuge tubes. Conservare le aliquote a-80 ° C fino all'utilizzo. Quando le aliquote di plasma congelato sono pronte, recuperarli e scongelare il plasma di incubazione a 37 ° C per 5 min.
- Centrifugare le cellule fisse a 700 x g per 10 min, poi scartare il surnatante.
- Miscelare il pellet cellulare con 2 gocce (circa 200 µ l) di plasma, 2 gocce di tromboplastina e 2 gocce di cloruro di calcio 0,025 M. Quindi, mescolare pipettando.
- Lasciare il composto formare un coagulo di cella a temperatura ambiente per 10 min, come mostrato nella Figura 2A. Poi, lavare il grumo di cellule con PBS due volte versando e rimuovendo PBS mediante pipetta. Il coagulo rappresentativo delle cellule bianche è mostrato nella Figura 2B.
- Inumidire un pezzo di carta da filtro con formalina e avvolgere il coagulo di cellulare con la carta da filtro pre-umidificata. Quindi, mettere il composto coagulato con un pincette in una cassetta di tessuto come mostrato in Figura 2.
- Posto la cassetta di tessuto in un vaso di vetro contenente 50 mL di formalina tamponata (formalina al 10% in PBS) durante la notte a 4 ° C per la fissazione in formalina.
3. tessuto lavorazione e inclusione in paraffina (una notte)
- La cassetta di tessuto contenente il coagulo di formalina cella di carico in un processatore di tessuti durante la notte come descritto in precedenza11. La lavorazione del tessuto è per la rimozione di acqua e condizionamento delle celle fisse prima dell'inclusione in paraffina. Per la ricerca senza lavorazione del tessuto, eseguire il procedura di lavorazione come indicato nella tabella 1del tessuto.
- Attivare il riscaldata incorporamento stazione e 60 minuti più tardi, controlla che non c'è paraffina fusa nello stampo metallo ivi (Figura 2D).
- Prendere il coagulo formato cella dal cassetto del tessuto e inserirlo nella paraffina fusa all'interno dello stampo in metallo.
- Posto la nuova cassetta di tessuto senza il coperchio in metallo stampo contenente la cella coagularsi in mezzo la paraffina fusa e versare più paraffina fusa nel cassetto del tessuto e su stampo in metallo. Quindi, lasciate che la paraffina solidificare nel piatto freddo per 30-60 secondi.
- Separare la cassetta di tessuto dallo stampo in metallo. Quindi, il blocco di cella di paraffina è pronto per immunocitochimica. Il coagulo di cella incorporata nel blocco paraffina cella è indicato dalla freccia nella Figura 2E.
4. preparazione dei vetrini per immunocitochimica (1h)
- Controllare l'area per il coagulo di cella nel blocchetto delle cellule di paraffina e tagliato a fette con spessori di 3-4 µm utilizzando un microtomo blocchetto delle cellule. Mettere le sezioni di paraffina sulle lastre di vetro rivestite con Silano, come mostrato nella Figura 2F.
- Porre i vetrini di sezione in un forno a 37 ° C per 30 min rendere le sezioni di aderire alle diapositive.
5. immunocitochimica di blocchi di celle (6h)
Nota: Per la colorazione su sezioni di blocco di celle di immunocitochimica, vari kit può essere utilizzato (Vedi Tabella materiali). Tutti questi kit hanno varie sensibilità e specificità a seconda delle loro modifiche.
- Incubare le sezioni in 50 mL di xilene per 4 min a-paraffinize.
- Incubare i vetrini in etanolo al 100% per 2 min per disidratazione e due volte in etanolo al 95% e 80% etanolo 2 min. Quindi, rimuovere l'etanolo in acqua corrente per 10 min.
- Per ricupero dell'antigene, porre i vetrini in un barattolo contenente 40 mL Tris-EDTA recupero tampone, pH 9.0 e far bollire in una pentola per 30 min.
- Lavare i vetrini in acqua corrente e li Incubare in etanolo al 95% per 10 min a 4 ° C. Quindi, segnare la zona di macchiatura delle cellule nelle diapositive con una penna di Pap per una facile identificazione.
- Lavare i vetrini in soluzione fisiologica tamponata contenente 0,2% Tween 20 (TBS-T) e incubare nel blocco di perossido di idrogeno (Vedi Tabella materiali) a temperatura ambiente per 15 minuti rimuovere qualsiasi residuo perossidasi attività. Quindi, lavare i vetrini in TBS-T tre volte per 2 minuti ciascuno.
- Preparare la soluzione di anticorpo diluito diluendo anticorpo primario nel blocco della proteina (Vedi Tabella materiali). Ad esempio, il CKAP2 anticorpo primario può essere diluito 1: 100 e l'anticorpo Ki-67 1: 500. Quindi, incubare i vetrini in 100 µ l di soluzione di anticorpo diluito per 1 h.
- Dopo il lavaggio in TBS-T cinque volte per 2 minuti ciascuno, incubare i vetrini nel rinforzatore di anticorpo primario nel kit per 15 min a temperatura ambiente al buio.
- Dopo il lavaggio in TBS-T quattro volte per 2 minuti ciascuno, aggiungere 2 gocce di polimero HRP (un anticorpo secondario marcato con perossidasi di rafano) e incubare i vetrini a temperatura ambiente per 30 min.
- Dopo il lavaggio in TBS-T cinque volte per 2 minuti ciascuno, aggiungere 100 µ l di soluzione diaminobenzidina (DAB) (Vedi Tabella materiali) e incubare i vetrini per 3 min.
- Dopo il lavaggio in TBS-T due volte, aggiungere 100 µ l di soluzione di ematossilina (la miscela di 100 µ l di ematossilina e 600 µ l di acqua distillata) e incubare i vetrini per 1 min.
- Dopo aver lavato le diapositive in TBS-T una volta, disidratare incubando in etanolo al 95% per 2 min, immersione in etanolo al 95% una volta, e fare un tuffo in etanolo 100% due volte. Quindi, incubare i vetrini in xilene 40 mL in un vaso di vetro per 5 min.
- Quando le diapositive sono asciutte da xilene, montare i vetrini coprioggetti rispettivi.
- Osservare il pattern di colorazione mediante microscopia chiara.
Risultati
In una diapositiva di hematoxylin-e-eosina-macchiate dal blocco di paraffina delle cellule (Figura 3AB), la maggior parte dei nuclei e citoplasma delle cellule sono intatte, suggerendo che la conservazione morfologica è eccellente con l'attuale protocollo ( Figura 3A). Nella macchiatura immunocytochemical, CKAP2 la macchiatura positiva è stata osservata in cromatina condensata, fuso mitotico e citoplasma (Figura 4), come precedentemente segnalato10. Ki-67 macchiatura è stata osservata nei nuclei delle cellule, come previsto (Figura 4). Solo le celle con CKAP2 colorazione in cromatina condensata (vedere le frecce in Figura 4AB) erano cellule mitotiche. Molte cellule CKAP2-positive sono state indicate nelle cellule HeLa altamente mitotiche che erano state preparate dopo un'incubazione in terreno completo (Figura 4A). In confronto, c'erano poche cellule CKAP2-positive nelle cellule HeLa siero-affamate (Figura 4B). La maggior parte delle cellule HeLa altamente mitotiche erano Ki-67 positivo (Figura 4). Confermarsi, il tasso di Ki-67-positive nelle cellule HeLa siero-affamate è rimasto alto come ~ 50% (Figura 4). Questi risultati sono abbastanza paragonabili a quelli di un precedente rapporto11, che suggerisce che il CKAP2 è un più affidabile indicatore di proliferazione in cellule di cancro che è Ki-67.
In blocchi di celle mal preparata, i nuclei sono separati dal citoplasma, e c'è anche, resultantly, povera conservazione morfologica. Più di pernottamento incubazione delle cellule fissate in frigorifero potrebbe causare tali scarsi risultati. Un altro problema importante è che le cellule non sono colorate bene da immunocitochimica, nonostante la morfologia eccellente. Questo problema si verifica più spesso quando il coagulo di cella è piccolo. In genere, l'intensità di colorazione è irregolare come illustrato in Figura 3B; ma quando il coagulo di cella è più grande, c'è molto meno probabilità di macchiatura irregolare. Pertanto, nel presente protocollo, abbiamo aumentato i volumi di plasma, cloruro di calcio e della tromboplastina al fine di formare un coagulo di grandi cellule.
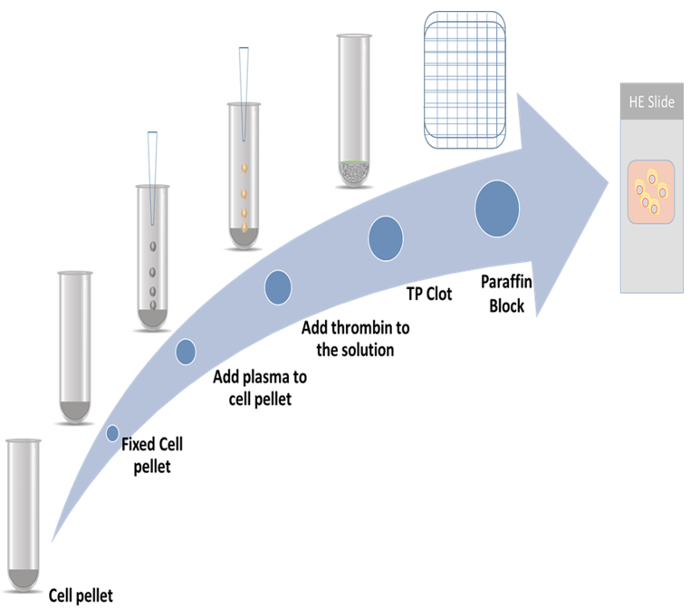
Figura 1: schema di preparazione Cell-block. Clicca qui per visualizzare una versione più grande di questa figura.
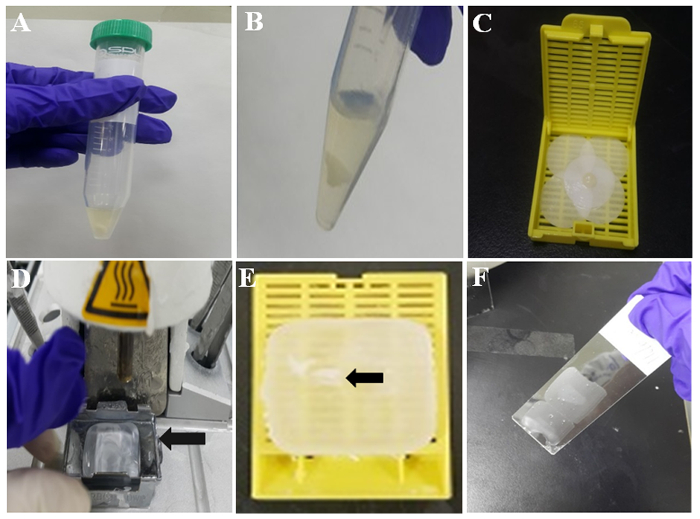
Figura 2: illustrazione di preparazione delle cellule-blocco di paraffina. (A) coagulo di cella della tromboplastina-plasma nel tubo. (B) coagulo di TP Cell dopo il lavaggio PBS. Coagulo di cella (C) su carta da filtro inumidito. (D) stazione inclusione di tessuti con cera fusa. Stampo in metallo (freccia) contiene cera fusa per solidificazione. (E) coagulo di cella paraffina-incastonati (freccia) incorporato in paraffina o paraffina celle del blocco. (F) sezione di paraffina sottile sulla parte centrale di una diapositiva rivestita. Clicca qui per visualizzare una versione più grande di questa figura.
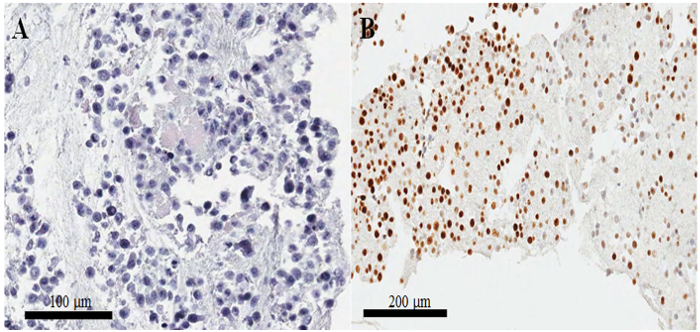
Figura 3: preparazione Cell-block e la conferma della qualità di ematossilina ed eosina e immunostaining. (A) hematoxylin-e-eosina-macchiate immagine delle cellule HeLa in una sezione di paraffina blocchetto delle cellule. (B) irregolare macchiatura di Ki-67 in immunocitochimica su un mal preparato paraffina cella-blocco sezione. Barre della scala sono (A) 100 e (B) 200 μm. Clicca qui per visualizzare una versione più grande di questa figura.
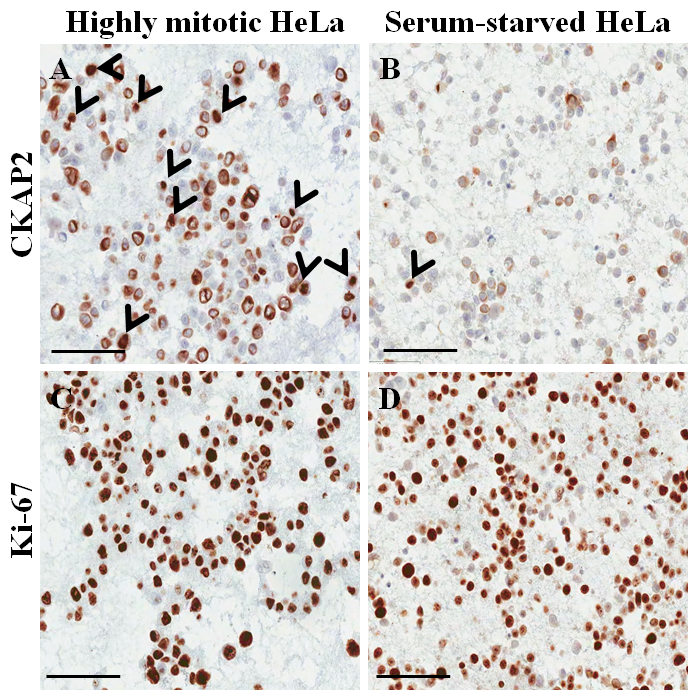
Figura 4: macchiatura Immunocytochemical sul blocchetto di paraffina cellule per cellule HeLa. (A) CKAP2 colorazione in condizioni altamente mitotiche. (B) CKAP2 colorazione in condizioni di siero-affamate. (C) Ki-67 che macchia in condizioni altamente mitotiche. (D) colorazione in condizioni di siero-affamate di Ki-67. Vengono visualizzate barre di scala 100 μm. Le frecce indicano le cellule CKAP2-positive. Clicca qui per visualizzare una versione più grande di questa figura.
| Procedura | Passaggi | Soluzione | Tempo/temperatura |
| Disidratazione | 1 | alcool al 70% | 15 min/RT |
| 2 | 80% di alcol | 15 min/RT | |
| 3 | alcol al 95% | 15 min/RT | |
| 4 | 100% di alcol | 15 min/RT | |
| Schiarimento | 1 | Xilene | 60 min/4 ° C |
| 2 | Xilene | 10 min/RT | |
| 3 | Xilene | 10 min/RT | |
| 4 | Xilene | 10 min/RT | |
| * RT, temperatura ambiente |
Tabella 1. Procedura di elaborazione del tessuto.
Discussione
Macchiatura immunofluorescente su cellule in coltura fisse è attualmente il metodo di scelta per la determinazione del livello di espressione della proteina in cellule mantenendo informazioni morfologiche1. Tuttavia, immunocitochimica su blocchi di paraffina delle cellule può essere un'ottima alternativa. Le procedure dettagliate per la preparazione di blocchi di celle di paraffina e immunocitochimica sono stati descritti nel presente protocollo, e speriamo che può facilitare l'applicazione di immunocitochimica in studi delle cellule.
Immunocitochimica presenta parecchi vantaggi sopra macchiatura immunofluorescente. Macchiatura immunofluorescente per cellule solitamente richiede celle appena colture, ma blocchi di celle di paraffina possono essere mantenuti a temperatura ambiente per diversi anni13. Inoltre, immunocitochimica su blocchi di celle possibile esplorare modelli di espressione intracellulare impiegando lo stesso anticorpo utilizzato in routine immunoistochimica su tessuti umani4. Inoltre, possono esplorare i cambiamenti nei livelli di proteina o modifiche di posttranslational sia pre-incubando le cellule con le varie droghe o sotto varie condizioni di cultura11.
In contrasto con i vantaggi di macchiatura immunocytochemical, la preparazione di blocchi di celle paraffina richiede tempo ed è costosa14. Inoltre, maggior parte dei laboratori di ricerca mancano di esperienza in questa tecnica, ed errori tecnici in tali circostanze sono comuni. Gli errori più comuni sono povera conservazione della morfologia delle cellule e colorazione sulle sezioni di blocco di paraffina cella di immunocitochimica scarsa o irregolare. Questi e molti altri utenti può essere evitati effettuando blocchi di celle sotto le migliori condizioni di cella e con soluzione abbastanza per formare coaguli di cella.
Come una dimostrazione del presente protocollo, blocchetti delle cellule sono state preparate per cellule HeLa e macchiatura immunocytochemical è stata effettuata per i due marcatori di proliferazione, CKAP2 e Ki-67, come precedentemente segnalato11. Per immunocitochimica, le cellule sono state manipolate tramite incubazione in media con e senza siero bovino fetale, e l'effetto di deprivazione di siero potrebbe essere osservato. Questi blocchi di celle di paraffina preparato possono essere impiegati per un gran numero di anticorpi, perché molte diapositive possono essere preparate da un blocco di celle utilizzando solo una sezione di blocco di celle µm di spessore di 4-5 per ogni diapositiva. Pertanto, i modelli di espressione corrispondente a due diverse condizioni possono essere valutati con diversi anticorpi differenti. Modelli di immunostaining per CKAP2 e Ki-67 nel carcinoma tessuti sono già stati segnalati9,10,11,12, e i risultati di macchiatura immunocytochemical potrebbe essere facilmente valutato, perché il pattern di colorazione erano abbastanza simili a quelli da immunohistochemistry.
In conclusione, immunocytochemical che macchia su blocchetti di paraffina delle cellule può essere un'ottima alternativa alla macchiatura immunofluorescente; Inoltre, esso può essere facilmente e in modo affidabile impiegato nella ricerca di base per l'espressione genica in linee cellulari mantenendo informazioni morfologiche.
Divulgazioni
Tutti gli autori non hanno dichiarato conflitti di interesse.
Riconoscimenti
Questo lavoro è stato supportato da borse di ricerca a K.-M.H. dal National Cancer Center, Korea (1510121) e National Research Foundation, Corea (no. NRF-2015R1A2A2A04007432).
Materiali
| Name | Company | Catalog Number | Comments |
| HeLa Cells | ATCC | HeLa (ATCC CCL-2) | |
| Ki-67 Antibody | Thermo Fisher Scientific | RM-9106-S1 | |
| Paraffin | Leica | 39601006 | |
| Xylene | Fisher SCientific | 1330-20-7,100-41-4 | |
| Ethenol | GD Chem | DJ16016 | |
| Hematoxylin | Agilent | 10118581 | |
| DAB Quanto Kit | Thermo Fisher Scientific | TA-125-QHDX, QHCX 170405 | |
| Ultravision LP detection Kit | Thermo Fisher Scientific | PBQ141209, LPB141209, LPH141210 | Kit for immunocytochemistry; contains protein block |
| TintoRetriever Pressure Cooker | Bio SB Corporation | BSB 7008 | |
| Tris-buffered saline | iNtRON Biotechnology | IBS-BT008 | |
| Tween 20 | USB Corporation | 115106 | |
| Thromboplastin | Neoplastin Cl Plus | NC0591432 | |
| Tris-EDTA retrival Buffer | Dignostic Biosystem | E625-A | |
| Trypsin EDTA | Thermo Fisher Scientific | 25200056 | |
| Fetal bovine serum (FBS) | Hyclone Laboratories Inc | SH30910.03 | |
| DMEM | Hyclone Laboratories Inc | SH30243.01 | |
| Antibiotic-Antimycotic, 100X | Thermo Fisher Scientific | 15240062 | |
| Ultra vision peroxide block H2O2 | Thermo Fisher Scientific | 02Q141212 | |
| Mounting Medium | Thermo Fisher Scientific | 363313 | |
| Pap-Pen | Vector Laboratories | H-4000 | |
| Filter Paper | GE Healthcare Life Sciences | 1001-0155 | |
| Calcium Chloride | Sigma-Aldrich | 21115-100ml | |
| Phosphate-buffered saline | PAA Laboratories | H21-002 | |
| Formalin | Daejung | 50-00-0 | |
| 15 ml tube | SPL Life Sciences | 50015 | |
| tissue processing cassette | Simport | M492-5 | |
| 100 mm culture dishes | BD Biosciences | 08-772E | |
| Glass Slide | Muto Pure Chemicals | 140712 | |
| Cover Glass | Marienfeld | 2262817 | |
| Glass Zar | Hyunil Lab-Mate | HIP-1027 | |
| Centrifuge | Eppendorf | 5810R | |
| Class II Laminar Flow Hood | Thermo Fisher Scientific | 1300 series A2 | |
| CO2 Incubator | Thermo Fisher Scientific | Series A2 | |
| Tissue Processor | Leica BioSystem | TP1020 | |
| Microtome | Thermo Fisher Scientific | HM340E | |
| Microscope | Olympus | CX-21 | |
| Paraffin embedding station | Thermo Fisher Scientific | EC 350-1, EC 350-2 | |
| Tissue Section Bath (Round) | CellPath | HCP-JAW-0100-00AEU | |
| Fume Hood | Hanyang Scientific Equipment Co. Ltd. | FH-150 |
Riferimenti
- Bhattacharyya, D., Hammond, A. T., Glick, B. S. High-quality immunofluorescence of cultured cells. Methods Mol Biol. 619, 403-410 (2010).
- Brown, C. M. Fluorescence microscopy - Avoiding the pit falls. J Cell Sci. 120, 1703-1705 (2007).
- Odell, I. D., Cook, D. Immunofluorescence Techniques. J Invest Dermatol. 133, e4 (2013).
- Kulkarni, M. B., Desai, S. B., Ajit, D., Chinoy, R. F. The utility of the thromboplastin-plasma cell-block technique for fine-needle aspiration and serous effusions. Diagn Cytopathol. 37 (2), 86-90 (2009).
- Shivakumarswamy, U., Arakeri, S. U., Karigowdar, M. H., Yelikar, B. Diagnostic utility of the cell block method versus the conventional smear study in pleural fluid cytology. J Cytol. 29 (1), 11-15 (2012).
- Nathan, N. A., Narayan, E., Smith, M. M., Horn, M. J. Cell block cytology: Improved preparation and its efficacy in diagnostic cytology. Am J Clin Pathol. 114 (4), 599-606 (2000).
- Keyhani-Rofagha, S., Vesey-Shecket, M. Diagnostic value, feasibility, and validity of preparing cell blocks from fluid-based gynecologic cytology specimens. Cancer. 96, 204-209 (2002).
- Young, N. A., Naryshkin, S., Katz, S. M. Diagnostic value of electron microscopy on paraffin-embedded cytologic material. Diagn Cytopathol. 9, 282-290 (1993).
- Jin, Y., Murakumo, Y., Ueno, K., Hashimoto, M., Watanabe, T., Shimoyama, Y., et al. Identification of a mouse cytoskeleton-associated protein, CKAP2, with microtubule-stabilizing properties. Cancer Sci. 95 (10), 815-821 (2004).
- Hong, K. U., Choi, Y. -. B., Lee, J. -. H., Kim, H. -. J., Kwon, H. -. R., Seong, Y. -. S., et al. Transient phosphorylation of tumor associated microtubule associated protein (TMAP)/cytoskeleton associated protein 2 (CKAP2) at Thr-596 during early phases of mitosis. Exp Mole Med. 40, 377-386 (2008).
- Sim, S. H., Bae, C. D., Kwon, Y., Hwang, H. -. L., Poojan, S., Hong, H. -. I., et al. CKAP2 (cytoskeleton-associated protein2) is a new prognostic marker in HER2-negative luminal type breast cancer. PLoS ONE. 12 (8), e0182107 (2017).
- Inwald, E. C., Klinkhammer-Schalke, M., Hofstadter, F., Zeman, F., Koller, M., Gerstenhauer, M., et al. Ki-67 is a prognostic parameter in breast cancer patients: results of a large population-based cohort of a cancer registry. Breast Cancer Res Treat. 139 (2), 539-552 (2013).
- Katikireddy, K. R., O'Sullivan, F. Immunohistochemical and immunofluorescence procedures for protein analysis. Methods Mol Biol. 784, 155-167 (2011).
- Beutner, E. H. Immunofluorescent staining: The fluorescent antibody method. Microbiol Mol Biol Rev. 25 (1), 49-76 (1961).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon