Method Article
Détermination du niveau d’Expression de protéine dans des cellules cultivées par immunocytochimie sur des blocs de paraffine cellulaire
Dans cet article
Résumé
Actuellement, l’immunofluorescence sur cellules fixes est la méthode de choix pour la détermination des niveaux d’expression de protéine lorsque l’information morphologique est également nécessaire. Ce protocole présenté ci-après fournit pour une méthode alternative d’immunocytochimie sur des blocs de paraffine cellulaire.
Résumé
Immunofluorescence est actuellement la méthode de choix pour la détermination des niveaux d’expression de protéine dans les systèmes de culture cellulaire lorsque l’information morphologique est également nécessaire. Le protocole d’immunocytochimiques coloration sur des blocs de paraffine cellulaire, présentées ici, est une excellente alternative à la coloration par immunofluorescence sur cellules fixes non-inclus en paraffine. Dans le présent protocole, un bloc de cellules de paraffine de cellules HeLa a été préparé à l’aide de la méthode de thromboplastine plasmatique et immunocytochimie a été réalisée pour l’évaluation de deux marqueurs de prolifération, CKAP2 et Ki-67. Les noyaux et la morphologie cytoplasmique des cellules HeLa ont été bien conservés dans les diapositives de la cellule-bloc. Dans le même temps, les colorations CKAP2 et Ki-67 dans l’immunocytochimie étaient assez semblables à celles d’immunohistochemical souillant en tissus cancéreux de paraffine. Avec des conditions de culture de cellules modifiées, y compris la pré-incubation des cellules HeLa dans des conditions sans sérum, l’effet pourrait être évalué tout en préservant l’architecture d’informations. En conclusion, immunocytochimie sur des blocs de paraffine cellulaire est une excellente alternative à la coloration par immunofluorescence.
Introduction
Dans la plupart des laboratoires, les blocs de paraffine de cellules ne sont pas couramment utilisés. Plutôt, fixe les cellules cultivées, les cellules non inclus en paraffine, travaillent dans les études de localisation subcellulaire. Pour ceux qui fixe les cellules cultivées, fluorescence au lieu de chromogène a été utilisé. Par conséquent, l’immunofluorescence est actuellement la méthode de choix pour la détermination des niveaux d’expression de protéine dans la recherche employant cell cultures1. Lames préparées pour immunofluorescence, toutefois, peuvent être observés qu’en microscopie par immunofluorescence, qui peut faire apparaître des images très différentes de celles indiquées sous plan microscopie2. En outre, préservation des diapositives pour immunofluorescence nécessite une protection contre la lumière vive et signaux fluorescents sont affaiblissent avec l’exposition répétée d’imagerie en raison de la perte du signal fluorescent3. Résultats d’immunocytochimie sur des blocs de paraffine cellulaire sont assez semblables à celles de l’immunohistochimie sur tissus inclus en paraffine4, et ils peuvent facilement être traduits dans des informations cliniques. Immunocytochimie peut donc s’avérer une excellente alternative. Cependant, préparation de bloc cellulaire a été pas populaire dans les laboratoires de recherche fondamentale. Dans ce protocole, puis, préparation de bloc cellulaire et immunocytochimiques coloration sont fournis pour promouvoir l’utilisation de cette méthode dans le domaine des études de culture cellulaire.
Immunocytochimie et préparation de bloc cellulaire ne sont pas des méthodes uniques, et ils ont déjà été appliqués entre le diagnostic clinique de recherche fondamentale4,5. Bien que la préparation de bloc cellulaire diverses méthodes ont été signalés à4,6 la thromboplastine plasmatique méthode est simple, rentable et facilement adaptable. Par conséquent, dans le protocole présenté dans cet article, la thromboplastine plasmatique méthode4,5,6,7,8 est utilisé pour la préparation des blocs de paraffine cellules.
Dans la présente étude, les procédures détaillées pour la préparation des blocs de cellules de thromboplastine plasmatique et la méthode immunocytochimie employant deux marqueurs de prolifération ont été démontrées. Un marqueur est protéine associée au cytosquelette 2 (CKAP2), qui a récemment été rapporté comme un marqueur mitotique9,10,11; l’autre est Ki-67, qui est le plus connu de marqueur de prolifération12. Le régime représentatif est illustré à la Figure 1.
Protocole
Le protocole de l’étude a été approuvé par les institutionnels Review Board de National Cancer Center, Corée (NCCNCS-12-630).
1. préparation (30 min)
- Pour la culture de cellules HeLa (CCL-2, ATCC), utiliser le milieu DMEM complet de 10 mL (sérum de veau fœtal 10 %, 1 % pen-strep) dans une boîte de Petri de 100 mm. Pour préparer les cellules HeLa privées de sérum, incuber les cellules HeLa confluentes en DMEM sans sérum de veau fœtal pendant 48 heures, tel que décrit dans une précédente étude11.
- Pour détacher les cellules, les laver avec une solution saline 2 mL tamponnée au phosphate (PBS) et ajouter 2 mL 0.25 % EDTA trypsine par boîte de Petri de 100 mm. Puis, incuber pendant 2-3 min dans un incubateur à CO2 à 37 ° C.
- Ajouter 5 mL de milieu DMEM complet à la boîte de Pétri pour désactiver la trypsine et transférer les cellules individuelles dans un tube de 15 mL. Puis, centrifuger les cellules à 300 g pendant 10 min former une boulette.
- Retirez le surnageant et laver le culot deux fois avec 2 mL de PBS froid par centrifugation à 300 x g pendant 10 min.
- Après élimination du surnageant, ajouter 1 mL d’éthanol à 95 % dans le culot cellulaire et mélanger le culot cellulaire avec de l’éthanol au vortex. Garder les cellules fixes sur la glace jusqu'à ce que la préparation du bloc cellulaire.
2. bloc cellulaire-préparation (1 h 30 min)
- Pour la préparation de plasma congelé aliquotes, recueillir le plasma EDTA du sang de donneur sain et centrifuger à 13 000 x g pendant 10 min. recueillir le plasma surnageant et aliquote 200-400 µL chaque microtubes tubes. Stocker les aliquotes à-80 ° C jusqu'à l’utilisation. Lorsque les aliquotes de plasma congelé sont prêts, les récupérer et dégelez le plasma en incubation à 37 ° C pendant 5 min.
- Centrifuger les cellules fixes à 700 x g pendant 10 min, puis jeter le surnageant.
- Mélanger le culot cellulaire avec 2 gouttes (environ 200 µL) du plasma, 2 gouttes de thromboplastine et 2 gouttes de chlorure de calcium 0,025 M. Ensuite, mélanger en pipettant également.
- Laissez le mélange former un caillot de la cellule à température ambiante pendant 10 min, comme illustré à la Figure 2 a. Puis, lavez le caillot de cellules avec du PBS deux fois en versant PBS en supprimant la pipette. Le caillot représentatif des globules blancs est illustré à la Figure 2 b.
- Humidifier un morceau de papier filtre avec formol et envelopper le caillot de la cellule avec le papier filtre humide. Ensuite, placez le mélange coagulé avec une pincette dans une cassette de tissu comme sur la Figure 2.
- Place de la cassette de tissu dans un bocal en verre contenant 50 mL de formol tamponné (10 % de formol dans du PBS) durant la nuit à 4 ° C pour la fixation au formol.
3. tissu traitement et intégration de paraffine (une nuit)
- Charger la cassette de tissu contenant le caillot de cellules fixés au formol dans un traitement de tissus du jour au lendemain comme décrit plus haut11. Le traitement de tissu est pour l’élimination de l’eau et le conditionnement des cellules fixées avant enrobage de paraffine. Recherche sans traitement des tissus, effectuez la procédure de traitement, tel qu’illustré dans le tableau 1les tissus.
- Activer la vérification chauffée encastrement station et à 60 minutes plus tard, qu’il y a des paraffine fondue dans le moule de métal qui y sont (Figure 2D).
- Prenons le caillot de la cellule formée de la cassette de tissu et placez-le dans la paraffine fondue dans le moule métallique.
- Place la nouvelle cassette de tissu sans le couvercle dans le moule métallique contenant la cellule se coaguler dans le milieu de la paraffine fondue et verser plus de paraffine fondue dans la cassette de tissu et sur le moule métallique. Alors, laissez la paraffine se solidifier dans la plaque froide pendant 30 à 60 secondes.
- Séparer la cassette de tissu du moule métallique. Ensuite, le bloc de paraffine cellulaire est prêt pour l’immunocytochimie. Le caillot de cellule intégrée dans le bloc cellulaire de paraffine est indiqué par la flèche sur la Figure 2E.
4. préparation des lames pour l’immunocytochimie (1 h)
- Vérifiez l’endroit pour le caillot de cellules dans le bloc cellulaire de paraffine et couper le bloc cellulaire en tranches avec une épaisseur de 3-4 µm à l’aide d’un microtome. Mettre les sections de paraffine sur lames de verre silane, comme illustré à la Figure 2F.
- Déposer les lames de section dans un four à 37 ° C pendant 30 min à faire les sections adhèrent aux diapositives.
5. immunocytochimique de blocs de cellules (6 h)
Remarque : Pour immunocytochimiques coloration sur des sections de bloc cellulaire, divers kits peuvent être utilisés (voir Table des matières). Tous ces kits ont différentes sensibilités et spécificités selon leurs modifications.
- Incuber les sections dans 50 mL de xylène pendant 4 min à la paraffinize.
- Incuber les lames dans l’éthanol à 100 % pendant 2 min pour déshydratation et deux fois dans l’éthanol à 95 % et dans l’éthanol à 80 % pendant 2 min. Puis, retirez l’éthanol dans l’eau pendant 10 min.
- Pour une recherche d’antigène, déposer les lames dans un bocal contenant 40 mL Tris-EDTA récupération tampon pH 9.0 et faire bouillir dans une cocotte pendant 30 min.
- Laver les lames sous l’eau courante et les incuber dans l’éthanol à 95 % pendant 10 min à 4 ° C. Puis, délimiter la zone de coloration cellulaire sur les diapositives avec un stylo de Pap pour une identification facile.
- Laver les lames dans une solution saline tamponnée Tris contenant 0,2 % Tween 20 (SCT-T) et incuber dans le bloc de peroxyde d’hydrogène (voir Table des matières) à température ambiante pendant 15 min enlever toute l’activité peroxydasique vestige. Ensuite, laver les diapositives dans TBS-T trois fois pendant 2 min de chaque.
- Préparer la solution d’anticorps dilué en diluant l’anticorps primaire dans le bloc de protéine (voir la Table des matières). Par exemple, le CKAP2 anticorps primaire peut être dilué au 1/100 et l’anticorps de Ki-67 1/500. Puis, incuber les lames dans 100 µL de solution d’anticorps dilué pendant 1 h.
- Apres le lavage du SCT-T cinq fois pendant 2 min chacun, incuber les lames dans l’amplificateur de l’anticorps primaire dans le kit pour 15 min à température ambiante dans l’obscurité.
- Après le lavage du SCT-t quatre fois pendant 2 min de chaque, ajouter 2 gouttes de polymère HRP (un anticorps secondaire marqué à la peroxydase de raifort) et incuber les lames à température ambiante pendant 30 min.
- Apres le lavage du SCT-T cinq fois pendant 2 min chacun, ajouter 100 µL de solution de la diaminobenzidine (DAB) (voir la Table des matières) et incuber les lames pendant 3 min.
- Après le lavage du SCT-t deux fois, ajouter 100 µL de solution de l’hématoxyline (le mélange de 100 µL de l’hématoxyline et 600 µL d’eau distillée) et incuber les lames pendant 1 min.
- Après avoir lavé les diapositives dans TBS-T une fois, déshydrater par incubation dans l’éthanol à 95 % pendant 2 min, trempant dans l’éthanol à 95 % une fois et trempage dans de l’éthanol 100 % deux fois. Puis, incuber les lames dans le xylène 40 mL dans une fiole en verre pendant 5 min.
- Lorsque les lames sont sèches de xylène, monter les lamelles respectifs.
- Observer les colorations au microscope photonique.
Résultats
Dans une diapositive hématoxyline et-éosine-colorés depuis le bloc de paraffine cellulaire (Figure 3 aB), la plupart des noyaux et du cytoplasme des cellules sont intacts, ce qui suggère que la préservation morphologique est excellente avec l’actuel (protocole Figure 3 a). La coloration immunocytochimique, CKAP2 une coloration positive a été observée dans la chromatine condensée, fuseau mitotique et cytoplasme (Figure 4), comme indiqué précédemment10. Coloration de Ki-67 a été observée dans les noyaux des cellules, comme prévu (Figure 4). Seules les cellules avec CKAP2 coloration dans la chromatine condensée (voir les flèches de la Figure 4 aB) sont des cellules mitotiques. Nombreuses cellules CKAP2-positives ont été montrées dans les cellules HeLa hautement mitotiques qui avaient été établis après une incubation en milieu complet (Figure 4 a). En comparaison, il y avait peu de cellules CKAP2-positif dans les cellules HeLa manquent de sérum (Figure 4 b). Ki-67 la plupart des cellules HeLa hautement mitotiques étaient positifs (Figure 4). Par contraste, le taux de Ki-67-positifs dans les cellules HeLa manquent de sérum est restée élevé à ~ 50 % (Figure 4). Ces résultats sont tout à fait comparables à ceux d’un précédent rapport11, qui donne à penser que le CKAP2 est un marqueur de prolifération plus fiable dans les cellules cancéreuses qu’est Ki-67.
Dans les blocs de cellules mal préparée, les noyaux sont séparés du cytoplasme, et il y a aussi, comme résultat, mauvaise conservation morphologique. Plus-que-toute la nuit l’incubation des cellules fixes dans un réfrigérateur peut provoquer ces mauvais résultats. Un autre problème important est que les cellules ne sont pas souillées par immunocytochimie, malgré l’excellente morphologie. Ce problème surgit plus souvent lorsque le caillot de la cellule est petit. En règle générale, l’intensité de la coloration est irrégulière, comme illustré à la Figure 3 b; mais lorsque le caillot de cellules est plus grand, il y a beaucoup moins de risques de taches irrégulières. Par conséquent, dans ce protocole, nous avons augmenté les volumes de plasma, de thromboplastine et chlorure de calcium pour former un caillot de grandes cellules.
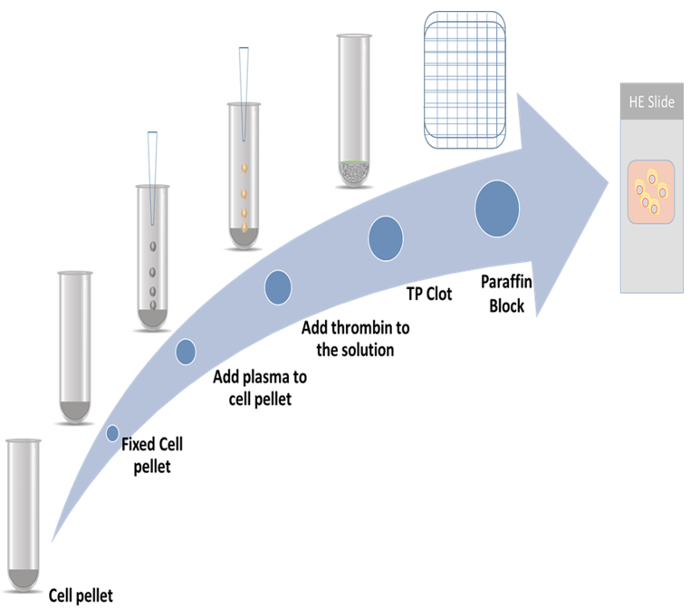
Figure 1 : schéma de préparation bloc cellulaire. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
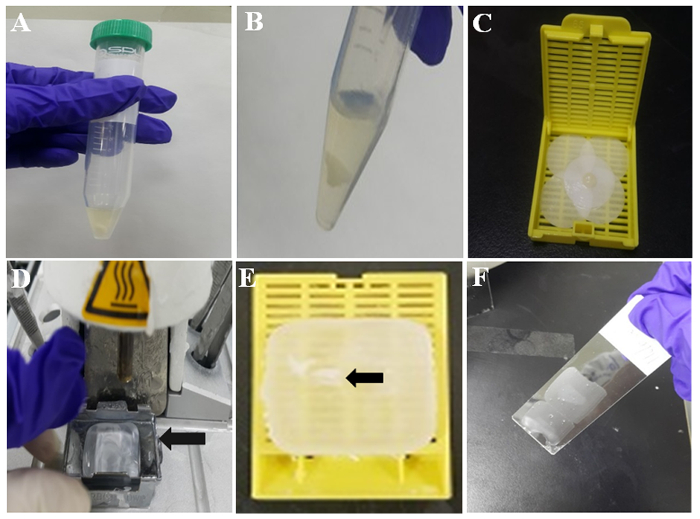
Figure 2 : Illustration de la préparation de cellules-bloc de paraffine. (A) caillot de cellule de thromboplastine plasmatique dans le tube. B caillot de cellules TP après lavage de PBS. Caillot de cellules (C) sur un papier filtre humide. D station enrobage tissu avec de la cire fondue. Moule métallique (flèche) est titulaire de cire fondue pour la solidification. E caillot (flèche) de la cellule paraffine noyés dans la paraffine ou bloc cellulaire de paraffine. (F) section de paraffine mince sur la partie centrale d’une glissière enduite. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
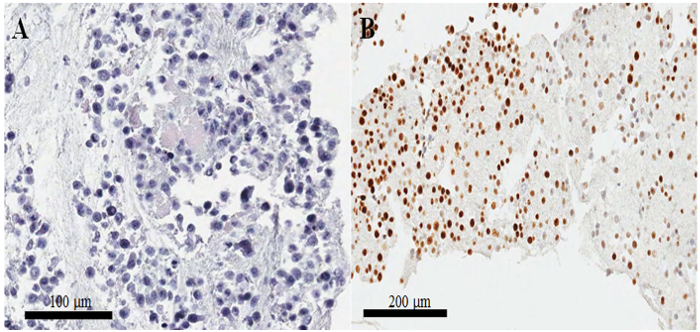
Figure 3 : préparation du bloc cellulaire et confirmation de la qualité par l’hématoxyline et éosine et immunostaining. (A) image l’hématoxyline et-éosine-coloration des cellules HeLa dans une section de la cellule-bloc de paraffine. (B) coloration irréguliers de Ki-67 en immunocytochimie sur un mal préparé section cellule-bloc de paraffine. Barreaux de l’échelle est (A) 100 et (B) 200 μm. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
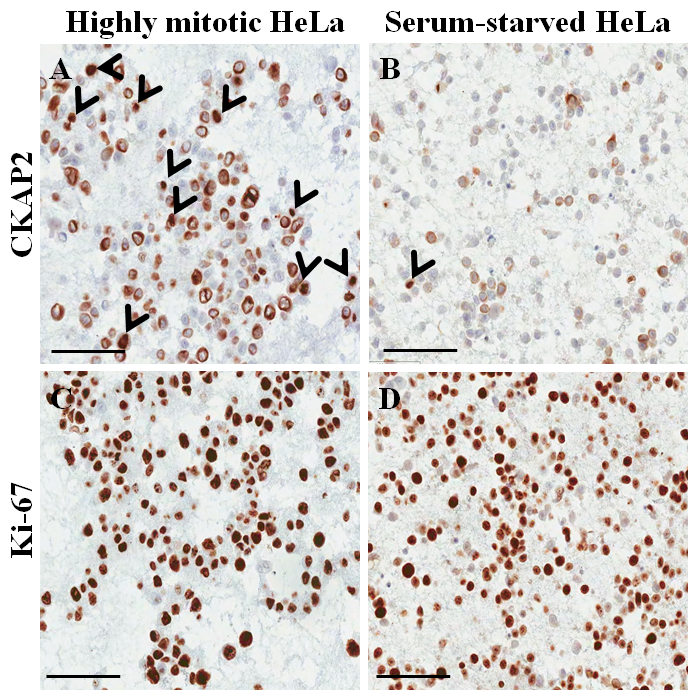
Figure 4 : immunocytochimiques coloration sur bloc de paraffine de cellule pour les cellules HeLa. (A) CKAP2 coloration dans des conditions hautement mitotiques. (B) CKAP2 coloration sous conditions manquent de sérum. (C) Ki-67 coloration dans des conditions hautement mitotiques. (D) Ki-67 coloration sous conditions manquent de sérum. 100 μm échelle barres s’affichent. Les flèches indiquent des cellules positives CKAP2. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| Procédure | Mesures | Solution | Temps/température |
| Déshydratation | 1 | alcool à 70 % | 15 min/RT |
| 2 | 80 % alcool | 15 min/RT | |
| 3 | 95 % d’alcool | 15 min/RT | |
| 4 | 100 % alcool | 15 min/RT | |
| Clairière | 1 | Xylène | 60 min/4 ° C |
| 2 | Xylène | 10 min/RT | |
| 3 | Xylène | 10 min/RT | |
| 4 | Xylène | 10 min/RT | |
| * RT, température ambiante |
Le tableau 1. Procédure de traitement des tissus.
Discussion
La coloration par immunofluorescence sur des cellules cultivées fixes est actuellement la méthode de choix pour la détermination du niveau d’expression de protéine dans les cellules tout en préservant l’information morphologique1. Cependant, l’immunocytochimie sur des blocs de paraffine cellule peut être une excellente alternative. Les procédures détaillées pour la préparation des blocs de paraffine cellules et immunocytochimie ont été décrits dans le présent protocole, et nous espérons qu'elle peut faciliter l’application de l’immunocytochimie en études de cellules.
Immunocytochimie a plusieurs avantages par rapport à la coloration par immunofluorescence. Immunofluorescence pour cellules généralement nécessite des cellules fraîchement cultivées, mais des blocs de paraffine cellule peuvent être conservés à température ambiante pendant plusieurs années13. En outre, immunocytochimie sur blocs cellulaires peut explorer des modèles d’expression intracellulaire en employant le même anticorps utilisé en routine immunohistochimie sur des tissus humains4. En outre, il peut explorer les changements dans les concentrations de protéines ou de modifications post-traductionnelles soit en incubant les cellules avec divers médicaments ou sous divers culture conditions11.
Par contraste avec les avantages de la coloration immunocytochimique, la préparation des blocs de paraffine cellule prend du temps et est coûteux14. Aussi, la plupart des laboratoires de recherche manquent d’expérience dans cette technique, et des erreurs techniques dans de telles circonstances sont communs. Erreurs les plus courantes sont immunocytochimiques faible ou irrégulier une coloration sur les sections de bloc de cellule de paraffine et la mauvaise conservation de la morphologie cellulaire. Ces et la plupart des autres peuvent être évités par la fabrication de blocs de cellules dans les meilleures conditions de cellule et d’utilisation suffisamment de solution pour former des caillots de la cellule.
Comme une manifestation du présent protocole, blocs cellulaires ont été préparés pour les cellules HeLa, et coloration immunocytochimiques a été réalisée pour deux marqueurs de prolifération, CKAP2 et Ki-67, comme indiqué précédemment11. Pour l’immunocytochimie, les cellules ont été manipulées par une incubation dans des milieux avec et sans sérum de veau fœtal et l’effet de la privation de sérum pourrait être observée. Ces blocs de cellules de paraffine préparés peuvent être utilisés pour un grand nombre d’anticorps, car de nombreuses diapositives peuvent être préparés dans un bloc de cellules en utilisant seulement une section de µm d’épaisseur cellulaire-bloc de 4-5 par diapositive. Par conséquent, les profils d’expression correspondant à deux conditions différentes peuvent être évaluées avec plusieurs types d’anticorps. L’immunomarquage de profils de CKAP2 et Ki-67 dans le cancer de tissus ont déjà été signalées9,10,11,12, et l’immunocytochimiques résultats de coloration ont pu être facilement évalués, car la colorations sont très semblables à ceux de l’immunohistochimie.
En conclusion, immunocytochimiques coloration sur des blocs de paraffine cellule peut être une excellente alternative à la coloration par immunofluorescence ; en outre, il peut être facilement et sûrement utilisé dans la recherche fondamentale pour le profilage de l’expression dans les lignées cellulaires tout en préservant l’information morphologique.
Déclarations de divulgation
Tous les auteurs n’ont déclaré aucun conflit d’intérêt.
Remerciements
Ce travail a été soutenu par subventions de recherche à K.-M.H. de National Cancer Center, Corée (1510121) et de National Research Foundation, Corée (no. NRF-2015R1A2A2A04007432).
matériels
| Name | Company | Catalog Number | Comments |
| HeLa Cells | ATCC | HeLa (ATCC CCL-2) | |
| Ki-67 Antibody | Thermo Fisher Scientific | RM-9106-S1 | |
| Paraffin | Leica | 39601006 | |
| Xylene | Fisher SCientific | 1330-20-7,100-41-4 | |
| Ethenol | GD Chem | DJ16016 | |
| Hematoxylin | Agilent | 10118581 | |
| DAB Quanto Kit | Thermo Fisher Scientific | TA-125-QHDX, QHCX 170405 | |
| Ultravision LP detection Kit | Thermo Fisher Scientific | PBQ141209, LPB141209, LPH141210 | Kit for immunocytochemistry; contains protein block |
| TintoRetriever Pressure Cooker | Bio SB Corporation | BSB 7008 | |
| Tris-buffered saline | iNtRON Biotechnology | IBS-BT008 | |
| Tween 20 | USB Corporation | 115106 | |
| Thromboplastin | Neoplastin Cl Plus | NC0591432 | |
| Tris-EDTA retrival Buffer | Dignostic Biosystem | E625-A | |
| Trypsin EDTA | Thermo Fisher Scientific | 25200056 | |
| Fetal bovine serum (FBS) | Hyclone Laboratories Inc | SH30910.03 | |
| DMEM | Hyclone Laboratories Inc | SH30243.01 | |
| Antibiotic-Antimycotic, 100X | Thermo Fisher Scientific | 15240062 | |
| Ultra vision peroxide block H2O2 | Thermo Fisher Scientific | 02Q141212 | |
| Mounting Medium | Thermo Fisher Scientific | 363313 | |
| Pap-Pen | Vector Laboratories | H-4000 | |
| Filter Paper | GE Healthcare Life Sciences | 1001-0155 | |
| Calcium Chloride | Sigma-Aldrich | 21115-100ml | |
| Phosphate-buffered saline | PAA Laboratories | H21-002 | |
| Formalin | Daejung | 50-00-0 | |
| 15 ml tube | SPL Life Sciences | 50015 | |
| tissue processing cassette | Simport | M492-5 | |
| 100 mm culture dishes | BD Biosciences | 08-772E | |
| Glass Slide | Muto Pure Chemicals | 140712 | |
| Cover Glass | Marienfeld | 2262817 | |
| Glass Zar | Hyunil Lab-Mate | HIP-1027 | |
| Centrifuge | Eppendorf | 5810R | |
| Class II Laminar Flow Hood | Thermo Fisher Scientific | 1300 series A2 | |
| CO2 Incubator | Thermo Fisher Scientific | Series A2 | |
| Tissue Processor | Leica BioSystem | TP1020 | |
| Microtome | Thermo Fisher Scientific | HM340E | |
| Microscope | Olympus | CX-21 | |
| Paraffin embedding station | Thermo Fisher Scientific | EC 350-1, EC 350-2 | |
| Tissue Section Bath (Round) | CellPath | HCP-JAW-0100-00AEU | |
| Fume Hood | Hanyang Scientific Equipment Co. Ltd. | FH-150 |
Références
- Bhattacharyya, D., Hammond, A. T., Glick, B. S. High-quality immunofluorescence of cultured cells. Methods Mol Biol. 619, 403-410 (2010).
- Brown, C. M. Fluorescence microscopy - Avoiding the pit falls. J Cell Sci. 120, 1703-1705 (2007).
- Odell, I. D., Cook, D. Immunofluorescence Techniques. J Invest Dermatol. 133, e4 (2013).
- Kulkarni, M. B., Desai, S. B., Ajit, D., Chinoy, R. F. The utility of the thromboplastin-plasma cell-block technique for fine-needle aspiration and serous effusions. Diagn Cytopathol. 37 (2), 86-90 (2009).
- Shivakumarswamy, U., Arakeri, S. U., Karigowdar, M. H., Yelikar, B. Diagnostic utility of the cell block method versus the conventional smear study in pleural fluid cytology. J Cytol. 29 (1), 11-15 (2012).
- Nathan, N. A., Narayan, E., Smith, M. M., Horn, M. J. Cell block cytology: Improved preparation and its efficacy in diagnostic cytology. Am J Clin Pathol. 114 (4), 599-606 (2000).
- Keyhani-Rofagha, S., Vesey-Shecket, M. Diagnostic value, feasibility, and validity of preparing cell blocks from fluid-based gynecologic cytology specimens. Cancer. 96, 204-209 (2002).
- Young, N. A., Naryshkin, S., Katz, S. M. Diagnostic value of electron microscopy on paraffin-embedded cytologic material. Diagn Cytopathol. 9, 282-290 (1993).
- Jin, Y., Murakumo, Y., Ueno, K., Hashimoto, M., Watanabe, T., Shimoyama, Y., et al. Identification of a mouse cytoskeleton-associated protein, CKAP2, with microtubule-stabilizing properties. Cancer Sci. 95 (10), 815-821 (2004).
- Hong, K. U., Choi, Y. -. B., Lee, J. -. H., Kim, H. -. J., Kwon, H. -. R., Seong, Y. -. S., et al. Transient phosphorylation of tumor associated microtubule associated protein (TMAP)/cytoskeleton associated protein 2 (CKAP2) at Thr-596 during early phases of mitosis. Exp Mole Med. 40, 377-386 (2008).
- Sim, S. H., Bae, C. D., Kwon, Y., Hwang, H. -. L., Poojan, S., Hong, H. -. I., et al. CKAP2 (cytoskeleton-associated protein2) is a new prognostic marker in HER2-negative luminal type breast cancer. PLoS ONE. 12 (8), e0182107 (2017).
- Inwald, E. C., Klinkhammer-Schalke, M., Hofstadter, F., Zeman, F., Koller, M., Gerstenhauer, M., et al. Ki-67 is a prognostic parameter in breast cancer patients: results of a large population-based cohort of a cancer registry. Breast Cancer Res Treat. 139 (2), 539-552 (2013).
- Katikireddy, K. R., O'Sullivan, F. Immunohistochemical and immunofluorescence procedures for protein analysis. Methods Mol Biol. 784, 155-167 (2011).
- Beutner, E. H. Immunofluorescent staining: The fluorescent antibody method. Microbiol Mol Biol Rev. 25 (1), 49-76 (1961).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon