Method Article
Immunocytochemistry 파라핀 끼워 넣어진 셀 블록에 의해 경작된 한 세포에 단백질 표정 수준 결정
요약
현재, 고정된 셀에 immunofluorescent 얼룩 때 단백질 식 레벨의 결정에 대 한 선택의 방법 형태학 정보도 필요 하다. 여기에 소개이 프로토콜 파라핀 끼워 넣어진 셀 블록에 immunocytochemistry의 다른 방법을 제공 합니다.
초록
Immunofluorescent 얼룩 때 현재 단백질 표정 수준 결정에 대 한 선택의 방법 세포 배양 시스템에 형태학 정보도 필요 하다. Immunocytochemical 파라핀 끼워 넣어진 셀 블록, 여기 제시에 얼룩의 프로토콜 파라핀 포함 된 고정된 셀에 immunofluorescent 얼룩에 우수한 대안 이다. 이 프로토콜에서 HeLa 세포에서 파라핀 셀 블록 thromboplastin 플라즈마 메서드를 사용 하 여 준비 하 고 immunocytochemistry 두 확산 마커, CKAP2 및 기-67의 평가 위해 수행 되었다. 핵 및 HeLa 세포의 세포질 형태학 셀 블록 슬라이드에서 잘 보존 했다. 같은 시간에는 immunocytochemistry에서 CKAP2와 기-67 얼룩 패턴 immunohistochemical 파라핀 암 조직에 얼룩에 아주 유사 했다. 혈 청 무료 조건 HeLa 세포의 사전 부 화를 포함 하 여 수정된 세포-배양 조건, 효과 아키텍처 정보를 유지 하면서 평가 수 있습니다. 결론적으로, 파라핀 끼워 넣어진 셀 블록에 immunocytochemistry immunofluorescent 얼룩에 우수한 대안 이다.
서문
대부분 실험실에서 파라핀 끼워 넣어진 셀 블록 하지 일반적으로 사용 됩니다. 오히려, 배양된 세포를 고정, 파라핀 포함 되지 셀 subcellular 지 방화 연구에서 채택 된다. 그 배양된 세포를 고정, 형광 chromogen 대신 사용 되었습니다. 따라서, immunofluorescent 얼룩 현재 셀 문화1을 채용 하는 연구에서 단백질 식 레벨의 결정에 대 한 선택의 방법입니다. 그러나 슬라이드, immunofluorescent 얼룩이 지기에 대 한 준비는, 비행기 현미경2아래 표시 된 아주 다른 이미지를 표시할 수 있습니다 immunofluorescent 현미경 검사 법에만 관찰할 수 있습니다. 또한, immunofluorescent 얼룩에 대 한 슬라이드의 보존 밝은 빛 으로부터 보호를 요구 하 고 형광 신호 약한 이미징 형광 신호3의 손실로 인해 반복 노출 되. 파라핀 끼워 넣어진 셀 블록에 immunocytochemistry의 결과 매우 비슷합니다 immunohistochemistry 파라핀 끼워 넣어진 조직4에서 그리고 그들은 쉽게 임상 정보로 번역 될 수 있다. 따라서, immunocytochemistry는 우수한 대안을 수 있습니다. 그러나, 셀 블록 준비 되지 않았습니다 인기 기초 연구 실험실에서. 이 프로토콜에서 다음, 셀 블록 준비 및 immunocytochemical 얼룩 제공 됩니다 셀-문화 연구의 분야에서이 방법의 사용을 촉진.
셀 블록 준비 및 immunocytochemistry는 독특한 방법, 하지 그리고 그들은 이미 기본 연구4,5임상 진단에서 적용 된. 다양 한 셀 블록 준비 방법 되었습니다 보고4,, 비용 효율적인, 간단 하 고 쉽게 적응할 수 있는6 thromboplastin 플라즈마 방법이입니다. 따라서,이 문서, thromboplastin 플라즈마 방법4,,56,7,에 소개 된 프로토콜8 파라핀 끼워 넣어진 셀 블록의 준비에 사용 됩니다.
현재 연구에서 두 확산 마커를 사용 하는 immunocytochemistry 메서드 및 thromboplastin 플라즈마 셀 블록의 준비에 대 한 자세한 절차 시연 했다. 한 표시는 골격 관련 단백질 2 (CKAP2), 최근에는 mitotic 마커9,,1011;으로 보고 되었습니다. 다른 하나는 가장 유명한 확산 마커12기-67. 대표적인 구조는 그림 1에 표시 됩니다.
프로토콜
연구 프로토콜은 기관 검토 위원회의 국립 암 센터, 한국 (NCCNCS-12-630)에 의해 승인 되었다.
1. 샘플 준비 (30 분)
- HeLa 세포 (CCL 2, ATCC)의 문화에 대 한 100 m m 문화 접시에 10 mL 전체 DMEM 매체 (10% 태아 둔감 한 혈 청, 1% 펜-strep)를 사용 합니다. 혈 청에 굶주린 HeLa 세포를 준비 하려면 품 어 소 태아 혈 청 하지 않고 DMEM에 confluent HeLa 세포 48 시간에 대 한 이전 연구11에 설명 된 대로.
- 세포를 분리 하려면 2 mL 인산 염 버퍼 식 염 수 (PBS)와 함께 그들을 씻어 하 고 100 m m 문화 접시 당 0.25 %EDTA 트립 신 2 mL를 추가 합니다. 그런 다음 37 ° c.에 CO2 배양 기에서 2-3 분 동안 품 어
- 트립 신, 비활성화 문화 접시에 완전 한 DMEM 매체의 5 mL을 추가 하 고 15 mL 튜브를 분리 된 세포를 전송. 그런 다음에 펠 릿을 형성 하기 위하여 10 분에 대 한 300 x g에서 셀 원심.
- 상쾌한, 제거 하 고 10 분에 대 한 300 x g에서 원심 분리 하 여 두 번 2 mL 차가운 PBS 가진 펠 릿을 세척.
- 상쾌한의 제거 후, 셀 펠 릿을 95% 에탄올의 1 mL을 추가 하 고 vortexing에 의해 셀 펠 릿 에탄올과 혼합 합니다. 셀 블록 준비까지 얼음에 고정된 셀을 계속.
2. 셀 블록 준비 (1 시간 30 분)
- 냉동된 플라즈마의 준비에 대 한 aliquots, 건강 한 기증자 혈액에서 EDTA 플라즈마를 수집 하 고 표면에 뜨는 플라즈마를 수집 하는 13000 x g에서 원심 분리기는 10 분에 대 한 약 200-400 수 µ L 각에 microfuge 관. 사용까지-80 ° C에서 aliquots를 저장 합니다. 냉동된 플라즈마 aliquots 준비가 되 면, 그들을 검색 하 고 5 분 동안 37 ° C에 외피에 의해 플라즈마를 녹여.
- 10 분 동안 700 x g에 고정 된 세포를 원심 다음 삭제는 상쾌한.
- 플라즈마, thromboplastin, 2 방울 및 0.025 M 염화 칼슘 2 방울 2 방울 (약 200 µ L) 셀 펠 릿 믹스. 그런 다음 pipetting으로 그들을 믹스.
- 그림 2A와 같이 10 분 동안 실내 온도에 셀 응고를 형성 하기 위하여 혼합물을 허용 한다. 그런 다음 세척 PBS와 셀 응고 두 번 붓는 피 펫으로 PBS를 제거 하 여. 대표적인 화이트 셀 응고는 그림 2B에 표시 됩니다.
- 포 르 말린와 필터 종이 축 축 하 게을 미리 moistened 필터 종이 셀 응고를 포장. 그런 다음 그림 2C와 같이 조직 카세트에는 pincette와 응고 혼합물을 놓습니다.
- 포 르 말린 고정을 위한 4 ° C에서 하룻밤 버퍼링 된 포 르 말린 (10% 포 르 말린 PBS에) 50 mL를 포함 하는 유리 항아리에 조직 카세트 장소.
3. 조직 처리 및 파라핀 포함 (하룻밤)
- 포함 하는 포 르 말린 고정 셀 응고 조직 카세트 로드 조직 프로세서에서 앞에서 설명한11하룻밤. 조직 처리 물 제거 및 파라핀 포함 이전에 고정 된 세포의 조절입니다. 조직 처리 없이 연구를 위한 조직 표 1에 표시 된 것 처럼 절차를 처리를 수행 합니다.
- (그림 2D) 온수 포함 역, 및 60 분 후, 검사는 녹은 파라핀 금속 금형에 거기에 설정.
- 조직 카세트에서 형성된 된 셀 응고 하 고 금속 금형 내에서 녹은 파라핀에.
- 장소는 셀을 포함 하는 금속 금형에 뚜껑 없이 새로운 조직 카세트 녹은 파라핀 중간 응고와 조직 카세트에 그리고 금속 금형에 더 많은 녹은 파라핀을 부 어. 그런 다음 30-60 초에 대 한 차가운 접시에 공고히 파라핀 하자.
- 금속 금형에서 조직 카세트를 분리 합니다. 그런 다음 파라핀 셀 블록은 immunocytochemistry에 대 한 준비. 파라핀 끼워 넣어진 셀 블록에 포함 된 셀 응고 그림 2E에서 화살표로 표시 됩니다.
4. Immunocytochemistry (1 시간)에 대 한 슬라이드의 준비
- 파라핀 셀 블록에 셀 응고에 대 한 영역을 확인 하 고는 톰을 사용 하 여 3-4 µ m의 두께와 조각으로 셀 블록을 잘라. 그림 2 층에서 보는 바와 같이 실 란 코팅 된 유리 슬라이드에 파라핀 섹션을 넣어.
- 슬라이드에 고착 하는 섹션을 30 분 동안 37 ° C 오븐에 섹션 슬라이드를 놓습니다.
5. 셀 블록 (6 h) Immunocytochemistry
참고: immunocytochemical 셀 블록 섹션에 얼룩, 다양 한 키트 사용할 수 있습니다 ( 재료의 표참조). 이러한 키트는 다양 한 감도 특이성 그들의 수정에 따라 있다.
- 크 실 렌 드 paraffinize 4 분의 50 mL에 섹션을 품 어.
- 100% 에탄올 탈수에 대 일 분에 두 번 95% 에탄올, 및 2 분 80% 에탄올에 슬라이드를 품 어. 그런 다음, 실행 10 분 동안 물에 에탄올을 제거 합니다.
- 항 원 복구에 대 한 병 포함 40 mL 트리 스-EDTA 검색 버퍼, pH 9.0, 슬라이드를 놓고 30 분 동안 솥에 삶아.
- 실행 물, 아래 슬라이드를 세척 하 고 95% 에탄올 4 ° c.에서 10 분 동안에 그들을 품 어 다음, 슬라이드에 세포 얼룩 지역 Pap 펜 쉽게 식별을 표시 합니다.
- Tris 버퍼 식 염 수 0.2%를 포함 하는 슬라이드 워시 트윈 20 (TBS-T), 그리고 과산화 수소 블록에서 품 어 ( 재료의 표참조) 모든 나머지 과산화 효소 활동을 제거 하려면 15 분 동안 실내 온도에. 그런 다음 2 분에 대 한 세 번 TBS T에 슬라이드를 씻어.
- 1 차적인 항 체 단백질 블록에서을 diluting 하 여 희석된 항 체 솔루션을 준비 ( 재료의 표참조). 예를 들어 기본 항 체 수 CKAP2 희석 배율을 사용, 그리고 기-67 항 체 1: 500. 다음, 1 시간에 대 한 항 체 희석된 솔루션의 100 µ L에서 슬라이드를 품 어.
- 5 시간 2 분을 위한 TBS T에서 세척, 후 어둠 속에서 실 온에서 15 분 동안 키트에 기본 항 체 증강에 슬라이드를 품 어.
- 4 시간 2 분을 위한 TBS T에서 세척 후 HRP 폴리머 (이차 항 체 양 고추냉이 과산화 효소와 함께 표시)의 2 방울을 추가 하 고 30 분 동안 실내 온도에 슬라이드를 품 어.
- 5 시간 2 분을 위한 TBS T에서 세척, 후 추가 diaminobenzidine (DAB) 솔루션의 100 µ L ( 재료의 표참조), 그리고 3 분에 대 한 슬라이드를 품 어.
- 씻은 후 TBS T에 두 번, 되며 솔루션 (100 µ L 되며의와 600 µ L의 증류수의 혼합물), 100 µ L을 추가 하 고 1 분에 대 한 슬라이드를 품 어.
- TBS-T에서 슬라이드를 한 번 세척 후 2 분에 대 한 95% 에탄올에 잠복기, 95% 에탄올에 담그고 한 번, 그리고 두 번 100% 에탄올에 담그고 탈수. 그런 다음 5 분 동안 유리 항아리 자일 렌 40 mL에에서 슬라이드를 품 어.
- 슬라이드는 크 실 렌에서 건조, 각 coverslips를 탑재 합니다.
- 가벼운 현미경 검사 법을 사용 하 여 얼룩 패턴을 관찰 합니다.
결과
파라핀 끼워 넣어진 셀 블록 (그림 3AB)에서 되며 후 오신 스테인드 슬라이드, 세포의 세포질과 핵의 대부분은 그대로, 형태 보존은 현재 프로토콜 (우수 제안 그림 3A)입니다. Immunocytochemical 얼룩에 긍정적인 CKAP2 얼룩이 관찰 되었다 압축된 chromatin, mitotic 스핀 들 및 세포질 (그림 4)에서 이전에 보고 된10. 기-67 얼룩 예상된 (그림 4)로 세포 핵에서 관찰 되었다. 만 셀 CKAP2 압축된 chromatin에서 얼룩 mitotic 세포 했다 ( 그림 4AB화살표 참조). 많은 CKAP2 양성 세포는 완전 한 매체 (그림 4A)에서 부 화 후 준비 된 했다 높은 mitotic HeLa 세포에 표시 했다. 비교에서는, 혈 청에 굶주린 HeLa 세포 (그림 4B)에서 몇 CKAP2-긍정적인 세포 있었습니다. 높은 mitotic는 HeLa 세포의 대부분이 기-67 긍정적인 (그림 4C). 반면, 혈 청에 굶주린 HeLa 세포에서 기 67 양성 율 50% (그림 4D)로 높은 유지. 이러한 결과 매우 그는 이전 보고서11, CKAP2은 보다 안정적인 확산 마커 암 세포에서 보다 기-67의 비교.
제대로 준비 된 셀 블록, 핵, 세포질에서 분리 하 고이 또한, 릴리스할, 불 쌍 한 형태 론 적. 냉장고에 고정된 셀의 하룻밤 보다 더 이상 보육 같은 가난한 결과 발생할 수 있습니다. 또 다른 중요 한 문제는 셀은 우수한 형태에도 불구 하 고 immunocytochemistry에 의해 잘 스테인드 하지. 이 문제는 셀 응고 작을 때 더 자주 발생 합니다. 일반적으로, 착 색 강도 그림 3B;에서 같이 일반 하지만 셀 응고 크면, 불규칙 한 얼룩의 더 적은 기회. 따라서,이 프로토콜에 우리는 큰 셀 응고를 형성 하기 위하여 플라즈마, thromboplastin, 및 염화 칼슘의 볼륨 증가.
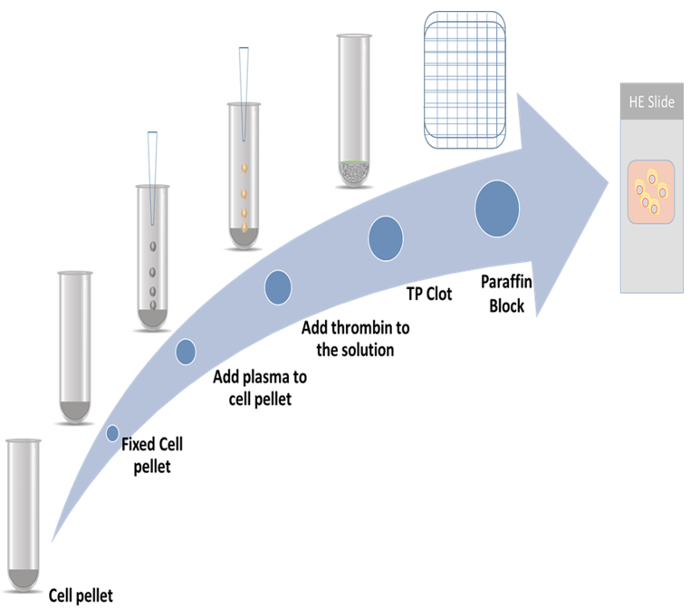
그림 1: 셀 블록 준비 계획. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
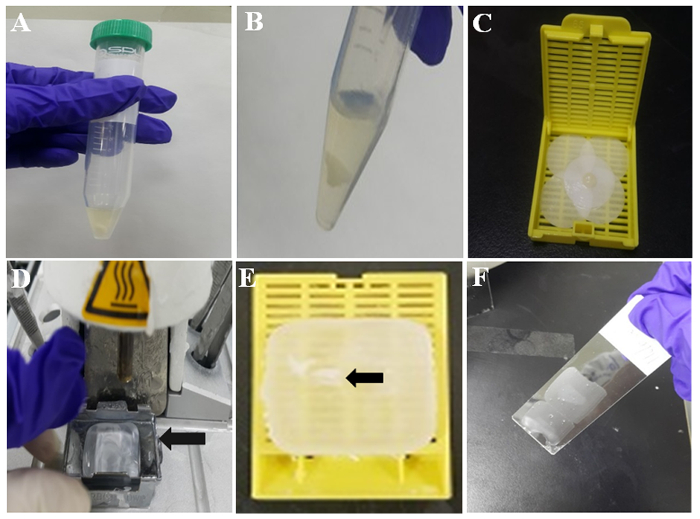
그림 2: 파라핀 셀 블록 준비의 그림. (A) thromboplastin 플라즈마 튜브에서 셀 병. (B) TP 셀 응고 PBS 세척 후. (C) 셀 moistened 필터 종이에 응고. (D) 조직을 포함 한 녹은 왁 스로 역. 금속 몰드 (화살표)에 녹은 왁 스 응고에 대 한 보유 하고있다. (E) 파라핀 포함 셀 응고 (화살표) 파라핀 또는 파라핀 끼워 넣어진 셀 블록에 포함 된. (F) 얇은 파라핀 코팅된 슬라이드의 중간 부분에 섹션. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
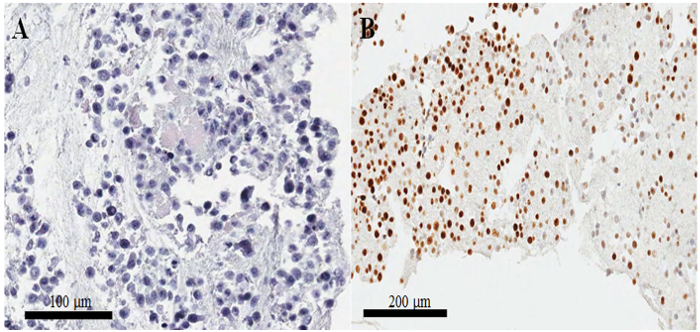
그림 3: 셀 블록 준비 및 확인 되며 오신 및 immunostaining 품질. (A) 되며-및-오신-스테인드 파라핀 끼워 넣어진 셀 블록 섹션에 HeLa 세포의 이미지. (B) 불규칙 착 색 기-67의 저조한에 immunocytochemistry에 파라핀 끼워 넣어진 셀 블록 섹션 준비. 스케일 바는 (A) 100 및 (B) 200 μ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
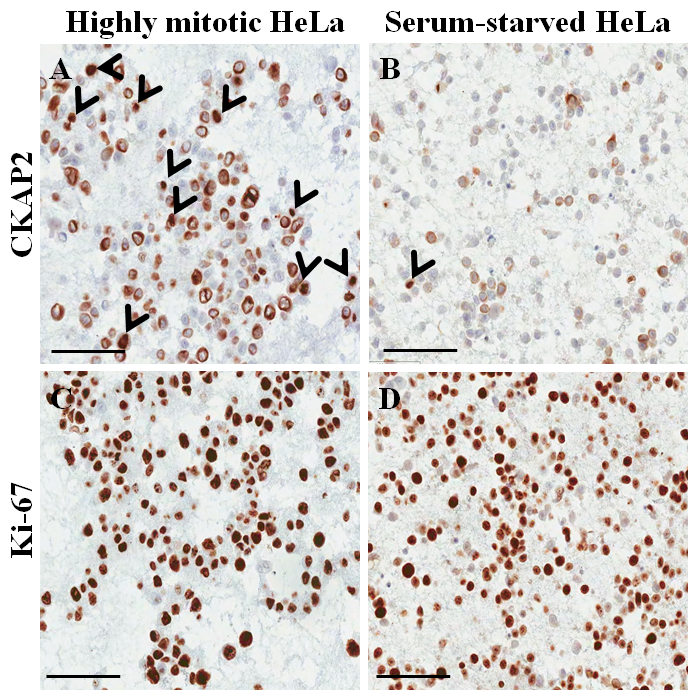
그림 4: Immunocytochemical 헬러 셀 파라핀 끼워 넣어진 셀 블록에 얼룩. (A) CKAP2 높은 mitotic 조건 하에서 얼룩. (B) CKAP2 혈 청 공 복 상태에서 얼룩. (C) 기-67 높은 mitotic 조건 하에서 얼룩. (D) 기-67 혈 청 공 복 상태에서 얼룩. 100 μ m 스케일 바 표시 됩니다. 화살촉 표시 CKAP2-긍정적인 세포. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
| 절차 | 단계 | 솔루션 | 시간/온도 |
| 탈수 | 1 | 70% 알코올 | 15 분/실시간 |
| 2 | 80% 알코올 | 15 분/실시간 | |
| 3 | 95% 알콜 | 15 분/실시간 | |
| 4 | 100% 알코올 | 15 분/실시간 | |
| 지우기 | 1 | 크 실 렌 | 60 분/4 ° C |
| 2 | 크 실 렌 | 10 분/실시간 | |
| 3 | 크 실 렌 | 10 분/실시간 | |
| 4 | 크 실 렌 | 10 분/실시간 | |
| * RT, 실내 온도 |
표 1입니다. 조직 처리 절차입니다.
토론
Immunofluorescent 고정된 경작된 한 세포에 얼룩 현재 형태학 정보1을 유지 하면서 단백질 표정 수준 셀에서의 결정에 대 한 선택의 방법입니다. 그러나, immunocytochemistry 파라핀 끼워 넣어진 셀 블록에 우수한 대안을 수 있습니다. 파라핀 끼워 넣어진 셀 블록와 immunocytochemistry의 준비에 대 한 자세한 절차는이 프로토콜에서 설명 되었습니다 그리고 우리 immunocytochemistry 셀 연구에의 응용을 촉진할 수 있다 바랍니다.
Immunocytochemistry immunofluorescent 얼룩 위에 몇 가지 장점이 있습니다. 하지만 갓 배양된 세포, 필요 immunofluorescent 일반적으로 셀에 대 한 얼룩 파라핀 셀 블록 몇 년13실 온에서 보관 하실 수 있습니다. 또한, immunocytochemistry 셀 블록에 일상적인 immunohistochemistry 인간의 조직4에 사용 된 동일한 항 체를 채용 하 여 세포내 식 패턴을 탐색할 수 있습니다. 또한, 그것은 단백질 수준 또는 posttranslational 수정 미리 다양 한 약물 또는 다양 한 문화 조건11세포 배양 하 여 변화를 탐색할 수 있습니다.
Immunocytochemical 얼룩의 장점, 달리 파라핀 끼워 넣어진 셀 블록의 준비 시간이 걸립니다 그리고 비용이 많이 드는14. 또한, 대부분 연구소가이 기법에서 경험이 부족 하 고 이러한 상황에서 기술적 오류는 일반적. 가장 일반적인 오류는 세포 형태학의 가난한 보존과 가난한 또는 불규칙 한 immunocytochemical 파라핀 셀 블록 섹션에 얼룩. 이들과 대부분의 다른 최고의 셀 조건 셀 블록을 만들고 충분 한 솔루션을 사용 하 여 셀 혈전을 형성 하 여 피할 수 있습니다.
현재 프로토콜의 데모, 셀 블록 HeLa 세포에 대 한 준비 하 고 두 확산 마커, CKAP2 및 이전에 보고 된11기-67에 대 한 수행 했다 immunocytochemical 얼룩. Immunocytochemistry, 세포가 외피와 소 태아 혈 청 하지 않고 미디어에 의해 조작 및 혈 청 기아의 효과 관찰 될 수 있었다. 많은 슬라이드만 슬라이드 당 4-5 µ m 두께 셀 블록 섹션을 사용 하 여 셀 블록에서 준비 될 수 있다 때문에 항 체의 많은 수에 대 한 이러한 준비 파라핀 포함 된 셀 블록을 사용할 수 있습니다. 따라서, 두 개의 서로 다른 조건에 해당 하는 식이 패턴은 여러 다른 항 체와 평가할 수 있습니다. immunostaining CKAP2에 대 한 패턴 및 조직 이미 되어 암에 기-67 보고9,10,,1112, 그리고 얼룩 결과 immunocytochemical 계산 될 수 쉽게, 때문에 얼룩 패턴 immunohistochemistry에서 그들과 아주 유사 했다.
끝으로, immunocytochemical 파라핀 셀 블록에 얼룩 immunofluorescent 얼룩;에 훌륭한 대안이 될 수 있습니다. 또한, 그것은 사용할 수 있습니다 쉽고 안정적으로 식 형태학 정보를 유지 하면서 셀 라인에서 프로 파일링에 대 한 기초 연구에.
공개
모든 저자는 관심 없음 충돌 선언 하 고 있다.
감사의 말
이 작품에서 국립 암 센터, 한국 (1510121) 및 국가 연구 재단, 한국 (아니 K. 수소를 연구 보조금에 의해 지원 되었다. NRF-2015R1A2A2A04007432).
자료
| Name | Company | Catalog Number | Comments |
| HeLa Cells | ATCC | HeLa (ATCC CCL-2) | |
| Ki-67 Antibody | Thermo Fisher Scientific | RM-9106-S1 | |
| Paraffin | Leica | 39601006 | |
| Xylene | Fisher SCientific | 1330-20-7,100-41-4 | |
| Ethenol | GD Chem | DJ16016 | |
| Hematoxylin | Agilent | 10118581 | |
| DAB Quanto Kit | Thermo Fisher Scientific | TA-125-QHDX, QHCX 170405 | |
| Ultravision LP detection Kit | Thermo Fisher Scientific | PBQ141209, LPB141209, LPH141210 | Kit for immunocytochemistry; contains protein block |
| TintoRetriever Pressure Cooker | Bio SB Corporation | BSB 7008 | |
| Tris-buffered saline | iNtRON Biotechnology | IBS-BT008 | |
| Tween 20 | USB Corporation | 115106 | |
| Thromboplastin | Neoplastin Cl Plus | NC0591432 | |
| Tris-EDTA retrival Buffer | Dignostic Biosystem | E625-A | |
| Trypsin EDTA | Thermo Fisher Scientific | 25200056 | |
| Fetal bovine serum (FBS) | Hyclone Laboratories Inc | SH30910.03 | |
| DMEM | Hyclone Laboratories Inc | SH30243.01 | |
| Antibiotic-Antimycotic, 100X | Thermo Fisher Scientific | 15240062 | |
| Ultra vision peroxide block H2O2 | Thermo Fisher Scientific | 02Q141212 | |
| Mounting Medium | Thermo Fisher Scientific | 363313 | |
| Pap-Pen | Vector Laboratories | H-4000 | |
| Filter Paper | GE Healthcare Life Sciences | 1001-0155 | |
| Calcium Chloride | Sigma-Aldrich | 21115-100ml | |
| Phosphate-buffered saline | PAA Laboratories | H21-002 | |
| Formalin | Daejung | 50-00-0 | |
| 15 ml tube | SPL Life Sciences | 50015 | |
| tissue processing cassette | Simport | M492-5 | |
| 100 mm culture dishes | BD Biosciences | 08-772E | |
| Glass Slide | Muto Pure Chemicals | 140712 | |
| Cover Glass | Marienfeld | 2262817 | |
| Glass Zar | Hyunil Lab-Mate | HIP-1027 | |
| Centrifuge | Eppendorf | 5810R | |
| Class II Laminar Flow Hood | Thermo Fisher Scientific | 1300 series A2 | |
| CO2 Incubator | Thermo Fisher Scientific | Series A2 | |
| Tissue Processor | Leica BioSystem | TP1020 | |
| Microtome | Thermo Fisher Scientific | HM340E | |
| Microscope | Olympus | CX-21 | |
| Paraffin embedding station | Thermo Fisher Scientific | EC 350-1, EC 350-2 | |
| Tissue Section Bath (Round) | CellPath | HCP-JAW-0100-00AEU | |
| Fume Hood | Hanyang Scientific Equipment Co. Ltd. | FH-150 |
참고문헌
- Bhattacharyya, D., Hammond, A. T., Glick, B. S. High-quality immunofluorescence of cultured cells. Methods Mol Biol. 619, 403-410 (2010).
- Brown, C. M. Fluorescence microscopy - Avoiding the pit falls. J Cell Sci. 120, 1703-1705 (2007).
- Odell, I. D., Cook, D. Immunofluorescence Techniques. J Invest Dermatol. 133, e4 (2013).
- Kulkarni, M. B., Desai, S. B., Ajit, D., Chinoy, R. F. The utility of the thromboplastin-plasma cell-block technique for fine-needle aspiration and serous effusions. Diagn Cytopathol. 37 (2), 86-90 (2009).
- Shivakumarswamy, U., Arakeri, S. U., Karigowdar, M. H., Yelikar, B. Diagnostic utility of the cell block method versus the conventional smear study in pleural fluid cytology. J Cytol. 29 (1), 11-15 (2012).
- Nathan, N. A., Narayan, E., Smith, M. M., Horn, M. J. Cell block cytology: Improved preparation and its efficacy in diagnostic cytology. Am J Clin Pathol. 114 (4), 599-606 (2000).
- Keyhani-Rofagha, S., Vesey-Shecket, M. Diagnostic value, feasibility, and validity of preparing cell blocks from fluid-based gynecologic cytology specimens. Cancer. 96, 204-209 (2002).
- Young, N. A., Naryshkin, S., Katz, S. M. Diagnostic value of electron microscopy on paraffin-embedded cytologic material. Diagn Cytopathol. 9, 282-290 (1993).
- Jin, Y., Murakumo, Y., Ueno, K., Hashimoto, M., Watanabe, T., Shimoyama, Y., et al. Identification of a mouse cytoskeleton-associated protein, CKAP2, with microtubule-stabilizing properties. Cancer Sci. 95 (10), 815-821 (2004).
- Hong, K. U., Choi, Y. -. B., Lee, J. -. H., Kim, H. -. J., Kwon, H. -. R., Seong, Y. -. S., et al. Transient phosphorylation of tumor associated microtubule associated protein (TMAP)/cytoskeleton associated protein 2 (CKAP2) at Thr-596 during early phases of mitosis. Exp Mole Med. 40, 377-386 (2008).
- Sim, S. H., Bae, C. D., Kwon, Y., Hwang, H. -. L., Poojan, S., Hong, H. -. I., et al. CKAP2 (cytoskeleton-associated protein2) is a new prognostic marker in HER2-negative luminal type breast cancer. PLoS ONE. 12 (8), e0182107 (2017).
- Inwald, E. C., Klinkhammer-Schalke, M., Hofstadter, F., Zeman, F., Koller, M., Gerstenhauer, M., et al. Ki-67 is a prognostic parameter in breast cancer patients: results of a large population-based cohort of a cancer registry. Breast Cancer Res Treat. 139 (2), 539-552 (2013).
- Katikireddy, K. R., O'Sullivan, F. Immunohistochemical and immunofluorescence procedures for protein analysis. Methods Mol Biol. 784, 155-167 (2011).
- Beutner, E. H. Immunofluorescent staining: The fluorescent antibody method. Microbiol Mol Biol Rev. 25 (1), 49-76 (1961).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유