Method Article
Immunocytochemistry hücre parafin gömülü bloklar tarafından kültürlü hücrelerdeki Protein ifade düzeyinin belirlenmesi
Bu Makalede
Özet
Morfolojik bilgi aynı zamanda gerekli olduğunda şu anda, immünfloresan sabit hücreleri üzerinde boyama seçim protein ifade düzeyleri tespiti için yöntemidir. Burada sunulan bu protokolü parafin gömülü hücre bloklar immunocytochemistry alternatif bir yöntem sağlar.
Özet
Morfolojik bilgi aynı zamanda gerekli olduğunda immünfloresan boyama Şu anda seçim protein ifade düzeyleri tespiti için hücre kültürü sistemlerinde yöntemidir. Burada, sunulan parafin gömülü hücre bloklar üzerinde boyama immunocytochemical Protokolü immünfloresan parafin katıştırılmış sabit hücreleri üzerinde boyama için mükemmel bir alternatiftir. Bu iletişim kuralı, HeLa hücreleri parafin hücre bloğundan thromboplastin-plazma yöntemi kullanılarak hazırlanan ve immunocytochemistry iki nükleer silahların yayılmasına karşı işaretleri, CKAP2 ve Ki-67 değerlendirme için gerçekleştirildi. Çekirdek ve sitoplazmik morfoloji HeLa hücrelerin hücre bloğu slaytlar iyi korunmuş. Aynı zamanda, immunocytochemistry CKAP2 ve Ki-67 boyama desenleri immunohistokimyasal parafin kanser dokularda boyama ile oldukça benzer. Serum serbest koşullarda HeLa hücrelerin ön kuluçka dahil olmak üzere değiştirilmiş hücre kültürü koşullarla etkisi mimari bilgi koruyarak değerlendirilecektir. Sonuç olarak, immunocytochemistry hücre parafin gömülü bloklar immünfloresan boyama için mükemmel bir alternatiftir.
Giriş
Çoğu laboratuvarlarda parafin gömülü hücre blokları yaygın olarak kullanılmaz. Daha doğrusu, kültürlü hücreleri sabit, hücreleri parafin gömülü değil, istihdam edilmektedir hücre altı yerelleştirme çalışmalarında. O kültürlü hücreleri sabit, floresans Kromojen yerine kullanılmıştır. Bu nedenle, immünfloresan boyama Şu anda seçim için belirlenmesi protein ifade düzeylerinin hücre kültürleri1istihdam araştırma yöntemidir. Slaytlar immünfloresan boyama için hazırlanan ancak, görüntüleri oldukça farklı uçak mikroskobu2altında belirtilen gösterebilir sadece immünfloresan mikroskobu altında görülebilir. Ayrıca, immünfloresan boyama için slaytlar korunması parlak ışık koruma gerektirir ve floresan sinyalleri ile tekrarlanan maruz kalma nedeniyle3floresan sinyal kaybı görüntüleme için zayıf olmak. İmmunocytochemistry hücre parafin gömülü bloklar sonuçlarından oldukça immünhistokimya parafin gömülü doku4üzerinden benzer ve klinik bilgileri kolayca çevrilebilir. Bu nedenle, immunocytochemistry mükemmel bir alternatif olabilir. Ancak, hücre block hazırlık temel araştırma laboratuvarlarında popüler olmamıştır. Bu protokol için sonra bu yöntem hücre kültürü çalışmaları alanında kullanılmasını sağlamak için hücre block hazırlık ve immunocytochemical boyama sağlanır.
Hücre block hazırlık ve immunocytochemistry benzersiz yöntemler değildir ve onlar zaten klinik tanı temel araştırma4,5' e uygulandıktan. 4,çeşitli hücre block hazırlama yöntemleri olmuştur rapor6 thromboplastin-plazma yöntemi basit, uygun maliyetli ve kolayca adapte edilebilir olsa da. Bu nedenle, bu yazıda, thromboplastin-plazma yöntemi4,5,6,7,sunulan protokolünde8 parafin gömülü hücre blokları hazırlanması için kullanılır.
Bu da çalışmanın, thromboplastin-plazma hücre blokları ve iki nükleer silahların yayılmasına karşı işaretleri istihdam immunocytochemistry yöntemi hazırlanması için ayrıntılı yordamlar gösterdi. Son zamanlarda bir mitotik marker9,10,11bildirilmiştir sitoiskeleti ilişkili protein 2 (CKAP2), bir işaretleyicidir; diğeri ise Ki-67, en iyi bilinen nükleer silahların yayılmasına karşı marker12' dir. Temsilcisi şeması Şekil 1' de gösterilen.
Protokol
Çalışma protokolü kurumsal İnceleme Kurulu Ulusal Kanser Merkezi, Kore tarafından (NCCNCS-12-630) kabul edildi.
1. numune hazırlama (30 dk)
- HeLa hücreleri (CCL-2, ATCC) kültür için bir 100 mm Kültür tabak içinde 10 mL tam DMEM Orta (% 10 fetal Sığır serum, % 1 kalem-strep) kullanın. Serum-hasret HeLa hücreleri hazırlamak için bir önceki çalışmada11' açıklandığı gibi 48 saat boyunca DMEM konfluent HeLa hücreleri fetal Sığır serum olmadan kuluçkaya.
- Hücreleri ayırmak için onları 2 mL fosfat tamponlu tuz (PBS) ile yıkamak ve 2 mL % 0.25 EDTA tripsin 100 mm Kültür çanak başına ekleyin. Sonra 2-3 dk 37 ° C'de CO2 kuluçka için kuluçkaya
- Tripsin devre dışı bırakmak için kültür yemek için tam DMEM orta 5 mL ekleyin ve müstakil hücreleri 15 mL tüp aktarın. Sonra 300 x g bir Pelet oluşturmak 10 dakika için hücreleri santrifüj kapasitesi.
- Süpernatant kaldırmak ve 300 x g 10 dk de Santrifüjü tarafından iki kez 2 mL soğuk PBS ile Pelet yıkayın.
- Süpernatant kaldırılması sonra 1 mL % 95 etanol hücre Pelet ve hücre pelet tarafından vortexing etanol ile karıştırın. Buz üzerinde sabit hücrelerin hücre block hazırlık kadar tutun.
2. hücre block hazırlık (1 saat 30 dk)
- Dondurulmuş plazma hazırlanması için aliquots, sağlıklı donör kan EDTA plazma toplamak ve 10 dakika süreyle 13.000 x g, santrifüj toplamak süpernatant plazma ve aliquot 200-400 µL her microfuge içine tüpleri. -80 ° C'de aliquots kullanmak kadar saklamak. Dondurulmuş plazma aliquots hazır olduğunuzda, onları almak ve 5 min için 37 ° C'de kuluçka tarafından plazma çözülme.
- 700 x g 10 min için de sabit hücreleri santrifüj kapasitesi sonra süpernatant atmak.
- Hücre Pelet plazma, thromboplastin 2 damla ve 0,025 M kalsiyum klorür 2 damla 2 damla (yaklaşık 200 µL) ile karıştırın. Sonra onları pipetting tarafından karıştırın.
- Oda sıcaklığında 10 dakika, hücre pıhtı oluşturmak karışım izin verin Şekil 2Agösterildiği gibi. Sonra hücre pıhtı PBS ile dökme ve pipet tarafından PBS kaldırarak iki kez yıkayın. Temsilcisi beyaz hücre pıhtı Şekil 2Biçinde gösterilir.
- Filtre kağıt formalin ile nemlendirin ve hücre pıhtı önceden ıslatılmış filtre kağıdı ile sarın. O zaman, pıhtılaşmış karışımı bir pincette ile Şekil 2Ciçinde gösterildiği gibi bir doku kaset yerleştirin.
- Doku kaset tamponlu formalin (PBS % 10 formalin) 50 mL formalin fiksasyon için 4 ° C'de gecede içeren bir cam kavanoz içinde bir yer.
3. doku işleme ve parafin (gece) katıştırma
- Formalin sabit hücre pıhtı içeren doku kaset yük bir doku işlemcide gecede11daha önce açıklandığı gibi. Su kaldırma ve klima parafin katıştırma önce sabit hücre doku işleme içindir. Doku işleme olmadan araştırma için Tablo 1' de gösterildiği gibi yordam işleme doku yapmak.
- Orada olduğunu erimiş parafin metal kalıp içinde orada ısıtmalı gömme İstasyonu ve 60 dakika sonra çeke (Şekil 2B) açın.
- Doku kaset kurulan hücre pıhtıyı almak ve metal kalıp içinde erimiş parafin yere koyun.
- Yer yeni doku kaset kapağı hücreyi içeren metal kalıp içine olmadan ortasında erimiş parafin pıhtısı ve daha fazla erimiş parafin içine doku kaset ve metal kalıp üzerine dökün. O zaman, 30-60 saniye içinde soğuk plaka kuvvetlendirmek parafin izin ver.
- Doku kaset metal kalıp ayırın. Sonra parafin hücre block immunocytochemistry için hazırdır. Katıştırılmış hücre pıhtı parafin gömülü Hücre bloğundaki Şekil 2Eoku simgesiyle gösterilir.
4. Immunocytochemistry (1 h) için slaytların hazırlanması
- Hücre pıhtı parafin Hücre bloğundaki alanı kontrol edin ve hücre bloğu bir microtome kullanarak 3-4 µm kalınlıkları ile dilimler halinde kesin. Parafin kesitler silane kaplı cam slaytlarda Şekil 2Fiçinde gösterildiği gibi koymak.
- Bölümü slaytları slaytlar için uygun bölümler yapmak 30 dk 37 ° C fırında yerleştirin.
5. Hücre blokları (6 h) Immunocytochemistry
Not: hücre block bölümler üzerinde boyama immunocytochemical için çeşitli kitleri kullanılabilir ( Tablo malzemelerigörmek). Böyle setleri çeşitli hassasiyetleri ve özelliklerine bağlı olarak onların değişiklikler var.
- Ksilen de-paraffinize için 4 dakika için 50 ml bölümlerini kuluçkaya.
- Dehidratasyon için 2 min için % 100 etanol ve iki kez % 95 etanol ve % 80 etanol 2 min için slaytlar kuluçkaya. Ardından, etanol akan suyun 10 min için kaldırın.
- Antijen almayla, slaytları bir kavanoz içeren 40 mL Tris-EDTA alma arabellek, pH 9.0, yerleştirin ve bir Ocak 30 dakika kaynatın.
- Slaytlar akan suyun altında yıkayın ve onları % 95 etanol 4 ° C'de 10 dakika içinde kuluçkaya Sonra hücre boyama alanını slaytlara kolay tanımlanması için Pap kalemle işaretlemek.
- Tris tamponlanmış salin % 0,2 içeren slaytlar yıkama ara 20 (TBS-T) ve hidrojen peroksit bloğunda kuluçkaya ( Tablo malzemelerigörmek) herhangi bir kalıntı peroksidaz aktivitesi kaldırmak 15 dakika oda sıcaklığında. Sonra slaytları TBS-T içinde üç kez 2 min için her yıkayın.
- Birincil antikor protein bloğundaki sulandrarak seyreltilmiş antikor çözüm hazırlamak ( Tablo malzemelerigörmek). Örneğin, birincil antikor olabilir CKAP2 1: 100 ve Ki-67 antikor 1:500 sulandırılmış. O zaman, seyreltilmiş antikor çözüm için 1 h 100 µL slaytları kuluçkaya.
- 2 min için beş kez TBS-t yıkandıktan sonra 15 dakika içinde belgili tanımlık karanlık oda sıcaklığında seti birincil antikor artırıcı slaytları kuluçkaya.
- TBS-t yıkama 2 min için dört kez sonrası HRP polimer (horseradish peroksidaz ile etiketli bir ikincil antikor) 2 damla ekleyin ve slaytlar, oda sıcaklığında 30 dk için kuluçkaya.
- 2 min için beş kez TBS-T yıkandıktan sonra diaminobenzidine (DAB) çözüm 100 µL ekleyin (bkz. Tablo reçetesi) ve 3 dak slaytlarını kuluçkaya.
- TBS-T içinde iki kez yıkama sonra 100 µL hematoksilen çözüm (100 µL Hematoksilen ve 600 µL distile su karışımı) ekleyin ve 1 dk. slaytlarını kuluçkaya.
- TBS-T slaytları bir kez yıkadıktan sonra % 95 etanol için 2 dk içinde kuluçka, % 95 etanol içinde bir kez daldırma ve % 100 etanol içinde iki kez daldırma kurutmak. Sonra 5 min için bir cam kavanoza 40 mL ksilen içindeki slaytları kuluçkaya.
- Slaytları ksilen kuru olduğunda, ilgili coverslips bağlayın.
- Işık mikroskobu kullanarak boyama desenleri gözlemlemek.
Sonuçlar
Hematoksilen ve eozin lekeli slayt içinde parafin gömülü hücre Block (Şekil 3AB), hücrelerin sitoplazma ve çekirdeklerin en sağlam, morfolojik korunması ile geçerli Protokolü (mükemmel olduğunu düşündüren Şekil 3A). İmmunocytochemical boyama, pozitif CKAP2 boyama yoğun kromatin, mitotik iğ ve sitoplazma (Şekil 4), daha önce bildirilen10' a kadar gözlendi. Ki-67 boyama hücre çekirdeği beklenen (Şekil 4) gözlenmiştir. Yalnızca yoğun kromatin boyama hücreleri CKAP2 ile (bkz. Şekil 4ABokları) Mitotik hücre vardı. Birçok CKAP2 pozitif hücreler bir kuluçka tam orta (Şekil 4A) sonra hazırlandığını yüksek oranda mitotik HeLa hücreleri içinde gösterilmiştir. Buna karşılık, serum-hasret HeLa hücreleri (Şekil 4B) kaç CKAP2 pozitif hücre vardı. En yüksek oranda mitotik HeLa hücreleri vardı Ki-67 pozitif (Şekil 4 c). Contrastingly, Ki-67-pozitif oranı serum-hasret HeLa hücreleri içinde ~ %50 (Şekil 4 d) yüksek kaldı. Bu sonuçlar bu CKAP2 Ki-67 daha bir daha güvenilir nükleer silahların yayılmasına karşı işaretleyicisinde kanser hücreleri olduğunu göstermektedir bir önceki rapor11, oldukça karşılaştırılabilir.
Kötü hazırlanmış hücre blokları, çekirdeklerin sitoplazma ayrılır ve ortada da, sonuçta, zavallı morfolojik koruma. Gecede daha uzun kuluçka buzdolabında sabit hücrelerin böyle kötü sonuçlar neden olabilir. Başka bir önemli sorun hücreleri de mükemmel morfoloji rağmen immunocytochemistry tarafından lekeli değil. Hücre pıhtı küçük olduğunda bu sorun daha sık ortaya çıkar. Genellikle, boyama yoğunluğu Şekil 3B' gösterildiği gibi düzensiz; Ama hücre pıhtı daha büyük olduğunda, düzensiz boyama çok daha az şans. Bu nedenle, bu protokol için biz büyük hücreli pıhtı oluşturmak üzere plazma, thromboplastin ve kalsiyum klorür hacimleri arttı.
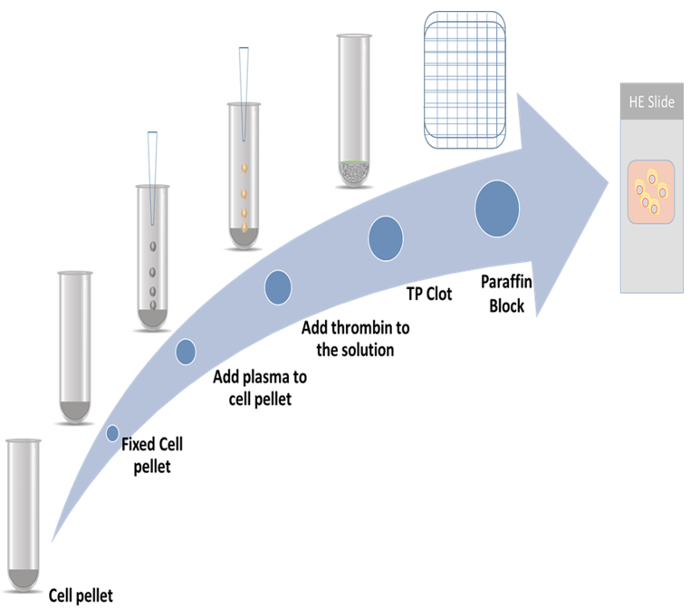
Şekil 1: hücre block hazırlık planı. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
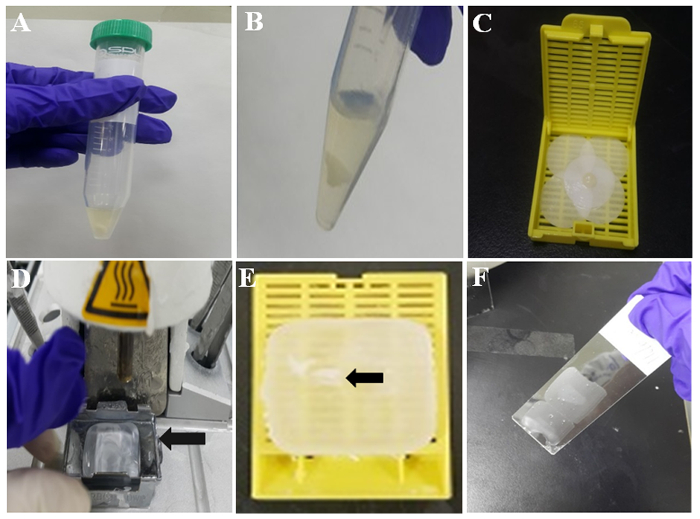
Şekil 2: illüstrasyon parafin hücre block hazırlık. (A) thromboplastin-plazma hücre pıhtı tüp. (B) TP hücre pıhtı PBS yıkama sonrası. (C) hücre pıhtı ıslatılmış süzgeç kağıt üzerinde. (D) doku gömme İstasyonu erimiş mum ile. Metal kalıp (ok) erimiş mum katılaşma için tutar. (E) parafin gömülü hücre pıhtı (ok) parafin veya parafin gömülü hücre block katıştırılabilir. (F) ince parafin bölüm kaplı bir slayt orta kısmında. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
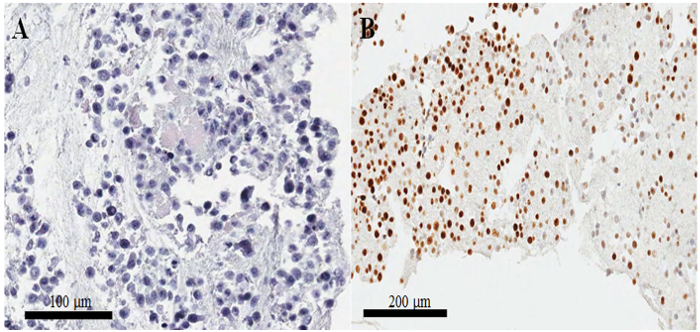
Şekil 3: hücre block hazırlık ve hematoksilen eozin ve immunostaining kalite onayı. (A) HeLa hücreleri parafin gömülü hücre-blok bölümündeki Hematoksilen ve-eozin-lekeli görüntü. (B) düzensiz Ki-67 immunocytochemistry üzerinde kötü içinde boyama parafin gömülü hücre-blok bölüm hazır. Ölçek barlar (A) 100 ve (B) 200 mikron vardır. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
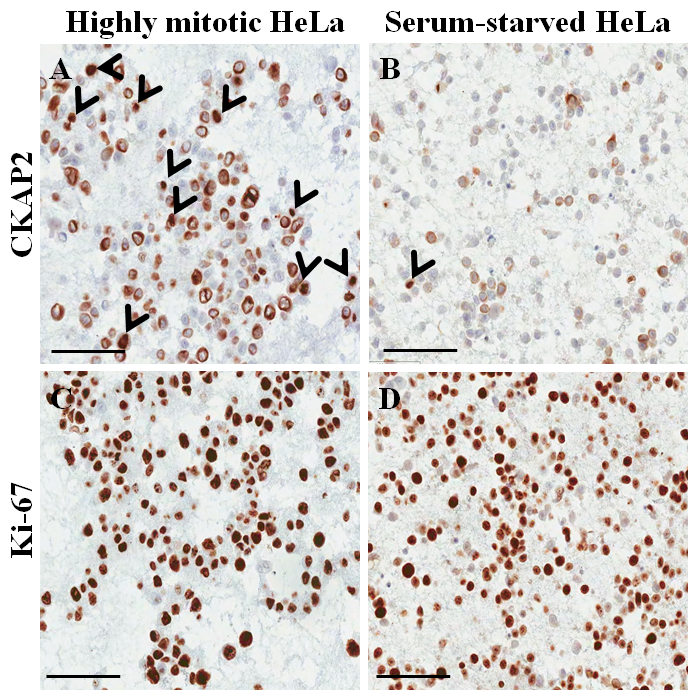
Şekil 4: HeLa hücreleri için parafin gömülü hücre blokta Immunocytochemical boyama. (A) yüksek oranda mitotik koşullar altında boyama CKAP2. (B) serum-hasret koşullar altında boyama CKAP2. (C) Ki-67 yüksek oranda mitotik koşullar altında boyama. (D) Ki-67 serum-hasret koşullar altında boyama. 100 μm kalınlığında ölçek çubuğu gösterilir. Ok uçları CKAP2 pozitif hücreler gösterir. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
| Yordamı | Adımları | Çözüm | Zaman/sıcaklık |
| Su kaybı | 1 | % 70 alkol | 15 dk/RT |
| 2 | % 80 alkol | 15 dk/RT | |
| 3 | % 95 alkol | 15 dk/RT | |
| 4 | %100 alkol | 15 dk/RT | |
| Takas | 1 | Ksilen | 60 dk/4 ° C |
| 2 | Ksilen | 10 dk/RT | |
| 3 | Ksilen | 10 dk/RT | |
| 4 | Ksilen | 10 dk/RT | |
| * RT, oda sıcaklığında |
Tablo 1. Doku işleme yordamı.
Tartışmalar
İmmünfloresan sabit kültürlü hücreleri üzerinde boyama Şu anda seçim tayin edilmesi protein ifade düzey hücrelerdeki morfolojik bilgi1koruma sırasında yöntemidir. Ancak, parafin gömülü hücre bloklar immunocytochemistry mükemmel bir alternatif olabilir. Parafin gömülü hücre blokları ve immunocytochemistry hazırlanması için ayrıntılı yordamlar bu protokol için tarif var ve immunocytochemistry hücre çalışmalarda uygulanmasının kolaylaştırılması umuyoruz.
Immunocytochemistry immünfloresan boyama üzerinde çeşitli avantajları vardır. İmmünfloresan hücreler için genellikle boyama taze kültürlü hücrelerin gerekli ama parafin hücre blokları, oda sıcaklığında birkaç yıl13tutulabilir. Ayrıca, immunocytochemistry hücre bloklar rutin immünhistokimya insan doku4' te kullanılan aynı antikor istihdam ederek hücre içi ifade desenleri keşfedebilirsiniz. Ayrıca, protein düzeyleri veya ardından değişiklikler önceden hücreleri ile çeşitli ilaçlar veya çeşitli kültür koşulları11altında kuluçka tarafından değişimler keşfedebilirsiniz.
İmmunocytochemical boyama avantajları, aksine parafin gömülü hücre blokları hazırlanması zaman alır ve pahalı14yaşında. Ayrıca, çoğu araştırma laboratuvarları bu teknik deneyim eksikliği, ve bu şartlar altında teknik hatalar yaygındır. En sık karşılaşılan hataları hücre morfolojisi zavallı korunması ve parafin hücre block bölümleri üzerinde boyama yoksul ya da düzensiz immunocytochemical vardır. Bu ve en diğerleri en iyi hücre koşullar altında hücre blok yapma ve hücre pıhtıları oluşturmak için yeterli bir çözüm kullanarak önlenebilir.
Bir gösteri mevcut iletişim kuralı olarak hücre blokları HeLa hücreleri için hazırlanmıştır ve immunocytochemical boyama iki nükleer silahların yayılmasına karşı işaretleri, CKAP2 ve Ki-67, daha önce bildirilen11olarak gerçekleştirildi. İmmunocytochemistry için hücreleri kuluçka medya ve fetal Sığır serum olmadan tarafından manipüle ve serum açlık etkisi dikkat edilmelidir. Çünkü birçok Slaytları slayt başına yalnızca bir 4-5 µm kalınlığında hücrede bölümü kullanarak bir hücre Block hazırladı bu hazırlanan parafin gömülü hücre bloklar antikorlar, çok sayıda için istihdam edilebilir. Bu nedenle, iki farklı koşullar için karşılık gelen ifade desenleri birkaç farklı antikorlar ile değerlendirilebilir. İmmunostaining CKAP2 için desen ve Ki-67 kanser dokuları-si olmak zaten be bildirdi9,10,11,12ve sonuçları boyama immunocytochemical kolayca, çünkü değerlendirilecektir boyama desenleri immünhistokimya üzerinden oldukça benzer.
Sonuç olarak, parafin hücre bloklar üzerinde boyama immunocytochemical immünfloresan boyama için mükemmel bir alternatif olabilir; Ayrıca, bu kolayca ve güvenle ifadesi hücre hatlarında morfolojik bilgi koruyarak profil oluşturma için temel araştırma istihdam edilebilir.
Açıklamalar
Tüm yazarlar hiçbir çıkar çatışmaları ilan etti.
Teşekkürler
Bu eser Ulusal Kanser Merkezi, Kore (1510121) ve Ulusal Araştırma Vakfı, Kore (Hayır. K.-M.H. için araştırma hibe tarafından desteklenen yapıldı. NRF-2015R1A2A2A04007432).
Malzemeler
| Name | Company | Catalog Number | Comments |
| HeLa Cells | ATCC | HeLa (ATCC CCL-2) | |
| Ki-67 Antibody | Thermo Fisher Scientific | RM-9106-S1 | |
| Paraffin | Leica | 39601006 | |
| Xylene | Fisher SCientific | 1330-20-7,100-41-4 | |
| Ethenol | GD Chem | DJ16016 | |
| Hematoxylin | Agilent | 10118581 | |
| DAB Quanto Kit | Thermo Fisher Scientific | TA-125-QHDX, QHCX 170405 | |
| Ultravision LP detection Kit | Thermo Fisher Scientific | PBQ141209, LPB141209, LPH141210 | Kit for immunocytochemistry; contains protein block |
| TintoRetriever Pressure Cooker | Bio SB Corporation | BSB 7008 | |
| Tris-buffered saline | iNtRON Biotechnology | IBS-BT008 | |
| Tween 20 | USB Corporation | 115106 | |
| Thromboplastin | Neoplastin Cl Plus | NC0591432 | |
| Tris-EDTA retrival Buffer | Dignostic Biosystem | E625-A | |
| Trypsin EDTA | Thermo Fisher Scientific | 25200056 | |
| Fetal bovine serum (FBS) | Hyclone Laboratories Inc | SH30910.03 | |
| DMEM | Hyclone Laboratories Inc | SH30243.01 | |
| Antibiotic-Antimycotic, 100X | Thermo Fisher Scientific | 15240062 | |
| Ultra vision peroxide block H2O2 | Thermo Fisher Scientific | 02Q141212 | |
| Mounting Medium | Thermo Fisher Scientific | 363313 | |
| Pap-Pen | Vector Laboratories | H-4000 | |
| Filter Paper | GE Healthcare Life Sciences | 1001-0155 | |
| Calcium Chloride | Sigma-Aldrich | 21115-100ml | |
| Phosphate-buffered saline | PAA Laboratories | H21-002 | |
| Formalin | Daejung | 50-00-0 | |
| 15 ml tube | SPL Life Sciences | 50015 | |
| tissue processing cassette | Simport | M492-5 | |
| 100 mm culture dishes | BD Biosciences | 08-772E | |
| Glass Slide | Muto Pure Chemicals | 140712 | |
| Cover Glass | Marienfeld | 2262817 | |
| Glass Zar | Hyunil Lab-Mate | HIP-1027 | |
| Centrifuge | Eppendorf | 5810R | |
| Class II Laminar Flow Hood | Thermo Fisher Scientific | 1300 series A2 | |
| CO2 Incubator | Thermo Fisher Scientific | Series A2 | |
| Tissue Processor | Leica BioSystem | TP1020 | |
| Microtome | Thermo Fisher Scientific | HM340E | |
| Microscope | Olympus | CX-21 | |
| Paraffin embedding station | Thermo Fisher Scientific | EC 350-1, EC 350-2 | |
| Tissue Section Bath (Round) | CellPath | HCP-JAW-0100-00AEU | |
| Fume Hood | Hanyang Scientific Equipment Co. Ltd. | FH-150 |
Referanslar
- Bhattacharyya, D., Hammond, A. T., Glick, B. S. High-quality immunofluorescence of cultured cells. Methods Mol Biol. 619, 403-410 (2010).
- Brown, C. M. Fluorescence microscopy - Avoiding the pit falls. J Cell Sci. 120, 1703-1705 (2007).
- Odell, I. D., Cook, D. Immunofluorescence Techniques. J Invest Dermatol. 133, e4 (2013).
- Kulkarni, M. B., Desai, S. B., Ajit, D., Chinoy, R. F. The utility of the thromboplastin-plasma cell-block technique for fine-needle aspiration and serous effusions. Diagn Cytopathol. 37 (2), 86-90 (2009).
- Shivakumarswamy, U., Arakeri, S. U., Karigowdar, M. H., Yelikar, B. Diagnostic utility of the cell block method versus the conventional smear study in pleural fluid cytology. J Cytol. 29 (1), 11-15 (2012).
- Nathan, N. A., Narayan, E., Smith, M. M., Horn, M. J. Cell block cytology: Improved preparation and its efficacy in diagnostic cytology. Am J Clin Pathol. 114 (4), 599-606 (2000).
- Keyhani-Rofagha, S., Vesey-Shecket, M. Diagnostic value, feasibility, and validity of preparing cell blocks from fluid-based gynecologic cytology specimens. Cancer. 96, 204-209 (2002).
- Young, N. A., Naryshkin, S., Katz, S. M. Diagnostic value of electron microscopy on paraffin-embedded cytologic material. Diagn Cytopathol. 9, 282-290 (1993).
- Jin, Y., Murakumo, Y., Ueno, K., Hashimoto, M., Watanabe, T., Shimoyama, Y., et al. Identification of a mouse cytoskeleton-associated protein, CKAP2, with microtubule-stabilizing properties. Cancer Sci. 95 (10), 815-821 (2004).
- Hong, K. U., Choi, Y. -. B., Lee, J. -. H., Kim, H. -. J., Kwon, H. -. R., Seong, Y. -. S., et al. Transient phosphorylation of tumor associated microtubule associated protein (TMAP)/cytoskeleton associated protein 2 (CKAP2) at Thr-596 during early phases of mitosis. Exp Mole Med. 40, 377-386 (2008).
- Sim, S. H., Bae, C. D., Kwon, Y., Hwang, H. -. L., Poojan, S., Hong, H. -. I., et al. CKAP2 (cytoskeleton-associated protein2) is a new prognostic marker in HER2-negative luminal type breast cancer. PLoS ONE. 12 (8), e0182107 (2017).
- Inwald, E. C., Klinkhammer-Schalke, M., Hofstadter, F., Zeman, F., Koller, M., Gerstenhauer, M., et al. Ki-67 is a prognostic parameter in breast cancer patients: results of a large population-based cohort of a cancer registry. Breast Cancer Res Treat. 139 (2), 539-552 (2013).
- Katikireddy, K. R., O'Sullivan, F. Immunohistochemical and immunofluorescence procedures for protein analysis. Methods Mol Biol. 784, 155-167 (2011).
- Beutner, E. H. Immunofluorescent staining: The fluorescent antibody method. Microbiol Mol Biol Rev. 25 (1), 49-76 (1961).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır