Method Article
マイクロマニピュレーション技術形成ダイナミクスの解析と細胞骨格のレギュレータの売り上げ高
要約
どのように FRAP など photoactivation のマイクロ ・ photomanipulation テクニック運動パラメーターの決定法を有効にして移行内のタンパク質の時空間ダイナミクスについて述べる。細胞内動態と回転運動の規制当局または基になるアクチン細胞骨格の実験的読み出しが含まれます。
要約
蛋白質の時空間的ダイナミクスを調べることは、さまざまなコンテキストでその機能の重要性を明らかにできます。この記事でそれは細胞レベル下の場所で蛋白質の時空間的ダイナミクスを研究する議論方法蛍光回復退色 (FRAP) と光技術を使用ことができますです。またこれらの技術がアクチン細胞骨格の調節および細胞の運動性にリンクされているさまざまなパラメーターの簡単な測定を有効にする方法を示す.さらに、細胞のマイクロインジェクションさらに記載されます (前または前述の photomanipulation 技術を補完する可能性のある) 代替治療としてトリガー瞬時に及ぼす転蛋白質の細胞形態と機能。マイクロマニピュレーション タンパク質注射または細胞膜透過性の薬や細胞骨格阻害剤の外用などが単一の細胞で、細胞内の細胞の変化を与えられた治療の直接の結果を記録するための強力なツールとして使用できます。レベル。これによって例証されるここで葉状の細胞の端の突起の即時誘導蛋白遺伝子組換え Rac1 注入による四半世紀の前を確立。さらに、我々 は強化された緑の蛍光蛋白質 (EGFP) の売り上げ高を決定するためプロトコルを提供-VASP、B16 F1 セルの葉状のヒントで蓄積され目立つようにアクチン フィラメント ポリメラーゼ FRAP を用いたなど関連データ解析と曲線フィット。タグ付きの EGFP β-アクチンを発現する細胞に代表されるよう、また葉状アクチン ネットワーク重合率を推定するためのガイドラインを提案します。急速なフィラメントのアセンブリ、ケラトサイト、突出のヒントなど photoactivation を使用してのサイトにおいてアクチンの設立に続いて、細胞の細胞内のアクチン単量体移動の率を調査する方法について指示がある最後に、近づきます。これらのプロトコルのどれもがコンポーネントまたはアクチン細胞骨格の調節だけでは類似しているファッション時空間ダイナミクスとさまざまな異なる細胞構造や機能タンパク質の機能を探索する簡単に拡張することができます。コンテキストです。
概要
蛋白質および他の分子の細胞内の時空間動態細胞および分子生物学の多くの分野で必要不可欠なツールになりました。高度な蛍光顕微鏡技術蛍光共鳴エネルギー移動 (FRET) FRET 蛍光寿命イメージング装置の (フレット FLIM) などまたは FRAP 蛍光退色 (フリップ) と光の損失と同様、他の多くを許可します。時間と空間の拡散の動力学とセル1,2つの蛋白質の局在を決定すると同様、タンパク質間相互作用、構造変化の追跡.特に FRAP 及び光技術、アクチン細胞骨格と細胞移動の規制を調べるため広く適用できます。これらの技術は単独でまたはマイクロインジェクション3など追加マイクロマニピュレーション技術との組み合わせで適用できます、蛍光標識したタンパク質の発現を伴います。彼らは糸状またはケラトサイト、焦点接着斑4蛋白質の売り上げ高など、細胞の移動に関与するタンパク質アクチンの豊富な構造会動態の推定を許可または分岐アクチン ネットワーク5。彼らはまた葉状アクチン重合率の定量、細胞質、突出のアクチン フィラメントの重合に細胞内のアクチン単量体転流の速度内単量体のアクチンの分散の評価を有効にします。ケラトサイト6、およびその他のパラメーター。
FRAP は、可視化とアクセルロッド7によって 1970 年代に開発された生きている細胞内のタンパク質の移動度を定量化の方法です。蛍光標識したタンパク質を設定、セル内の利益 (率 ROI) の領域は、時間の与えられた短い期間中にこの地域に存在の蛍光分子の漂白を引き起こすに十分な高強度レーザーに一過性公開されます。無漂白、ROI 外漂白中に、あるタンパク質を蛍光標識は、拡散し、時間をかけて photobleached 分子の変位を引き起こしている彼らの時空間ダイナミクスに応じて漂白地域に潜入します。漂白領域の蛍光回復率はサイズおよび特定の分子の拡散の速度など、さまざまな要因に依存して、もちろん推定以内の離職率は、漂白構造を関連付けられています。したがって、水溶性タンパク質の焦点接着斑などの構造体にしっかりと関連付けられている蛋白質中の拡散を介して急速に漂白の ROI 内の蛍光回復を仲介、回転時間が長くなる蛍光回復されますよう構造関連の端数のタンパク質と解離・会合反応の可溶性画分の拡散の両方に依存してください。蛍光回復は通常取得し、蛍光の前漂白剤強度の初期レベルに到達するまでを定量化します。ただし、初期の蛍光強度の一部拡散によって補充することができないいわゆる不動分画に属するまたは携帯電話を構成する分子の大半と比べて非常に遅い速度で補給する場合は発生しませんこれ割合です。タンパク質代謝回転の率を決定するには、時間をかけて蛍光回復の程度を表す FRAP 曲線が生成されます。これらの回復曲線からタンパク質の回収の平均半分時間を計算できます。カーブ フィットの平均 FRAP データ、およびそれゆえ数学的な解析を作成すると、それはモバイルの割合の平均離職率分子の 1 つの同質な人口の複合体を構成するかどうかで構成されるを推測することが可能も分子変化率でめくりの 2 つ以上の集団。定量的アプローチによるタンパク質離職率を推定、に加えてラメリポディアにおける photobleached 領域の回復を追跡もできます逆行流れ、前突のような葉状運動パラメーターの正確な定量化のためアクチン重合率。したがって、FRAP は生きている細胞の構造内のさまざまなパラメーターの評価に適用される汎用性の高いツールを構成します。
光は、拡散とタンパク質、分子細胞の指定された場所からの移動を追跡するために使用方法です。技術を採用、例えば、パターソンとリッピンコット シュワルツは8、その蛍光は高度への露出に増加することができる方法で変異が当初開発した野生型緑色蛍光タンパク質 (GFP) のバリアント紫外線 (UV) (約 400 nm; ここでは、405 nm)。パターソンらによる記述で。、野生型 GFP の発色団は、中性フェノールと約 397 で主要な吸収ピークを生成する陰イオンのフェノールの混合された人口として存在する nm および 475 マイナー 1 nm、それぞれ。紫外光を用いたタンパク質の照射、人口は光電、アニオン形へシフトを受けます。488 によって励起され、nm、photoconverted/センサー蛋白質蛍光性、高い固有バック グラウンド蛍光による GFP を非アクティブし、アクティブの間を区別するために練習不足の 3 倍の増加を展示します。ただし、背景強度の低下は GFP シーケンス (ヒスチジン置換位置 203) に単一のアミノ酸変異を導入することで達成されています。結果の T203H の変異、活性型 GFP (PA-GFP) は紫外線を照射後、488 nm の光によって励起され、ほぼ 100 倍増加したマイナー ピークの吸光度の大幅な削減によって特徴付けられるとも呼ばれます。したがって、PA GFP 付けられた蛋白質の過剰発現は細胞内の拡散の定量と分子の運動ができる広く使用されているアプローチです。我々 は以前の突出に細胞質だけでなく、その混入率内で自分たちのモビリティの探査だけでなく許可を PA GFP 付けられたアクチン アクチン単量体ゾル性細胞質の領域からの分散の率を決定するに適用しました。葉状アクチン ネットワーク6。最近の文献では、原則的に類似の方法で使用することができます、新しい写真に変換できるタンパク質についても説明しますが既に写真変換の前に表示されるように潜在的な利点をかくまっています。蛍光蛋白質のこのグループのための例には、Dendra2 と mEos29,10,11,12が含まれて。
この記事では、マイクロインジェクション細胞蛋白質との方法論を説明します。我々 はさらにたたきでこの手法を結合する退色タンパク質アクチン細胞骨格制御と運動性に関与する方法、FRAP 曲線とモバイル分数の回復の時間の半分の派生を説明します。加えて、我々 は FRAP 手法を使用して、葉状ネットワークのアクチン重合率を決定する方法の例を提供します。指示と単量体のアクチンの細胞内移動とアクチン ケラトサイト混入率を決定する使用ことができます光の実験を実行する方法についてのヒントをお願いいたします。もちろん、これらのテクニックはありませんアクチン細胞骨格部品を追跡するが、潜在的に必要な適度な適応または最適化時にのみ、広く適用できる他のセルタイプまたは構造、異なった蛋白質を調査してパラメーター。
プロトコル
1. Coverslip の洗浄と殺菌
- 15 mm (直径) カバーガラス (その 1) 40 mL 37 %hcl と 60 mL 100% の混合物を含む 500 mL フラスコを浸しエタノール (洗浄ソリューション 100 mL あたり 100 以上 coverslips)。
注: 新しく購入した場合でも coverslips 必要があります厳しく洗浄する表面上に細胞を播種する前に。これは肉眼的に見えないが、接着と生きているセルの適切な広がりを妨げることができます効率的にグリースの薄膜を含むかもしれないためにです。そのようなフィルムを効率的に酸または塩基を含む溶液で削除できるに対し (フィッシャーらを参照してください。13)、我々 は日常的に上記酸/アルコール混合物を使用します。 - 含有回転シェーカー上で 30 分間カバー ガラス フラスコを振る。自由に旋回するが、頻繁に破壊を避けるために十分にゆっくりカバーガラスを可能にする速度を選択します。再利用する場合は、壊れたガラスの破片を削除するソリューションをろ液します。
- 少なくとも 200 mL 滅菌水の入ったフラスコにカバー メガネを転送し、酸性の臭いが消えているまで何度も水を交換しながら回転シェーカーで孵化させなさい。数時間にわたって複数の洗浄は、塩酸エタノール トレースの完全な除去に適しています。
- フィルター紙のシート上の個々 のカバー ガラスを乾燥させます。
- 場所 (直径) 10 cm シャーレの下部にカバー メガネ フィルター ペーパーおよび熱カバー ドライ滅菌します。カバーガラスにくっついてしまうのでオートクレーブに入れることは避けてください。
2. 細胞、トランスフェクション、カバーガラス上播種の治療
- 10% ウシ胎仔血清、2 mM グルタミンと 37 ° c, 7% CO21% ペニシリン-ストレプトマイシンを含む DMEM (4.5 G/L グルコース) の標準的な細胞培養条件によると F1 B16 マウスメラノーマ細胞を成長します。
- DMEM (4.5 G/L グルコース) 含む 10% 牛胎児血清、1 mM ピルビン酸ナトリウム、1 x MEM 非本質的なアミノ酸標準培養条件 (37 ° c、7% CO2培養インキュベーター) に従って薬剤の NIH3T3 線維芽細胞を成長します。、2 mM グルタミンと 1% ペニシリン-ストレプトマイシン。
- Transfections、B16 F1 セルを 3 cm (直径) プラスチックの皿に 10 センチメートルの皿と 1:5 の比率で通路で 100% 合流点まで増えます。
- 同じ日に B16 F1 セルが少なくとも 6 時間の遵守が許可された後は、活性型 GFP PA アクチンの 500 ng/皿またはタグ付きの EGFP β-アクチン プラスミド DNA transfect します。MCherry エンコード ベクトルを用いた PA GFP アクチンの共同 transfections は、1 μ g のプラスミド DNA 3 cm 皿あたりの合計を混在させます。
- トランスフェクション試薬 (材料表) と B16 F1 セルを transfect します。3 cm 皿ミックス 150 mm NaCl 500 を含む 200 μ L 150 mm NaCl のトランスフェクション試薬の 1 μ L を含む 200 μ L で ng の DNA の構築 (すなわちDNA (μ g): 試薬 (μ L) 1:2 の比率が使用された)。
- トランスフェクション混合物常温 (RT)、ピペットで移しなさい drop-wise セルを含む 3 センチメートルの皿の上に 20 分間、インキュベートします。優しく料理をミックスし、37 ° C、7% CO2で一晩インキュベートを旋回します。
- 50 mM トリス、pH 7.4 と 150 mM の NaCl を含むラミニン コーティング バッファーを準備します。
- B16 F1 セルのラミニン (ラミニン コーティング バッファーで 25 μ g/mL) の 150 μ L を広めることで 15 mm カバーガラスをコートし、室温 1 時間インキュベートNIH3T3 細胞のフィブロネクチン溶液 (リン酸緩衝生理食塩水 (PBS) で 25 μ g/mL) でカバーガラスをコートし、室温 1 時間インキュベート
- PBS、ラミニン、フィブロネクチン培養カバー ガラスを洗浄し、PBS を吸引 transfected セル 2 mL を加えます。
- シード transfected B16 F1 セル (1:30 に合流皿から比)、ラミニン被覆カバーガラス上、トランスフェクション後の日に。NIH3T3 細胞を播く (1:20 で合流の皿から比) フィブロネクチン被覆カバーガラス上。
- 細胞の顕微鏡の前に 37 ° C で培養インキュベーターで一晩ラミニン、フィブロネクチン コート カバー ・ メガネに広がりを許可します。また、顕微鏡実験は細胞は少なくとも 2-3 h の普及できることを考えれば、同じ日に開始できます。
3. 顕微鏡イメージング商工会議所総会
- イメージング顕微鏡検査 (図 1、) のため商工会議所熱導電性 RC 26 アルミを使用します。注射器 (図 1b) を使用して、プラスチック製のシーラー オープニングの輪郭の周りにシリコン グリスを塗る。
- 商工会議所 (図 1c) に細胞側でカバーガラスを配置します。
- Coverslip と商工会議所との間のセキュリティで保護されたシールにカバーガラスの上にプラスチック製のシーラーを配置します。漏れ (図 1d) 媒体を避けるために商工会議所にスライド式のクランプをねじ込んで (斜め coverslip の破損を避けるため) にプラスチック製のシーラーを修正します。
- ピペット 37 ° C 予熱した顕微鏡媒体中心部に。蛍光が小さくなり、したがって顕微鏡用に最適化、中、上記が f12 キー-ハムではなくさらに CO2 (図のない状態で細胞を培養するため 20 mM HEPES を含む DMEM 培として同じレシピを使用します。1e)。
- 商工会議所の指定されたスロットに熱感知器を挿入し、商工会議所の電極を 37 ° C (図 1f) の一定した温度を維持する TC 324B 自動温度コント ローラーにリンクします。
- 目的に浸漬油の小滴を置き、上に商工会議所を配置します。
- チャンバー内に取付時の温度低下から回復し、顕微鏡媒体に適応できるように、少なくとも 10-30 分のための細胞を孵化させなさい。
- 顕微鏡が開始される前にメディア コンポーネントおよび培地の蒸発により血清の不適切な集中を避けるため商工会議所 (約 800 μ L) の中央貯蔵所で培養液を取り付けます。開いている部屋で長時間顕微鏡セッションは、蒸発中のルーチンを変更する必要があります。
4. 注入法
- コート、coverslips、細胞を準備し、上記のようにイメージングの商工会議所を組み立てます。
- 注入する浄化された蛋白質の因数を解凍 (通常 10 μ L 以下) と適切なマイクロインジェクション バッファーで希釈します。
注: バッファー組成にタンパク質と細胞の種類によって異なりますが 6.95 と 8.00 の間の pH を使用して PBS を使用しないように世話をほとんどセル PBS を注入すること好きではないようです。 - Rac1 マイクロインジェクションの 100 mM の NaCl、50 mM トリス塩酸 pH 7.5、MgCl2, 5 mM 1 mM DTT を格納するバッファーを準備します。Mg2 +イオンは小さい gtp アーゼの安定性に不可欠です。
メモ: タンパク質濃度は通常 0.1-1 間異なる mg/mL (最大 2 mg/mL)、蛋白質によって、実験、およびセルの種類を入力します。 - 該当する場合は、注射の前に針流の存在を確認することができ、実験後の成功した注射のマニュアルを許可をタンパク質溶液に不活性デキストラン (0.5 μ g/mL, 70 kDa) などの蛍光色素を追加します。
注: 次注入 Rac1 のダイナミクスの直接蛍光標識タンパク質のリクエスト可能になるのみを目指したがないここでの実験。蛍光色素や蛍光タンパク質を融合蛋白質の結合は可能、しかし回避ここ Rho ファミリー GTPase Rac1 のような小さい蛋白質の特定のシグナリングの機能に支障を及ぼすおそれを抱いてそれに (20 kDa)。 - 針の目詰まりキャピラリーのマイクロインジェクションに存在する場合につながるタンパク質の凝集体を削除する、少なくとも 30 分間、10,000 × g でタンパク質溶液を遠心します。
- 柔軟なピペット チップ/microloader チップを使用して後ろ側から 1 μ L 注入混合物のマイクロインジェクション針 (マイクロインジェクション毛細血管) をロードします。
- 空気の泡が針の先端に存在する場合、それらを削除するために針ベースを軽きます。針の先端は、ニードルの目詰まりの原因の乾燥を避けるために急速に進みます。
- マイクロマニピュレーション デバイス上の持針器を慎重に調整します。針ロードする前に、位相コントラスト イメージングに倒立顕微鏡を使用する顕微鏡コンデンサーを妨げることがなく針を上下に移動するのに十分なスペースがあります。
- 針ホルダーにマイクロキャピ ラリーをねじ込む時に細胞培養液に針の先端を透過する前にマイクロインジェクション加圧装置を使用して針に圧力 (20-50 hPa 背景圧力) を適用します。
注: 媒体、針のときの圧力をアクティブにするを毛管力によって吸引される中で結果、従って興味のソリューションの注射を禁止します。 - (容易に低倍率の目的を使用して) ビューのフィールドに針を置きます。マイクロインジェクション実験用 40 × 乾燥対物はここに使用されました。
- 肉眼的 (これは加速する針の先端を見つけること) 対物レンズの中央を基準にして垂直位置に針の先端を配置します。位相差光学顕微鏡を使用すると、ビューのフィールド、光学面を基準にして水平面内針の先端も上記細胞層に移動します。
注: 針最初ビューのフィールドに影として表示され、焦点面は、先端を視覚化する調整できます。針の先端が見つかったら、細胞層に近い位置の下に針の先端が続く光の平面を徐々 に低きます。 - 蛍光デキストランを使用するとき蛍光チャネルに切り替えることによって針の流れを確認するし、圧装置を使用して一定の「背景」の流れを取得する流れを調整します。
注: この記事で述べる接触セルを介して細胞膜を壊すことによって媒介される手動注入表面し、定針フロー中に針先の動きを穏やかな。これは後細胞集団に続いて高い細胞数の注入に適している注入イベント中にプログラムされた針を下げるとニードル圧力増加を伴う自動噴射装置から区別されねばなりません。解析。ここで説明する方法は、および、マイクロインジェクション前後後タイムラプス顕微鏡による単一細胞解析に最適です。 - 興味のセルは、セルの上針は徐々 に低きます。
- Microinject する準備ができたら、フォーカスでセルを保ちながらマイクロマニピュレーター ジョイスティックの罰金のピニオンを使用して細胞核領域に向かって徐々 にニードルを下げます。
- マイクロインジェクション、細胞膜、細胞内に侵入、または顕微鏡のセットアップに非常に穏やかな蛇口での過渡膜破裂を援助するだけで十分ですが、セルをそっと触れます。
注: 針の先端に白いドットはプラズマ膜との接触の時間を示します。針の先端が再シール膜破裂、次のセルに注入剤の穏やかな流れを伴います。 - セルへの流れが見えるとすぐに注入プロセスを停止 (理想的には 0.3 以内 s) 媒体に針の先端を移動することによって。蛍光デキストランを使用する場合、成功した注射は蛍光によってすぐに化も。
- 必要な場合は、コマ撮り画像集録、マイクロインジェクションの前後を開始します。
注: 薬物や阻害剤のローカル アプリケーションはここでは、すべてのステップで、マイクロインジェクション イベント自体を除いて実行できます。ローカル アプリケーションの実行中の分子の拡散を流量圧力によって制御および蛍光、文書化でき、針の先端を目的の高さに配置できます。ローカル アプリケーション実験の例としては、例えば、中小企業ロットナー14または Kaverinaらを参照してください。15 - 次の顕微注入、タンパク質の効果が発生するまでを待ちます。異なった蛋白質のためと期待される成果に応じて、インキュベーション時間が異なる場合があります。小さい gtp アーゼ Rac1 lamellipodium 形成の反応開始 1 分以内またはそれ以下にすることができますが、(図 1g, h) を完全に開発する平均で約 10-15 分かかります。
- マイクロインジェクションの後の細胞の生存率を判断します。
注: 不適切または有害な注射は、非固有セル端撤回や細胞膜破壊を伴っている頻繁になる細胞損傷を引き起こす可能性が。- フラット細胞領域で注射のため発生する可能性が、上部と下部の両方の細胞膜をつつきは避けてください。
注: 注入量を最小限に抑える必要があります (理想的に < 細胞容積の 5%)、通常用いた範囲になります。必要な注入量、濃度の変化によっても制御できますが、タンパク質濃度の > 2 mg/mL を頻繁に針の目詰まりによる非実用的になる可能性があります。ただし、これはまた、品質と精製タンパク質の挙動に依存します。例えば、蛍光結合アクチンの注射は針の先端の濃度に依存し、やむを得ない重合により、複雑し、これが今日実行されるほとんど (小さいらを参照してください。16)。
- フラット細胞領域で注射のため発生する可能性が、上部と下部の両方の細胞膜をつつきは避けてください。
- 前に中、または、マイクロインジェクションの効果の後、FRAP や光に対して実行できる同じセル (セクション 5 および 6 を参照)。
5. FRAP の手順
- Transfect プラスミッド DNA の蛍光タグ興味の蛋白質を符号化と利子 (B16 F1 細胞) の細胞型 (ここでは、β-アクチンの EGFP タグ付きバージョンを使用)。ラミニン被覆カバーガラス (ステップ 2.10) 上細胞を播きます。
- イメージングの商工会議所 (セクション 3) を組み立てます。
- 葉状地域退色の次の設定を使用: 65 mw レーザー (変数実験のセットアップおよびレーザーのソースによると);10 ピクセル レーザー ビーム径;1 ms の漂白剤ドウェル時間/ピクセル;500 ms GFP 露光時間;1,500 ミリ秒の時間間隔。100 X 1.4NA アポクロマート目的で本実験を行った。
- Photobleached 領域の寸法の精度を確保するためのレーザー校正を実行します。前に、任意のセル/蛍光信号を欠けている領域にビューのフィールドを移動し、ディスプレイ上の画像を確認します。
- それぞれ拡大ボタンをクリックして対物レンズの倍率を選択し、(3-5 mW) のレーザー出力を削減、"パネル |強度」メニュー。Visiview ソフトウェア (v2.1.4) 手動キャリブレーションを開始するを選択、"構成 |FRAP」メニューをクリックし、"調整 |マニュアルを調整」メニュー。シャープなドットとレーザーを区別できることを確認します。そうでない場合、再び焦点を合わせるまたはレーザー ハードウェアを調整します。
- 手動であらかじめ決められたソフトウェア X-Y 座標にレーザーを導くことによって、キャリブレーションを実行します。これはソフトウェアに具体的には現在の拡大率をユーザー定義の領域にレーザーをターゲットにする方法を指示します。
- レーザーをトリガーする前に GFP のチャネルに切り替えるし、画像/時間経過の取得を開始します。
- ディスプレイを見ながら GFP チャンネルで photobleached をする領域を手動で描画します。
- 405 nm レーザの手動トリガー画像集録の開始後、少なくとも 3-4 フレーム退色を開始します。退色前のフレームを取得は、後でデータ分析で画像の正規化に必要です。
6. Photoactivation の手順
注: ソフトウェア、顕微鏡のセットアップ、設定、レーザー パワーを除いて FRAP のものに似ています。Photoactivation、たたきと比較して重要な違いは、405 nm レーザー電源よりかなり低い PA GFP を同時に退色せずにアクティブに、退色を使用する必要がありますを採用すること。
- 共同関心のセルタイプを transfect (B16 F1 ここ細胞; ステップ 2.5 を参照) プラスミド DNA にエンコード PA GFP アクチンと別の蛍光標識したタンパク質 (例えば、 mCherry または mCherry Lifeact)。
注: ほとんどの場合、mCherry 陽性細胞もなります PA GFP アクチンのベクトルは、後者の photoactivation の前に GFP チャネルでは通常見られ肯定的です。MCherry 陽性細胞も PA GFP 陽性であることのチャンスを高めるためには、mCherry:PA の 1:2 のトランスフェクションの比率を使用して-GFP-アクチン。このプロトコル、mCherry を発現している細胞の 90% 以上と、PA GFP アクチンの巧妙な活発化が表示されます。 - ラミニン被覆カバーガラス (ステップ 2.10) 上 F1 B16 細胞を播きます。
- イメージングの商工会議所 (セクション 3) を組み立てます。
- Photoactivation の実験を開始する前に必要な場合は、選択された目標 (ステップ 5.4-5.6) でレーザー調整を実行します。
- 500 ms (実験計画) によって露出と 1,500 ms 間隔に GFP/488 nm の画像の取得を設定します。
-
ソフトウェアの設定を調整する「波長シリーズ」正方形をマーキングし希望のチャンネル数を選択することによってデュアル チャネルやトリプル チャネルの時間経過映画を取得、"取得 |波長"メニュー。時間経過映画に位相差顕微鏡および GFP チャンネルがつけたことをお勧めします。
- 必要に応じて、mCherry チャネルがあります。ただし、光損傷を誘発する可能性がありますあまりにも多くの光を細胞を公開します。これは、セル室のシールに効果的な治療の必要がありますが Oxyrase17など酸素スカベン ジャーと避けることができます。
- MCherry チャネルの transfected セルを検索します。
- レーザーをトリガーする前に画像/時間経過集録を開始し、位相コントラスト チャンネルのセンサーに表示領域を手動で描画します。
- 405 nm レーザの手動のトリガーの photoactivation を開始 (から 5-15 mW 間の強度設定、「パネル |強度」メニュー)、画像集録の開始後、少なくとも 3-4 フレーム。
7. データの解析と縛る結果のプレゼンテーション
注: この場合は癒着と突出ケラトサイトの先端に関連付けます、VASP のアクチンの動的アセンブリのサイトで蓄積蛋白質の売り上げ高を調査するため提示メソッドを使用します。Lamellipodium 先端での売り上げ高を分析しているが、VASP または他の蛋白質および他の細胞内コンパートメントの売り上げ高を調査するための分析の同じ原則を適用できます。
- 久万ソフトウェアの Visiview から派生したコマ撮りムービーを開きます。この記事では、久万 v7.8.10 が使用されました。
- 手動でアウトライン久万のそれぞれの領域によって photobleached 領域の輝度値を導出します。葉状の強度の変化を追跡ために (すなわち端が突き出ている場合)、必要な場合 photobleached 領域の一部または全体をカバーし、後続のフレームの位置を手動で調整 lamellipodium の先端の形状を描く先端変位時に各コンポーネント。
- 背景とフォトブリーチを行なった買収の補正のため、細胞外領域を分析します。図 2、測定された強度の代表的な地域を参照します。
- ROI を選択して、メニューを使用して久万で強度値を抽出」メジャー |地域の測定」。「設定」メニューの「経過時間」と「平均強度」のオプション選択を確認します。「ログを開く」をクリックし、「動的データ交換」を選択。Excel スプレッドシートを開くし、久万値を Excel に貼り付けるに再び「ログを開く」ボタンをクリックして"OK"をクリックしてします。
注: これらの値は、蛍光の回復曲線を生成するために使用されます。 - (退色する前に領域の強度に正規化) photobleached 地域の lamellipodium 先端の蛍光回復曲線を生成すると、次の式が適用されます。
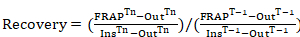 式 1
式 1
場所: FRAPTnは次のフォトブリーチング; 興味の各フレームの photobleached 地域の強さTnは興味の各フレームのセル (背景) の外部にある領域強度以下フォトブリーチを行なった。InsTnは、(時間をかけて買収フォトブリーチング正規化に使用); 退色、次の興味の各フレームの領域強度内平均 2FRAPT-1はフォトブリーチング; 前に photobleached 領域強度です。T-1は退色。 前に、のセル (背景) の外部にある領域強度です。InsT-1が退色する前に興味の各フレームの領域強度内平均 2. - 興味の時間フレームごとに方程式 1を使用して、調査するすべてのタイム フレームを含む蛍光回復曲線を取得します。時間の長さは厳密に調査中のタンパク質に依存しています。不明ですが、タンパク質の離職率を取得する予備的な実験を実行します。
- 回復の半分の時間を計算する、シグマ プロット (v.12) に対応する時間 (単位は秒) の蛍光回復曲線の値を貼り付けるし、フィットを使用して曲線を実行、「ダイナミック フィット ウィザード |最大指数上昇は"ツールです。[モノラル指数 (シングル、3 つのパラメーター) または bi 指数 (ダブル、4 パラメーター) によって最高のカーブ フィット機能。
- モノラル指数関数に次の数式を使用します。
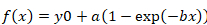 方程式 2
方程式 2
- Bi 指数関数に次の数式を使用します。
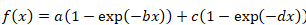 式 3
式 3
- パラメーター"b"と"d"回復の半分時間を計算する Excel にシグマ プロット (式 2または式 3) から派生を貼り付けます。次の式が適用されます。
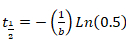 方程式 4
方程式 4
または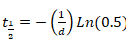 式 5
式 5
- モノラル指数関数の結果に合わせて正確な曲線として、方程式 4のみが適用されます。
- モノラル指数関数が良いカーブ フィットされない、式 4と式 5を解くことによって bi 指数の数式が適用されます。2 つの異なるタンパク質分数を表すものとして回復の結果 2 半分時間を検討してください: 急速とゆっくりと交換率それぞれ。
8 FRAP 葉状アクチン重合率の決定
- 葉状アクチン重合速度を決定する、EGFP タグ β-アクチン、B16 F1 セルを transfect photobleach 葉状地域 (ステップ 5.9) は 1.5 秒間隔と 500 ms GFP 露出して。
- 久万, で Visiview から取得したコマ撮り映画を開き、使用目的に従ってピクセル/μ m 比を調整、「メジャー |距離を調整」ツールです。
- コマ撮りムービーを再生し、後方に流れる線としてラメラに向かって、葉状の蛍光回復がラメラに到達し、さらに後方の流れを追跡できるときフレームにそれを停止します。
- Μ m、lamellipodium の先端と回復した蛍光の背面との間の距離を測定します。この距離は、逆行の流れと突起の距離の合計に相当します。
- また、逆行性の流れから突起を分離する変質する前にラインの 1 つのフレームで葉状の先端をマークします。行の参照としてポイント フォトブリーチング; 時 lamellipodium 先端の元の位置を参照する後続のフレーム使用突起の距離と逆行性を測定する基準点を使用できます。
- 発生する退色後蛍光回復に必要な時間 (単位は秒) を注意してください。時間がフレーム レートから手動で計算するか、久万を可視化した、"メジャー |領域測定」ツールです。
- (8.4 と 8.6 の手順から久万測定に基づくいくつかの方程式のパラメーター) に次の式を使用してアクチン重合速度を派生させます。
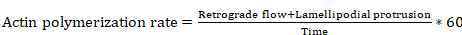 方程式 6
方程式 6
どこアクチン重合率は μ m/分で、逆行性距離は μ m で、葉状突起の距離は、μ m、時間は秒単位。
9. タンパク質拡散と光に移動の解析
メモ: ここで紹介した方法は、可視化と細胞質内タンパク質拡散過程の定量化に示すように、PA-GFP を融合したアクチンの photoactivation を用いたアクチン単量体移動の分析を示します。
- ゾル性細胞質領域として葉状領域内で蓄積から活性型アクチンの拡散を測定、次の地域で時間をかけて強度を決定する久万を使用 (図 3に示す、): 細胞内センサー領域 (PA);葉状の地域、どのセンサー蛋白質 (ラム); 時間をかけて蓄積を見込んでいます(うち) 背景の蛍光性の正規化に使用される細胞外領域。
- アクチンは細胞質内での流動性を判断するには、(図 3に、領域 R1 R5 を参照) のゾル性細胞質領域を測定します。フォトブリーチング買収を起動時に焦点 - および最終的に細胞全体の蛍光性の増加のためにたたきと同様の方法で特定できないことに注意してください。
- 7.4 の手順で説明するように、すべての地域の強度値を Excel のスプレッドシートに久万から転送します。
- Photoactivation のゾル性細胞質領域や定款 (0 時ゾル性細胞質センサー領域のパーセントの強度として表される両方) 葉状領域内の速度から活性型アクチンの変位率を調べる、ステップ 9.3 のデータから蛍光曲線を生成します。次の式が適用されます。
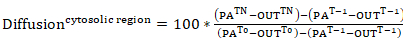 方程式 7
方程式 7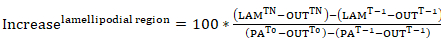 方程式 8
方程式 8
場所: PATnは次の photoactivation; 興味の各フレームのゾル性細胞質センサー領域の強度ラムTnは次の photoactivation; 興味の各フレームの葉状部強度です。Tnうちは興味の各フレームに対応するセル (背景) の外部にある領域の強度以下 photoactivation;PAT-1は photoactivation; 前に細胞内センサー領域の強度ラムT-1は photoactivation; 前に葉状部強度です。T-1は photoactivation。 前に、のセル (背景) の外部にある領域の強度PAT0はゾル性細胞質センサー領域の強度時間 0 (すなわち、最初のフレーム photoactivation 後);T0は 0 (すなわち、最初の photoactivation 後フレーム) の時点 (背景) セルの外部にある領域の強度。 - 必要に応じて、データのより良い視覚化のためには、後続の各フレームから photoactivation 後最初のフレームの強度を引いて 0 強度曲線を正規化します。
メモ: 次の分析メソッド (手順 9.6-9.8) も細胞質内センサー アクチンの細胞内の分散を計算できます。 - 連続的に賦活部位から遠位配置されているゾル性細胞質領域の強度を測定します。
- 時 0 にセンサー領域のパーセントの強度としてこれらの地域の強度を表す、方程式 8、葉状強度の強度と各のゾル性細胞質の ROI を置き換えられますを適用します。サイズと地域の数は、測定するセル サイズと飛散距離によって異なります。
- センサー蛋白質のゾル性細胞質地域ごとの浸潤率の定量値を算出、シグマ プロット (セクション 7 で FRAP 解析に類似) に時間と各地域の蛍光強度が増加曲線の値を貼り付け、を使用するには2 方程式方程式 4プラトーに達することの蛍光強度の半分時間を導出します。異なる実験グループの間 t1/2の値を比較します。
結果
図 1 ghは、事前 NIH3T3 線維芽細胞の位相コントラスト画像と 10 分後マイクロインジェクション Rac1、小さな Rho ファミリー GTPase の複雑な波との相互作用を通じてケラトサイト形成を誘導することが可能であるを示しています。セルは、最初その生存率と形態、ケラトサイトの欠如など、確認してマイクロインジェクション (図 1g)、前に可視化します。10 分後のインジェクションでセルは明らかに成功した注入 (図 1h) を表し、この治療から期待されて、その形態を変更されました。
シンプルさと透明度、次の細胞は、さらに microinjected されていない FRAP ・光分析模範的な結果を提供します。
図 2a ~ fに EGFP タグ VASP lamellipodium 先端の回転の分析を示します。VASP さらに新生と焦点接着斑、小さくて細長い細胞内部18,19ドット対象であることに注意してください。先端に明確な VASP 蓄積と葉状領域の蛍光強度は漂白され、各時間フレームの前に、中、および、lamellipodium 突出転送、漂白後、ROI の輪郭に従うことによって測定します。漂白の EGFP VASP タンパク質は、これらのサイトでの分子の非漂白によってリサイクルされています、蛍光の緩やかな回復は観察した (図 2b)。FRAP 復旧曲線 (表記 1) 事前ブリーチ強度に正規化し、この方法で得られるは、図 2cで見ることができます。フォトブリーチング効率が変わることができるし、t0 の値から決定するように、この例では漂白する前に、値の約 20% であった (退色後最初のフレーム)。漂白する前に蛍光の約 80% で示されている例では高原を蛍光の増加に達する。回復は、(の場合、図 2の赤い矢印の不動の割合として定義後に事前ブリーチ強度と高原蛍光の違いに達して焦点接着などの実験の経過中に静的な構造でc、e)、漂白および完全復旧の時間の間回復した蛍光性の量に対しはモバイルの分数 (図 2c、eの緑矢印に変わったら) として定義されます。ここ分析 lamellipodium ヒントなど動的に変化する構造で IF の範囲可能性がありますだけでなく不動の分子を表すが、EGFP VASP 強度はこれに依存して知られている隆起速度の減少を由来パラメーター18。回復の半分の時間を計算するため、フィット カーブはシグマ プロット (図 2d) に作成されました。この場合、方程式 2を解決から抽出した"b"パラメーターの値は等しい 0.0754、するときに対数関数 (式 4) に適用 9.19 の回復の半分の推定時間の結果 s (図 2d、右端のパネル) は比較的高速、平均と比較してこの特定のセルには、以前5公開します。それは、回復 1.5 倍異なることがあります時々 大幅セルからセルに同じ集団内で注意しなければなりません。したがって、代表的な結果を得るため、少なくとも 15-20 セルから平均値としてこのパラメーターを決定することをお勧めします。15 セルの平均 EGFP VASP 回復の算術平均の分散の度合いを説明するために各時点が生成された (図 2e) と平均曲線適合作成し、似ています (図 2で表示されます。f)。
葉状アクチン ネットワークの重合率には、フォワード ネットワーク突起と逆行の流れの合計が装備されています。FRAP は、EGFP タグ β-アクチンとフォトブリーチング葉状突出地域 (図 2g) (この場合は B16 F1) で株細胞のアクチン重合速度を測定するために適用できます。葉状アクチン ネットワークの重合反応の解析、EGFP タグ β-アクチンの漂白時に蛍光回復時間をかけて評価が。(これはすべてフロント20に向かってポイント) 葉状アクチン フィラメントの有刺鉄線の両端にアクチン単量体が進む重合、ネットワークは常に転後方と転送、進行率を簡単にすることができます。退色時の蛍光の偏光の回復を介して取得。Lamellipodium の蛍光回復が完了するとすぐに漂白のゾーン、lamellipodium の背面部分とより多くのフィラメントの水平配置バンドルの低密度によって特徴付けられるラメラ間遷移領域に達しています。ひっくり返ること、lamellipodium で観察されたものよりもはるかに遅く。突起と逆行 (個別に代表される流れの距離を測ることができますラメラへの逆方向の端に水平ラインとしての蛍光回復を視覚化できます図 2gに示すように、オレンジと赤の矢印に変わったら、として図 2gの右端のパネルでそれぞれ)。
また PA GFP アクチン細胞質のアクチン単量体の移動とケラトサイトの突出に含める率を追跡するための B16 F1 セルに光に用いています。405 nm レーザーへの露出によってセンサー図 3a、bに示すように、ゾル性細胞質領域には、画像は、GFP に買収された中チャネルごとの 1.5 s GFP タグ、センサー アクチンの分布を可視化します。図 3bのゾル性細胞質領域拡散センサー GFP アクチンを見ることができます。センサーのゾル性細胞質領域の蛍光強度の減少率は t0 で初期強度の割合として表されます (最初 photoactivation; 後フレーム図 3c). センサー アクチンはまたケラトサイト、突起の中にアクチン フィラメントを伸長の成長とげのある端に新しいアクチン単量体を追加する場合の先端に統合します。葉状の混入率を推定するには、約 5 μ m の幅と高さに 1 μ m の 2次元輪郭/地域の時間をかけての蛍光強度を測定しました。地域が突出してそれと lamellipodium の先端に常に再配置されます。アクチン結合は t0 でセンサーのゾル性細胞質領域の蛍光強度の割合として表された (図 3d)。アクチン フィラメントの伸長に伴って新しいアクチン単量体が葉状の前面に組み込まれました。これらのアクチン単量体のほんの一部は、モノマーがセンサーをしたゾル性細胞質のプールから派生した確率的。これは、結果最初の 20 ラメリポディアにおける蛍光の急激な増加、photoactivation 後 s。葉状のフロント、逆行性流れによるラメラへフィラメントを以前組み込まれたアクチン単量体流に新規モノマーを追加されています。時間をかけて、投資収益率は完全に満ちている蛍光モノマーと蛍光のプラトーに達する (図 3d)。細胞全体のセンサーのモノマーの拡散に続くとき蛍光の漸進的な低下はさらに観察を非センサー アクチン単量体ますます再に追加されている葉状フロント。この蛍光の減少は、センサーとセンサー以外の単量体間のセル全体のバランス (データは示されていない) に達するとすぐに到達する新しい高原を見つけるでしょう。
細胞質中のアクチン単量体の可動性は等しいサイズ (図 3、ラベルの色分けされた地域によっての代表されるセンサー領域から遠配置の地域で蛍光強度を測定することにより派生しました。R1-R5)。図 3eで示すように、これらの領域のそれぞれの蛍光強度から離れて減少しつつ、cytosolically センサー領域センサー アクチン単量体の一部となるますますで希釈アクティブ化されていない (つまり、非蛍光) 単量体。さらに、蛍光のピークに達する後で: より遠い測定地域のあるセンサー領域からこれらの地域に拡散してアクチン単量体に必要な時間が長くなります。蛍光高原に達するの半分の時間を定量化することで、各地域にアクチン単量体浸潤度の代表値を派生できます。遠くにびまん性に存在するアクチンをセンサーにかかる地域は、もはや、従ってより多くの時間は蛍光高原に到達するのに必要な高い t1/2値 (図 3e) に 。

図 1: 商工会議所アセンブリ、マイクロインジェクション プロシージャをイメージングします。(、) のイメージングの商工会議所のコンポーネント。(b) シリコン グリスをプラスチック製のシーラーの開口部の周り慎重に塗った。(c)、coverslip はセル側イメージング チャンバー開口部に上向きに配置されます。(d) 安全シールを設立、coverslip の上にプラスチック製のシーラーを配置することで、側面のクランプを締めて。(e) 顕微鏡媒体は、商工会議所スロットに戻です。顕微鏡ステージにイメージング室 (f) が配置されて、熱感知器、電極は 37 ° C に設定事前加熱装置にリンクされて、細胞は顕微鏡を開始する前に、少なくとも 30 分の適応できます。この例では、顕微鏡ステージも装備マイクロマニピュレーター薬剤を実行するため、マイクロインジェクション針は、イメージングのチャンバーに細胞層をカバーする媒体に浸したもの。(g)、NIH3T3 線維芽細胞はマイクロインジェクションの前に位相差顕微鏡による可視化します。核コンパートメントの赤十字は、かさばる核に近いのため高い細胞質領域に対応する将来のマイクロインジェクションの場所を示します。Rac1 と 10 分以下 (h) マイクロインジェクション、セル (緑色の矢印によって示されます) セル全体周辺ケラトサイトの著名な形成によって反応します。この図の拡大版を表示するのにはここをクリックしてください。

図 2:FRAP タンパク質回転または葉状アクチン重合の速度を決定することができます。示される葉状部退色する前に EGFP VASP を表現する B16 F1 セルの (、) の代表例です。別様に着色された輪郭/図形蛍光強度測定の時間の経過と考えられていた領域を示すラベルが付けられます。メモ赤い輪郭感嘆符、複数の小胞と細胞表面フリルを含む領域に配置されているゾル性細胞質領域のラベルを付けられます。彼らが不正確な結果を引き起こす可能性があります蛍光の強い短期的な変動によって特徴付けられる、このような動的な領域は蛍光参照領域を選択するため避けてください。(b) 葉状 EGFP VASP 発現細胞前に、と退色後の領域。時系列的に視覚化が紫でマークされた領域内で退色後蛍光信号の回復。矢印はアクチン フィラメントの高密度のために可能性が高い VASP の濃縮、マイクロ スパイクの先端を示します重合が19。縛るの例 (c) 復旧曲線としては b 赤 photobleached lamellipodium (紫色の輪郭) の蛍光強度の定量化から派生し、右側の緑の線は、それぞれ、不動とモバイルの分画を示します。(d) A は c (左側のパネル) で縛る復旧曲線と回復半分時間 (右側のパネル) を導出するために使用する計算法の例のフィット。FRAP 復旧の例 (e) 曲線は、サンプルの母集団内の可変性を示す SEM バーで 15 細胞の蛍光回復曲線を平均から派生します。(f) カーブ フィットは、平均 15 セル (左側のパネル) と回復半分時間 (右側のパネル) を導出するために使用する計算法の例の FRAP 回復曲線フィットから派生します。(g) 葉状部漂白示されるように、上に続いて、lamellipodium の蛍光回復時間の前後にタグ付きの EGFP β-アクチンを表現する B16 F1 セルの lamellipodium を突出のタイムラプス パネル。右端のパネルでは、突起の測定値と逆行の距離が提供されます (オレンジと赤、それぞれ)。画像パネルの下の計算では、突起と逆行の距離の合計を使用して葉状アクチン ネットワークの重合率を導出する方法を明らかにします。この図の拡大版を表示するのにはここをクリックしてください。
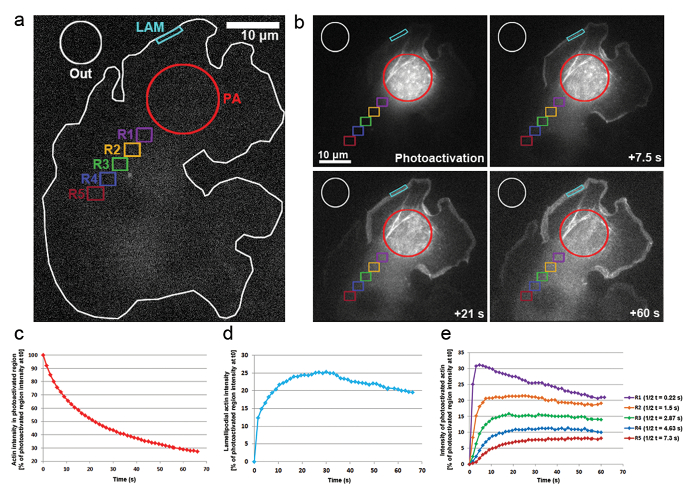
図 3:PA GFP アクチン単量体細胞全体の追跡のための Photoactivation 。赤丸 (PA) ゾル性細胞質領域の光をトリガーする前に PA GFP アクチンを表現する B16 F1 セルの (、) A の代表的な例。別様に着色された輪郭蛍光強度測定の時間の経過と考えられていた領域を示すラベルが付けられます。次の PA GFP アクチンの時空間分布の図 (b) の光。それから拡散するセンサー アクチン蛍光センサー、ゾル性細胞質領域 (赤い円) の漸進的な減少に注意します。フロントとネットワークにアセンブリへの拡散、原因センサー アクチン単量体はケラトサイト (シアン領域) で、距離と時間依存的細胞質 (別色分けされた領域) の中で徐々 に拡張されています。蛍光センサーのゾル性細胞質領域 (b で赤い輪郭) の (c) 代表的な一時的な減少。(d) 時間葉状領域 (b シアン輪郭) の蛍光強度の変化。(e) ゾル性細胞質の地域 (b の色分け) photoactivation の領域から可変間隔の位置決めのための蛍光強度の変化の代表的な曲線。蛍光に到達半分倍のプラトーに注意してください (右側の凡例に示されます) の距離とともに増加地域 photoactivation の領域に、与えられた可能性が増加との関連付けにアクチン単量体の拡散に必要な時間、それぞれの地域。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
ここで我々 はこの記事と異なる実験条件でアプリケーションの最適化することができる方法で説明する方法で重要な手順について説明します。
インジェクションは、外因性タンパク質、阻害剤、または薬の導入からインスタントの効果を細胞の監視に適用できる方法です。困難なタンパク質の機能を決定するため特に有利であることができる細胞の種類を使ってまたは長期的な表現が望まれていない場合。それは、特定の種類の細胞の生存率は細胞外マトリックスに播かれるによって異なります注意しなければなりません。最も上皮、内皮細胞や線維芽細胞のような細胞の種類、どんな些細なもののように魚実質細胞 (ダンらを参照してください。21とアンダーソンとクロス22) に正常に注入することができます。ただし、細胞遊走のエクセレント モデル システムを構成するが、未知の理由のための下地のこのタイプの注入と互換性がない、ラミニンでシード B16 F1 セルなどの例外があります。NIH3T3 線維芽細胞を注射を実行定期的にフィブロネクチンの下地とこれら線維芽細胞 (を参照してください FRAP (光とも; B16 F1 セルここに示されている) なども同じように実行できる追加 photomanipulation テクニック例えば、Köstlerら3). また、機能のプロパティと実験目標によると、異なった蛋白質が変化、秒から時間に変化を引き起こす時間の異なる量を取るかもしれないことを考慮されなければなりません。技術の利点は、プラスミド トランスフェクションを使用してときに、外因性物質の用量・濃度をより例えば、単一セルのレベルで正確に制御可能、です。さらに、タンパク質の蛍光タグのセルには、他の蛍光付けられた蛋白質の同時多チャンネル可視化が必要な場合、柔軟性を高めることができますその存在を保証するために必要ではありません。マイクロインジェクションにインスタント細胞の形態や細胞骨格 (例えば、ダンらのダイナミックな変化に及ぼす特定の蛋白質または蛋白質の混合物の分析に特に役立ちます21 Arp2/3 複雑な阻害剤はアーピンによって移行にインスタントの効果の例のため)。技術の欠点は、その侵襲性、細胞損傷を引き起こす可能性や細胞の形態に影響を与えることができます。したがって、薬剤を実行するときの重要な考慮事項は、細胞生存率を監視されています。ここで紹介した方法は、手動操作に依存します。成功した注入、線維芽細胞のフィブロネクチン下地の成長などに対応するテスト条件でここで説明した手動注入プロトコルにより近い 100% の成功率。これは、高度で時間のかかるフォロー アップ実験ビデオ顕微鏡または FRAP、3は、以前公開などでこの方法を結合するときに不可欠です。これは時折それを除外しません、個々 の細胞は核と細胞質、セル端収縮によって続いてのコントラストの急激な変化によって安全に認識できるマイクロインジェクションのイベントから被る可能性が。このようなまれな実験的ケースは除外、さらなる分析のはみ。
ただし、半自動のアプローチはまた通常使用、例えば急速な採用 (< 300 ms) マシン制御の針を下げる針だけ前にそれぞれ各セルの上に配置されるがある、射出圧力の増加と一致します。インジェクション。半自動注射の成功率は、当然単に上記で説明した手動のアプローチよりも低い速度のために最適化されたに続いて正常にこの治療を生き延びた複数細胞の解析従ってそれは個々 のセルの挿入に依存しません。したがって、単一細胞解析とは対照的には、半自動注射よりなどビデオ顕微鏡低倍率でまたはセル固定および汚損による数百細胞の注入効果の分析に適しています。採用詳細な手法に関係なくマイクロインジェクション エンドポイント アッセイを構成していませんが、さまざまなテクニック、FRAP または photoactivation の3を含むと組み合わせることができます。
顕微鏡のセットアップおよびイメージ投射条件に応じて、レーザーの強度を最適化する必要がある FRAP によるタンパク質の離職率を決定する際 (倍率、目標、等細胞型、構造、および蛍光タンパク質のためだけでなく、フォトブリーチング用)。最適なレーザー出力で効率的な漂白と組み合わせるを最小限の光損傷収縮を避けるため、分析 (例えば、ケラトサイトまたは糸状) あるいは細胞レベルでの損傷の下で構造の後退を完了するために注意してください。理想的には、漂白効果の少なくとも 70-80% を達成する必要がありますの場合に、50% 以上のものも許容があります蛋白質の非常に急速な売り上げ高によって妨げられることがあります完全な漂白が。与えられた構造と蛍光色素の最適な漂白力が実験的に試されるべき、続いて低いレーザー力から始まって、徐々 に増加。もちろん、任意の蛍光色素が定義によって漂白するレーザー光励起のピークの近くで (488 nm FITC や EGFP など頻繁に使用される緑の染料のため)。ただし、近紫外レーザーなどのより短い波長のレーザーは高い力を提供し、したがって、一般的に使用される染料の効率的な漂白のためは使用もできます。我々 は日常的に 405 nm ダイオード レーザーを採用 (120 mW) 後者 (データ表示されません) の場合わずかに低い効率を伴い EGFP と赤の蛍光染料 (mCherry) などの漂白のため。PA GFP (下記参照) の photoactivation の 405 nm のダイオードが使える、柔軟性が最大でこのシステムを与えます。
B16 F1 セル構造と蛍光タンパク質 photobleached ここでは、65-100 mW 405 nm レーザー権限が適用されました。Photobleached 領域を分析する場合、かどうか与えられた構造は元の形にかけて保存、分析期間を考慮することが重要です。例えば、ケラトサイト ヒントで蛋白質の売り上げ高を分析する際注意が必要ケラトサイトの曲率は、大幅に時間をかけて、変更するかどうか、分析領域/輪郭がない場合、曲率の変化が不正確な結果につながる可能性があります。完全に各測定フレームの構造の全体を包含します。さらに、バンドル ケラトサイト、microspikes などに埋め込まれたが、蛍光強度で偏差を引き起こす可能性がありますに注意してください。図 2b (9 s の時間フレームの白い矢印) で示すように、田宇構造測定 photobleached 領域の横にある、測定の期間を通してそれの外側に残ります、したがっていずれかを発生しません不正確さ。タンパク質代謝回転の分析、地域分析の場所とサイズを選択するときの重要な考慮事項は、時間をかけて彼らの蛍光必要があります大幅に左右されない細胞形態の変化以外のハードを避けるために買収フォトブリーチを行なった。例えば、構造分析の構造に大きく量的貢献を提供する移動しないでください測定領域から分析時にさらに、タンパク質を引き付ける小胞の構造など無関係な蛍光灯のエンティティは分析中に興味の分野を入れません。葉状アクチン重合の速度を決定するため注意が必要、後退または機嫌 (すなわち、上向きに折る) ケラトサイトはない分析し、これが強く結果の精度に影響を与えるよう。さらに、潜在的に葉状のアクチン重合率の過大評価につながる葉状地域の急速な後方転として表示されます。追加の考慮事項は、(取得退色の補正のための参照位置として取られる) 細胞内正規化領域の距離直接を避けるために十分に大きいべき退色の実際の位置からphotobleached エリアに影響を与えます。
PA GFP 付けられた構造の photoactivation のための最適な条件を設定する場合 photoactivation の中にインスタント漂白を避けるために注意が必要があります。レーザーの力で我々 の仕事で最良の結果が得られた 5-10 倍低い EGFP の漂白のため通常用いられる。センサー分子の画像を取得する露光時間とフレーム間の時間間隔が地域とセンサー構造のサイズを考慮して最適化して分析する、センサーの潜在的な移動だけでなく、蛋白質は細胞内の他の場所に。蛍光イメージングのすべての種類、細胞生存率の維持は生理学的に関連する結果を取得するため重要です。
次のダイナミクスの均等に強力なメソッドと、lamellipodium など細胞レベル下の構造の売り上げ高は、原則として mEos など質のバリエーション12蛍光タンパク質の緑-赤光変換を構成する (例えば、見なさい・ バーネットら23). PA GFP ではなく後者の方法の利点は前に、と共同その他の赤い蛍光蛋白質を表現する必要性なし、2 つの異なる色で変換後タンパク質ダイナミクスに続く可能性であります。ただし、予備実験でコントラストの変化の程度、PA GFP の photoactivation の時に達成した蛍光信号の強さが大きかった photoconverted プローブと比較しておそらく赤と緑の優れた分光機能のため蛍光プローブ (データは示されていない)。いずれの場合では、詳細な研究ケラトサイトやワクシニア ウイルス性アクチン尾などセル端の突起部にアクチン フィラメントの売り上げ高のところのみ公開されている PA GFP 誘導体5,6,24を使用しています。
次の photoactivation を分析するどのセル領域を考慮する場合いくつかの要因べきである考慮し、(細胞質で活性化セルの端でのアクチン単量体の定款) を示す具体的な例を使用して説明するが、様々 な類似している科学的な問題に確かに推定することができます。まず、測定時葉状 cytosolically センサー蛋白質、例えば、定款の異なる実験条件で (ディムチェフらに示すよう6) ゾル性細胞質領域と葉状の端に彼らの間隔のサイズは、実験群間で同等にする必要があります。また、photoactivating 細胞質領域セル厚が核に近い位置で大きいときそれを考慮することが重要です。厚い細胞領域をアクティブにすると、与えられたがアクティブにする蛋白質の分布、細胞質に分散してゆく活性タンパク質の多量可能性があります。最後に、個々 のセルでアクティブにする蛋白質の表現のレベルを非常に可変することができますは確かに。これら変動の考慮による cytosolically 活性化タンパク質他の起動時に特定の地域で得られた合計の蛍光に対する細胞の混入レベルを比較することが重要です。
マイクロインジェクションを蛋白質の細胞の形態に及ぼす影響を調査するためのツールとしても使え、NIH3T3 と線維芽細胞が microinjected の葉状構造の強力な誘導を示すことによってこれを例示して述べるが、小さい gtp アーゼ Rac1。以前、傷跡/波3の C ターミナル WCA ドメインと microinjected のセルの Arp2/3 機能と干渉するためにこの手法を適用した.FRAP や光など、他の試金による microinjected 細胞の様々 なパラメーターを分析できます。細胞内動態とアクチン単量体の移動を調査するため、縛ると光を活用する方法を説明しました。FRAP は私たちのグループによって使用されています以前5ケラトサイト VASP、Abi、cortactin コフィリンなどにローカライズしてキャッピングの蛋白質、蛋白質の成分存在下における焦点接着斑の回転を解明するための売り上げ高を調査するにはRac の不在通知4.また、退色 EGFP タグ β-アクチン5にアクチンの重合率を測定を行うことができます、代替方法が存在します。生細胞イメージング-互換性のあるプローブ Lifeact25, などの細胞のアクチンを標識で見られるように蛍光の不均一性を追跡雇用6,26をこともできます。ここの利点は、β-アクチンの発現回避できます、セル端突起および移行を高めることができるし、したがって特定のアッセイまたは実験的質問と干渉する可能性がある (例えば、影らを参照26;ペッカムら27). ただし、Lifeact プローブの明瞭な不利な点は、細胞における Lifeact によるアクチン フィラメント構造の漂白プローブ回転でのみ情報を提供しますので、その高速に on/off するアクチン フィラメントに結合の速度論を構成します。25バインドするアクチン フィラメントの売り上げ高ではないが。蛍光の不均一性の追跡を採用した6,26は実用的な妥協を提供する、蛍光スペックルの広く使用されている追跡に似て組み込まれて糸状細胞骨格(例えばサーモンとウォーターマンの28を参照) の構造を使用するとまっすぐ進むと EGFP タグ F アクチン構造の縛るほど正確にできない場合があります。光は、アクチン単量体突出実験調整細胞内アクチン レベル6のコンテキストで、細胞質中での移動性と同様、ケラトサイト、混入率を推定するため私たちが適用されています。テクニックは、ゾル性細胞質領域などの比較的大規模な地域から派生した移動度とタンパク質の分布を調べる場合に役立ちます。しかし、比較的小さなセンサー構造由来のタンパク質の分布を調べるなど成長円錐は、蛍光分子活性の低い数字、弱い信号、およびこうして感度の不足のため困難な可能性があります。光や蛍光 (上記参照) の潜在的な代替技術は逆 FRAP フォトブリーチング依存から離れて蛍光分子の移動を追跡することによって続いて、ROI を除く全体のセルを含めることができます。この地域では。テクニックは、過剰発現タンパク質の活性型バージョンは必要ありませんが、レーザ、光損傷などの望ましくない副作用を引き起こす可能性がありますの異常に高い線量への露出は、常に。
明らかに、蛋白質はモノマー、ダイマー、または少しでもオリゴマーとして動いているかどうか、彼らは追加の結合パートナーとの組み合わせで移動かどうか photoactivation、FRAP を区別できません。その種の情報は、蛍光相関分光技術29あるいは30FLIM フレットから代わりに取得できます。それにもかかわらず、FRAP と光は、直接細胞、関心、細胞内の場所、または研究細胞型のタンパク質に関係なくローカルおよびグローバルなタンパク質の動態を評価するために簡単な方法を構成します。
開示事項
著者が明らかに何もありません。
謝辞
金融サポート (グラント Nr RO2414/5-1 kr) のドイツ研究振興協会 (DFG) に感謝しております。
資料
| Name | Company | Catalog Number | Comments |
| B16-F1 mouse skin melanoma cells | American Type Culture Collection, Manassas, VA | CRL-6323 | |
| NIH-3T3 cells | American Type Culture Collection, Manassas, VA | CRL-1658 | |
| DMEM 4.5g/L glucose | Life Technologies, Thermno Fisher Scientific, Germany | 41965-039 | |
| Ham’s F-12 medium | Sigma-Aldrich | N8641 | |
| Fetal calf serum (FCS) | PAA Laboratories, Linz, Austria | A15-102 | |
| Fetal bovine serum (FBS) | Sigma-Aldrich, Germany | F7524 | Lot054M3396 |
| MEM Non essential amino acids | Gibco, ThermoFisher Scientific, Germany | 11140035 | |
| L-Glumatine 200mM (100x) | Life Technolgies | 25030-024 | |
| Pen-Strep 5000 U/mL | Life technologies | 15070063 | |
| Sodium Pyruvate (100 mM) | Gibco, ThermoFisher Scientific, Germany | 11360-039 | |
| Laminin | Sigma-Aldrich | L-2020 | |
| Laminin coating buffer | Self-made: 50mM Tris ph7.4, 150mM NaCl | ||
| Fibronectin from human plasma | Roche Diagnostics, Mannheim, Germany | 11 051 407 001 | |
| Jetpei | Polyplus Transfection, Illkirch, France | 101-10N | |
| JetPei buffer | Polyplus Transfection, Illkirch, France | 702-50 | 150mM NaCl |
| PA-GFP-actin plasmid DNA | described in Koestler et al.2008 | ||
| pEGFP-actin plasmid DNA | Clontech, Mountain View, CA, USA | ||
| Rac1 protein for microinjection | Purified as GST-tagged version, and cleaved from GST prior to injection | ||
| Microinjection buffer | Self-made: 100mM NaCl, 50mM Tris-HCl ph7.5, 5mM MgCl2, 1mM DTT | ||
| Dextran, Texas Red, 70,000 MW, Lysine Fixable | Molecular Probes, Thermno Fisher Scientific, Germany | D1864 | |
| Microscope circular cover glasses 15mm, No.1 | Karl Hecht, Aisstent, Sondheim, Germany | 1001/15 | |
| Eppendorf Femtotips Microloader Tips | Eppendorf, Hamburg, Germany | 5242 956 003 | |
| Eppendorf Femtotip Microinjection Capillary Tips | Eppendorf, Hamburg, Germany | 930000035 | |
| Silicone Grease | ACC Silicones, Bridgewater, England | SGM494 | |
| Aluminium Open Diamond Bath Imaging Chamber | Warner instruments | RC-26 | |
| Automatic temperature controller | Warner Instruments | TC-324B | |
| Microscope: Axio Observer | Carl Zeiss, Jena, Germany | ||
| CoolSnap-HQ2 camera | Photometrics, Tucson, AZ | ||
| Lambda DG4 light source | Sutter Instrucment, Novato, CA | ||
| Laser source | Visitron Systems | ||
| Eppendorf FemtoJet microinjector | Eppendorf, Hamburg, Germany | With built-in compressor for pressure supply | |
| Nikon Narishige Micromanipulator system | Nikon Instruments, Japan | ||
| Visiview software v2.1.4 | Visitron Systems, Puchheim, Germany | ||
| Metamorph software v7.8.10 | Molecular Devices, Sunnyvale, CA | ||
| Sigma Plot v.12 | Systat Software Inc. |
参考文献
- Day, R. N., Davidson, M. W. The fluorescent protein palette: tools for cellular imaging. Chem Soc Rev. 38 (10), 2887-2921 (2009).
- Ishikawa-Ankerhold, H. C., Ankerhold, R., Drummen, G. P. Advanced fluorescence microscopy techniques--FRAP, FLIP, FLAP, FRET and FLIM. Molecules. 17 (4), 4047-4132 (2012).
- Koestler, S. A., et al. Arp2/3 complex is essential for actin network treadmilling as well as for targeting of capping protein and cofilin. Mol Biol Cell. 24 (18), 2861-2875 (2013).
- Steffen, A., et al. Rac function is crucial for cell migration but is not required for spreading and focal adhesion formation. J Cell Sci. 126, Pt 20 4572-4588 (2013).
- Lai, F. P., et al. Arp2/3 complex interactions and actin network turnover in lamellipodia. EMBO J. 27 (7), 982-992 (2008).
- Dimchev, G., et al. Efficiency of lamellipodia protrusion is determined by the extent of cytosolic actin assembly. Mol Biol Cell. 28 (10), 1311-1325 (2017).
- Koppel, D. E., Axelrod, D., Schlessinger, J., Elson, E. L., Webb, W. W. Dynamics of fluorescence marker concentration as a probe of mobility. Biophys J. 16 (11), 1315-1329 (1976).
- Patterson, G. H., Lippincott-Schwartz, J. A photoactivatable GFP for selective photolabeling of proteins and cells. Science. 297 (5588), 1873-1877 (2002).
- McKinney, S. A., Murphy, C. S., Hazelwood, K. L., Davidson, M. W., Looger, L. L. A bright and photostable photoconvertible fluorescent protein. Nat Methods. 6 (2), 131-133 (2009).
- Gurskaya, N. G., et al. Engineering of a monomeric green-to-red photoactivatable fluorescent protein induced by blue light. Nat Biotechnol. 24 (4), 461-465 (2006).
- Lippincott-Schwartz, J., Patterson, G. H. Photoactivatable fluorescent proteins for diffraction-limited and super-resolution imaging. Trends Cell Biol. 19 (11), 555-565 (2009).
- Kremers, G. J., Piston, D. Photoconversion of purified fluorescent proteins and dual-probe optical highlighting in live cells. J Vis Exp. (40), (2010).
- Fischer, A. H., Jacobson, K. A., Rose, J., Zeller, R. Preparation of slides and coverslips for microscopy. CSH Protoc. 2008, 4988(2008).
- Small, J. V., Rottner, K. Actin-based Motility. Carlier, M. F. , Springer. Dordrecht. (2010).
- Kaverina, I., et al. Enforced polarisation and locomotion of fibroblasts lacking microtubules. Curr Biol. 10 (12), 739-742 (2000).
- Small, J., Rottner, K., Hahne, P., Anderson, K. I. Visualising the actin cytoskeleton. Microsc Res Tech. 47 (1), 3-17 (1999).
- Mikhailov, A. V., Gundersen, G. G. Centripetal transport of microtubules in motile cells. Cell Motil Cytoskeleton. 32 (3), 173-186 (1995).
- Rottner, K., Behrendt, B., Small, J. V., Wehland, J. VASP dynamics during lamellipodia protrusion. Nat Cell Biol. 1 (5), 321-322 (1999).
- Svitkina, T. M., et al. Mechanism of filopodia initiation by reorganization of a dendritic network. J Cell Biol. 160 (3), 409-421 (2003).
- Small, J. V., Isenberg, G., Celis, J. E. Polarity of actin at the leading edge of cultured cells. Nature. 272 (5654), 638-639 (1978).
- Dang, I., et al. Inhibitory signalling to the Arp2/3 complex steers cell migration. Nature. 503 (7475), 281-284 (2013).
- Anderson, K. I., Cross, R. Contact dynamics during keratocyte motility. Curr Biol. 10 (5), 253-260 (2000).
- Burnette, D. T., et al. A role for actin arcs in the leading-edge advance of migrating cells. Nat Cell Biol. 13 (4), 371-381 (2011).
- Humphries, A. C., et al. Clathrin potentiates vaccinia-induced actin polymerization to facilitate viral spread. Cell Host Microbe. 12 (3), 346-359 (2012).
- Riedl, J., et al. Lifeact: a versatile marker to visualize F-actin. Nat Methods. 5 (7), 605-607 (2008).
- Kage, F., et al. FMNL formins boost lamellipodial force generation. Nat Commun. 8, 14832(2017).
- Peckham, M., Miller, G., Wells, C., Zicha, D., Dunn, G. A. Specific changes to the mechanism of cell locomotion induced by overexpression of beta-actin. J Cell Sci. 114, Pt 7 1367-1377 (2001).
- Salmon, E. D., Waterman, C. M. How we discovered fluorescent speckle microscopy. Mol Biol Cell. 22 (21), 3940-3942 (2011).
- Machan, R., Wohland, T. Recent applications of fluorescence correlation spectroscopy in live systems. FEBS Lett. 588 (19), 3571-3584 (2014).
- Becker, W. Fluorescence lifetime imaging--techniques and applications. J Microsc. 247 (2), 119-136 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved