Method Article
新生児モデル敗血症マウスの制御モデル
* これらの著者は同等に貢献しました
要約
このプロトコルは、必要な手順を確立し、7 日齢マウスの新生児敗血症の評価を提供します。
要約
新生児敗血症のまま世界的な負担。画面の効果的な予防や治療介入する前臨床モデルが必要です。新生児マウス モデル敗血症生活 7 マウスの日に腹腔内盲腸スラリーを注入して、次の週のそれらの監視によって誘導されうる。この新生児敗血症モデルの実装に必要な詳細な手順は、ここで紹介します。これは、用量は体重とゴミ調整、監視スケジュールの概要と人道的エンドポイントを定義するために使用, 健康カテゴリの定義に希釈、均質な盲腸スラリー株式を作る含まれています。プールされたドナーから同種の盲腸スラリー株式の世代ドナー、ばらつきを削減し、潜在的に有毒のグリセロールを使用できないように、時間をかけて多くの仔に管理が可能です。使用監視戦略は、生存転帰の予測と人道的エンドポイントの以前の識別を可能にする、死に進行後マウスの識別します。2 つの主な行動機能を使用して、正常性スコア、右自身背中とモビリティの彼らのレベルに置かれたときに新生児マウスのすなわち、能力を定義します。精度を確認する予備的研究が実行される限り、これらの条件をマウスの新生児疾患の他の研究でアドレス人道的エンドポイントに適用潜在的でした。結論として、このアプローチは、動物福祉障害者動物の初期の人道的エンドポイントを定義するために使用を評価するためのリソースを提供しながらマウスでモデル新生児敗血症を標準化する方法を提供します。
概要
敗血症は人間の新生児の感染症死亡1の主要な原因であります。新生児敗血症がよく理解されていないので、病気の初期段階でリスクの高い新生児の同定と効果的な治療法や一人の開発でほとんど進展を します。これは、プロセス、テストの可能な介入を理解する敗血症の動物モデルの使用を必要とします。さらに、大人の齧歯動物は同じ致命的な線量 (LD) を取得する管理する細菌数の有意差と新生児2に比べて結果のホスト応答の違い、敗血症に別様に答え。新生児敗血症は新生児で勉強することあり。いくつかの成人の敗血症モデルは、敗血症の研究で使用されています。大人の人間敗血症や盲腸結紮穿刺 (CLP) に関与している特定の生物と静脈内のチャレンジが含まれます。CLP は、最終的に微生物とその製品3の全身の普及につながる、盲腸手術分離結紮、あり、腹膜に腸の内容物の漏れを許可するように穴をあけられる内因性チャレンジ モデルです。しかし、CLP を確立するために必要な手術は新生児動物に致命的ですしたがって、別の方法は、新生児敗血症を誘発する CLP のモデル挑戦を模倣する必要です。新生児モデル敗血症の盲腸スラリー モデル動物の盲腸内容は収穫、水 (D5W) で滅菌ブドウ糖 5% で中断され、腹腔内注入による新生児マウス2というこの必要性に対処するため開発されました。これは、新生児と成人の両方の動物の敗血症を勉強する人気モデルとなっていると病気のプロセス4,5,6,7 機械論的洞察力が大幅に進んだ ,8,9,10、11,12,13,14,15。
このモデルの使用の増加と直接出版物間で結果を比較する研究者の欲求を考えると、よく説明され、標準化された研究全体を技術的な側面の必要性があります。標準化は、モデルの 3 つの側面すなわち、i) ii) チャレンジ因数の実験動物に注入のための準備及び iii) 人道的エンドポイントの定義、盲腸スラリー ストックの準備という動物挑戦の実験で nonsurvivors とみなされます。具体的には、盲腸のスラリーの在庫を準備する方法はモデル2を紹介元の記事にしばしば参照されます。そのモデルの概要は、成体マウスの盲腸内容だった収穫、滅菌 D5W 80 mg/mL の濃度に浮遊実験動物を注入する 2 h の内で使用されます。この原型は、盲腸内容を収穫する前に 2 週間以内の彼らのそれぞれの研究施設で収容された同じベンダー場所から同じ年齢のマウスを使用しました。社内飼育マウスの使用正規仕入先配信から性別と年齢のより広い範囲の余分なマウスの使用を可能にするコストの削減が、ドナー-ドナーばらつきも大幅に増やします。これは、当時まだ避けようと13-80 ° C で保存されます大きな在庫を準備するという複数のマウスの盲腸内容物一緒をプール、代替技術の開発動機。この方法は、複数グループ14,15適応されました。しかし、その適応の結果使用ストレージ メディア (10% または 15% のグリセロールまたは単独で D5W) と微粒子を除去するろ過の戦略の両方いくつかの技術的なバリエーション (860 μ m し 190 μ m による多段ろ過フィルター、または個人100 μ m または 70 μ m フィルターろ過)13,14,15。単独でグリセリンの注入 25-50% グリセロール注射は腎障害16,17,18,19、齧歯動物モデルとして使用されていることを考えれば、問題を起こす可能性 20。グリセロールの予想外の副作用を避けるためには、本研究ではマウスの盲腸スラリーの在庫の準備が D5W のグリセロール、なし凍結し、-80 ° c のストレージから細菌性のテストが実行されます。本研究で使用されるろ過戦略は、70 μ m のフィルターは、記載されている他の濾過方法と直接に比較されていない 1 つのパスです。
致死量盲腸スラリーの注入の重量調整施設を異なる場合があります、個々 のグループの希望の致死性に胃をする必要があります。別の課題の用量、必然的に伴う挑戦ボリュームを変更します。ただし、この方法論の詳細は、前に報告されていません。さらに、腹腔内投与などの標準的な手順についてはほとんど文献内を詳しく述べたが、新生マウス注入時の漏れし、その最終結果に影響を与えるかどうか個々 の技術に影響を与える可能性があります。
人道的エンドポイントの定義を含む動物の福祉は、感染症や炎症の齧歯動物21のモデル、このモデルの中央の側面です。1998 年、カナダの理事会に動物ケア (CCAC) 公開人道的エンドポイント選択のための広範なガイドライン「実際か潜在的な痛みや苦痛、不快感する最小化か最も早いを選択することによって軽減として人道的エンドポイントを定義します。研究の科学的調査の目的と互換性がエンドポイント"22。その他の人道的エンドポイントを確立する必要があります注意基づく動物の状態だけで21の主観的な解釈ではなく科学的根拠にも。資源の富がある一方臨床、行動、および人道的エンドポイントについて、感染症や炎症の中でも身体条件記号ベース基準具体的に21,23,24、これらのどれも、新生マウスに言及人道的エンドポイント22、CCAC ガイドラインを含みます。したがって、客観的かつ科学的に正当化された人道的エンドポイントが限られた行動能力と証拠の欠如を与えられた大人のため広く使われている減量のような条件から生まれたばかりの動物の確立するより困難マウス。現在、モデル2を導入したオリジナルの原稿に戻って参照すべて盲腸スラリー文学 5-12 日古い新生児マウス用人道的エンドポイント基準。この元論文で新生児動物の人道的エンドポイントの定義は、2 つの条件に基づいていたすなわち、時間以内に死に至る (散乱) 巣外のマウスの位置と白斑の欠如を見られていた。人道的エンドポイントの設定の複雑な問題は、ミルク スポットなる生活 (DOL) の 14 日まで病気の動物を監視しながら、人生の最初の週後に一般的に使用される c57bl/6 j ひずみなどの暗い毛皮マウス系統の参照してくださいすることは困難です。さらに、死んだ動物がこれらの基準を適用する場合 postchallenge は見つけることが (自身の観測; 未発表);したがって、人道的エンドポイントのより厳密な定義は、実験動物の苦しみを軽減し、結果明察ことができる正確に以前の状況で死亡を避けるため必要です。
盲腸スラリー ストックの準備を詳述した標準操作手順のとおりで盲腸スラリー モデルのすべての 3 つの方法論的側面、実験動物を注入法用量の間注入ボリューム定数を保つこととリークのリスクと行動モデリングのシステムに基づいて 7-12 日齢のマウスの人道的エンドポイントの定義を軽減します。マウス正常性スコア以上の 240 の実験動物の行動情報は収集され、人道的エンドポイントの証拠駆動型定義を示す、最終的な生存の結果によってグループ化されます。実験動物の苦しみを削減するには、キーの変数を観察することによって生物学的に重要な存続の結果を推論できる、可能な限り早い時点で瀕死の新生児マウスを識別します。盲腸のスラリーの調製と新生児マウス動作の両方の視覚的な表現は、敗血症や新生児のチャレンジ モデル動物の勉強グループに優秀なリソースとして機能します。
プロトコル
このプロトコルのすべての実験は、プロトコル番号 A17-0110 の下で動物の世話をブリティッシュ ・ コロンビアの大学委員会によって承認されています。
1. ツール殺菌
- 生物学的安全キャビネット (BSC) をオンにし、予熱 250 ° C、使用する前に、少なくとも 30 分に熱いビーズ滅菌。
- 70% エタノールでツールを浸しなさい。
- 1 分の最低予熱した熱いビーズ滅菌にツールが水没します。
注: ツールのハンドルは熱くなるし、1.5 分以上のホット ビーズ滅菌の場合に燃やすことができます。 - それを殺菌し、70% エタノールとペーパー タオルのマットをスプレーします。
- 滅菌水中の他のツールの非滅菌処理するツール部に触れることがなくホット ビーズ滅菌器からツールを削除して、エタノール スプレー ペーパー タオルの上に置きます。
- 30 を待つ s 郭清のためにそれらを使用する前に冷却するためのツールを 2 分します。
2. 盲腸スラリーの調製
- 15 mL 遠沈管 (安楽死するすべての 5 のマウスの 1 つの管) を preweigh します。
- ローカル動物のケアのガイドラインに従って盲腸スラリー ドナーを安楽死させるか以下のプロトコルを使用します。
注: 6 および 12 週の間の 40 の c57bl/6 j マウスまで古いと使用された盲腸スラリー調製のため最大 5 匹同時に安楽死します。- 安楽死室へマウスを移動し、イソフルラン麻酔器を酸素血流を 5% に設定します。
- マウス移動して麻酔の手術の平面に入るそれらを参照する能力の損失を観察し、最後に、呼吸を停止を監視します。
- 安楽死室から、マウスを削除、その足を挟まない、脚引き込みまたは吸入を観察します。いずれかが存在する場合は、安楽死室; マウスを返すそうでなければ、続けます。
- 急激な頚部転位によってマウスを安楽死末期。
- 盲腸の郭清、BSC の presterilized と冷却ツール (セクション 1 を参照してください) を使用を実行します。
- マウスその腹部には 23 G 針を使用して押し出し発泡ポリスチレン ボードをマウスの足を固定します。確保し、70% エタノールで腹部をスプレーします。
- 滅菌ピンセットとはさみを使って、皮膚を切って、右側にはさみ、カット オープン、胸骨に脚の付け根から四角形領域と腹膜のライニングと左側から皮膚を緩めます。腹膜から任意の毛皮を削除します。
- 切り替えツールものがコンタクトを使用されている場合、皮膚肌のため行われていた長方形の開口部を作り、腹膜を断ち切る滅菌道具の新しいペアに切り替えます。
- ボディに右に走る左が盲腸を識別します。腸から盲腸の枝を識別し、腸から盲腸をカットする結合組織を混乱させます。紙の重さの滅菌シートで盲腸の場所。
注: は、どちらかの側面との両方でそれを残して、乾燥する 70% エタノール噴霧や紫外線照射による滅菌することが紙の重量を量るします。また、盲腸は滅菌ペトリ プレートで解剖できます。
- 盲腸コンテンツ押出
- BSC、無菌のツールを使用して、盲腸の両端をカットします。
- 滅菌ピンセットで盲腸の中央を押し、盲腸内容カットを終了すると、転がり運動と上皮を引き裂くことができるスクレーピング動きを回避するを使用して優しくプッシュするフラット滅菌金属ヘラを使用します。内容を収集し、preweighed 15 mL 遠心管にそれらを置きます。
- 同じチューブから最大 5 つのマウスの盲腸内容にプールします。チューブの重量を量るすべての内容が追加されると再び。
注: 期待する 300 mg の平均と最大 390 mg あたりマウス盲腸スラリー、マウスごと再懸濁の D5W の 2.4 1.8 mL を必要とします。このステップの間に 5 つ以上のマウスを使用してしたがって、15 mL 遠心管を満杯に。 - エタノール スプレー ペーパー タオルときれいなツールをワイプし、手順 1.2 1.6 を繰り返すことによってそれらを滅菌します。
- 盲腸のスラリーのろ過
- 盲腸内容でいっぱい遠心管の重量を量るし、盲腸内容の重量を割って次式のように、1 ミリリットル当たりミリグラムの望ましい株式集中して盲腸内容に追加する D5W の量を計算します。
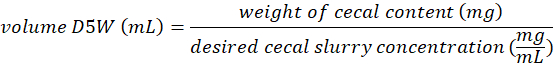
- BSC の盲腸内容を含む 15 mL 遠心管に冷たい D5W の必要な量を追加します。
- 渦 15 mL 遠心分離機管の垂直方向と水平方向に、直径 1-3 mm 以上の粒子の 30 s. チェックのと場合は、引き続きボルテックスまですべての大きな粒子が目に見えて消えています。
- 氷上に置いた 50 mL の遠心管に滅菌 70 μ m の細胞のストレーナーを配置します。セル ストレーナーにし、コレクションの管に盲腸の再懸濁液の 4 mL のピペットします。X-3 2x 上下ピペッティングにより粒子を再懸濁します。フィルタ リングされてないより多くの水滴がなくなるまでピペット チップで内容を攪拌しながらフィルタ リングの速度を増加する気泡を押し出す優しく。
注: 混合使用する場合可能性があります微粒子 5 mL ピペットを接続するのに十分な大きさ。この場合、ステップ、2.5.3 からボルテックスを繰り返し、ソリューションまだ壊れない離れて場合、は、遠心分離機管の壁に粒子を押すピペットを使用します。 - 手順を繰り返します 2.5.4、セル ストレーナー盲腸スラリーの各チューブとプールの間の変更のすべての内容、氷で保たれる同じ 50 mL 遠心分離機コレクションの管にまたは 2 番目の 50 mL の遠心管に濾液量がアイス ボックスに氷レベルを超えた場合。
- 盲腸内容でいっぱい遠心管の重量を量るし、盲腸内容の重量を割って次式のように、1 ミリリットル当たりミリグラムの望ましい株式集中して盲腸内容に追加する D5W の量を計算します。
- 盲腸のスラリーの約数。
- 該当する場合より大きい滅菌容器 (例えば、1,000 mL ストレージ ボトル) ステップイン 2.5.5 から複数 50 mL 盲腸スラリー濾液チューブを組み合わせます。その後、15 s と場所新しい 50 mL の遠心管に 20 mL の渦。
- 渦は 5-10 秒の時間をかけて蒸発を防ぐために、ゴムのシールがある 3 つの 2 mL セラム チューブに 500 μ L 分注 50 mL の遠心管に盲腸スラリー株式。すぐに氷の上マスター ストックと検体のセラムを配置します。
- 2.6.1 と 2.6.2 手順を繰り返してと、検体、盲腸のスラリーのすべてされているボルテックス任意の粒子の沈降を防止し、均一混合物を維持するためにすべての 3 つセラム チューブ後マスターの在庫。
- -80 ° C で盲腸スラリー試料を凍結します。
注: は、各大人のマウスから 500 μ L で 3 〜 4 在庫バイアル間期待します。各株式のバイアルは、DOL 7 で 8 匹の挑戦の 1 つのくずにほぼ十分なはずです。
3. 敗血症 7 日齢の新生仔マウスの挑戦
- 分離、識別、および新生仔マウスの重量を量る。
- BSC、ダムからマウスを保持し、ダムにストレスを減らす新しいケージに新生仔マウスを転送します。
- 削除し、手袋にケージのにおいを転送する手袋とネストの材料の一部をこする。小さい巣にネスティング材料を成形し、ダムなしの新しいケージに入れます。
- 新生仔マウスを新しいケージにネスト材料に転送します。
- 新しいケージに 2 番目の空の巣を作るより多くのネスト材料を転送します。
- 終了して、新生仔マウスの苦痛のいずれかを聞くことからダムに負荷がかかっていないので、フードからダムのケージを削除します。
- 時間をかけてゴミの内で個々 の新生児マウスを追跡するためには、前面または必要に応じてすべての 12-24 時間を再適用する尾の逆に 1 ~ 5 個のドットをマークするのにエタノール証拠マーカーを使用します。
- 挑戦は、計量後巣セカンダリにそれぞれ配置してすべてのマウスのこの手順を繰り返します各マウスの重量を量る。
- ダムに割り切れる盲腸スラリーの挑戦を準備する前に全体のごみを返します。
- 個別に各くずに対してこの手順を完了する、以下の計算または指定されたワークシートを使って盲腸スラリー及び必要な希釈 D5W の個々 の重量調整用量を計算する (補足ファイルを参照してください)。
- 盲腸スラリー マウス (c) のグラム当たりのミリグラムで必要なチャレンジ線量グラム (b) でマウスの重量を掛けることによってそれぞれのマウスに投与すること (、) 盲腸スラリーのミリグラムを計算します。
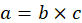
- ストックの盲腸スラリー濃度、盲腸のスラリーの 160 mg ステップ 3.2.1 (、) からのマウスごとに必要な盲腸のスラリーのミリグラムを割ってマイクロリットル (d) のマウスごとに必要な原液の盲腸スラリー株式の個々 のボリュームを計算します。D5W の 1 ミリリットルあたり (e) マイクロリットル ミリリットルから変換する 1 ミリリットルあたり 1,000 μ L を乗算することです。
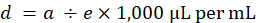
- 盲腸のスラリーの在庫数量がnマウス、マウス (n) の数で割った値のごみのマウスあたり盲腸スラリー株式 (d) の量を合計することによってマウス (g) あたり必要な平均。
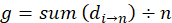
- マウス (g) あたりに必要な盲腸のスラリーの平均在庫量平均注入量 (100 μ L) で割って盲腸スラリー株式 (h) 平均希釈倍率を計算します。
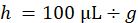
- 平均希釈倍率 (h) 在庫盲腸スラリー必要 (d) の各マウスのボリュームを乗じてマイクロリットル (j) でそれぞれのマウスの特定の注入量を計算し、最も近い 10 にそれを丸く (一致するように、10 μ L ずつ注射器)。
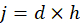
- 平均注入量 (100 μ L) から平均盲腸スラリー株式 (g) を引いて D5W 盲腸スラリー株式 (k) を希釈するための平均必要量を計算します。
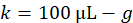
- このゴミ (n) でマウスの数によってマイクロリットル (g) でマウスあたり平均株価盲腸スラリーを乗算し、余分なを作成する 1.4 を掛けることにより盲腸スラリー入荷マイクロリットル (l) の合計金額を計算します。
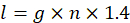
- マイクロリットル (m) D5W の平均必要量を乗じて盲腸スラリー株式をうすめる必要で D5W の合計金額を算出 (k) マウス (n) および余分な作成に 1.4 を掛ける数。
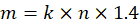
- 盲腸スラリー マウス (c) のグラム当たりのミリグラムで必要なチャレンジ線量グラム (b) でマウスの重量を掛けることによってそれぞれのマウスに投与すること (、) 盲腸スラリーのミリグラムを計算します。
- ストック盲腸スラリー必要 (ステップ 3.2.7 からl ) の量を計算した後の挑戦因数を準備します。BSC、必要な室温、ピペッティングをミックスするその内容で盲腸スラリー株式バイアル数を解凍します。
- これ以上目に見える氷の結晶解凍盲腸スラリー内に存在場合は、滅菌 1.8 mL 遠心チューブに盲腸スラリー株式 (ステップ 3.2.7 からl ) の計算量を転送します。
- 3.2.8 (m) の手順で計算された冷たい D5W を追加することで必要な濃度に希釈します。氷上チャレンジ因数を格納します。
- 注射器をロードする前に、それをフリックで遠心チューブをミックスの策定と盲腸スラリーの 300-500 μ L を追放して 500 cc 28 G 1/2 インチ インスリン注射器で 3 x を続けて、20 x。
- 同じ注射器に盲腸スラリーの約 150 μ L を描画します。
- プランジャーから気泡を除去し、注射器で少し引く、泡を追放し、シリンジにフリックします。
- 3.2.5 (j) の手順で個々 のマウスが注射器に読み込まれるために計算された、1 つのマウスの盲腸のスラリーの適切な量まで遠心チューブに戻って余分な盲腸スラリーを調剤します。
- 腹腔内関連ローカル動物医療機関のガイドラインによると盲腸のスラリーを注入または以下の手順を使用します。
- BSC 手順 3.1 ダムから新生児マウスを区切ります。
- 首筋、首の後ろでマウスは親指および人差し指を使用して。
- 背中の中間およびリング指、またはリングとピンキーの指の前にねずみのしっぽを保護します。
- 、リークを最小限に抑える傾け新生児マウスを使用して、それは下向き、上向き、足と性器、浅いと皮下に針を維持する間針の針ベベルを挿入します。
- 1 cm の針を挿入すると、下方に押し、腹膜を穿刺針を感じる転送します。ゆっくりと横方向の動きは、マウスの臓器を傷つけることが、針の先端を可能な限りとして着実に維持する、ピストンを低下させます。
- 慎重に針を撤回 5-10 秒、マウスのボディの緊張を減らすために除去の中に中指をリラックスのように、同じルートに続きます。
- 漏れをチェックするには、時間を閉じるには、注射部位に針を除去した後数秒間マウスを押したまま、任意の漏れまたはその時点でマウス使用しないでください分析の注射部位の膨隆を観察します。
注: 注射部位の皮膚の隆起が皮下注射液で失敗した腹腔内投与を示します。 - ペーパー タオルの上にマウスを置くし、一歩を踏み出すには、マウスを許可します。マウスが携帯電話 5 の場合 s、尾を軽く押します。
- マウスをピックアップし、注射部位の盲腸のスラリーの漏れをチェックします。漏れがある場合、マウスを解析から除外してマウスを安楽死させます。
4. マウスの監視
- 人道的エンドポイントに到達するためにそれらをチェックする定期的にマウスを監視します。
- 2 h postchallenge 注入関連合併症のマウスを観察します。
- 敗血症関連の罹患率および人道的エンドポイントでマウスの id にマウス 12 h postchallenge を監視 (手順の基準 4.2 4.3 を参照)。
- その後最初の 2 日間、一晩、8 h を除く新生児マウスが出席したすべての 4 〜 6 時間を監視します。
- 2 日 postchallenge を超えて一日 1 x-2 x を監視します。病気マウスまたはマウスの正常性スコアの減少が観察される場合は、すべての 4 〜 6 時間に監視の頻度を増やします。
- 新生仔マウスを監視
- 新生仔マウスを含む任意のプロシージャの転送新しいケージに素材の寝具 3.1 の手順で説明するよう (同じ理由で説明したようにある)。看護しながら巣からドラッグされた新生児を慎重に確認します。マウスに散在する、看護しながらトイレからドラッグするマウスはありません。
- 上部を取り外す、巣は新生仔マウスの任意の散乱を巣からいずれかで識別またはネスト材料、看護しながらトイレからドラッグ マウスを除いて、彼らの同腹子から立ち往生。4.5 の手順で基準マウスが見つかった場合散乱人道的エンドポイントを参照してください。
- マウスの立ち直り反射と移動度を測定します。
- ペーパー タオルの上にマウスを配置し、最大 4 内自体を右に、その能力の監視 s。その背中に置かれたとき、マウスがオブジェクトの左側または右側には、4 s のカウント開始に分類されます。
注:「権利」グループに分類されるマウスする必要があります少なくとも取得することができる 1 のペーパー タオルの上のパッドの足 3 つ 4 つの s です。それはまだそれが倒れる場合自体を右することとしてグループ化されます。- 8 の場合は、マウス自体を右することができます、待ちます s モビリティのレベルを判断します。
- 自体を右行に複数の手順を実行して、環境を探検することができる場合は、マウス「権利-モバイル」として分類します。
- 自体を右、その環境を探索するいくつかの手順を実行することができます「権利無気力」としてマウスを分類します。このグループのマウスがステップしながら倒れ、自分の足で不安定に見るし、ステップ間で一時停止します。
- それは自体を右することができますが、多くの周りに移動しません「権利 Nonmobile」としてマウスを分類します。それはまだ、落ちることがありますそれは 8 内のステップを行われない場合、s、権利 Nonmobile としてグループ化されます。
- マウス可能性があります自体適切でない、観測された股関節の動きに基づいて移動性を分類します。
注: を繰り返さない監視またはスコアリング システムと人道的エンドポイントに影響を与えることができるので、マウスが背中に費やしている時間の長さを増加して、時々 4 s 内自体を右に失敗するマウスとしてそうすればより多くの時間を与えられました。- 分類としてマウス「右 (FTR) に失敗する-モバイル」それ自体を右ことができない水平から 90 ° の角度を超えると股関節の動きが表示されるかどうか。一部のマウスで右自身 4 以上を指定した場合 s が、まだ腰の動きに基づいて移動スコアと FTR、として分類される必要があります。
- それは自体を右することができる、水平方向から 90 ° の角度の下の腰の動きが表示される場合は、「FTR 無気力」としてマウスを分類します。
- 「FTR-Nonmobile」それは自体を右することができる、足を振るまたは振動を持っている場合がない腰の動きとマウスを分類します。手足が拡張または撤回はない横方向の動きがあります。マウスは、目に見えて病気人道的エンドポイントに達した。
- ペーパー タオルの上にマウスを配置し、最大 4 内自体を右に、その能力の監視 s。その背中に置かれたとき、マウスがオブジェクトの左側または右側には、4 s のカウント開始に分類されます。
- 双方を記録、マウス側 4.3 手順を繰り返します。
注: は、観測を記録するための補足ファイルを参照してください。 - マウス人道的エンドポイントでは、安楽死、以下に表 1のとおりを必要とするかどうかを決定します。
- マウスを異なる立ち直りと 4.3 と 4.4 の手順に記載されている監視観測に基づく移動レベルに分類しました。マウスの移動は、各側の測定し、モバイルの動作がマウスに安楽死が必要かどうかを決定する使用されます。
- 人道的エンドポイントに巣から分離 FTR-Nonmobile (a) または (b) FTR 無気力の反射と、真っ直ぐにすることではネズミを割り当てます。
- 20 h postchallenge を超える時間ポイントを監視、表示されているデータは、これらのマウスは最終的に病気に屈するし、そうでない高精度で予測するため任意マウスの「右に失敗」人道的エンドポイントで両側の立ち直り反射とを分類します。回復します。
- 4.5 の手順で決定された安楽死させたことに、別のマウス。人道的エンドポイントでは、監視対象のマウスが表示されない場合、ダムなし新しいケージに 2 番目の空の巣に配置し、他の新生児マウスに進みます。
- 全体のごみを監視すると、新生仔マウスの中央の部屋に巣を改質、ダムでケージにネスト材料の半分を移動します。
注: 不適切な形式の巣に散布し、ダムを提供することができます利用可能なケアの量を減らすにマウス可能性があります。 - ダムとケージに戻って新生児マウスを転送します。
- くずに残りのネスト材料を置くと場所のネスト材料を保護する蓋の周りそれをつまんで優しく巣くずを囲みます。
- 地方機関の要件に従ってステップ 4.6 で区切られた新生児マウスを安楽死させます。
5. 盲腸のスラリーの滴定
- 必要な課題の線量 (セクション 3) でマウスに挑戦し、成果 (セクション 4) を監視します。
- 最終的な結果が必要な LD の結果かどうかを観察し、そうでない場合によって 5%-10% を調整して上位または下位の挑戦用量で新しいごみのセクション 3 と 4 を繰り返します。
注: チャレンジ用量に図 1 bのようかもしれない各施設とマウスのひずみの価する必要があります。 - また、マウスが高速または図 1 bで期待される速度よりも遅い人道的エンドポイントを達成してセクション 3 と 4 で 5%-10% を調整して上位または下位の挑戦用量で新しいごみを繰り返すかどうかを確認します。
結果
連続希釈と盲腸スラリー株式 5% 羊血液寒天培地トリプシン大豆後, 好気性培養 37 ° C で 24 時間の因数をめっきによって時間をかけて盲腸スラリー生存率-80 ° C で保存をテストことができます。それ以降の 6 ヶ月にわたって変えること発見された盲腸スラリー調製の培養コロニー形成単位 (CFU) 量のカウントおよび生存率あった-80 ° C (図 2) で長期保存の影響を受けません。各ドナーのマウスは、平均で 3 〜 4 リットル (データは示されていない) に挑戦する十分な盲腸のスラリーで起因しました。
マウス盲腸スラリー分離敗血症を誘発する DOL 7 で挑戦課題の 12 h 以内人道的エンドポイントに到達しから組み合わせるカプラン ・ マイヤー生存曲線にみられるモデル敗血症の主、48 h postchallenge によって解決されました。データ以上の 200 の挑戦マウス (図 1 a)。致死率は投与、結果挑戦線量で 5% の変化の挑戦線量に依存していた、生存率 (図 1 b) で約 15% の差。マウスの体重は、監視の各訪問で測定しました。いる間存続は結局マウスとない初期 24 時間の間に postchallenge (図 1) には、差別のないすべての挑戦動物で体重減少を見た。24 h 後ほとんどの現存の動物は、すべて nonsurvivors の重量を失うことを続けて、人道的エンドポイントに移動し、自分の体重を取り戻すために始めた。ただし、ごく一部の生存も重量を失うことを続けている彼らの立ち直り反射を保持または実験、挑戦の 40 h 以内の初期体重の 20% を失っても最後まで体重が増加する失敗を持っていた動物の。減量存続は結局マウスとそうしなかった者との間の重複があったと体重や減量のしきい値の変更される可能性がありますいない基準として人道的エンドポイントの生存者を正確に分割の目標を維持しながらnonsurvivors。
プロトコルでは表2 のとおり、マウスの動作が監視されました。カテゴリは、健康のスナップショット表示されます (図 3 a-c)。これらの写真はマウスの別の健康カテゴリを表示し、人は彼らの背部に置かれて後右自身、重要な区別である FTR 携帯と FTR、無気力の違いの概要を説明できませんでした。この時代の比類のない健康なマウスは FTR 無気力アクティビティを表示しません。したがって、この健康カテゴリ病気と挑戦への応答のマーカーであります。マウス FTR 無気力症状 (図 3 b) を表示し、FTR Nonmobile (図 3)、上の足が下の脚と平行、に向かって逆行でした病気ゼロのヒップの動きを揺動にはほとんどの 1 つであるの基準の人道的エンドポイントです。マウスが回復がまた増加腰の動きを得るなり FTR 携帯 (図 3 a)。左右各マウスの右側の立ち直り反射とモビリティのスコアを測定し、マウスが人道的エンドポイントに達したかどうかを決定する最高のスコアを用いている.240 動物の盲腸のスラリーの致死量 60 (LD60) に挑戦以上の行動情報を集め、144 人道的エンドポイントを認めた (図 3 D-Fおよび表 1)。この証拠駆動型のアプローチを用いて定義し、生存者と nonsurvivors の両方の動作の違いに基づく実験者と人道的エンドポイント到達率による分類、4 つの病期にわたって人道的エンドポイントを絞り込むそれぞれの時間帯。初期の実験の中に股関節の動きがなかった FTR Nonmobile マウス一貫して観察されているこの行動の 4-6 h 以内に死んで発見されました。表示された情報のコレクション、FTR Nonmobile 健康得点は人道的エンドポイントの基準として使用されました。12-21 h postchallenge から FTR Nonmobile マウスを安楽死させ、存続と糸状の動物非常に似たような行動パターンを表示し、(図 3 D) その他の方法で識別できませんでした。21-48 h postchallenge からマウスを存続の大半を取り戻した彼らの立ち直り反射、FTR の行動観察の 1% 未満になる動物の間生き残る (図 3 e) 実験。したがって、両側から彼ら自身を右に失敗したマウスは、この時間の間に人道的エンドポイントの追加条件をなった。12 と 20 h postchallenge、間人道的エンドポイントの合計数の 12.5%、観察された 20 ~ 48 h、80.5% と 7% 対後 48 時間 (表 1)。存続を終えたマウス間の区別の特徴と立ち直り反射、股関節可動性 (図 3 f) の独立の損失であった人道的エンドポイントに最終的に悪化します。確かに、挑戦後 20、48 h、間 121 マウスの合計は 116 (回復しないマウスを識別するに 96% の精度を表す) 人道的エンドポイントに最終的に進むこれらのマウスの両方の側面から彼ら自身を右に失敗していた。挑戦後 48 時間を超えて 11 マウスは人道的エンドポイント (91% 精度) に側面これらの進行の 10 から右自身が観察されました。挑戦後 20 時間を超えて、双方の立ち直り反射を失ったマウスの数は 90% 以上の精度で最終的な結果を予測しています。したがって、この人道的エンドポイントの条件は、以前 nonrecovering マウスを識別し、(表 1) に苦しんでいるマウスを減らすに追加されています。
マウスを監視する必要があること頻度は死 postchallenge の異なるレートの変動により、随時変更し、表 1に記載されています。マウス自体を右にそれが失敗した場合、任意の時点でその人道的エンドポイントですると考えられていたし、両側にモバイルの股関節の動きを表示マウスが巣から散乱が発見されたかどうかまたは自体を右ことができませんでしたし、無気力な腰の動きをしていた。これらの条件のいずれかにマウスのくずに復帰し、挑戦後 4-6 h. 開始 20 h 以内 FTR Nonmobile に観察されていることが期待できない、新しい人道的エンドポイントは、提示された情報は広大な示していますので追加しました両側から FTR が病気に屈すること終わるマウスの大半。
動画、テーブル、および本稿で紹介するリソースは、挑戦されたマウスの正しい行動割り当ての効果的な教育リソースです。7 実験者は、トレーニング ビデオを見るし、60 挑戦動物に動作を割り当てる前に、プロトコルとテーブルの両方を読むようにしました。人道的エンドポイントの割り当ての id が表示されますその他の行動 (図 4 a) マウスから特徴的な FTR Nonmobile マウスと許容時間枠 (内右自身ができたマウスから FTR マウスの両方で正確です図 4 b)。
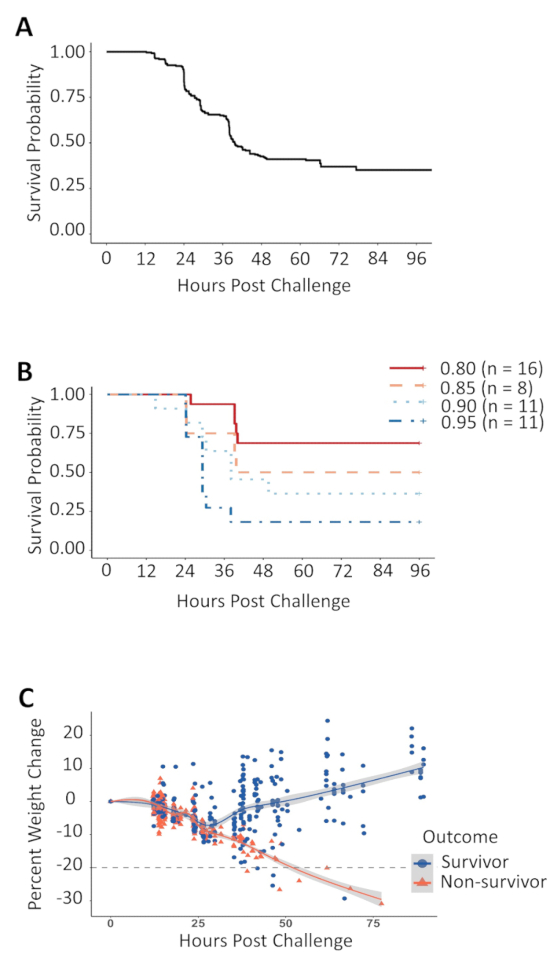
図 1: カプラン ・ マイヤー生存曲線、盲腸スラリー線量滴定、および次の盲腸スラリー チャレンジ重量変化します。(A) DOL 7 で腹腔内の盲腸スラリー注入で挑戦した新生児の c57bl/6 j マウスの生存の結果。この図のデータは、これらのマウスに至る 0.7 グラムの体重ごと盲腸スラリーの 1.3 mg の用量が投与された複数の挑戦を使用して独立した実験から結合しました。1 つの盲腸スラリー調製から 0.80 に 0.95 mg グラム体重当たり盲腸スラリーの挑戦 (B) 新生児マウスは与えられた盲腸のスラリーの量と生存率の用量依存関係を表示します。(C) 挑戦の時から体重の 20% の損失を示す点線とチャレンジ重量と比較して重量の変化の割合。この図の拡大版を表示するのにはここをクリックしてください。
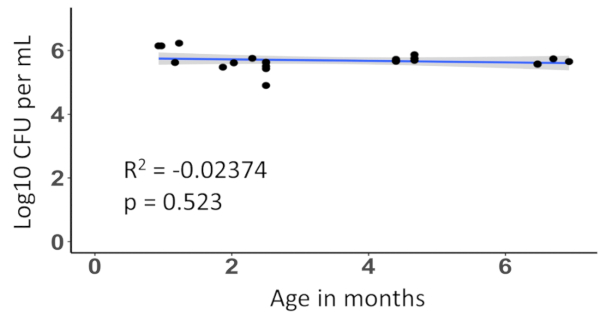
図 2:-80 ° C で保存盲腸スラリー入荷 CFU 濃度は 6 ヶ月にわたって変わりません。CFU 濃度におよぼす盲腸スラリー時代は、線形回帰を使用してテストされました。各ポイントは、同じ盲腸スラリーの調製、順次希釈し、6 ヶ月にわたってメッキの 1 つの因数を表します。この図の拡大版を表示するのにはここをクリックしてください。
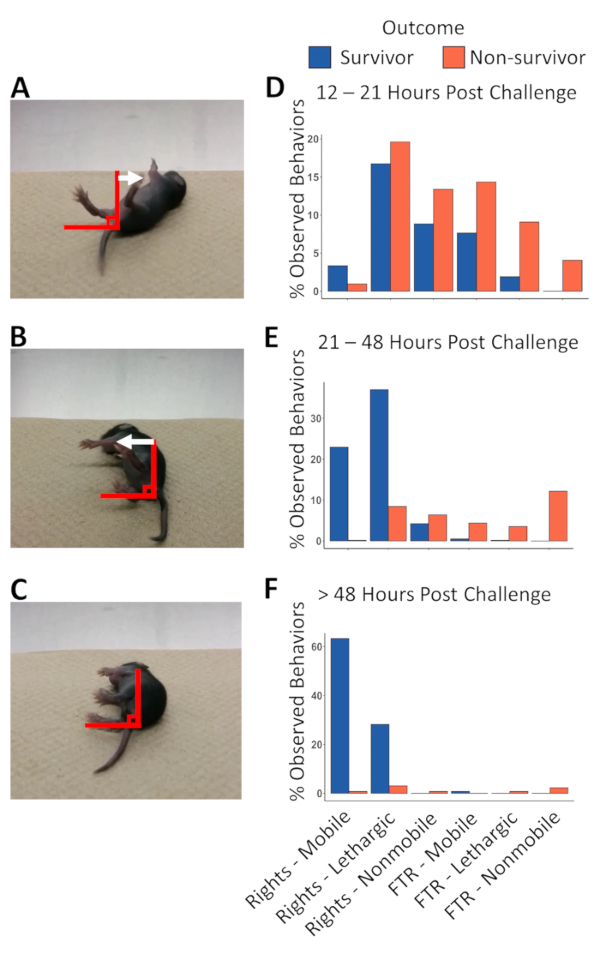
図 3: モビリティ カテゴリ マウス右自身に失敗して様々 な時間で postchallenge 動物の行動をヒップします。自分の背中に置かれたとき、敗血症、挑戦されているマウス股関節の動きの度合いによって測定することができます合併症の兆候が表示されます。右 (FTR) に (A) の失敗-モバイル マウスは水平方向から 90 ° の角度を超えるその上脚の股関節の動揺の動きを示しています。(B) の FTR-無気力マウスの動きを揺動を示していますヒップが、4 の途中で水平方向から 90 ° の角度を超えない監視の s。(C) いくつか FTR-Nonmobile マウス膝を曲げ、自分の足を拡張するが、ゼロのヒップホップ ロッキング運動と足に非常に少ない (角度 10 ° 未満) が表示されますは、互いに平行になります。(D) 動物の行動 12 21 h 負荷後ショー FTR Nonmobile 動作のみが nonsurvivors から生存者を分離します。(E) 48 h postchallenge 21 日から 592 観測 FTR 行動 (0.67%) から 4 だけは、真っ直ぐにすることを許可する、生存者に属する最終的な結果を予測し、人道的エンドポイントの新しいクリテリウムとして使用する反射。(F) を超えて 48 h の感染後、立ち直り反射を持っていた 6 のうち 131 マウス (4.55%) FTR グループの一部になるようになったし、回復のコース全体の持続的な監視を正当化する実験の終わりによって犠牲にされました。この図の拡大版を表示するのにはここをクリックしてください。
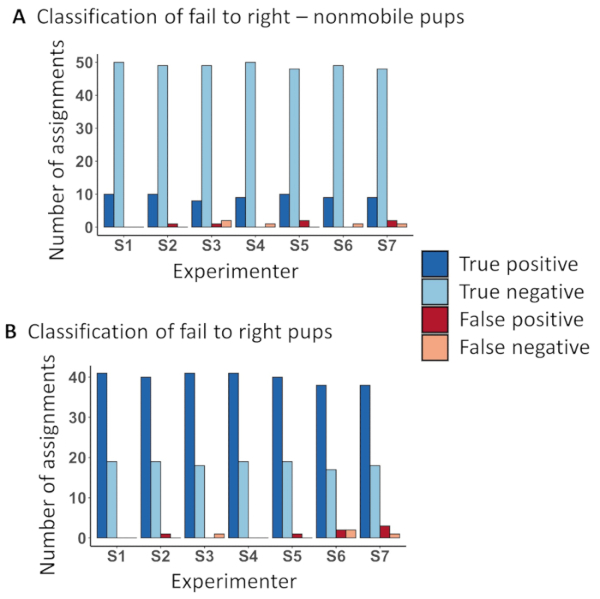
図 4: 教育リソースは、独立した実験者による正確な行動分類。このプロトコルを伴うビデオを見て訓練を実験者が別の健康グループに 60 新生児マウスの動画を分類します。(A) 動物愛護のエンドポイントを区別する能力を求めたし、行動の 97% の平均は正確に分類として FTR Nonmobile かどうか、FTR Nonmobile マウスの 1% だけが誤認された間。マウスの 2% は FTR Nonmobile として誤って識別されました。正しく FTR マウスまたは 4 内右自身に能力を持っているそれらの間を区別する (B) 2 番目の人道的エンドポイントの識別クリテリウム譜中唯一の 97% に彼らの背部に置かれているが正しく割り当てられています。自身の立ち直りとしてマウスの 0.96% が正しく割り当てられないし、FTR としてマウスの 2% が正しく割り当てられない。この図の拡大版を表示するのにはここをクリックしてください。
| 病期 | A: 高い罹患率、いいえ、死亡率 | B: 高い罹患率、死亡率は低い | C: 高い罹患率、死亡率が高い | D: 低罹患率、死亡率を低 |
| 時間後の挑戦 | 0−12 | 12−20 | 20−48 | > 48 |
| 監視頻度 | 2 h 投稿チャレンジ | すべての 4−6 h | すべての 4−6 h、8 h、一晩無人 | 1−2 倍、毎日必要な場合 |
| 観測された合計の人道的エンドポイントの割合 | 0/144 | 18/144 | 116/144 | 10/144 |
| 観測された人道的エンドポイントの割合 | 0% | 12.5% | 80.5% | 7% |
| 人道的エンドポイント基準 | 1. 両側 FTR−Nonmobile | 1. 両側 FTR−Nonmobile | ||
| 2 FTR−Lethargic で、巣からの散乱 | 2 FTR−Lethargic で、巣からの散乱 | |||
| 3. (移動スコア) と右側または左側に FTR | ||||
表 1: 監視および人道的エンドポイント基準病気のさまざまな段階の周波数。監視頻度、人道的エンドポイント観察、人道的エンドポイントおよび人道的エンドポイント基準の割合病気のさまざまな段階で。
| 立ち直り反射 | モビリティ | 制限時間は右背中に置かれて後 | 時間制限を (モバイル/無気力/モバイル) の移動量を測定する | モビリティの採点基準 |
| 権利 | 携帯 | 4 s | 追加 8 s | マウスは、複数のステップは、前方への勢いを維持すること、行とその環境を探検します。子犬は転倒しにくい。 |
| 無気力 | マウスが一歩を踏み出すが、停止し、別を服用する前に一時停止します。子犬が倒れることがあります。 | |||
| Nonmobile | マウス自体を復原後の手順を取らない。子犬が倒れることがあります。 | |||
| 右に失敗します。 | モバイル腰 | 同じ 4 s 立ち直り反射の測定に使用 | エネルギッシュな腰の動きは、大腿 4 内で少なくとも一度水平から 90 度を超えて回転 s。 | |
| 無気力な腰 | 腰の動きが水平から 90 ° を超えられない。 | |||
| モバイル以外の腰 | 拡張し、後退して手足を動かすことができるが、腰が回転しないでしょう。子犬は、非常に病弱な見えます。 |
表 2: テーブルおよびマウスの正常性スコアを決定する際に条件を監視します。指定した検索条件は、マウス、健康カテゴリ グループを定義して正常性スコアの割り当てに個々 の差異を減らすために使用されました。
ディスカッション
出生後の新生児マウスが非常に限られた移動性と比類のない時でさえ、彼らの背中に置かれて後彼ら自身を右に失敗します。DOL 7 マウスのこのモデルの挑戦の時代動きは FTR 携帯する権利携帯からまたがるの範囲で認められた比類のないマウスで重要な違い、すなわちこの年齢で比類のないマウスでは FTR 無気力動作が表示されませんでした。敗血症モデル挑戦マウスのみに観察された FTR 無気力。したがって、この応答は、病気の重症度の指標をすることができます。股関節の動きを水平方向から 90 ° の角度のカットオフに気配りをされているマウスの無気力やモバイルの腰の動きの一貫性と正確な割り当てのためことができます。4 の時間枠比類のないマウスは、一貫して彼ら自身をこの時間枠内右にできたので、マウス自体を右することができるかどうかを参照してくださいに s が選ばれました。繰り返される同じマウスの測定を避け、彼ら自身を右にしながら、ヒップ動揺度の測定は 4 に限られていた s、食糧および暖かさが得られることに影響を与えることができる影響を与えることができるマウスを過度に疲れを避けるために、予後を良きます。左側と右側の両方から真っ直ぐにすること自体が認められ, とスコアの高いマウスられた人道的エンドポイントでどうか、1 つの側面に FTR Nonmobile を表示するいくつかのマウスが見つかったのでまだ他の側と b 上高いモビリティに使用されました。e は最終的に回復することができます。
マウスの正常性を評価するために使用得点システムは動きのスペクトルはカテゴリ別ヒューズのアプリケーションに依存して、したがって、個々 のバイアスになりやすいかもしれない。スタッフは一人一人得点マウス同じ; ように一緒に訓練されました。ただしは変化につながる主観のレベル、おそらくまま。7 を持っていることによって得点の一貫性が評価された新生児マウス監視以前に行われなかった者このプロトコルとビデオで概説する要件を学ぶ、独立して動作を割り当てるし、動物愛護を決定エンドポイントです。97% の精度は、このモデルの行動の割り当てでは、個々 のバイアスに相当な役割を担わないことを示唆、60 の挑戦されたマウスに対して得点が観察されました。提案する行動監視プロトコルは DOL 7 に挑戦の動物の観察に基づいてまだ比類のない健康な状態で 6 日間より若いマウス一貫して右自身にことはできません。したがって、若いマウスに直接説明した人道的エンドポイント基準を適用できませんでした。若いマウスはこの実験モデルで使用される場合、または異なった病気の反応速度で別の課題モデルを適用した場合は、適切な人道的エンドポイント基準する必要があるを開発してそれ以外の場合、最終的には、マウスの安楽死を避けるために操縦回復します。スコアリング システムは、テストと確認、他のモデルに潜在的適用可能性のある人道的エンドポイントの分類を改善する堅牢な方法を表示します。
盲腸スラリーの各準備または新しいマウス緊張の使用と同様の致命的な線量を達成するために管理する盲腸スラリー量の retitration が必要。各準備が関心、すなわち生存の読み出しによって標準化された同じ細菌数を与えることではなく。少し、潜在的ドナーの共生細菌の違いや重量のばらつきによりを様々 な各盲腸スラリー調製の実行可能な細菌濃度は盲腸スラリー株式 postfiltration の携帯こし器の左。盲腸のスラリーの滴定の間に最初の 2 つのくずは 2 つのグループに分けられた、くずの各半分は 2 つの線量の 1 つに挑戦した、2 リットルでテストされる各用量。結果生存率で必要なレベルが一致しない場合チャレンジ線量が増加またはによって 5%-10% 減少し、実験を繰り返した。複数の仔は、抵抗の原因またはくずで敗血症に対する感受性増加してごみ-ごみの違いを考慮して使用されました。価盲腸スラリーの新しい滴定が以前盲腸スラリー製剤に匹敵することを確認する各の新しい準備が付いている盲腸スラリー在庫正確にすることが重要だった。過剰雑音と具体的にはアスファルトと近くの建物や道路の建設の圧縮時の振動の期間は、ダムの圧力を高めるに観察されました。これは共食いの増加率に相関し、も比類のないマウスは、余分な影響の制御が必要な新生児の生存率があることを示すに影響を与える生存実験の死亡率に影響します。
盲腸スラリー在庫の準備のための従来の方法には、新鮮な盲腸スラリーの使用またはないチャレンジ中に転送されると必然的にグリセロールでストレージを含む方法のさまざまなを使用して、冷凍の盲腸スラリー調製のいずれかが含まれています。新鮮な盲腸スラリーの使用元の盲腸内容に最も近い細菌の組成を持っていることの利点が、共生細菌の変化による個々 のドナーのマウスとの差異のリスクがあります。到着と実験の進行の間に最小限の時間で同じベンダーから盲腸のドナーを使用して最小限に抑えられますが、このいくつかの研究所のコストがオプションになることができる、ことで別タイミング物流課題を提示年齢をマッチさせたマウス盲腸スラリーを開始するときに使用できる 7 日歳された新生児マウスで実験します。新鮮な盲腸スラリーを使用する別の方法が利用された、複数の大人のドナーの盲腸内容物をプール、D5W、-80 ° C、グリセリンなしで冷凍で再停止される、実験のための時間で 1 つの因数を解凍しました。新生児敗血症を研究する大人のドナー盲腸スラリーの使用率は、さらされていない新生児マウス盲腸スラリー内に存在する細菌の種類を移すことができる可能性があることができます新生児マウス敗血症の研究戦略だと過去の13,14,15新生児マウス生物学の研究に使用されています。一度細菌を注入して、壊死性に腹腔内に栄養素の可用性を模倣するように行われていた、アクティブな感染の確立を許可する細菌に栄養を提供する D5W の盲腸スラリー希釈腸炎。グリセリンはグリセロール注入だけから生じる潜在的な負副作用のため細菌を凍結の安定化剤として含まれませんでした。グリセロールは、盲腸のスラリーの調製に含まれていた場合、潜在的な損傷、グリセリンだけで引き起こすことができる必要がありますグリセリンだけ (欠けている盲腸スラリー) を含めることによってテストする増加するいるとマウスに注入マウスは使用。盲腸スラリー株の細菌生存率グリセリンなし盲腸スラリー株式を凍結後にテストされた、-80 ° C、6 の上に格納されている同じ盲腸スラリー調製の別の因数で細菌濃度の変更なしで、定数であることがわかったヶ月の期間。グリセリンなし記憶域が一貫性のある生物学的結果を提供することで可能であることが示唆されました。一括準備のフローズン盲腸スラリー タイプの使用は、コストを削減し、したがってマウス消耗を減らすことがなければ繁殖から余分な男性のマウスを活用し、社内で飼育されたマウスの使用も許可。
マウスで失敗した課題の識別は、システムに余分なノイズを追加しないようにすることが重要だった。盲腸のスラリーの腹腔内投与を受け、実際に皮下が失敗した注入を示されている肌の下に膨らみが存在するマウスを認めた。両方の針を除去した直後、マウスが時々、注入後のステップを取ることができます後マウスが注射部位のリークをみしてステップを踏む注射部位の手足を移動した後にのみリーク (稀に)。膨らみやリーク注入を以下の存在の結果分析から、マウスを削除します。結局のところ、盲腸スラリー注入課題量の 5% の違いはその後の生存率に影響を与える観察されている、不適切な量により異なる結果にこれらのいずれかの可能性があります。
盲腸スラリー挑戦実験重量調整用量を変化させてさまざまなターゲット致死線量も必要です。このため、注入量として 20 μ L、100 μ L までの範囲です。関連付けられている比例の実験誤差死んで針でボリュームも直接異なる用量を比較する難易度が高く、注入量と共に変更します。注入量を標準化することの簡単な修正との差異のこのソースは、実験から削除されます。
新生仔マウスの行動の監視システムは、このプロトコルで使用され、その種の最初のです。新生児マウスと倫理的な研究を行う上で研究者の意図がこの年齢で動物の幸福を評価するためにリソースの挑戦的な欠如にしばしば直面します。提示された直感的な一貫性のある監視システムは、この知識のギャップに対処するため開始されます。重要なは、この証拠型アプローチ得られた実験データの品質を向上させるだけでなく、同時に、また実験動物の苦しみを減らします。
開示事項
博士ジェームス ウィン サポートを受け取るは、健康国立研究所 (NIH) から/全国一般医療科学 (R01GM128452) の研究所と NIH/ユーニス · ケネディ · シュライバー児童保健および人間の開発 (NICHD) (研究所R01HD089939)。
謝辞
特別指導・動物監視と幸福に入力クレア ・ ハリソンと、動物介護老人施設彼らのサポートのためのブリティッシュ ・ コロンビア小児病院研究所 (BCCHR) で動物の仕事だけでなく、博士 Po ヤン チェンに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 0.1 - 20 μL pipette tips | VWR | 732-0799 | |
| 1.8 mL Microcentrifuge tube | Costar | 3621 | |
| 100 - 1000 μL pipette tips | VWR | 732-0801 | |
| 1 - 200 μL pipette tips | VWR | 732-0800 | |
| 15 mL Centrifuge tube | FroggaBio | TB15-25 | |
| 23G1 needles | Becton Dickinson | 305145 | only the needle, not the syringe, used for pinning mouse to styrofoam |
| 28G 0.5 mL Insulin syringe | BD | 329461 | |
| 2 mL Cryogenic vial | Corning | 430488 | |
| 50 mL Centrifuge tube | Fisher scientific | 14-432-22 | |
| 5 mL pipette | Costar | 4487 | |
| 6 - 10 week old C57BL/6J adult mice | Jackson Laboratories | 664 | |
| 7 + day old C57BL/6J neonatal mice | Bred in house | n.a | |
| 70 μm Cell strainer | Falcon | 352350 | |
| Defibrinated Sheep's Blood | Dalynn | HS30-500 | |
| Dextrose 5% Water (D5W) | Baxter | JB0080 | |
| Dissecting forceps | VWR | 82027-386 | |
| Dissecting Scissors, Sharp Tip | VWR | 82027-592 | |
| Dissecting Scissors, Sharp/Blunt Tip | VWR | 82027-594 | |
| Ethanol (HistoPrep 95% Denatured Ethyl Alcohol) | Fisherbrand | HC11001GL | diluted to 70% with double distilled water |
| Ethanol-proof marker; Lab marker | VWR | 52877-310 | |
| EZ Anesthesia Vaporizer | EZ Anesthesia | EZ-155 | |
| Germinator 500, Dry sterilize surgicial instrument (Hot bead sterilizer) | Braintree Scientific | GER 5287-120V | |
| Isoflurane | Fresenius Kabi | CP0406V2 | |
| Micro Spatula | Chemglass | CG-1983-12 | |
| Pipette-Aid | Drummond | 4-000-100 | |
| Rainin Classic Pipette PR-1000 | Rainin | 17008653 | |
| Rainin Classic Pipette PR-20 | Rainin | 17008650 | |
| Rainin Classic Pipette PR-200 | Rainin | 17008652 | |
| Scale | Sartorius | BL 150 S | |
| Specimen forceps | VWR | 82027-440 / 82027-442 | |
| Square 1000 mL Storage Bottle | Corning | 431433 | |
| Styrofoam board | Any | n.a | |
| Sure-Seal Mouse/Rat euthanasia chamber | Euthanex | EZ-178 | |
| Tryptic Soy Agar | Sigma-Aldrich | 22091-2.5KG | |
| VX-200 Lab Vortex Mixer | Labnet International | S0200 | |
| weigh paper | Fisherbrand | 09-898-12B |
参考文献
- Liu, L., et al. Global, regional, and national causes of child mortality in 2000-13, with projections to inform post-2015 priorities: an updated systematic analysis. The Lancet. 385 (9966), 430-440 (2015).
- Wynn, J. L., et al. Increased mortality and altered immunity in neonatal sepsis produced by generalized peritonitis. Shock. 28 (6), 675-683 (2007).
- Fink, M. P. Animal models of sepsis. Virulence. 5 (1), 143-153 (2014).
- Wynn, J. L., et al. Defective innate immunity predisposes murine neonates to poor sepsis outcome but is reversed by TLR agonists. Blood. 112 (5), 1750-1758 (2008).
- Cuenca, A. G., et al. Critical role for CXC ligand 10/CXC receptor 3 signaling in the murine neonatal response to sepsis. Infection and Immunity. 79 (7), 2746-2754 (2011).
- Gentile, L. F., et al. Protective immunity and defects in the neonatal and elderly immune response to sepsis. Journal of Immunology. 192 (7), 3156-3165 (2014).
- Cuenca, A. G., et al. Delayed emergency myelopoiesis following polymicrobial sepsis in neonates. Innate Immunity. 21 (4), 386-391 (2015).
- Gentile, L. F., et al. Improved emergency myelopoiesis and survival in neonatal sepsis by caspase-1/11 ablation. Immunology. 145 (2), 300-311 (2015).
- Wynn, J. L., et al. Targeting IL-17A attenuates neonatal sepsis mortality induced by IL-18. Proceedings of the National Academy of Sciences of the United States of America. 113 (19), E2627-E2635 (2016).
- Fallon, E. A., et al. Program Cell Death Receptor-1-Mediated Invariant Natural Killer T-Cell Control of Peritoneal Macrophage Modulates Survival in Neonatal Sepsis. Frontiers in Immunology. 8, 1469(2017).
- Young, W. A., et al. Improved survival after induction of sepsis by cecal slurry in PD-1 knockout murine neonates. Surgery. 161 (5), 1387-1393 (2017).
- Rincon, J. C., et al. Adjuvant pretreatment with alum protects neonatal mice in sepsis through myeloid cell activation. Clinical & Experimental Immunology. 191 (3), 268-278 (2018).
- Starr, M. E., et al. A new cecal slurry preparation protocol with improved long-term reproducibility for animal models of sepsis. PLoS ONE. 9 (12), e115705(2014).
- Hansen, L. W., et al. Deficiency in milk fat globule-epidermal growth factor-factor 8 exacerbates organ injury and mortality in neonatal sepsis. Journal of Pediatric Surgery. 52 (9), 1520-1527 (2017).
- Fujioka, K., et al. Induction of heme oxygenase-1 attenuates the severity of sepsis in a non-surgical preterm mouse model. SHOCK. 47 (2), 242-250 (2017).
- Al Asmari, K. A., et al. Protective effect of quinacrine against glycerol-induced acute kidney injury in rats. BMC Nephrology. 18, PMC5273840(2017).
- Geng, X., et al. Differences in gene expression profiles and signaling pathways in rhabdomyolysis-induced acute kidney injury. International Journal of Clinical and Experimental Pathology. 8 (11), 14087-14098 (2015).
- Kim, J. H., et al. Macrophage depletion ameliorates glycerol-induced acute kidney injury in mice. Nephron Experimental Nephrology. 128 (1-2), 21-29 (2014).
- Nara, A., et al. Evaluations of lipid peroxidation and inflammation in short-term glycerol-induced acute kidney injury in rats. Clinical and Experimental Pharmacology and Physiology. 43 (11), 1080-1086 (2016).
- Zager, R. A., Johnson, A. C. M., Lund, S., Hanson, S. Acute renal failure: determinants and characteristics of the injury-induced hyperinflammatory response. American Journal of Physiology Renal Physiology. 291 (3), F546-F556 (2006).
- Olfert, E. D., Godson, D. L. Humane Endpoints for Infectious Disease Animal Models. Institute for Laboratory Animal Research Journal. 41 (2), 99-104 (2000).
- Canadian Council on Animal Care. Guidelines on: choosing an appropriate endpoint in experiments using animals for research, teaching and testing. , https://www.ccac.ca/Documents/Standards/Guidelines/Appropriate_endpoint.pdf (1998).
- Nemzek, J. A., Xiao, H. Y., Minard, A. E., Bolgos, G. L., Remick, D. G. Humane endpoints in shock research. SHOCK. 21 (1), 17-25 (2004).
- Morton, D. B. A systematic approach for establishing humane endpoints. Institute for Laboratory Animal Research Journal. 41 (2), 80-86 (2000).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved