Method Article
ヒト幹細胞由来腸腸単層におけるM細胞様細胞の誘導分化
要約
このプロトコルは、ヒト幹細胞由来の回腸単層におけるM細胞の分化を誘導する方法と、その発達を評価する方法について説明する。
要約
腸のM(マイクロフォールド)細胞は、頂点の内腔から免疫細胞が存在する基礎となるペイヤーのパッチおよび層体プロプリアに抗原を輸送し、腸内の粘膜免疫に寄与する。M細胞が腸内でどのように分化するか、またM細胞による抗原取り込みの分子機構を完全に理解することは欠けている。これは、M細胞は腸内の細胞の稀な集団であり、M細胞のインビトロモデルは堅牢ではないためです。腸の自己更新幹細胞培養システムの発見は、エンテロイドと呼ば、M細胞を培養するための新たな可能性を提供した。エンテロイドは、ゴブレット細胞、パネ細胞、腸内内分泌細胞および腸細胞を含む腸内のいくつかの主要な細胞型に分化することができるので、標準的な培養細胞株よりも有利である。サイトカインRANKLはM細胞の発達に不可欠であり、培養培養培養にRANKLおよびTNF-αを添加すると、M細胞に分化する腸腸内腸から細胞のサブセットを促進する。以下のプロトコルは、ヒトIleal腸腸を用いた腸のトランスウェル上皮偏光単層系におけるM細胞の分化のための方法を説明する。この方法は、M細胞の発達および機能の研究に適用することができる。
概要
M(マイクロフォールド)細胞は、主にペイヤーのパッチ1と呼ぶ小さなリンパ管領域の上皮関連上皮(FAE)に主に見出される専門腸上皮細胞である。M細胞は短い不規則な頂点マイクロビリを有し、その側に深く入植され、免疫細胞が細胞体2に密接に存在することを可能にする。このユニークな形態は、M細胞が腸の頂点内膜から抗原をサンプリングし、基礎となる免疫細胞2に直接届けることを可能にする。このように、M細胞は腸内の免疫監視のために重要であるが、また、ラミナプロプリア1、2、3、4、5に入るための病原体によって利用することができる。 6,7.
M細胞の研究は、いくつかの要因によって妨げられている。まず、M細胞はマウスおよびヒト腸8において低周波で見出される。培養細胞系では、M細胞様細胞は、偏光腺癌細胞株Caco-2を、マウスペイヤーのパッチまたはB細胞リンパ腫細胞株のBリンパ球と共培養することによって分化するように誘導されている、Raji B9,10.この結果、偏光上皮9、10におけるM細胞マーカーシアリルルイスA抗原およびUEA-1を発現するCaco-2細胞のサブセットをもたらす。(これらのマーカーは腸組織のゴブレット細胞にも発現しているので、今日では決定的なM細胞マーカー11,12としてあまり使用されていない。)このCaco-2-M細胞系は、粒子取り込みおよび細菌転移13、14を研究するために使用されてきた。しかしながら、Caco-2細胞は、Caco-2細胞の異なる供給源が実験室15の間で異なる発せ型を示す交絡因子を有する大腸腺癌からの確立された細胞株である。また、それらは、現在知られているM細胞マーカーGP2およびSpiB16の発現を欠いているため、真のM細胞の転写レベルを完全に要約しないかもしれない。したがって、M細胞の発達と機能を研究するためには、追加の生理的に関連する培養モデルが必要である。
過去10年以内に、腸の腸管由来モデルシステムの分野は、ヒト腸生検に由来する腸幹細胞が培養中に自己伝播し、自己再生できるという初期の発見から急速に進歩している。17歳,18.重要なことに、増殖培養物からの幹細胞促進因子の除去は、これらの幹細胞培養物が腸18に見られる多くの細胞型に分化することを可能にする。さらに、最近の研究は、腸19、20におけるM細胞発達におけるRANKL-RANKシグナル伝達の重要性を示唆している。RANK受容体は、腸内の上皮前駆細胞に発現される受容体のTNFファミリーのメンバーであり、RANKL(RANK受容体リガンド)は、ペイヤーのパッチ20の間質細胞によって放出される。腸内エンテロイドに存在する上皮細胞型はRANKLを産生しないため、腸内腸内膜培養におけるM細胞分化は、培養培地21,22へのRANKLの添加によって誘導されうる。培養培養培養培養物中にTNFαを含めることは、腸腸エンテロイド23におけるM細胞の発達をサポートするのに役立つ。ここでは、ヒトIleal腸腸に由来する腸単層におけるM細胞の分化誘導方法について説明する。我々の方法は、以下のプロトコル21、22、23からの変更に部分的に基づいています。
プロトコル
ここに記載されているすべての方法は、タフツ大学IBCとIRBによって承認されています.
1. ヒト腸腸状単層におけるM細胞分化の誘導
注:このプロトコルは、ヒト組織生検に由来する腸腸を使用する。これらの細胞を成長させ、通過する方法については、公開されたプロトコルを参照してください18,24.単層を開発するための以下の方法は、Zou et al.24から適合した。腸腸状由来培養におけるM細胞を誘導する方法は、以前の報告21、22、23から適応した。すべての作業は、無菌組織培養フードで行われ、インキュベーションは、示されているようにフードまたは組織培養インキュベーター内にある。腸腸腸単層および各種媒体を調作成するために必要な材料の表を参照してください。
- 細胞外マトリックス(ECM)で4〜10日間イレアルエンテロイドを成長させる(図1参照)。
- コーティングトランスウェル膜
- 24ウェルプレートに所望のトランスウェルを配置し、2チャンバシステムを作成します。
- 冷たい無菌リン酸緩衝生理食塩分(PBS)でECMを25倍希釈し、膜上の各上部チャンバーに100μLの冷たい希釈溶液を加えます。
注:ECMおよび希釈されたECM溶液は、添加直前まで氷上に保持する必要があります。 - 蓋で24ウェルプレートを覆い、37°Cの組織培養インキュベーターに2時間置き、膜上のECM固化を可能にします。
- 2時間後、インキュベーターからプレートを取り出し、組織培養フードに入れます。滅菌ピンセットを使用して、各トランスウェルを反転させ、残りの溶液を穏やかに除去する。細胞が集められている間、蓋を開けたままフードの中で膜をエアドライにします(ステップ1.3.1- 1.3.11)。
- 腸内腸を単一細胞に解離する
- インキュベーターから腸エンテロイドのプレートを取り出し、真空吸引またはピペットで各ウェルから培養培地を静かに取り除きます。
注:約100の健康な嚢胞を含む腸エンテロイドの1つの井戸は、1.5-2ウェルを播種するのに十分である。 - ECMに懸濁した腸エンテロイドを含む各ウェルに500μLの氷冷0.5mMエチレンディアミンテトラセチン酸(EDTA)を加えてECMを分解します。P1000ピペッターを500μLに設定して激しく上下にピペットを入れ、ECMを分解し、溶液中にイレアルエンテロイドを放出します。ECMの溶解を改善するために、ピペッティング後、プレートを4°Cで30分間激しく振る。
- 各井戸から15 mL円錐形のチューブに溶液を収集します。
注:最適の単一細胞のコレクションのための15 mL円錐形の管ごとの10までの井戸を集める。 - ペレットは140 x gと4°Cの遠心分離機で5分間ペレットが見えるはずですが、簡単に脱落することができるので、真空吸引またはピペットで上清をゆっくりと除去します。
注:ペレットと細胞の損失が懸念される場合は、ピペットを使用し、別のチューブに上清を保存します。 - タイトなジャンクションリンケージを消化し、腸内腸を単一の細胞に分割するには、ステップ1.3.3で収集された5ウェルごとに室温トリプシンの500 μLでペレットを再中断します。P1000を使用して、上下にピペットを上下に凝縮し、5分以下の37°Cの水浴でチューブをインキュベートします。
注:最適化は、細胞が分解されるが、死ぬまで過剰にトライプシン化しないようにチューブをインキュベートするのに必要な適切な時間を決定するために必要です。ステップ1.3.9でトリパンブルーを使用して、トリプシン処理後に細胞が生存可能であることを確認します。 - トリプシンの500 μLあたり10%の胎児牛血清(FBS)で高度なDMEM/F12の1 mLを追加し、トリプシンを不活性化します。
- P1000を500μLに500μLに設定して上下にピペットを、円錐管の側面に対して少なくとも50回、残りの塊をさらに単一細胞に分解する。
- 40 μmセルストレーナーを50 mLの円錐形の上に置き、10%FBSで高度なDMEM/F12の1 mLを加えてセルストレーナーを濡らします。15 mL円錐形からストレーナーに単一セル懸濁液をピペット。高度なDMEM/F12の1 mLでストレーナーを10%FBSで洗浄します。
- 50 mL円錐形からセルストレーナーを通過した細胞を新しい15 mL円錐管に移します。遠心分離ステップ1.3.10の間に、細胞ペレットは15 mL円錐形の管でより容易に見られる。血球計を使用して細胞を数えます。トリパンブルーを使用して、セルがまだ生きていることを確認します。典型的には、>95%の生存率が観察される。
- 細胞を数えながら、新しい15 mLチューブ内の細胞を400 x gで遠心分離し、室温を5分間見えるようにする必要があります。ピペットで上清を慎重に取り除き、ペレットが脱落した場合に備えて上清を保存します。
- 10 μM Y-27632を補充した修飾完全増殖培剤25(MCMGF+培中)を調製する。MCMGF+で2.5 x 105細胞/200 μLでペレット化した細胞を再中断します。セルシード数の最適化に関する説明を参照してください。
注:MCMGF+ メディアは、75% L-Wnt3a 条件付きメディアを備えた高度な DMEM/F12 です。 10% R-スポンドイン条件付き媒次剤, 5% ノギン条件付き培地, 1x B27 サプリメント, 1x N2 サプリメント, 1 mM N-アセチルシステイン, 50 ng/mL マウス組換え EGF, 500 nM A-8301, 10 nM [Leu15]ガストリン I,10 mM HEPES、2 mMグルタマックス、および1xペニシリン/ストレプトマイシン(オプション)。 - ステップ1.2で調製したECM被覆膜が、目で評価されているように完全に乾燥していることを確認してください。MCMGF+の200 μLで上部のチャンバを洗浄します。各上部チャンバに200μLの細胞溶液を加えます。
- 各下部チャンバに10 μM Y-27632を含むMCMGF+の700 μLを追加します。5%CO2で37°C組織培養インキュベーターにプレートを置きます。
- 成長の1日後、上部のチャンバーから培画像を取り出し、新鮮なMCMGF+の200 μLに置き換え、複数の細胞層の増殖を防ぎます。
- インキュベーターから腸エンテロイドのプレートを取り出し、真空吸引またはピペットで各ウェルから培養培地を静かに取り除きます。
- 媒体の置き換え
- 単層が~80%コンフルエント(通常は1~3日目のシード後)に、対照ウェルの分化媒体(DM)に置き換えるか(詳細についてはステップ1.4.2を参照)、またはM細胞誘導ウェルのMセルメディアを使用します(詳細についてはステップ1.4.3を参照)。両方の条件の DM で上部のメディアを交換します。
注:DMは5%のノギン条件付きメディアと高度なDMEM/F12です, 1x B27サプリメント、1x N2サプリメント、1mM N-アセチルシステイン、50 ng/mLマウス組換えEGF、50nM A-8301、10nM [Leu15]-ガストリンI、10 mM HEPESバッファ、2 mMグルタマックス、および1xペニックペニン).M細胞培養は、200 ng/mL RANKLおよび50 ng/mL TNFαを補充したDMである。 - M細胞を含まないコントロールウェルの場合は、上部チャンバに200 μLのDMを追加し、底部チャンバに700 μL DMを追加します。
- M細胞を誘導するには、上部チャンバに200μLのDMを加え、底部チャンバに700μLのM細胞培中を加える。
- 2 日ごとにメディアを交換します。制御ウェルの場合は、上下のチャンバーで DM を交換してください。M細胞ウェルの場合は、上部チャンバのDMと下部チャンバのM細胞培中にDMを交換してください。
注:7日目までに、M細胞は単層において完全に誘導される。
- 単層が~80%コンフルエント(通常は1~3日目のシード後)に、対照ウェルの分化媒体(DM)に置き換えるか(詳細についてはステップ1.4.2を参照)、またはM細胞誘導ウェルのMセルメディアを使用します(詳細についてはステップ1.4.3を参照)。両方の条件の DM で上部のメディアを交換します。
2. qRT-PCRによるM細胞分化の検証
注:無菌RNAEフリーベンチスペースで以下の作業を行います。qRT-PCR の優先材料の一覧については、資料表を参照してください。
- 上部および下部のチャンバーからメディアを取り外し、室温PBSの300 μLで上部のチャンバ2xを穏やかに洗います。
- 各上部のチャンバーに300 μLのトリゾールを追加します。室温で5分間インキュベートします。
注意:メーカーの指示に従って皮膚との接触を避けるためにトリゾールを使用する場合は、手袋と目の保護を着用してください。 - 一方、各ウェルにマイクロ遠心管をラベル付けし、各チューブに700 μLのトリゾールを追加します。
- P1000で3倍のピペッティングで細胞均質を収集し、対応するマイクロ遠心管に内容物を移します。5sを混合するための渦。
- サンプルを室温で3分間保持します。その後、最大1ヶ月間-80°Cで保存します。
- RNA単離、DNase処理、逆転転写およびqRT-PCR反応に関する標準的なqRT-PCR方法論に従ってください。材料の表のプライマーリストを参照してください。
3. 免疫蛍光によるM細胞分化の検証
注:常に膜が濡れているようにPBSで満たされたプレートの下部の部屋を維持します。この手順は、ベンチで実行されます。免疫蛍光に関する好ましい材料のリストについては、材料の表を参照してください。
- 上部のチャンバから培温を取り外し、室温PBSの300μLで2xを穏やかに洗います。室温4%PFAの室温の100 μLを上部のチャンバーに加えます。プレートをホイルで覆い、室温で25分間放置します。4% PFA を削除します。
注意:4%のPFAは、有害な化学廃棄物として適切に処分されるべきです。 - 室温PBSの300 μLで上部のチャンバ3xを洗浄します。この時点で、サンプルは染色の前に1ヶ月間4°Cに残ることができます。一度染色したら、サンプルは最高の品質の画像のために1週間以内に視覚化する必要があります。
- 5%の牛血清アルブミン(BSA)の100 μLで単層をインキュベートし、室温で30分間PBSに溶解し、単層を遮断する。
- 1:100の希釈でPBSで1%BSAでGP2一次抗体溶液を調出します。ウェルあたり 100 μL を追加します。暗闇の室温で1時間の汚れ。ソリューションを削除します。
注:M細胞の最適な一次GP2表面染色が透過的に達成されるため、GP2の一次染色が生じる前に単層を透過化しないでください。 - 室温PBSの300 μLで上部のチャンバを3倍に3倍洗います。
- 蛍光タグ付きヤギ抗マウスIgGの二次染色液を1:200、ファロイジンを1:100で、DAPIを1%BSA+0.1%のトリトンでPBSに調製する。ウェルあたり 100 μL を追加します。暗闇の中で室温で30分間汚れます。
注:トリトンは、適切なファロイジン染色のためにこのステップ中に細胞を透過化する二次染色液に添加される。 - 300 μL PBS で 3x を洗浄します。
- ガラススライドに5μLの取り付け液(材料の表)を置きます。24ウェルプレートからウェルを取り出し、反転します。慎重にメスを使用して井戸から膜をカットします。ガラススライド上の取り付け溶液の液滴の上に上向きの細胞と膜を置きます。10 μLの取り付け液を膜の上部と中心に追加し、カバースリップを上に置き、ガラススライドとカバースリップの間の膜をシールします。
- 24時間の暗闇の中で室温でスライドを乾燥させる. 染色されたスライドは、染色後1週間以内に共焦点顕微鏡で視覚化する必要があります。
結果
ECMで成長した腸エンテロイドは、イレアルエンテロイド培養および単層での使用のための品質管理の手段として、相対的な健康状態および分化状態について、視覚的およびqRT-PCRによって分析される。ECMで増殖した未分化腸エンテロイドは、形態学において明確かつ嚢胞性に見え、多くの幹細胞の存在を示す(図1A)。時間が経つにつれて、成長培地で成長する未分化の腸エンテロイドは、一部が嚢胞性に見え、一部が不透明に見える中間表現型を取る可能性があります(図1B)。多くの場合、私たちの未分化サンプルは図1Aではなく図1Bに示されているサンプルに似ています。 これらの中間培養物は、腸球マーカーの発現によって測定されるより末端に分化された腸細胞を含み、スクレーズイソマルターゼ(SI)、およびおそらく内膜の死有期細胞が密な外観に寄与する。単層化のためにこの中間状態でイレアルエンテロイドを使用することができますが、培養中に存在する腸幹細胞の量が少なく、いくつかの分化細胞タイプが存在する可能性があることに留意する必要があります(例えば、qRT-PCRを参照)。図2の図1Bに似たECMで成長した未分化サンプルのレベル)比較のために、ECMで5日以上分化培地で培養された腸腸エンテロイドは、均一に暗く見え、この形態を持つ培養物は単層の播種に適した候補ではない(図1C)。
幹細胞遺伝子および腸細胞分化の遺伝子の発現は、ECMで増殖した腸エンテロイドの健康状態と、トランスウェル上の単層として播種された後の分化能力を評価する別の手段としてqRT-PCRによって分析することができる。幹細胞遺伝子の発現は、LGR5、腸細胞遺伝子、SI、ゴブレット細胞遺伝子、MUC2、およびパネス細胞遺伝子、LYZ、ECMで増殖した未分化腸腸内核培養と分化回腸内性培養物との比較を行う。 RANKL/TNFαの有無における腸内単層(図2)。値は実験によって異なる場合がありますが、LGR5の発現は単層18、26の分化後に減少するはずです。 LGR5発現は、通常、7日目までにRANKLおよびTNFαを伴わない分化回回回単層では検出されない。逆に、SIおよびMUC2などの特定の細胞型の分化のマーカーの発現は、分化後に増加する18。 LYZの発現は、一般的に我々の文化の分化後に減少する。単層を作るのに使用される腸腸エンテロイド培養が図1Aよりも図1Bに似ている場合、これらの初期培養は異種であるため、腸分化マーカーの増加は、分化後に控えめである可能性がある。腸細胞型とSIとMUC2のより高い基底レベルを有する。しかし、単層における分化は、LGR5発現および顕微鏡検査の喪失によって評価された通りであり続ける(下記参照)。さらに、分化媒体へのRANKLおよびTNFαの添加は、LGR5発現の損失を減少させる(図2)。並行して、SIおよびMUC2の発現は、そのレベルが未分化条件を上回るが、RANKLおよびTNFαを欠いている分化状態よりもわずかに低い。
単層におけるM細胞分化は、細胞表面糖タンパク質2(GP2)および転写因子SpiB21を含む2つのM細胞特異的マーカーを用いてqRT−PCRおよび免疫蛍光の両方によって決定される。GP2およびSPIBの発現は、RANKLおよびTNFαの存在下で回腸腸状単層においてアップレギュレートされ、非RANKLおよびTNFα処理サンプルでは検出されない(図3)。これらのマーカーの発現は、利用可能な場合には、小腸組織22の一部に正規化することもできる。これにより、これらのM細胞マーカーの折り目変更を、これらのマーカーの発現を持たない単層を制御するのではなく、M細胞を有する組織と比較することができ、1つの実験室での実験間の標準化を可能にする。M細胞は、免疫蛍光によるGP2の表面発現によっても検出される(図4)。典型的には、コンフルエント単層において、RANKLおよびTNFα(図4A-D)で処理された試料において、6日目から8日目までに40倍の倍率で所定の顕微鏡場で1〜5M細胞が観察される。未処理サンプルにはGP2発現は見られない(図4E)。ファロイジンプローブと重ね合わされたXZ平面の直交図は、M細胞の頂点表面上の各細胞およびGP2発現を取り囲むアクチン構造を示す(図4F-G)。このモデルは、ヒト腸1、2、8に見られるM細胞の低周波を要約する。さらなる研究のためにM細胞を精製・単離するために、M細胞はGP2表面発現を用いて染色し、GP2+細胞のFACSを用いてソートすることができる。
M細胞は腸内膜から上皮2の下に存在する免疫細胞に抗原を結合して輸送する。腸内で産生される分泌IgAは細菌に結合し、微生物27、28の輸送を容易にするためにM細胞の頂点表面に結合することができる。このモデルで開発されたM細胞がIgAに結合することができるかどうかを決定するために、ヒト血清IgAを上部チャンバに添加し、1時間結合させ、次いで単層が免疫蛍光分析のために調製される。M細胞上のIgAの存在は、ヒト血清IgAの重鎖を認識する蛍動結合二次抗体を用いて可視化される。IgAで1時間処理したM細胞は、頂点表面に結合したIgAを持ち(図5A)、一方、IgAに二次抗体でしか処理できなかった制御ウェルのM細胞は検出可能なシグナルを持たない(図5B)。また、IgAはM細胞の頂点表面に特異的に結合し、GP2表面染色を有する任意の細胞に結合することは見出されない。さらに、M細胞は、その頂点表面2に特徴的に短い緻密なアクチンを有する。このモデルでM細胞形態を分析するために、イレアル腸腸状単層を7日間増殖させ、ファロイジンを用いたF-アクチンの免疫蛍光分析のために採取した。アクチン画素強度の測定値は、ImageJソフトウェアを使用して各Mセルに直接隣接するMセルおよび非Mセルについて計算されます(図6A)。このモデルの GP2+ M 細胞ではアクチン強度が低下し、代表的な画像を図 6Bに示します。全体的に、この腸腸状単層モデルで開発されたM細胞は、特徴的な遺伝子発現、形態およびIgAへの結合などのヒト腸M細胞の一部のM細胞機能を有する。
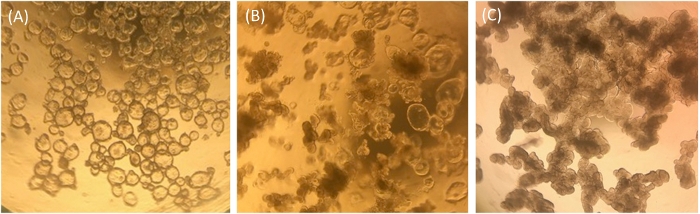
図1:ECMの1週間後のヒト腸腸内膜の代表的形態(A) クリアで嚢胞性未分化腸エンテロイド。(B) いくつかの嚢胞性腸エンテロイドといくつかの不透明な小葉性腸エンテロイドを有する中間表現型。(C) 暗く、小葉区別された腸エンテロイド。iPhone7カメラを用いて4倍の倍率で光学顕微鏡のレンズを通して撮影した画像。この図のより大きなバージョンを表示するには、ここをクリックしてください。
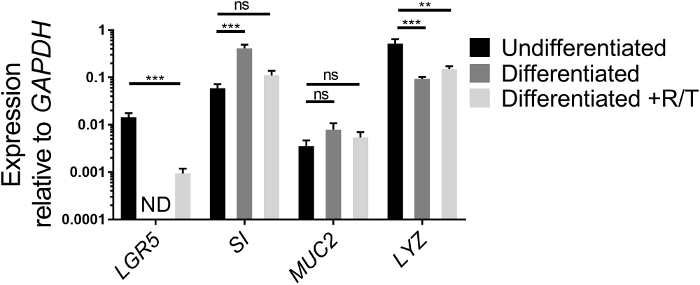
図2:ECMで増殖したヒト腸腸エンテロイドの幹細胞および分化マーカーの相対発現または単層として分化した。イレアルエンテロイドは、ECM(未分化)で7日間増殖させたか、またはRANKLおよびTNFα(分化+R/T)を用いて単層として増殖および分化した。腸内腸内膜培養または単層は、RNA抽出のためにトリゾールで採取した。遺伝子発現はqRT-PCRによって決定され、GAPDHに対して相対的に発現される。データは、条件ごとの回腸エンテロイドまたは単層の3つの独立したウェルの平均である。エラー バーは、SEM. ND が検出されないことを示します。統計的有意性は、一方通行の分散値を用いて、Dunnettの多重比較検定を用いて非未分化値と比較して決定された。** p < 0.01, *** p < 0.001この図のより大きなバージョンを表示するには、ここをクリックしてください。
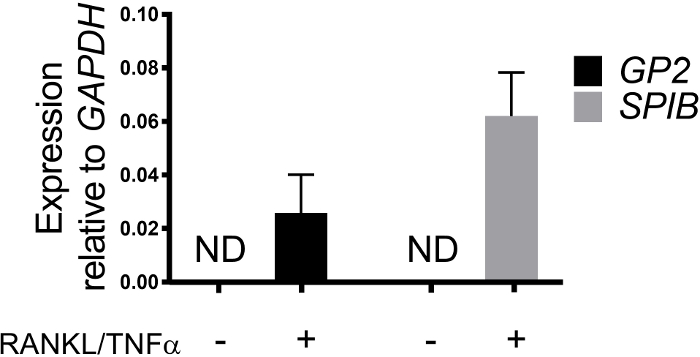
図3:ヒト腸腸状単層からのM細胞特異的マーカーGP2およびSPIBの相対発現。RANKL/TNFα処理および非処理ヒト腸腸状単層は、播種後7日後にRNA抽出のためにトリゾールで採取した。遺伝子発現はqRT-PCRによって決定され、GAPDHに対して相対的に発現される。データは、条件ごとに 6 つの独立した単層の平均です。エラー バーは、SEM. ND が検出されないことを示します。この図のより大きなバージョンを表示するには、ここをクリックしてください。
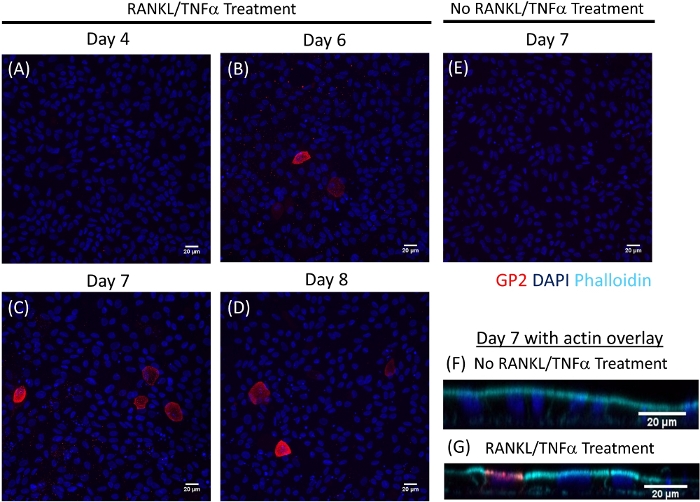
図4:ヒト腸腸状単層におけるM細胞における表面GP2発現の免疫蛍光は、経時に現像する。RANKL/TNFα処理および非処理ヒト腸腸状単層を4%PFAに固定し、種分後の様々な示された日に免疫蛍光のために染色した。画像はImageJソフトウェアを用いて分析した。DAPI = 青;糖タンパク質2(GP2)=赤。(A-D)RANKL/TNFαは、種まき後の様々な日に単層を処理した。(E)7日目に収穫された非処理単層は播種後に採取した。(F-G)7日目の単層の直交XZ面は、F-アクチン用のファロイジンプローブを重ねた。ファロイジン = シアンこの図のより大きなバージョンを表示するには、ここをクリックしてください。
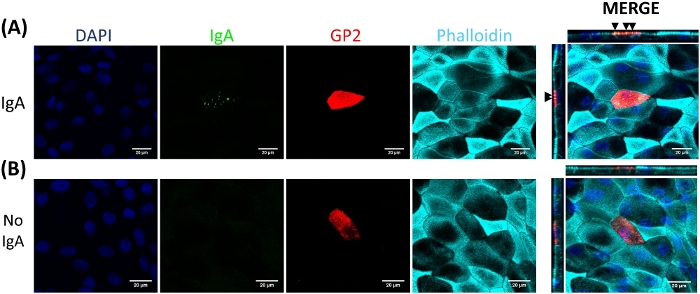
図5:IgAは、M細胞の頂点表面に特異的に結合する。RANKL/TNFα処理ヒト腸腸状単層を7日間増殖させ、次いで(A)10μgのヒト血清IgAを1時間または(B)でPBSのみで模擬処理した(IgA対照なし)。1時間後、単層をPBSで2倍洗浄し、4%PFAで固定し、0.1%TritonX-100で透過化し、免疫蛍光のために染色した。画像はImageJソフトウェアを用いて分析し、3つの独立した実験を代表する。DAPI = 青;糖タンパク質 2 (GP2) = 赤;ヒト血清IgA=グリーンに対する抗体;ファロイジン = シアン黒い矢印は、Mセルの頂点サーフェスに結合された IgA を示します。この図のより大きなバージョンを表示するには、ここをクリックしてください。
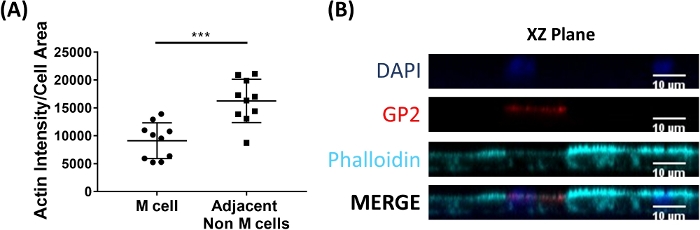
図6:M細胞は、隣接する非M細胞と比較してアクチン強度を低下させた。RANKL/TNFα処理ヒト腸腸状単層を7日間増殖させ、次いで4%PFAで固定し、免疫蛍光のために染色した。(A) ImageJを用いて、GP2+M細胞をフリーハンド選択ツールを用いて概説し、面積と積分密度の測定をファロイジンチャネルで撮影した。その後、M セルに隣接する隣接する非 M セルごとに同じ解析が完了しました。生の積分密度は、正規化のために個々の細胞の面積で割った。平均積分密度/面積は、各Mセルについて隣接する非Mセルごとに算出した。画像は3つの独立した実験から分析された。各ドットは、M セルまたは隣接セルの平均です。誤差バーは、SD. 統計的有意性が対化t検定を使用して対数変換値で決定されたことを示します。p= 0.0001(B) A. 画像のプロットからXZ平面の代表的な画像をImageJソフトウェアを用いて分析した。DAPI = 青;糖タンパク質 2 (GP2) = 赤;ファロイジン = シアンこの図のより大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
主要腸細胞型やM細胞に適切に分化する単層を開発するには、いくつかの要因に注意することが重要です。腸エンテロイドは、未分化であり、Lgr5+幹細胞の高い割合を持つECM培養物から収穫されなければなりません。視覚的には、ECM培養中の腸エンテロイドの大部分を暗くし、多ロブ状にしてはならないし、LGR5発現はqRT-PCR分析によってこれらの培養物中に検出されるべきである。 条件付きメディアの品質管理は、時間の経過に伴う未分化カルチャの伝播に不可欠であり、生成される条件付きメディアのバッチごとに完了する必要があります。品質管理は、いくつかのECM培養物で新しいメディアバッチをテストし、1週間の間にメディアの以前のバッチに腸腸エンテロイドの形態を比較することによって完了することができます。LGR5発現は、前のバッチと比較して新しい培地で成長した腸腸内膜培養物において比較的類似したままであるべきである。
単層として播種するための腸内腸の調製時に、トリプシンでインキュベーションした後に細胞溶液を激しくピプトして、腸内腸を単一細胞に分解することが重要である。細胞束は、単層の種子の場合、多層形成につながる可能性があります。また、得られる個々の回腸腸線ごとに単層を形成するために必要な細胞の数を経験的に決定することが不可欠である。通常、この値は2.5 x 105 - 5.0 x 105細胞/ウェルの範囲であり、培養中の嚢胞性から非嚢胞性腸エンテロイドの程度に依存し、個々の回腸エンテロイド線ごとに変化する。経験から、嚢胞性が低いと思われるECMで増殖した腸エンテロイドは、単層を達成するためにより高い細胞播種密度を必要とする。メディアを2~3回ゆっくりと上下にピペッティングし、新鮮な成長培源に置き換えることで、成長の1日後に上室を洗浄することをお勧めします。このプロセスは、他の細胞の上に着陸した細胞を脱落させ、多層形成の可能性を減少させる。単層が2日目に通常発生する〜80%のコンフルエントである場合、上部チャンバー内の培地を成長培地からM細胞培地に切り替えることで、良好なM細胞分化を達成するのに役立ちます。M細胞誘導時に上段にRANKL/TNFαを添加しても、単層あたりのより多くのM細胞の発達にはつながりないため、上部チャンバー培媒体から取り除くことができる。様々な細孔サイズのトランスウェルは、M細胞の発達に影響を与えることなく、このプロトコルで使用することができます。ただし、細胞の播種密度は、より大きな細孔サイズの場合に最適化する必要があります。コラーゲンIVは、特定の用途に適する可能性のあるトランスウェルまたはウェルプレートの地下膜タンパク質コーティングとしてECMに置き換えることができます。
トランスウェル上の腸腸管由来単層は、4-5種類の上皮腸細胞が偏光して各々の表面マーカーを発現できるように、定義された頂点および浴盤面の作成を可能にする2チャンバーシステムを提供する。腸で見つかったものに対して相対的な側。粒子、感染剤、またはその他の細胞タイプなどのいずれかの側に追加の因子を追加できます。ただし、現在までにいくつかの制限が残っています。記載されているように、このシステムは、生理的流れ、腸収縮、および腸の内容物を欠く静的システムである。さらに、平らな単層の形成によって、ビルス暗号アーキテクチャは失われる。これらのシステムには、Peyerのパッチ領域、免疫細胞、および間質細胞が欠けています。M細胞の下に密接に存在する免疫細胞と間質細胞の欠如が、このシステムおよび他の生理機能では観察されない膣内不存在に影響を及ぼすかどうかは、今後の重要な調査領域である。このプロトコルは96ウェル版かマルチウェル版フォーマットに合わせることができる。96ウェルプレートをECMでコーティングし、腸腸エンテロイドから単一細胞で播種する手順は、トランスウェルの場合と同じままである。単層を得るために必要な細胞種密度の滴定は行う必要がありますが、通常は96ウェルプレート形式で1.0 x 105 - 3.0 x 105セル/ウェルの範囲です。M細胞は、単層が初期細胞種分密度に応じて通常1〜3日で80%のコンフルエントである場合に増殖培媒をM細胞培メで置き換えることによって誘導される。
この方法では、M細胞をインビトロで回腸エンテロイドから分化し、Caco-2法に対して著しい改善を提供する。腸内腸は一次細胞であり、少なくとも4〜5種類の上皮細胞が系内に存在する。さらに、異なる人々に由来する腸腸腸線を研究し、遺伝学や疾患状態がM細胞の発達と行動にどのように影響するかを調べることができます。M細胞分化中の腸腸エンテロイドの追加操作は、M細胞前駆細胞の特徴付けを含むM細胞の発達のより良い理解を可能にする。最後に、M細胞の咽頭症と経減少症の分子機構はまだ完全に理解されていないので、このモデルは、M細胞による抗原および粒子取り込みを研究し、視覚化する機会を提供する。
開示事項
著者は何も開示していない。
謝辞
この研究は、NIAID U19AI131126博士イスバーグ博士(タフツ大学医学部)とカプラン博士(タフツ大学)によって支援されました。(JMはプロジェクト2リーダー)とNIAID R21AI128093をJMにACF は NIAID T32AI00777 によって部分的にサポートされました。SEB および MKE は NIAID U19AI116497-05 によってサポートされました。私たちは、メクサスラボ、Ngラボ、タフツ大学医学部のイスバーグ博士に有益な議論をしてくださったことに感謝します。共焦点イメージングは、タフツ神経科学研究センターP30 NS047243で行われました。
資料
| Name | Company | Catalog Number | Comments |
| [Leu15]-Gastrin I | Sigma-Aldrich | G9145 | MCMGF+ and DM ingredient Solvent: PBS Stock Concentration: 10 µM Final Concentration: 10 nM |
| 0.5 M EDTA | Invitrogen | 15575020 | For breaking up ECM Solvent: PBS Stock Concentration: 0.5 M Final Concentration: 0.5 mM |
| 40 µm cell strainer | Corning | 352340 | For excluding clumps from single cells Solvent: Stock Concentration: Final Concentration: |
| A-8301 | Sigma-Aldrich | SML0788-5MG | MCMGF+ and DM ingredient Solvent: DMSO Stock Concentration: 500 µM Final Concentration: 500 nM |
| Advanced DMEM/F12 | Invitrogen | 12634-028 | MCMGF+ and DM Basal medium Solvent: Stock Concentration: Final Concentration: |
| Alexa Fluor 594 goat anti-mouse IgG | Thermo Fisher | A-11005 | For secondary stain Solvent: Stock Concentration: Final Concentration: 1:200 |
| Alexa Fluor 647 Phalloidin | Invitrogen | A22287 | Optional secondary stain for F-actin Solvent: Stock Concentration: Final Concentration: 1:100 |
| B27 Supplement | Invitrogen | 17504-044 | MCMGF+ and DM ingredient Solvent: Stock Concentration: 50x Final Concentration: 1x |
| Bovine Serum Albumin | Chem-Impex | 00535 | 5% for blocking solution Solvent: PBS Stock Concentration: Final Concentration: 0.01 |
| Chloroform | Fisher Scientific | C298-500 | For RNA isolation Solvent: Stock Concentration: Final Concentration: |
| Circle coverslips | Thomas Scientific | 1157B50 | For mounting membrane on glass slide Solvent: Stock Concentration: Final Concentration: |
| DAPI (4′,6-diamidino-2-phenylindole) | Thermo Fisher | 62247 | For secondary stain Solvent: PBS Stock Concentration: 100x Final Concentration: 1x |
| DEPC Treated RNAse free H2O | Fisher Scientific | BP561-1 | For RNA isolation Solvent: Stock Concentration: Final Concentration: |
| DNA Removal Kit | Invitrogen | AM1906 | For RNA isolation Solvent: Stock Concentration: Final Concentration: |
| Ethyl Alcohol, 200 proof | Sigma Aldrich | EX0276-4 | For RNA isolation Solvent: Stock Concentration: Final Concentration: |
| Feather Scalpels | VWR | 100499-580 | For cutting membrane from transwells Solvent: Stock Concentration: Final Concentration: |
| Fetal Bovine Serum (FBS) | Gibco | 26140079 | For inactivating trypsin Solvent: Advanced DMEM/F12 Stock Concentration: 1 Final Concentration: 0.1 |
| Glass slides | Mercedes Scientific | MER 7200/90/WH | For mounting membrane on glass slide Solvent: Stock Concentration: Final Concentration: |
| GlutaMAX | Invitrogen | 35050-061 | MCMGF+ and DM ingredient Solvent: Stock Concentration: 200 mM Final Concentration: 2 mM |
| GP2 Antibody | MBL International | D277-3 | Surface stain for M cells Solvent: Stock Concentration: Final Concentration: 1:100 |
| HEPES | Invitrogen | 15630-080 | MCMGF+ and DM ingredient Solvent: Stock Concentration: 1 M Final Concentration: 10 mM |
| Human Serum IgA | Lee BioSolutions | 340-12-1 | For functional analysis of M cells Solvent: PBS Stock Concentration: 1 mg/mL Final Concentration: 10 µg |
| L-Wnt3a conditioned media | Cell line from ATCC | CRL-2647 | Refer to ATCC Product Sheet for L Wnt3A (ATCC CRL2647) for conditioned media protocol; MCMGF+ ingredient Solvent: Stock Concentration: Final Concentration: 75% in MCMGF+ 0% in DM |
| Matrigel, GFR, phenol free | Corning | 356231 | Extracellular Matrix (ECM) Solvent: Stock Concentration: Final Concentration: |
| Mouse recombinant EGF | Invitrogen | PMG8043 | MCMGF+ and DM ingredient Solvent: PBS Stock Concentration: 50 µg/mL Final Concentration: 50 ng/mL |
| N2 Supplement | Invitrogen | 17502-048 | MCMGF+ and DM ingredient Solvent: Stock Concentration: 100x Final Concentration: 1x |
| N-acetylcysteine | Sigma-Aldrich | A9165-5G | MCMGF+ and DM ingredient Solvent: H2O Stock Concentration: 500 mM Final Concentration: 1 mM |
| Noggin conditioned media | Cell line gift from Dr. Gijs van den Brink (University of Amsterdam) | Ref 30 for conditioned media protocol; MCMGF+ and DM Ingredient Solvent: Stock Concentration: Final Concentration: 5% in MCMGF+ 5% in DM | |
| Paraformaldehyde (PFA) | MP Biomedicals | 2199983 | For fixing monolayers Solvent: PBS Stock Concentration: 0.16 Final Concentration: 0.04 |
| PBS, -Mg, -Ca | Corning | MT21040CV | Solvent for 0.5 mM EDTA Solvent: Stock Concentration: Final Concentration: |
| Penicillin/Streptomycin | Invitrogen | 15140-122 | Optional ingredient of MCMGF+ and DM Solvent: Stock Concentration: 100x Final Concentration: 1x |
| Prolong Gold | Invitrogen | P36930 | Antifade mounting solution Solvent: Stock Concentration: Final Concentration: |
| Qiagen RNeasy Kit | Qiagen | 74106 | For RNA isolation Solvent: Stock Concentration: Final Concentration: |
| Recombinant human RANKL | Peprotech | 310-01 | Used to induce M cells Solvent: H2O Stock Concentration: 0.1 mg/mL Final Concentration: 200 ng/mL |
| Recombinant murine TNFa | Peprotech | 315-01A | Used to induce M cells Solvent: H2O Stock Concentration: 5 mg/mL Final Concentration: 50 ng/mL |
| R-spondin conditioned media | Cell line from Trevigen | 3710-001-01 | Refer to Trevigen Cultrex Rspo1 Cells product manual (HA-R-Spondin1 293T cell line) for conditioned media protocol; MCMGF+ Ingredient Solvent: Stock Concentration: Final Concentration: 10% in MCMGF+ 0% in DM |
| Secondary anti-human IgA antibody | Jackson Immuno Research | 109-545-011 | For secondary stain Solvent: Stock Concentration: Final Concentration: 1:200 |
| Super Script IV Reverse Transcriptase | Thermo Fisher | 18091200 | For conversion of RNA to DNA Solvent: Stock Concentration: Final Concentration: |
| Transwell inserts, 24 well-sized | Greiner Bio-One | 662641 | 0.4 µm pore size Solvent: Stock Concentration: Final Concentration: |
| TritonX-100 | Sigma-Aldrich | T8787 | Not required during GP2 primary stain Solvent: 1% BSA Stock Concentration: Final Concentration: 0.001 |
| TRIzol | Invitrogen | 15596018 | For RNA isolation Solvent: Stock Concentration: Final Concentration: |
| TrypLE Express | Invitrogen | 12605010 | Trypsin for breaking up enteroids into single cells Solvent: Stock Concentration: Final Concentration: |
| Y-27632 | Sigma-Aldrich | Y-0503 | MCMGF+ ingredient on day 0 Solvent: H2O Stock Concentration: 5 mM Final Concentration: 10 µM |
| GAPDH forward primer | CATGAGAAGTATGACAACAGCCT | ||
| GAPDH reverse primer | AGTCCTTCCACGATACCAAAGT | ||
| GP2 forward primer | CAATGTGCCTACCCACTGGA | ||
| GP2 reverse primer | ATGGCACCCACATACAGCAC | ||
| LYZ forward primer | CGCTACTGGTGTAATGATGG | ||
| LYZ reverse primer | TTTGCACAAGCTACAGCATC | ||
| MUC2 forward primer | ATGCCCTTGCGTCCATAACA | ||
| MUC2 reverse primer | AGGAGCAGTGTCCGTCAAAG | ||
| SI forward primer | TCCAGCTACTACTCGTGTGAC | ||
| SI reverse primer | CCCTCTGTTGGGAATTGTTCTG | ||
| SPIB forward primer | CAGCAGCCGCTTTTAGCCAC | ||
| SPIB reverse primer | GCATATGCCGGGGGAACC | ||
| LGR5 forward primer | TCAGTCAGCTGCTCCCGAAT | ||
| LGR5 reverse primer | CGTTTCCCGCAAGACGTAAC |
参考文献
- Kraehenbuhl, J. P., Neutra, M. R. Epithelial M cells: differentiation and function. Annual Review of Cell and Developmental Biology. 16, 301-332 (2000).
- Neutra, M. R., Frey, A., Kraehenbuhl, J. P. Epithelial M cells: gateways for mucosal infection and immunization. Cell. 86 (3), 345-348 (1996).
- Nakamura, Y., Kimura, S., Hase, K. M. cell-dependent antigen uptake on follicle-associated epithelium for mucosal immune surveillance. Inflammation and Regeneration. 38, 15 (2018).
- Clark, M. A., Hirst, B. H., Jepson, M. A. M-cell surface beta1 integrin expression and invasin-mediated targeting of Yersinia pseudotuberculosis to mouse Peyer's patch M cells. Infection and Immunity. 66 (3), 1237-1243 (1998).
- Jensen, V. B., Harty, J. T., Jones, B. D. Interactions of the invasive pathogens Salmonella typhimurium, Listeria monocytogenes, and Shigella flexneri with M cells and murine Peyer's patches. Infection and Immunity. 66 (8), 3758-3766 (1998).
- Jones, B. D., Ghori, N., Falkow, S. Salmonella typhimurium initiates murine infection by penetrating and destroying the specialized epithelial M cells of the Peyer's patches. Journal of Experimental Medicine. 180 (1), 15-23 (1994).
- Marra, A., Isberg, R. R. Invasin-dependent and invasin-independent pathways for translocation of Yersinia pseudotuberculosis across the Peyer's patch intestinal epithelium. Infection and Immunity. 65 (8), 3412-3421 (1997).
- Ohno, H. Intestinal M cells. Journal of Biochemistry. 159 (2), 151-160 (2016).
- Kerneis, S., Bogdanova, A., Kraehenbuhl, J. P., Pringault, E. Conversion by Peyer's patch lymphocytes of human enterocytes into M cells that transport bacteria. Science. 277 (5328), 949-952 (1997).
- Gullberg, E., et al. Expression of specific markers and particle transport in a new human intestinal M-cell model. Biochemical and Biophysical Research Communications. 279 (3), 808-813 (2000).
- Giannasca, P. J., Giannasca, K. T., Leichtner, A. M., Neutra, M. R. Human intestinal M cells display the sialyl Lewis A antigen. Infection and Immunity. 67 (2), 946-953 (1999).
- Jang, M. H., et al. Intestinal villous M cells: an antigen entry site in the mucosal epithelium. Proceedings of the National Academy of Sciences of the United States of America. 101 (16), 6110-6115 (2004).
- Beloqui, A., Brayden, D. J., Artursson, P., Preat, V., des Rieux, A. A human intestinal M-cell-like model for investigating particle, antigen and microorganism translocation. Nature Protocols. 12 (7), 1387-1399 (2017).
- Martinez-Argudo, I., Jepson, M. A. Salmonella translocates across an in vitro M cell model independently of SPI-1 and SPI-2. Microbiology. 154 (Pt 12), 3887-3894 (2008).
- Lee, J. B., et al. Quantitative analysis of lab-to-lab variability in Caco-2 permeability assays. European Journal of Pharmaceutics and Biopharmaceutics. 114, 38-42 (2017).
- Mabbott, N. A., Donaldson, D. S., Ohno, H., Williams, I. R., Mahajan, A. Microfold (M) cells: important immunosurveillance posts in the intestinal epithelium. Mucosal Immunology. 6 (4), 666-677 (2013).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Knoop, K. A., et al. RANKL is necessary and sufficient to initiate development of antigen-sampling M cells in the intestinal epithelium. Journal of Immunology. 183 (9), 5738-5747 (2009).
- Taylor, R. T., et al. Lymphotoxin-independent expression of TNF-related activation-induced cytokine by stromal cells in cryptopatches, isolated lymphoid follicles, and Peyer's patches. Journal of Immunology. 178 (9), 5659-5667 (2007).
- de Lau, W., et al. Peyer's patch M cells derived from Lgr5(+) stem cells require SpiB and are induced by RankL in cultured "miniguts". Molecular and Cellular Biology. 32 (18), 3639-3647 (2012).
- Rouch, J. D., et al. Development of Functional Microfold (M) Cells from Intestinal Stem Cells in Primary Human Enteroids. PloS One. 11 (1), e0148216 (2016).
- Wood, M. B., Rios, D., Williams, I. R. TNF-alpha augments RANKL-dependent intestinal M cell differentiation in enteroid cultures. American Journal of Physiology: Cell Physiology. 311 (3), C498-C507 (2016).
- Zou, W. Y., et al. Human Intestinal Enteroids: New Models to Study Gastrointestinal Virus Infections. Methods in Molecular Biology. , (2017).
- Kozuka, K., et al. Development and Characterization of a Human and Mouse Intestinal Epithelial Cell Monolayer Platform. Stem Cell Reports. 9 (6), 1976-1990 (2017).
- Barker, N., et al. Identification of stem cells in small intestine and colon by marker gene Lgr5. Nature. 449 (7165), 1003-1007 (2007).
- Mantis, N. J., et al. Selective adherence of IgA to murine Peyer's patch M cells: evidence for a novel IgA receptor. Journal of Immunology. 169 (4), 1844-1851 (2002).
- Rios, D., et al. Antigen sampling by intestinal M cells is the principal pathway initiating mucosal IgA production to commensal enteric bacteria. Mucosal Immunology. 9 (4), 907-916 (2016).
- Miller, H., Zhang, J., Kuolee, R., Patel, G. B., Chen, W. Intestinal M cells: the fallible sentinels?. World Journal of Gastroenterology. 13 (10), 1477-1486 (2007).
- Heijmans, J., et al. ER stress causes rapid loss of intestinal epithelial stemness through activation of the unfolded protein response. Cell Reports. 3 (4), 1128-1139 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved