Method Article
Differenziazione indotta di cellule M in monostrati Enteroidi Ileal Imbecilli derivati da cellule staminali umane
In questo articolo
Riepilogo
Questo protocollo descrive come indurre la differenziazione delle cellule M nei monostrati e metodi ileali derivati dalle cellule staminali umane per valutarne lo sviluppo.
Abstract
M (microfold) cellule della funzione intestinale per trasportare l'antigene dal lume apicale alle patch del Peyer sottostante e lamina propria dove le cellule immunitarie risiedono e quindi contribuiscono all'immunità mucosale nell'intestino. Manca una comprensione completa di come le cellule M si differenziano nell'intestino così come i meccanismi molecolari dell'assorbimento dell'antigene da parte delle cellule M è carente. Questo perché le cellule M sono una rara popolazione di cellule nell'intestino e perché i modelli in vitro per le cellule M non sono robusti. La scoperta di un sistema di coltura delle cellule staminali auto-rinnovante dell'intestino, chiamato enteroidi, ha fornito nuove possibilità per coltivare le cellule M. Gli enteroidi sono vantaggiosi rispetto alle linee cellulari coltivate standard perché possono essere differenziati in diversi tipi di cellule principali presenti nell'intestino, tra cui cellule di calice, cellule di Paneth, cellule enteroendocrine e enterociti. La citochina RANKL è essenziale nello sviluppo delle cellule M, e l'aggiunta di RANKL e TNF-z ai media di coltura promuove un sottoinsieme di cellule da enteroidi ileali per differenziarsi in cellule M. Il seguente protocollo descrive un metodo per la differenziazione delle cellule M in un sistema di mominipolare polarizzato epiteliale transwell dell'intestino utilizzando enteroidi ileali umani. Questo metodo può essere applicato allo studio dello sviluppo e della funzione delle cellule M.
Introduzione
Le cellule M (microfold) sono cellule epiteliali intestinali specializzate che si trovano principalmente nell'epitelio associato al follicolo (FAE) dell'intestino sovrastante piccole regioni linfoidi definite macchie di Peyer1. Le cellule M hanno microvilli apicali irregolari corti e sono profondamente invaginate sul loro lato basolaterale, il che consente alle cellule immunitarie di risiedere strettamente al loro corpo cellulare2. Questa morfologia unica consente alle cellule M di campionare l'antigene dal lume apicale dell'intestino e consegnarlo direttamente alle cellule immunitarie sottostanti2. In questo modo, le cellule M sono importanti per la sorveglianza immunitaria nell'intestino, ma possono anche essere sfruttate dagli agenti patogeni per l'ingresso nella propriamina1,2,3,4,5, 6,7.
Lo studio delle cellule M è stato ostacolato da diversi fattori. In primo luogo, le cellule M si trovano a bassa frequenza nel topo e nell'intestino umano8. Nei sistemi di cellule coltivate, le cellule simili a cellule M sono state indotte a differenziarsi co-culminando una linea cellulare polarizzata di adenocarcinoma, Caco-2, con linfociti B dai cerchi di Peyer del topo o dalla linea cellulare del linfoma delle cellule B, Raji B9,10 . Questo si traduce in un sottoinsieme di cellule Caco-2 che esprimono i marcatori di cellule M Sialyl Lewis Un antigene e UEA-1 nell'epitelio polarizzato9,10. (Questi marcatori sono espressi anche su cellule di calice nei tessuti intestinali, quindi al giorno d'oggi sono meno frequentemente utilizzati come marcatori cellulari M definitivi11,12.) Questo sistema cellulare Caco-2-M è stato utilizzato per studiare l'assorbimento di particelle e la traslocazione batterica13,14. Tuttavia, le cellule Caco-2 sono una linea cellulare stabilita da un grande adenocarcinoma intestinale con il fattore di confusione che diverse fonti di cellule Caco-2 mostrano diversi fenotipi tra i laboratori15. Inoltre, essi non possono ricapitolare completamente i livelli di trascrizione di cellule M reali, in quanto mancano di espressione dei marcatori di cella M attualmente noti GP2 e SpiB16. Pertanto, sono necessari modelli di coltura aggiuntivi e più rilevanti dal livello fisiologico per essere in grado di studiare lo sviluppo e le funzioni delle cellule M.
Negli ultimi dieci anni, il campo dei sistemi modello dell'intestino derivati da enteroidi è progredito rapidamente dalla scoperta iniziale che le cellule staminali intestinali derivate dalla biopsia intestinale umana potrebbero auto-propagarsi e auto-rinnovarsi in coltura 17 mi lato , 18. Importante, la rimozione dei fattori di promozione delle cellule staminali dai mezzi di crescita consente a queste colture di cellule staminali di differenziarsi nei molti tipi di cellule presenti nell'intestino18. Inoltre, recenti lavori suggeriscono l'importanza della segnalazione DI RANKL-RANK nello sviluppo delle cellule M nell'intestino19,20. Il recettore RANK è un membro della famiglia tNF di recettori che si esprime sulle cellule precursori epiteliali nell'intestino19 mentre RANKL (il ligando recettore RANK) viene rilasciato dalle cellule stromali delle patch del Peyer20. Poiché i tipi di cellule epiteliali presenti negli enteroidi ileali non producono RANKL, la differenziazione cellulare M nelle colture enteroidi ileali può essere indotta dall'aggiunta di RANKL ai mezzi di coltura21,22. L'inclusione del TNF nei mezzi di coltura aiuta a sostenere lo sviluppo di cellule M negli enteroidi ileali23. Qui, descriviamo i metodi per indurre la differenziazione delle cellule M nei monostrati intestinali derivati dagli enteroidi ileali umani. I nostri metodi si basano in parte sulle modifiche dai seguenti protocolli21,22,23.
Protocollo
Tutti i metodi qui descritti sono stati approvati dalla Tufts University IBC e IRB.
1. Indurre la differenziazione delle cellule M nei Monostrati derivati dall'enteroide Umano Ileal
NOT: Questo protocollo utilizza enteroidi ileali derivati dalla biopsia del tessuto umano. Si prega di fare riferimento ai protocolli pubblicati per i metodi su come crescere e passare queste cellule18,24. I seguenti metodi per lo sviluppo di monostratisono stati adattati da . I metodi per indurre cellule M in colture derivate da enteroidi ileali sono stati adattati dai rapporti precedenti21,22,23. Tutto il lavoro viene svolto in una cappa di coltura tissutale sterile e le incubazioni sono in incubatore di cappa o di coltura tissutale come indicato. Vedere Tabella dei Materiali necessari per preparare monostrati enteroidi ileali e vari supporti.
- Coltivare enteroidi ileali per 4-10 giorni in matrice extracellulare (ECM) (vedi Tabella dei materiali) (Figura 1), a seconda deiloro tassi di crescita intrinseci, prima di eseguire il seeding sui transwell.
- Membrane trasversali di rivestimento
- Posizionare il numero desiderato di traswell in una piastra di 24 pozze creando un sistema a due camere.
- Diluire l'ECM 25 volte nella salina raffreddore sterile con buffer da fosfato (PBS) e aggiungere 100 L di soluzione diluita a freddo in ogni camera superiore sulla membrana.
NOT: ECM e la soluzione ECM diluita devono essere tenuti sul ghiaccio fino a poco prima dell'aggiunta. - Coprire la piastra di 24 pozze con coperchio e collocare la piastra in un'incubatrice a coltura tissutale a 37 gradi centigradi per 2 h per consentire la solidificazione ECM sulla membrana.
- Dopo 2 h, rimuovere la piastra dall'incubatrice e metterla in una cappa di coltura tissutale. Utilizzando pinzette sterili, invertire ogni transwell per rimuovere delicatamente la soluzione rimanente. Lasciare asciugare le membrane in cappuccio con il coperchio aperto mentre le cellule vengono raccolte (passaggi 1.3.1- 1.3.11).
- Dissociare gli enteroidi ileali in singole cellule
- Rimuovere la piastra degli enteroidi ileali dall'incubatrice e rimuovere delicatamente i supporti di coltura da ogni pozzo per aspirazione sottovuoto o con una pipetta.
NOT: Un pozzo di enteroidi ileali contenente circa 100 cisti sane è sufficiente per semire1.5-2 pozzi. - Aggiungere 500 l di ghiaccio freddo 0,5 mm di acido etilenediaminetracetraacetica (EDTA) a ogni pozzo contenente enteroidi ileali sospesi in ECM per rompere l'ECM. Pipetta su e giù vigorosamente con un P1000 pipettor impostato a 500 .L per rompere ECM rilasciando in tal modo enteroidi ileali nella soluzione. Per migliorare la dissoluzione dell'ECM, dopo la pipa, agitare vigorosamente la piastra a 4 gradi centigradi per 30 min.
- Raccogliere la soluzione da ogni pozzo in tubi conici da 15 mL.
NOT: Raccogliere fino a 10 pozzi per 15 mL tubo conico per la raccolta ottimale di una singola cella. - Pellet le cellule in una centrifuga a 140 x g e 4 gradi centigradi per 5 min. Pellet dovrebbe essere visibile, ma può essere facilmente sloggiato, in modo da rimuovere lentamente il supernatante con aspirazione a vuoto o con una pipetta.
NOT: Se si è preoccupati per la perdita di pellet e cellule, utilizzare una pipetta e salvare il supernatante in un tubo separato. - Per digerire stretti collegamenti di giunzione e suddividere gli enteroidi ileali in singole celle, risospendere il pellet in 500 , l'ora di temperatura ambiente trypsin ogni 5 pozzi raccolti al punto 1.3.3. Utilizzando un P1000, pipetta su e giù per disaggregare i grumi e incubare i tubi in un bagno d'acqua 37 C per 5 minuti o meno.
NOT: L'ottimizzazione è necessaria per determinare la quantità appropriata di tempo necessaria per incubare i tubi in modo che le cellule siano rotte, ma non eccessivamente-tripsinizzate al punto che muoiono. Utilizzare Trypan blu nel passaggio 1.3.9 per garantire che le cellule siano vitali dopo il trattamento della trypsin. - Aggiungere 1 mL di Advanced DMEM/F12 con 10% Siero Bovino Fetale (FBS) per 500 - L di trypsin per inattivare la trypsin.
- Pipetta su e giù con un P1000 impostato a 500 L almeno 50 volte contro il lato del tubo conico per disaggregare ulteriormente i grumi rimanenti in singole celle.
- Posizionare un colino a celle da 40 m su un conico da 50 mL e aggiungere 1 mL di Advanced DMEM/F12 con il 10% di FBS per umidare il colino cellulare. Pipette la sospensione a cella singola dal connico 15 mL sul colino. Lavare il colino con 1 mL di Advanced DMEM/F12 con 10% FBS.
- Trasferire le cellule che hanno attraversato il colino cellulare dal conico 50 mL in un nuovo tubo conico da 15 mL. Durante la fase di centrifugazione 1.3.10, il pellet cellulare sarà più facilmente visibile in un tubo conico da 15 mL. Contare le cellule usando un emocitometro. Usa Trypan blu per verificare che le cellule siano ancora vive. In genere, si osserva una fattibilità >95%.
- Durante il conteggio delle cellule, centrifugare le cellule nel nuovo tubo da 15 mL a 400 x g e la temperatura ambiente per 5 min. Cell pellet dovrebbe essere visibile. Rimuovere con cura il supernatante con una pipetta, salvando nuovamente il supernatante nel caso in cui il pellet si sloga.
- Preparare i supporti di crescita completi modificati25 (supporti MCMGF) integrati con 10 -M Y-27632. Risospendere le celle pellettate a 2,5 x 105 celle/200 -L in MCMGF. Vedere le osservazioni in discussione sull'ottimizzazione del numero di seeding delle celle.
NOT: Il supporto MCMGF è Advanced DMEM/F12 con 75% di supporti condizionati L-Wnt3a, 10% R-spondin con condizioni media, 5% Noggin con condizionato media, 1x B27 Supplemento, 1x N2 Supplemento, 1 mM N-acetylcysteine, 50 ng/mL mouse ricombinante EGF, 500 nM A-8301, 10 nM [Leu15]-Gastrin I, 10 mHe HEPES, 2 mM GlutaMAX e 1x Penicillin/Streptomycin (opzionale). - Assicurarsi che le membrane rivestite e Cm preparate nel passaggio 1.2 siano completamente essiccate, come valutato a occhio. Lavare la camera superiore con 200 luna di MCMGF. Aggiungere 200 l di soluzione cellulare in ogni camera superiore.
- Aggiungete 700 l di MCMGF con 10 M Y-27632 ad ogni camera inferiore. Collocare la piastra in un'incubatrice a coltura di tessuto a 37 gradi centigradi con il 5% di CO2.
- Dopo 1 giorno di crescita, rimuovere il supporto dalla camera superiore e sostituirlo con 200 -L di MCMGF fresco, per evitare la crescita di più strati cellulari.
- Rimuovere la piastra degli enteroidi ileali dall'incubatrice e rimuovere delicatamente i supporti di coltura da ogni pozzo per aspirazione sottovuoto o con una pipetta.
- Sostituzione di medie
- Una volta che i monostrati sono confluenti dell'80%, di solito tra i giorni 1-3 post-seeding, sostituire i supporti basolaterali con i supporti di differenziazione (DM) per i pozzi di controllo (vedere il passaggio 1.4.2 per maggiori dettagli) o con i supporti cella M per i pozzi di induzione delle cellule M (vedere il passaggio 1.4.3 per maggiori dettagli). Sostituire il supporto nella camera superiore con DM per entrambe le condizioni.
NOT: DM è Advanced DMEM/F12 con 5% Noggin con condizioni, 1x B27 Supplemento, 1x Supplemento N2, 1 mM N-acetylcysteine, 50 ng/mL mouse ricombinante EGF, 500 nM A-8301, 10 nM [Leu15]-Gastrin I, 10 mM HEPES Buffer, 2 mM GlutaMAX e 1x Penicillina/Sptomycin opzionale (facoltativo 10 mM HEPES ). Il supporto delle celle M è DM integrato con 200 ng/mL RANKL e 50 ng/mL TNF. - Per i pozze di controllo che non devono contenere celle M, aggiungere 200 L di DM nella camera superiore e 700 DM nella camera inferiore.
- Per indurre le cellule M, aggiungere 200 l of DM alla camera superiore e 700 -L di supporto cellulare M alla camera inferiore.
- Sostituire il supporto ogni 2 giorni. Per i pozzi di controllo, sostituire DM nelle camere superiore e inferiore. Per i pozze di cella M, sostituire DM nella camera superiore e nel supporto delle celle M nella camera inferiore.
NOT: Di giorno 7 semi cellule post, le cellule M sono completamente indotte nei monostrati.
- Una volta che i monostrati sono confluenti dell'80%, di solito tra i giorni 1-3 post-seeding, sostituire i supporti basolaterali con i supporti di differenziazione (DM) per i pozzi di controllo (vedere il passaggio 1.4.2 per maggiori dettagli) o con i supporti cella M per i pozzi di induzione delle cellule M (vedere il passaggio 1.4.3 per maggiori dettagli). Sostituire il supporto nella camera superiore con DM per entrambe le condizioni.
2. Verifica della differenziazione delle celle M da qRT-PCR
NOT: Eseguire le seguenti operazioni in uno spazio sterile senza RNA. Vedere Tabella dei materiali per un elenco dei materiali preferiti per qRT-PCR.
- Rimuovere il supporto dalle camere superiore e inferiore e lavare la camera superiore 2x delicatamente con 300 -L di temperatura ambiente PBS.
- Aggiungere 300 l di Trizol ad ogni camera superiore. Incubare a temperatura ambiente per 5 min.
MASSIMA VIA: Indossare guanti e protezione degli occhi quando si utilizza Trizol per evitare il contatto con la pelle come indicato nelle istruzioni del produttore. - Nel frattempo, etichettare i tubi di microcentrifuga per ogni pozzo e aggiungere 700 lofl di Trizol ad ogni tubo.
- Raccogliere l'omologazione cellulare pipetting su e giù 3x delicatamente con un P1000 e trasferire il contenuto nel tubo di microcentrifuga corrispondente. Vortice per 5 s per mescolare.
- Conservare i campioni a temperatura ambiente per altri 3 min. Conservare quindi a -80 gradi centigradi per un massimo di un mese.
- Seguire la metodologia qRT-PCR standard per l'isolamento dell'RNA, il trattamento DNase, la trascrizione inversa e le reazioni qRT-PCR. Fare riferimento all'elenco dei numeri di riferimento nella tabella dei materiali.
3. Verifica della differenziazione delle cellule M mediante immunofluorescenza
NOT: Mantenere sempre la camera inferiore della piastra riempita con PBS in modo che le membrane rimangano bagnate. Questa procedura viene eseguita in panchina. Vedere La Tabella dei Materiali per un elenco dei materiali preferiti per l'immunofluorescenza.
- Rimuovere il supporto dalla camera superiore e lavare 2x delicatamente con 300 . Aggiungere alla camera superiore 100 l di temperatura ambiente 4% PFA in PBS. Coprire la piastra con un foglio e lasciare riposare per 25 min a temperatura ambiente. Rimuovere 4% PFA.
AVVISO: il 4% di PFA deve essere smaltito correttamente come rifiuti chimici pericolosi. - Lavare la camera superiore 3x con 300 gradi l di PBS a temperatura ambiente. A questo punto, i campioni possono rimanere a 4 gradi centigradi per un massimo di un mese prima della colorazione. Una volta macchiati, i campioni devono essere visualizzati entro una settimana per le immagini di migliore qualità.
- Incubare i monostrati con 100 gradi l del 5% di Bovine Serum Albumin (BSA) sciolti nella PBS per 30 min al buio a temperatura ambiente per bloccare i monostrati.
- Preparare la soluzione anticorpale primaria GP2 nell'1% di BSA in PBS con una diluizione di 1:100. Aggiungere 100 l per pozzo. Macchie per 1 h a temperatura ambiente al buio. Rimuovere la soluzione.
NOT: Non permeabilizzare i monostrati prima che si verifichi la colorazione primaria per GP2 perché la colorazione della superficie primaria GP2 delle cellule M viene ottenuta senza permeabilizzazione. - Lavare la camera superiore 3 volte con 300 gradi l di PBS a temperatura ambiente.
- Preparare la soluzione di macchia secondaria di IgG di capra fluorescente con tag anti-tono a 1:200, phalloidin a 1:100 e DAPI in 1% BSA 0,1% tritoon in PBS. Aggiungere 100 l per pozzo. Macchie per 30 min a temperatura ambiente al buio.
NOT: Triton viene aggiunto alla soluzione di macchia secondaria per permeabilizzare le cellule durante questo passaggio per una corretta macchia di fallidina. - Lavare 3x con 300 l PBS.
- Posizionare una goccia di 5 -l di soluzione di montaggio (Tavolo dei materiali) su uno scivolo di vetro. Rimuovere il pozzo dalla piastra 24 pozzo e invertire. Tagliare con cura la membrana dal pozzo utilizzando un bisturi. Posizionare la membrana con le celle rivolte verso l'alto sulla goccia di soluzione di montaggio sullo scivolo di vetro. Aggiungere 10 l di soluzione di montaggio sulla parte superiore e centrale della membrana e posizionare un coperchio sulla parte superiore per sigillare la membrana tra lo scivolo di vetro e coverslip.
- Asciugare i vetrini a temperatura ambiente al buio per 24 h. I vetrini macchiati devono essere visualizzati al microscopio confocale entro 1 settimana dopo la colorazione.
Risultati
Gli enteroidi Ileal coltivati in ECM vengono analizzati visivamente e da qRT-PCR per il loro stato di salute relativa e gli stati di differenziazione come mezzo di controllo di qualità per le colture enteroidi ileali e per l'uso nei monostrati. Gli enteroidi ileali indifferenziati coltivati in ECM appaiono chiari e cistici nella morfologia, indicando la presenza di molte cellule staminali (Figura 1A). Nel corso del tempo, gli enteroidi ileali indifferenziati coltivati nei media di crescita possono assumere un fenotipo intermedio in cui alcuni appariranno cistici e alcuni appariranno opachi (Figura 1B). Spesso, i nostri campioni indifferenziati assomigliano a quelli illustrati nella Figura 1B anziché nella Figura 1A. Queste colture intermedie contengono enterociti più differenziati terminalmente, misurati dall'espressione del marcatore enterocito, dell'isovista di sucrasite (SI) e presumibilmente estrusi enterociti morti nel lume contribuiscono al loro aspetto denso. Gli enteroidi ileali possono essere utilizzati in questo stato intermedio per lo sviluppo di monostrato, ma va tenuto presente che la quantità di cellule staminali intestinali presenti nelle colture può essere bassa e alcuni tipi di cellule differenziate possono essere presenti (ad esempio, vedi qRT-PCR livelli in campioni indifferenziati coltivati in ECM simile Figura 1B figura 2). Per fare un confronto, gli enteroidi ileali coltivati con supporti di differenziazione in ECM per 5 giorni appariranno uniformemente scuriti e lobulari e le culture con questa morfologia non sono buoni candidati per la semina di monostrati (Figura 1C).
L'espressione dei geni delle cellule staminali e dei geni della differenziazione delle cellule intestinali può essere analizzata da qRT-PCR come un altro mezzo per valutare lo stato di salute degli enteroidi ileali coltivati nell'ECM e le loro capacità di differenziazione una volta seminato come monostrati sui transwell. L'espressione di un gene di cellule staminali, LGR5, un gene enterocito, SI, un gene cellulare del calice, MUC2, e un gene cellulare panettico, LY ,viene confrontato tra colture indifferenziate di enteroidi ileali coltivati in ECM e ileali differenziati monostrati enteroidi in presenza o assenza di RANKL/TNF (Figura 2). Mentre i valori possono differire tra gli esperimenti, l'espressione di LGR5 dovrebbe diminuire dopo la differenziazione dei monostrati18,26. L'espressione LGR5 di solito non viene rilevata nei monostrati ileali differenziati senza RANKL e TNF al giorno 7. Al contrario, l'espressione di marcatori di differenziazione di tipi di cellule specifiche, come SI e MUC2, aumentano dopo la differenziazione18. L'espressione di LY diminuisce generalmente dopo la differenziazione nelle nostre culture. Se le colture enteroidi ileali utilizzate per rendere i monostrati assomigliano più alla figura 1B che alla figura 1A, gli aumenti dei marcatori di differenziazione intestinale possono essere modesti dopo la differenziazione, poiché queste colture iniziali sono eterogenee in tipi di cellule intestinali e hanno un più alto livello basale di SI e MUC2. Tuttavia, la differenziazione nei monostrati si verifica ancora come valutata dalla perdita di espressione LGR5 e microscopia (vedi sotto). Inoltre, l'aggiunta di RANKL e TNF al supporto di differenziazione riduce la perdita di espressione LGR5 (Figura 2). Parallelamente, l'espressione di SI e MUC2 è leggermente inferiore rispetto alla condizione differenziata che manca di RANKL e TNF, anche se i loro livelli aumentano al di sopra della condizione indifferenziata.
La differenziazione delle cellule M nei monostrati è determinata sia dalla qRT-PCR che dall'immunofluorescenza utilizzando due marcatori specifici delle cellule M, tra cui la glicoproteina 2 (GP2) e il fattore di trascrizione SpiB21. L'espressione di GP2 e SPIB è regolata nei monolayer derivati dagli enteroidi ileali in presenza di RANGOL eTNF, e non viene rilevata nei campioni trattati in tag RANKL e TNF . L'espressione di questi marcatori può anche essere normalizzata in un pezzo di piccolo tessuto intestinale22, se disponibile. Questo permette di confrontare la modifica di questi marcatori di cellule M con il tessuto che ha cellule M piuttosto che controllare i monostrati che non hanno alcuna espressione di questi marcatori e consente la standardizzazione tra gli esperimenti in un laboratorio. Le cellule M sono rilevate anche dall'espressione superficiale di GP2 dall'immunofluorescenza (Figura 4). Tipicamente, in un mostrato confluente, le cellule da 1 a 5 M sono osservate in un dato campo del microscopio all'ingrandimento 40X entro i giorni da 6 a 8 post-seeding in campioni trattati con RANKL e TNF (Figura4A-D). Nei campioni non trattati ( Figura4E) non viene visualizzata alcuna espressione GP2 . La vista ortogonale del piano X, sovrapposto con una sonda di phalloidin, mostra le strutture di actina che circondano ogni cella e l'espressione GP2 sulla superficie apicale delle cellule M (Figura 4F-G). Questo modello ricapitola la bassa frequenza delle cellule M trovate nell'intestino umano1,2,8. Per purificare e isolare le cellule M per ulteriori studi, le cellule M possono essere macchiate utilizzando l'espressione di superficie GP2 e ordinate utilizzando FACS per le cellule GP2.
Le cellule M si legano e trasportano l'antigene dal lume intestinale alle cellule immunitarie che risiedono sotto l'epitelio2. Secretory IgA prodotto nell'intestino si lega ai batteri e può legarsi alla superficie apicale delle cellule M per facilitare il trasporto dei microbi27,28. Per determinare se le cellule M sviluppate in questo modello sono in grado di legarsi all'IgA, il siero umano IgA viene aggiunto alla camera superiore, lasciato legare per 1 h, e quindi i monostrati sono preparati per l'analisi dell'immunofluorescenza. La presenza di IgA sulle cellule M viene visualizzata utilizzando un anticorpo secondario coniugato a fluor che riconosce la catena pesante del siero umano IgA. Le cellule M trattate con IgA per 1 h non hanno IgA legate alla superficie apicale (Figura 5A), mentre le cellule M nei pozzetti di controllo che sono state trattate solo con l'anticorpo secondario a IgA non hanno alcun segnale rilevabile (Figura 5B). Inoltre, IgA si lega specificamente alla superficie apicale delle cellule M e non si trova legato ad alcuna cella priva di macchia superficiale GP2. Inoltre, le cellule M hanno un actina densa caratteristicamente più corta sulla loro superficie apicale2. Per analizzare la morfologia delle cellule M in questo modello, i monostrati derivati da enteroidi sono coltivati per 7 giorni e raccolti per l'analisi dell'immunofluorescenza della F-actin usando la phalloidina. Le misurazioni dell'intensità dei pixel actin sono calcolate per le celle M e per le celle non M che sono direttamente adiacenti a ciascuna cella M utilizzando il software ImageJ (Figura 6A). L'intensità actin è ridotta sulle celle GP2 e M in questo modello e un'immagine rappresentativa è mostrata nella Figura 6B. Nel complesso, le cellule M sviluppate in questo modello di momolo derivato da enteroidi ileali hanno un'espressione genica caratteristica, una morfologia e alcune funzioni cellulari M delle cellule M umane, come il legame con IgA.
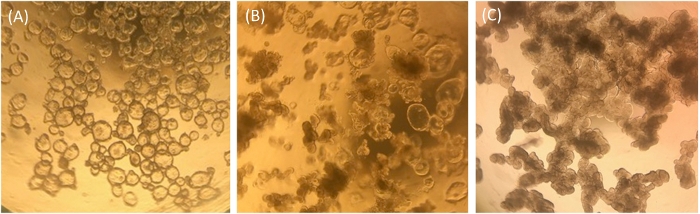
Figura 1: morfologia rappresentativa degli enteroidi ileali umani nell'ECM dopo la divisione. (A) Enteroidi ileali chiari e cistici indifferenziati. (B) Fenotipo intermedio con alcuni enteroidi ileali cistici e alcuni enteroidi ileali loblare opachi. (C) Inenteroi di enteroidi ileali differenziati scuri e lobulare. Immagini scattate attraverso l'obiettivo di un microscopio a luce ottica con ingrandimento 4x utilizzando una fotocamera iPhone7. Fare clic qui per visualizzare una versione più grande di questa figura.
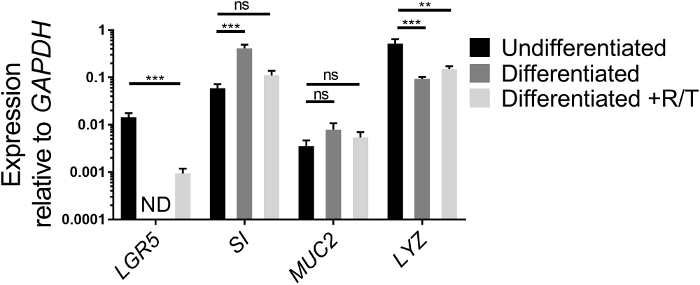
Figura 2: Espressione relativa delle cellule staminali e dei marcatori di differenziazione degli enteroidi ileali umani coltivati in ECM o differenziati come monostrati. Gli enteroidi ileali sono stati coltivati per 7 giorni in ECM (Undifferentiated) o coltivati e differenziati come monostrati senza (differenziati) o con RANKL e TNF . Le colture enteroidi ileali o monostrati sono state raccolte a Trizol per l'estrazione dell'RNA. L'espressione genica è stata determinata da qRT-PCR ed è espressa in relazione a GAPDH. I dati sono in media di 3 pozzi indipendenti di enteroidi ileali o monostrati per condizione. Le barre di errore indicano che SEM. ND non è stato rilevato. La significatività statistica è stata determinata su valori di trasformazione log utilizzando ANOVA unidirezionale con il test di confronto multiplo di Dunnett rispetto all'Indifferenziato. p < 0,01, p < 0.001 Fare clic qui per visualizzare una versione più grande di questa figura.
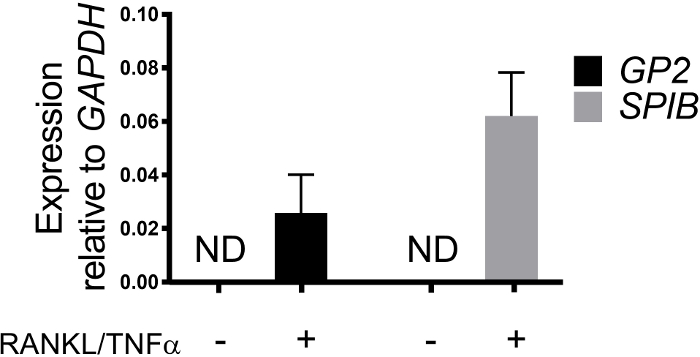
Figura 3: Espressione relativa dei marcatori specifici della cellula M GP2 e SPIB da monostrati derivati da enteroidi umani. A Trizol sono stati raccolti monostrati derivati da enteroidi umani trattati e non trattati e non trattati per l'estrazione dell'RNA dopo 7 giorni dopo la semina. L'espressione genica è stata determinata da qRT-PCR ed è espressa in relazione a GAPDH. I dati sono in media di 6 monostrati indipendenti per condizione. Le barre di errore indicano che SEM. ND non è stato rilevato. Fare clic qui per visualizzare una versione più grande di questa figura.
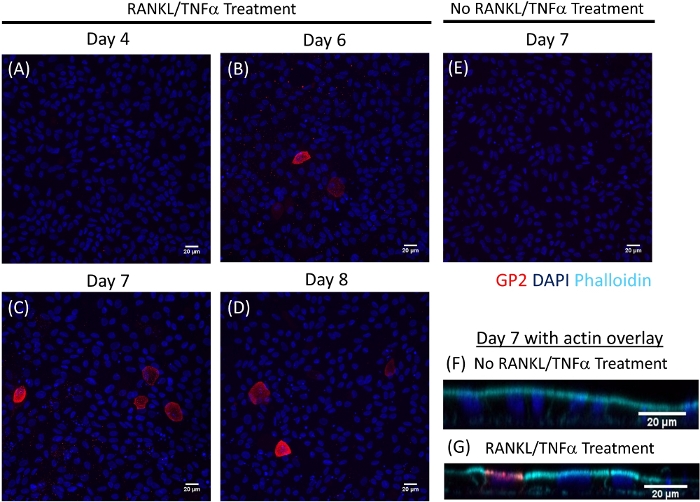
Figura 4: Immunofluorescenza dell'espressione di GP2 di superficie sulle cellule M nei monostrati derivati da enteroidi umani nel tempo. I monostrati ipotetici trattati e non trattati sono stati fissati nel 4% di PFA e macchiati per l'immunofluorescenza in vari giorni indicati dopo la semina. Le immagini sono state analizzate utilizzando il software ImageJ. DAPI - Blu; Glicoproteina 2 (GP2) - Rosso. (A-D) RANKL/TNF, ha trattato i monostrati in vari giorni dopo la seeding. (E) Mostrato non trattato raccolto al giorno 7 post-seeding. (F-G) Piano ortogonale di monostrati all'ora 7 post-seeding sovrapposto con sonda di fallidina per F-actin. Phalloidin - Ciano. Fare clic qui per visualizzare una versione più grande di questa figura.
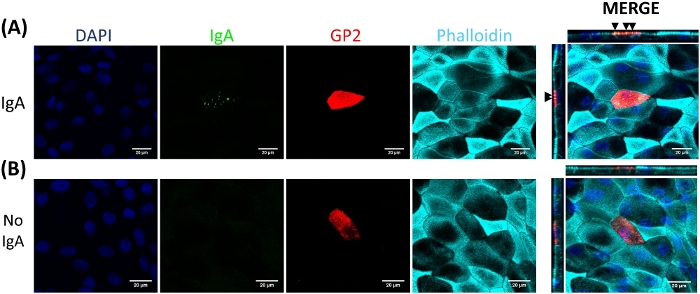
Figura 5: IgA si lega in modo specifico alla superficie apicale delle cellule M. I monostrati derivati da enteroidi umani trattati con RANGOL/TNF sono stati coltivati per 7 giorni e poi (A) sono stati trattati con 10 g di siero umano IgA per 1 h o (B) trattati mock con PBS solo (controllo No IgA). Dopo 1 h, i monostrato sono stati lavati 2x in PBS, sono stati fissati nel 4% di PFA, permeabilizzati con 0,1% TritonX-100, e macchiati per immunofluorescenza. Le immagini sono state analizzate utilizzando il software ImageJ e sono rappresentative di 3 esperimenti indipendenti. DAPI - Blu; Glicoproteina 2 (GP2) - Rosso; Anticorpo al siero umano IgA - Verde; Phalloidin - Ciano. Le frecce nere indicano IgA legato alla superficie apicale della cella M. Fare clic qui per visualizzare una versione più grande di questa figura.
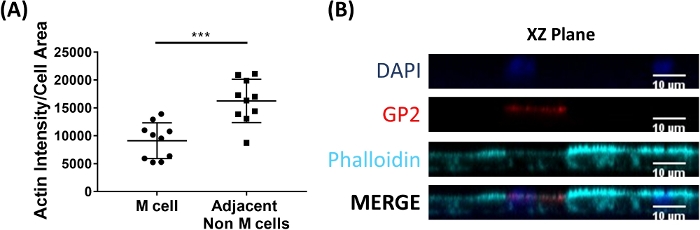
Figura 6: Le cellule M hanno ridotto l'intensità dell'atto rispetto alle cellule non M adiacenti. I monostrati derivati da enteroidi umani trattati da RANGOL/TNF sono stati coltivati per 7 giorni e poi fissati nel 4% di PFA e sono stati macchiati per l'immunofluorescenza. (A) Utilizzando ImageJ, le celle GP2 sono state delineate utilizzando lo strumento di selezione a mano libera e le misurazioni di Area e Densità integrata sono state prese nel canale Phalloidin. La stessa analisi è stata quindi completata per ogni cella non-M adiacente che scontra la cella M. La Densità Integrata Raw è stata divisa per l'Area di ogni singola cella per la normalizzazione. La media Integrated Density/Area è stata calcolata per ogni cella non M adiacente per ogni cella M. Le immagini sono state analizzate da 3 esperimenti indipendenti; ogni punto è una cellula M o la media delle cellule vicine. Le barre di errore indicano che la significatività statistica è stata determinata sui valori trasformati nel log utilizzando un test Paired t. p - 0.0001 (B) Immagine rappresentativa del piano X s'in-plot in A. Le immagini sono state analizzate utilizzando il software ImageJ. DAPI - Blu; Glicoproteina 2 (GP2) - Rosso; Phalloidin - Ciano. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Per sviluppare monostrati che si differenziano correttamente nei principali tipi di cellule intestinali e cellule M, è fondamentale essere consapevoli di diversi fattori. Gli enteroidi ileali devono essere raccolti da colture ECM che sono indifferenziate e hanno un'alta percentuale di cellule staminali Lgr5. Visivamente, la maggior parte degli enteroidi ileali nelle impostazioni ECM non deve essere oscurata e multilobulare, e l'espressione LGR5 deve essere rilevata in queste colture mediante l'analisi qRT-PCR. Il controllo della qualità dei supporti condizionati è essenziale per la propagazione di culture indifferenziate nel tempo e deve essere completato per ogni lotto di supporti condizionati che viene prodotto. Il controllo qualità può essere completato testando un nuovo lotto di supporti su alcune colture ECM e confrontando la morfologia degli enteroidi ileali con un precedente lotto di supporti nel corso di una settimana. L'espressione LGR5 dovrebbe rimanere relativamente simile nelle impostazioni cultura degli enteroidi ileali coltivate nel nuovo batch di supporti rispetto al lotto precedente.
Durante la preparazione degli enteroidi ileali per la semina come monostrati, è importante pipettare vigorosamente la soluzione cellulare dopo l'incubazione con la trypsin per rompere gli enteroidi ileali in singole cellule. I grumi cellulari possono portare alla formazione multistrato quando si esegue il seme per i monostrati. Inoltre, è essenziale determinare empiricamente il numero di cellule necessarie per formare un monostrato per ogni singola linea di enteroidi ileali che si ottiene. In genere, questo valore può variare da 2,5 x 105 – 5,0 x 105 celle/bene, ma dipende dal grado di cistico agli enteroidi ileali non cistici nelle colture e varia per ogni singola linea di enteroidi ileali. Per esperienza, gli enteroidi ileali coltivati in ECM che appaiono meno cistici richiedono una maggiore densità di semina delle cellule per ottenere monostrati. Si consiglia di lavare la camera superiore dopo 1 giorno di crescita pipetting il supporto su e giù 2-3 volte e sostituendo con supporti di crescita fresco. Questo processo sposta le cellule che sono atterrate sopra altre cellule riducendo la probabilità di formazione multistrato. Il passaggio dei supporti nella camera superiore dai supporti di crescita ai media delle cellule M quando i monostrati sono confluenti dell'80%, che di solito si verifica al secondo giorno, aiuta a raggiungere una buona differenziazione delle cellule M. L'aggiunta di RANKL/TNF alla camera superiore durante l'induzione delle cellule M non porta allo sviluppo di un maggior numero di cellule M per monome e quindi può essere lasciata fuori dai supporti della camera superiore. I traspozzi di varie dimensioni dei pori possono essere utilizzati in questo protocollo senza influenzare lo sviluppo delle cellule M; tuttavia, la densità di semina delle cellule deve essere ottimizzata per coloro che hanno dimensioni dei pori più grandi. Il collagene IV può essere sostituito da ECM come rivestimento proteico della membrana seminterrato per transwell o placche di pozzo che possono essere più adatte per determinate applicazioni.
I monostrati derivati da enteroidi ileali sui transwell forniscono un sistema a due camere che consente la creazione di superfici apicali e basolaterali definite in modo tale che i 4-5 diversi tipi di cellule intestinali epiteliali possano polarizzare per esprimere marcatori di superficie su ciascuna lato rispetto a quello trovato nell'intestino. Ulteriori fattori possono essere aggiunti a entrambi i lati come particelle, agenti infettivi o altri tipi di cellule. Tuttavia, ad oggi rimangono alcune limitazioni. Come descritto, questo sistema è un sistema statico che manca di flusso fisiologico, contrazioni intestinali, e contenuti intestinali. Inoltre, l'architettura villus-cripta è persa dalla formazione di un monostrato piatto. Questi sistemi mancano delle regioni di patch di Peyer, delle cellule immunitarie e delle cellule stromali. Se la mancanza di cellule immunitarie e stromali che risiedono vicino sotto le cellule M influisce sulle invaginazioni che non sono osservate in questo sistema e altri funzionamenti fisiologici è un'importante area futura di indagine. Questo protocollo può essere adattato a una piastra da 96 pozzetto o un formato multi-bene piastra. La procedura per il rivestimento della piastra da 96 pozze con ECM e la semina con singole cellule da enteroidi ileali rimane la stessa di quella per i transwell. La titolazione della densità di semina cellulare necessaria per ottenere i monostrati deve essere fatta, ma in genere varia da 1,0 x 105 – 3,0 x 105 celle / bene in un formato di piastra 96-well. Le cellule M vengono indotte sostituendo il supporto di crescita con i supporti cellulari M quando i monostrati sono confluenti dell'80% in genere entro i giorni 1-3 a seconda della densità iniziale di semina delle cellule.
Questo metodo di differenziare le cellule M dagli enteroidi ileali in vitro fornisce miglioramenti significativi rispetto al metodo Caco-2. Gli enteroidi ileali sono cellule primarie e almeno 4-5 tipi di cellule epiteliali sono presenti nel sistema. Inoltre, le linee enteroidi ileali derivate da persone diverse possono essere studiate per studiare come la genetica o lo stato della malattia influenzano lo sviluppo e il comportamento delle cellule M. Un'ulteriore manipolazione degli enteroidi ileali durante la differenziazione delle cellule M consentirà una migliore comprensione dello sviluppo delle cellule M, tra cui la caratterizzazione delle cellule precursori delle cellule M. Infine, poiché i meccanismi molecolari della fagocitosi cellulare M e della transcitosi non sono ancora completamente compresi3,29, questo modello offre l'opportunità di studiare e visualizzare l'assorbimento di antigeni e particelle da parte delle cellule M.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato supportato da NIAID U19AI131126 al Dr. Isberg (Tufts University School of Medicine) e Dr. Kaplan (Tufts University); (JM è leader nel Progetto 2) e NIAID R21AI128093 a JM. ACF è stata sostenuta in parte da NIAID T32AI0070777. SEB e MKE sono stati supportati da NIAID U19AI116497-05. Ringraziamo i membri del laboratorio Mecsas, del laboratorio Ng e del dottor Isberg della Tufts University School of Medicine per le discussioni utili. L'imaging confocale è stato eseguito presso il Tufts Center for Neuroscience Research, P30 NS047243.
Materiali
| Name | Company | Catalog Number | Comments |
| [Leu15]-Gastrin I | Sigma-Aldrich | G9145 | MCMGF+ and DM ingredient Solvent: PBS Stock Concentration: 10 µM Final Concentration: 10 nM |
| 0.5M EDTA | Invitrogen | 15575020 | For breaking up ECM Solvent: PBS Stock Concentration: 0.5 M Final Concentration: 0.5 mM |
| 40 µm cell strainer | Corning | 352340 | For excluding clumps from single cells Solvent: Stock Concentration: Final Concentration: |
| A-8301 | Sigma-Aldrich | SML0788-5MG | MCMGF+ and DM ingredient Solvent: DMSO Stock Concentration: 500 µM Final Concentration: 500 nM |
| Advanced DMEM/F12 | Invitrogen | 12634-028 | MCMGF+ and DM Basal medium Solvent: Stock Concentration: Final Concentration: |
| Alexa Fluor 594 goat anti-mouse IgG | Thermo Fisher | A-11005 | For secondary stain Solvent: Stock Concentration: Final Concentration: 1:200 |
| Alexa Fluor 647 Phalloidin | Invitrogen | A22287 | Optional secondary stain for F-actin Solvent: Stock Concentration: Final Concentration: 1:100 |
| B27 Supplement | Invitrogen | 17504-044 | MCMGF+ and DM ingredient Solvent: Stock Concentration: 50x Final Concentration: 1x |
| Bovine Serum Albumin | Chem-Impex | 00535 | 5% for blocking solution Solvent: PBS Stock Concentration: Final Concentration: 0.01 |
| Chloroform | Fisher Scientific | C298-500 | For RNA isolation Solvent: Stock Concentration: Final Concentration: |
| Circle coverslips | Thomas Scientific | 1157B50 | For mounting membrane on glass slide Solvent: Stock Concentration: Final Concentration: |
| DAPI (4′,6-diamidino-2-phenylindole) | Thermo Fisher | 62247 | For secondary stain Solvent: PBS Stock Concentration: 100x Final Concentration: 1x |
| DEPC Treated RNAse free H2O | Fisher Scientific | BP561-1 | For RNA isolation Solvent: Stock Concentration: Final Concentration: |
| DNA Removal Kit | Invitrogen | AM1906 | For RNA isolation Solvent: Stock Concentration: Final Concentration: |
| Ethyl Alcohol, 200 proof | Sigma Aldrich | EX0276-4 | For RNA isolation Solvent: Stock Concentration: Final Concentration: |
| Feather Scalpels | VWR | 100499-580 | For cutting membrane from transwells Solvent: Stock Concentration: Final Concentration: |
| Fetal Bovine Serum (FBS) | Gibco | 26140079 | For inactivating trypsin Solvent: Advanced DMEM/F12 Stock Concentration: 1 Final Concentration: 0.1 |
| Glass slides | Mercedes Scientific | MER 7200/90/WH | For mounting membrane on glass slide Solvent: Stock Concentration: Final Concentration: |
| GlutaMAX | Invitrogen | 35050-061 | MCMGF+ and DM ingredient Solvent: Stock Concentration: 200 mM Final Concentration: 2 mM |
| GP2 Antibody | MBL International | D277-3 | Surface stain for M cells Solvent: Stock Concentration: Final Concentration: 1:100 |
| HEPES | Invitrogen | 15630-080 | MCMGF+ and DM ingredient Solvent: Stock Concentration: 1 M Final Concentration: 10 mM |
| Human Serum IgA | Lee BioSolutions | 340-12-1 | For functional analysis of M cells Solvent: PBS Stock Concentration: 1 mg/mL Final Concentration: 10 µg |
| L-Wnt3a conditioned media | Cell line from ATCC | CRL-2647 | Refer to ATCC Product Sheet for L Wnt3A (ATCC CRL2647) for conditioned media protocol; MCMGF+ ingredient Solvent: Stock Concentration: Final Concentration: 75% in MCMGF+ 0% in DM |
| Matrigel, GFR, phenol free | Corning | 356231 | Extracellular Matrix (ECM) Solvent: Stock Concentration: Final Concentration: |
| Mouse recombinant EGF | Invitrogen | PMG8043 | MCMGF+ and DM ingredient Solvent: PBS Stock Concentration: 50 µg/mL Final Concentration: 50 ng/mL |
| N2 Supplement | Invitrogen | 17502-048 | MCMGF+ and DM ingredient Solvent: Stock Concentration: 100x Final Concentration: 1x |
| N-acetylcysteine | Sigma-Aldrich | A9165-5G | MCMGF+ and DM ingredient Solvent: H2O Stock Concentration: 500 mM Final Concentration: 1 mM |
| Noggin conditioned media | Cell line gift from Dr. Gijs van den Brink (University of Amsterdam) | Ref 30 for conditioned media protocol; MCMGF+ and DM Ingredient Solvent: Stock Concentration: Final Concentration: 5% in MCMGF+ 5% in DM | |
| Paraformaldehyde (PFA) | MP Biomedicals | 2199983 | For fixing monolayers Solvent: PBS Stock Concentration: 0.16 Final Concentration: 0.04 |
| PBS, -Mg, -Ca | Corning | MT21040CV | Solvent for 0.5 mM EDTA Solvent: Stock Concentration: Final Concentration: |
| Penicillin/Streptomycin | Invitrogen | 15140-122 | Optional ingredient of MCMGF+ and DM Solvent: Stock Concentration: 100x Final Concentration: 1x |
| Prolong Gold | Invitrogen | P36930 | Antifade mounting solution Solvent: Stock Concentration: Final Concentration: |
| Qiagen RNeasy Kit | Qiagen | 74106 | For RNA isolation Solvent: Stock Concentration: Final Concentration: |
| Recombinant human RANKL | Peprotech | 310-01 | Used to induce M cells Solvent: H2O Stock Concentration: 0.1 mg/mL Final Concentration: 200 ng/mL |
| Recombinant murine TNFa | Peprotech | 315-01A | Used to induce M cells Solvent: H2O Stock Concentration: 5 mg/mL Final Concentration: 50 ng/mL |
| R-spondin conditioned media | Cell line from Trevigen | 3710-001-01 | Refer to Trevigen Cultrex Rspo1 Cells product manual (HA-R-Spondin1 293T cell line) for conditioned media protocol; MCMGF+ Ingredient Solvent: Stock Concentration: Final Concentration: 10% in MCMGF+ 0% in DM |
| Secondary anti-human IgA antibody | Jackson Immuno Research | 109-545-011 | For secondary stain Solvent: Stock Concentration: Final Concentration: 1:200 |
| Super Script IV Reverse Transcriptase | Thermo Fisher | 18091200 | For conversion of RNA to DNA Solvent: Stock Concentration: Final Concentration: |
| Transwell inserts, 24 well-sized | Greiner Bio-One | 662641 | 0.4 µm pore size Solvent: Stock Concentration: Final Concentration: |
| TritonX-100 | Sigma-Aldrich | T8787 | Not required during GP2 primary stain Solvent: 1% BSA Stock Concentration: Final Concentration: 0.001 |
| TRIzol | Invitrogen | 15596018 | For RNA isolation Solvent: Stock Concentration: Final Concentration: |
| TrypLE Express | Invitrogen | 12605010 | Trypsin for breaking up enteroids into single cells Solvent: Stock Concentration: Final Concentration: |
| Y-27632 | Sigma-Aldrich | Y-0503 | MCMGF+ ingredient on day 0 Solvent: H2O Stock Concentration: 5 mM Final Concentration: 10 µM |
| GAPDH forward primer | CATGAGAAGTATGACAACAGCCT | ||
| GAPDH reverse primer | CGTTTCCCGCAAGACGTAAC | ||
| GP2 forward primer | CAATGTGCCTACCCACTGGA | ||
| GP2 reverse primer | ATGGCACCCACATACAGCAC | ||
| LYZ forward primer | CGCTACTGGTGTAATGATGG | ||
| LYZ reverse primer | TTTGCACAAGCTACAGCATC | ||
| MUC2 forward primer | ATGCCCTTGCGTCCATAACA | ||
| MUC2 reverse primer | AGGAGCAGTGTCCGTCAAAG | ||
| SI forward primer | TCCAGCTACTACTCGTGTGAC | ||
| SI reverse primer | CCCTCTGTTGGGAATTGTTCTG | ||
| SPIB forward primer | CAGCAGCCGCTTTTAGCCAC | ||
| SPIB reverse primer | GCATATGCCGGGGGAACC |
Riferimenti
- Kraehenbuhl, J. P., Neutra, M. R. Epithelial M cells: differentiation and function. Annual Review of Cell and Developmental Biology. 16, 301-332 (2000).
- Neutra, M. R., Frey, A., Kraehenbuhl, J. P. Epithelial M cells: gateways for mucosal infection and immunization. Cell. 86 (3), 345-348 (1996).
- Nakamura, Y., Kimura, S., Hase, K. M. cell-dependent antigen uptake on follicle-associated epithelium for mucosal immune surveillance. Inflammation and Regeneration. 38, 15 (2018).
- Clark, M. A., Hirst, B. H., Jepson, M. A. M-cell surface beta1 integrin expression and invasin-mediated targeting of Yersinia pseudotuberculosis to mouse Peyer's patch M cells. Infection and Immunity. 66 (3), 1237-1243 (1998).
- Jensen, V. B., Harty, J. T., Jones, B. D. Interactions of the invasive pathogens Salmonella typhimurium, Listeria monocytogenes, and Shigella flexneri with M cells and murine Peyer's patches. Infection and Immunity. 66 (8), 3758-3766 (1998).
- Jones, B. D., Ghori, N., Falkow, S. Salmonella typhimurium initiates murine infection by penetrating and destroying the specialized epithelial M cells of the Peyer's patches. Journal of Experimental Medicine. 180 (1), 15-23 (1994).
- Marra, A., Isberg, R. R. Invasin-dependent and invasin-independent pathways for translocation of Yersinia pseudotuberculosis across the Peyer's patch intestinal epithelium. Infection and Immunity. 65 (8), 3412-3421 (1997).
- Ohno, H. Intestinal M cells. Journal of Biochemistry. 159 (2), 151-160 (2016).
- Kerneis, S., Bogdanova, A., Kraehenbuhl, J. P., Pringault, E. Conversion by Peyer's patch lymphocytes of human enterocytes into M cells that transport bacteria. Science. 277 (5328), 949-952 (1997).
- Gullberg, E., et al. Expression of specific markers and particle transport in a new human intestinal M-cell model. Biochemical and Biophysical Research Communications. 279 (3), 808-813 (2000).
- Giannasca, P. J., Giannasca, K. T., Leichtner, A. M., Neutra, M. R. Human intestinal M cells display the sialyl Lewis A antigen. Infection and Immunity. 67 (2), 946-953 (1999).
- Jang, M. H., et al. Intestinal villous M cells: an antigen entry site in the mucosal epithelium. Proceedings of the National Academy of Sciences of the United States of America. 101 (16), 6110-6115 (2004).
- Beloqui, A., Brayden, D. J., Artursson, P., Preat, V., des Rieux, A. A human intestinal M-cell-like model for investigating particle, antigen and microorganism translocation. Nature Protocols. 12 (7), 1387-1399 (2017).
- Martinez-Argudo, I., Jepson, M. A. Salmonella translocates across an in vitro M cell model independently of SPI-1 and SPI-2. Microbiology. 154 (Pt 12), 3887-3894 (2008).
- Lee, J. B., et al. Quantitative analysis of lab-to-lab variability in Caco-2 permeability assays. European Journal of Pharmaceutics and Biopharmaceutics. 114, 38-42 (2017).
- Mabbott, N. A., Donaldson, D. S., Ohno, H., Williams, I. R., Mahajan, A. Microfold (M) cells: important immunosurveillance posts in the intestinal epithelium. Mucosal Immunology. 6 (4), 666-677 (2013).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Knoop, K. A., et al. RANKL is necessary and sufficient to initiate development of antigen-sampling M cells in the intestinal epithelium. Journal of Immunology. 183 (9), 5738-5747 (2009).
- Taylor, R. T., et al. Lymphotoxin-independent expression of TNF-related activation-induced cytokine by stromal cells in cryptopatches, isolated lymphoid follicles, and Peyer's patches. Journal of Immunology. 178 (9), 5659-5667 (2007).
- de Lau, W., et al. Peyer's patch M cells derived from Lgr5(+) stem cells require SpiB and are induced by RankL in cultured "miniguts". Molecular and Cellular Biology. 32 (18), 3639-3647 (2012).
- Rouch, J. D., et al. Development of Functional Microfold (M) Cells from Intestinal Stem Cells in Primary Human Enteroids. PloS One. 11 (1), e0148216 (2016).
- Wood, M. B., Rios, D., Williams, I. R. TNF-alpha augments RANKL-dependent intestinal M cell differentiation in enteroid cultures. American Journal of Physiology: Cell Physiology. 311 (3), C498-C507 (2016).
- Zou, W. Y., et al. Human Intestinal Enteroids: New Models to Study Gastrointestinal Virus Infections. Methods in Molecular Biology. , (2017).
- Kozuka, K., et al. Development and Characterization of a Human and Mouse Intestinal Epithelial Cell Monolayer Platform. Stem Cell Reports. 9 (6), 1976-1990 (2017).
- Barker, N., et al. Identification of stem cells in small intestine and colon by marker gene Lgr5. Nature. 449 (7165), 1003-1007 (2007).
- Mantis, N. J., et al. Selective adherence of IgA to murine Peyer's patch M cells: evidence for a novel IgA receptor. Journal of Immunology. 169 (4), 1844-1851 (2002).
- Rios, D., et al. Antigen sampling by intestinal M cells is the principal pathway initiating mucosal IgA production to commensal enteric bacteria. Mucosal Immunology. 9 (4), 907-916 (2016).
- Miller, H., Zhang, J., Kuolee, R., Patel, G. B., Chen, W. Intestinal M cells: the fallible sentinels?. World Journal of Gastroenterology. 13 (10), 1477-1486 (2007).
- Heijmans, J., et al. ER stress causes rapid loss of intestinal epithelial stemness through activation of the unfolded protein response. Cell Reports. 3 (4), 1128-1139 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon